木鳖子水煎液抗肿瘤作用的研究
2017-02-07张真真段永建杜钢军
张 群,张真真,段永建,杜钢军
1.河南大学药学院 药物研究所,河南 开封 475004; 2.河南大学第一附属医院,河南 开封 475004
随着人们生活节奏的加快,长期超负荷的工作和生活,再加上不健康的饮食方式,使得我国恶性肿瘤发病率逐年上升,并趋于年轻化。目前,恶性肿瘤已成为严重危害人类生命和健康的主要疾病[1],其中,肺癌已经成为世界及中国范围内发病率和死亡率最高的恶性肿瘤。原发性肝癌在全球每年新发病例和死亡病例中,中国占比超过一半,在各系统恶性肿瘤疾病发病率和死亡率中仅次于肺癌[2]。目前,治疗恶性肿瘤的主要手段仍然是手术切除、放疗、化疗、联合用药等方式。众所周知,这些治疗方式不良反应多,易产生耐药,易复发和转移,对人体正常细胞也存在较强毒副作用[3]。对于癌症晚期患者,在身体极度衰弱的情况下,很难承受放疗或化疗,患者往往痛苦不堪,生存质量明显下降。近年来,随着国家对中医药产业的大力扶持,加上中医药自身的快速发展,许多中药已被开发应用于抗肿瘤治疗及调节机体失调的机能。长期临床观察结果表明,中药可改善放疗、化疗、手术等引起的损伤及不良反应,提高患者的生存质量[4]。中医学认为,肿瘤是一个全身为虚,局部为实的全身性疾病,致病因素比较复杂,可归结为正气内虚、外邪侵袭、饮食老伤、七情失调四个方面。
中药木鳖子为葫芦科植物木鳖(Momordica cochinchinensis (Lour.)Spreng)的干燥成熟种子。味苦微甘,凉,有毒,具有散结消肿、攻毒疗疮的功效[5]。可用于疮疡、肿毒、瘰疬等病症。而清热解毒,以毒攻毒法是中医治疗肿瘤,特别是恶性肿瘤最常用的法则,基于此理论,本研究采用其苦凉、有毒特性,通过建立H22肝癌皮下移植瘤模型,评价木鳖子水煎液对小鼠肿瘤治疗作用,并探究其对A549人肺癌细胞增殖及迁移的影响,以期为木鳖子在抗肿瘤方面提供有价值的资料,为临床进一步研究提供依据。
1 实验材料
1.1 药品
木鳖子购自开封市天济堂药店。木鳖子水煎液的制备:称取木鳖子原药材100g,加3倍体积的水浸泡30min,先武火煮沸,再转中火慢沸6h左右,去渣取煎煮液,再将煎煮液继续加热浓缩至终浓度为1g/mL,即每毫升相当于1g原药材。
1.2 试剂
DMEM培养基、胰蛋白酶(美国Gibco-BRL);链霉素、青霉素(华北制药股份有限公司);MTT(Sigma公司);胎牛血清(四季青生物公司);DMSO(天津基准化学试剂有限公司);PBS缓冲液(称取KCl0.2g,KH2PO40.2g,NaCl8g,Na2HPO4·12H2O1.53g,加入800mL双蒸水,溶解,定容至1 000mL,pH调至7.3);体积分数为4%的多聚甲醛溶液;二甲苯;苏木精伊红染色液(德州润昕实验仪器有限公司)。
1.3 实验动物
雄性昆明种小鼠,体质量(20±5)g,由河南大学药理实验室提供。
1.4 瘤株
H22肝癌细胞、人源A549肺癌细胞,中科院提供,由本实验室传代保存。
1.5 仪器
ELX-800UV型酶标仪(美国Bio-Tek公司);LDZX-75KBS立式压力蒸汽灭菌锅(四川新德医疗器械厂);CO2细胞培养箱(SL公司);超净工作台(上海博迅实业公司);XDS-500D型倒置荧光显微镜(上海蔡康光学仪器有限公司);WH-866涡旋振荡器(太仓市科教器材厂);85-2恒温磁力搅拌器(常州国华电器有限公司);电热恒温培养箱(上海跃进医药器械厂);FA1004B型电子天平(上海越平科学仪器有限公司);电子体温计(泰克曼电子仪器有限公司);微量移液器(上海佳安分析仪器厂);YLS-1A多功能小鼠自主活动仪(安徽淮北正华生物仪器有限公司);TDL-508台式离心机(上海安亭科学仪器厂);BCD-539WT低温冰箱(海尔集团);YN-ZD-2电热蒸馏水器(上海博讯实业有限公司);RM2235轮转切片机(LeicaBiosystemsNussiochGmbH);游标卡尺、酒精计(郑州泽铭科技有限公司);PHS-2C酸度计(德州润昕实验仪器有限公司)。
2 试验方法
2.1 木鳖子对A549肺癌细胞增殖能力的影响
2.1.1 木鳖子作用于A549细胞后其形态学变化 取对数生长期的A549肺癌细胞,设置对照组,给药组。对照组加100μL/孔的DMEM完全培养基;给药组加含木鳖子水煎液药物,浓度依次为:20、10、5g/L的培养基,100μL/孔,每一浓度设5个复孔,接种于96孔板中,边缘孔用PBS缓冲液填充,置于37 ℃,体积分数为5%的CO2培养箱中培养48h后取出,在光学显微镜下观察各组细胞形态并拍照。
2.1.2MTT法检测木鳖子对A549细胞增殖的影响 取对数生长期的A549细胞,经胰酶消化,放入细胞培养箱中1~2min,1 000r/min离心,加入DMEM完全培养液重悬并用计数板进行计数后调整细胞浓度到所需的细胞数,以每孔7×103/100μL接种于96孔板内,置于含体积分数5%的CO2培养箱中 37 ℃培养,待细胞贴壁后,加不同浓度(浓度梯度为0、1.25、2.5、5、10、20g/L)的含药培养基,100μL/孔,每一浓度设5个复孔,对照组加100μL/孔的完全培养基。继续培养72h,取出后轻甩出孔中培养基,每孔加200μLPBS缓冲液,洗去孔中残留药物,甩去所加PBS缓冲液,补加200μL/孔PBS,再加入MTT(浓度为5g/L,PBS配制)溶液10μL/孔,于体积分数为5%的CO2,37 ℃培养箱中培养4h,取出甩出孔中MTT,加二甲基亚砜(DMSO),100μL/孔,待完全溶解后,用酶标仪于570nm下测定各孔OD值。计算肿瘤细胞增殖抑制率[6],再得到细胞的IC50值。
细胞增殖抑制率(%)=1-OD值(给药组)/OD值(对照组)。绘制增殖抑制率随药物浓度变化的曲线图(药物浓度为X轴、抑制率为Y轴)。
2.2 木鳖子对A549肺癌细胞迁移能力的影响
取对数生长期的A549细胞,胰酶消化后,1 000r/min离心,加入无血清的培养基重悬,制成单细胞悬液,使用细胞计数板计数,并根据需要调整细胞浓度,以1×105/孔个细胞,按每孔200μL接种到48孔细胞培养板中,于含体积分数5%的CO2培养箱中37 ℃下培养,培养至细胞能单层铺满细胞板底部,用20μL微量移液器枪头于每孔中央呈“一”字划痕,弃去孔内培养基,再用无菌PBS缓冲溶液冲洗细胞3次,去除划掉的细胞。显微镜下观察划痕情况,并拍照记录。然后,对照孔加入含体积分数2%的胎牛血清DMEM培养基200μL,加药孔加人200μL/孔含木鳖子水煎液浓度为10g/L的含药血清培养基。每组设置4个平行孔,置于体积分数为5%的CO2培养箱中37 ℃下继续培养,按0 、12、24h分别于倒置显微镜下观察并拍照。
2.3 木鳖子对小鼠H22肝癌皮下移植瘤的作用
2.3.1 小鼠培养 选取2mon的昆明雄鼠36只。将小鼠保持在最佳的卫生、温度、湿度和光(12h暗/亮)条件下,自由饮水食。
2.3.2 动物分组及给药 按小鼠体质量均匀分成3组(每组12只):正常组(正常小鼠)、模型组(皮下接种H22肝癌细胞的小鼠)、给药组(皮下接种H22肝癌细胞的小鼠)。肿瘤细胞接种后第二天开始,正常组和模型组每天灌胃生理盐水;给药组每天灌胃药物浓度为0.05g/mL木鳖子水煎液,以0.2mL/10g方式给药,连续给药3周。
2.3.3 肿瘤接种 无菌抽取接种10d左右,生长良好的H22肝癌小鼠的腹水,用生理盐水稀释细胞浓度约为5×106/mL个细胞。按0.2mL/只接种于昆明雄性小鼠皮下,共接种24只,建立H22肝癌皮下移植肿瘤模型。
2.3.4 小鼠生命体征数据采集 每日密切观察3组小鼠的状况,并记录数据。包括:体质量间隔4d记录1 次,体温间隔4d记录1 次。待小鼠皮下瘤长至可测量时,隔天测小鼠体质量1次。小鼠自主活动状况,每周测2次。
2.3.5 测量肿瘤体积 待肿瘤长出后开始用游标卡尺隔天测肿瘤直径(包括长径和短径)1次,计算小鼠瘤体积,绘制各组小鼠的肿瘤生长曲线。待小鼠瘤体积长至约4 000mm3时,处理小鼠,结束实验。
肿瘤体积(V)=(肿瘤长径×肿瘤短径2)/2。
2.3.6 小鼠死亡率 在实验过程中记录各组小鼠的死亡时间、存活个数,并计算各组小鼠的死亡率。死亡率=(死亡只数/该组总只数)×100%。
2.3.7 抑瘤率及脏器指数
末次给药24h后,称小鼠体质量,测量瘤径,然后颈椎脱臼处死小鼠,剥离皮下肿瘤、脾脏并称定质量。按文献[7]的方法计算肿瘤抑制率和脏器指数。
抑瘤率(%)=(模型组瘤质量均值-给药组瘤质量均值)/模型组瘤质量均值×100%;脏器指数(%)=脏器质量/处死当日小鼠体质量×100%。
2.3.8 病理学检测 将剥离的小鼠肿瘤先拍照,之后用体积分数为4%的多聚甲醛溶液浸泡,固定48h后,脱水,二甲苯透化,用石蜡包埋,切片做HE染色,于显微镜下观察小鼠瘤组织的病理情况。
2.4 统计学处理
3 实验结果
3.1 木鳖子对A549肺癌细胞增殖能力的影响
3.1.1 木鳖子作用于A549细胞后的形态学变化 对照组细胞呈不规则菱形,贴壁生长;给药组细胞形态发生改变,细胞皱缩、变圆、脱落,部分细胞呈碎块状,细胞生长受到抑制,并呈剂量依赖性。
3.1.2MTT法检测木鳖子对A549肺癌细胞增殖能力的影响 通过酶标仪测定结果:给药组测得的OD值明显较对照组OD值小,且随着药物浓度增大,给药组OD值在逐渐变小,药物浓度为0、1.25、2.5、5、10 、20g/L时,木鳖子水煎液对肿瘤细胞A549的抑制率分别为0、5.75%、6.44%、26.76%、76.76%。计算分析得IC50为13.7g/L。倒置显微镜下观察到随药物浓度的加大,细胞整体状态也在变差。因此得出:木鳖子水煎液对A549肺癌细胞的抑制作用呈一定的浓度依赖性。见图1、图2。

图1 木鳖子水煎液对A549肺癌细胞的抑制率
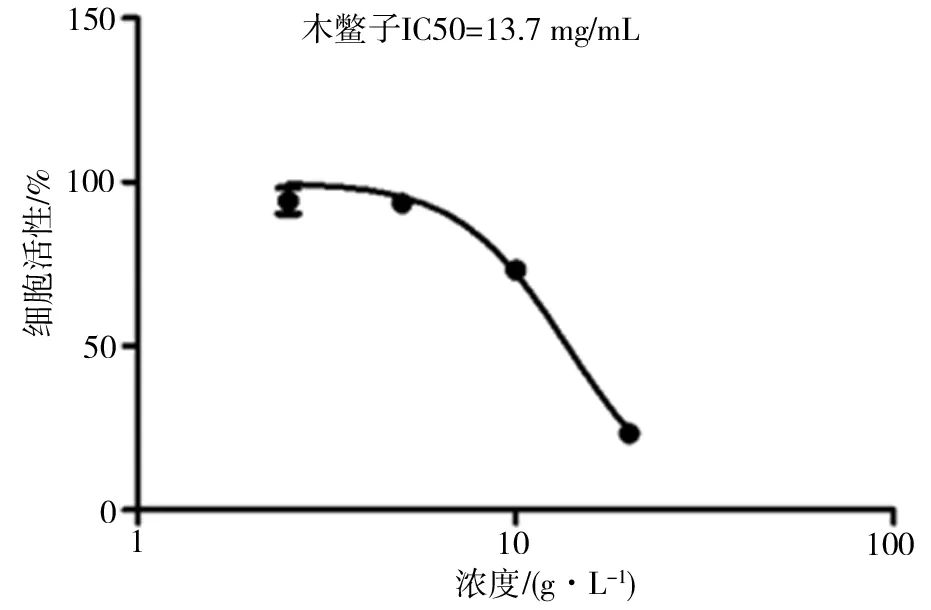
图2 木鳖子水煎液对A549肺癌细胞IC50值
3.2 木鳖子对A549细胞迁移能力的影响
分别在0、12、24h于倒置显微镜下观察并拍照记录。结果显示:与对照组相比,给药组细胞增殖数明显低于对照组;12h时拍照观察显示,对照组细胞出现较明显迁移,划痕宽度变窄,给药组边缘划痕界限较明显,细胞略有迁移;24h时拍照观察显示,对照组划痕边际出现大量细胞,划道宽度更窄,给药组划痕边际细胞略向中间迁移,但并不明显。
3.3 对小鼠H22肝癌皮下移植瘤的作用
3.3.1 对小鼠生命体征变化的影响 通过实验过程中的观察及测定的数据:模型组小鼠生存状态变差,体质量随时间波动幅度较大,而给药组小鼠的体质量增长缓慢,上升的趋势较模型组平缓,与正常组小鼠体质量相当,与模型组相比有显著性差异,见图3;模型组的小鼠的自主活动随着实验时间的延长而逐渐减少,而给药组的小鼠的自主活动高于模型组,见图4;在实验过程中,模型组小鼠的死亡率为33.33%,而给药组小鼠未出现死亡。
3.3.2 对小鼠肿瘤生长的影响 相比于模型组,前14d,给药组和模型组小鼠肿瘤体积均较小,两组肿瘤体积大小无明显差异,而后,模型组小鼠肿瘤体积开始迅速增长,而给药组小鼠肿瘤体积始终增长缓慢,木鳖子水煎液对小鼠皮下移植瘤的生长抑制率为52.63%。通过所剥离的两组小鼠肿瘤大小图可看出,给药组小鼠的肿瘤体积明显小于模型组小鼠的肿瘤体积,肿瘤组织质地较软,而模型组的肿瘤组织质地较坚硬。通过两组小鼠肿瘤生长形态图来看,模型组肿瘤发生溃破,渗出液有浓烈的腥臭味,而给药组小鼠肿瘤外观完整,未出现溃烂、液体渗出现象。结果见表1、图5、图6、图7、图8。

图3 木鳖子水煎液对小鼠体质量的影响

图4 木鳖子水煎液对小鼠自主活动的影响

组别瘤重/g抑瘤率/%模型组2.73±0.35-给药组1.29±0.21*52.63
注:与模型组相比,*P<0.05。
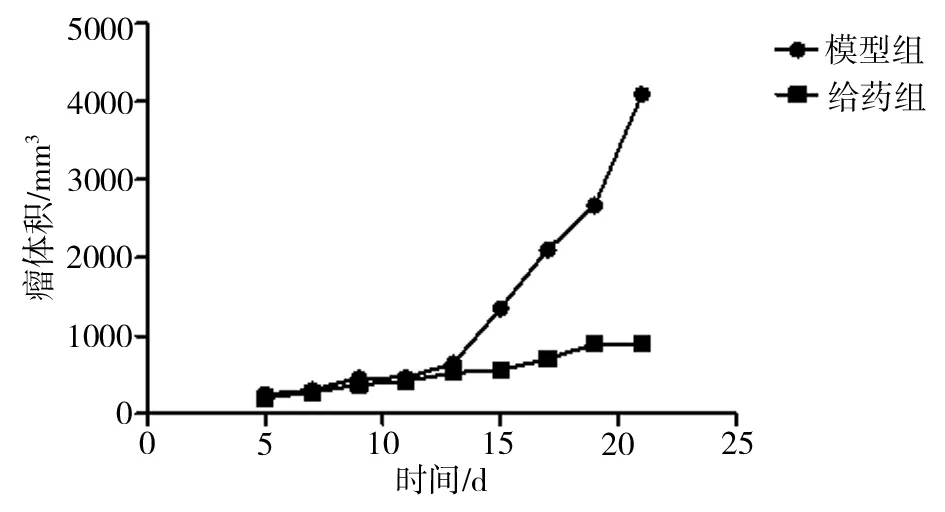
图5 木鳖子水煎液对小鼠肿瘤体积的影响

图6 两组小鼠肿瘤大小比较注:图上部分为给药组小鼠肿瘤,图下部分为模型组小鼠肿瘤

图7 木鳖子水煎液对小鼠肿瘤质量的影响

图8 小鼠肿瘤生长形态图
3.3.3 对小鼠脏器指数的影响
相比于模型组,给药组小鼠肝、脾指数均显著下降,计算结果见表2。
表2 木鳖子水煎液对H22肝癌皮下移植瘤小鼠脏器指数的影响
注:与模型组相比,*P<0.01。
3.3.4 对小鼠肿瘤组织病理学检测
将各组小鼠的肿瘤组织切片进行HE染色,显微镜下观察:模型组与给药组肿瘤组织中的肿瘤细胞均呈弥散分布,肿瘤细胞大小较一致,细胞内只可见少量细胞质,模型组小鼠瘤细胞核密集,染色质大多呈块状,致密深染呈墨水滴样,部分核畸形,核与质比例失常,而给药组小鼠瘤细胞核明显小于模型组,核染色较浅,瘤细胞密度较稀,核密集区域相对较少。见图8。

图8 小鼠瘤组织病理学HE染色结果
4 讨论
《本草经疏》指出,中药木鳖子是散血热、除痈毒之要药,已被作为复方抗癌中药的君药。有研究[8]指出木鳖子具有抗炎、抗菌、抗病毒等作用。其入药对多种癌症具有治疗作用。本实验中的体外实验通过观察A549人肺癌细胞的增殖及迁移情况,探究木鳖子水煎液对恶性肿瘤的敏感程度。结果显示,不同浓度木鳖子水煎液(2.5、5、10、20g/L)均可抑制人肺癌细胞A549的生长,20g/L的浓度作用于A549细胞24h后,生长抑制率可达到76.76%,通过显微镜观察,木鳖子5~20g/L作用于小鼠24h后,A549细胞形态发生改变,细胞由原来的菱形变小、变圆。
肿瘤细胞一般具有较长的休眠期,而大多抗癌药物只对增殖活跃期的肿瘤细胞有效。这也是临床上,患者一旦觉察,一般已经是癌症中晚期的原因之一[9]。肿瘤化疗主要通过干扰其增殖而控制肿瘤生长,而细胞增殖是肿瘤细胞和正常细胞共有特征。且目前化疗药物大多针对性差,在抑制肿瘤细胞的同时,会损害人体正常细胞,引起各种不良反应, 降低患者存活质量。 中医治病讲究辩证施治,阴阳平衡,其治癌理念为:“扶正抑瘤,带瘤生存”[10]。本研究采用H22肝癌小鼠皮下移植瘤模型,来探究木鳖子水煎液对小鼠皮下移植瘤的治疗作用。发现给药组小鼠皮下移植瘤生长始终比较缓慢,肿瘤体积较小,生存特征与正常组相当,实验期间,未出现死亡,存活率明显提高,很好地印证了中医“扶正抑瘤,带瘤生存”的治癌理念。
清热解毒中药可抗炎、抗病毒、提高免疫力,控制肿瘤及其周围组织炎症[11]。木鳖子药性苦寒,具有清热解毒,软坚散结的功效,通过对比模型组与给药组小鼠肿瘤生长形态,发现模型组肿瘤出现大面积溃烂,渗出液明显,属热毒侵袭,而给药组小鼠肿瘤组织外观完好;从小鼠肿瘤组织病理学形态图中可看出,给药组较模型组瘤细胞核染色浅,核密集区较少,且质地较软。现在普遍认为,导致恶性肿瘤发生的主要原因之一是毒邪,去除毒邪当以毒攻毒疗效佳[12]。如何变毒药为治癌圣药,关键是如何掌握好“度”。本研究应用木鳖子有毒特性,以 0.05g/mL的药物浓度进行动物实验,发现整个实验期间荷瘤小鼠未见死亡,生存特征与正常组大致相当。许多研究已证实,肿瘤浸润的免疫细胞会促进其生长、侵袭及转移。而本实验中小鼠肝脏指数和脾脏指数均明显降低,可能与木鳖子水煎液可降低因肿瘤而肿大的脾脏和肝脏相关。
综上所述,木鳖子水煎液可有效抑制A549细胞的增殖和迁移,抑制皮下移植瘤生长,有望成为临床联合化疗药治疗恶性肿瘤的有效药物。
[1] 王艳红,郭向娇,薛燕. 2010-2014年郑州市中原区居民恶性肿瘤死因分析[J].河南预防医学杂志,2017,28(2):94-96.
[2]ChenWQ,ZhengRS,BaadePD,etal.CancerstatisticsinChina,2015[J].CACancerJClin,2016,66(2):115-132.
[3]ZhengHC.Themolecularmechanismsofchemoresistanceincancers[J].Oncotarget, 2017,8(35):59950-59964.
[4] 朱元章,张贵彪,朱国福.中药复方抗肿瘤机制研究进展[J].中国实验方剂学杂志,2017,23(16):227-234.
[5] 国家药典委员会.中华人民共和国药典(一部).中国药典[S].北京:化学化工出版社,2015:65-66.
[6] 戚笑笑.反左金丸抗肿瘤和抗转移的机制研究[D].开封:河南大学,2015.
[7] 刘迎辉,林海红,杜钢军.复方马钱子的抗肿瘤作用探讨[J].河南大学学报(医学版),2013,32(1):28-31.
[8] 林慧彬,安芸,路俊仙,等.中药木鳖子的研究进展[J].时珍国医国药,2009,10(4):785-787.
[9] 汪爱国.高压氧及其联合化疗药物对结肠腺癌细胞CT26小鼠移植瘤生长的影响[D].南京:东南大学,2005.
[10] 程海波,姚志华,李柳,等.中医肿瘤“带瘤生存”学术思想探讨[J].时珍国医国药,2016,27(6):1436-1437.
[11] 逯敏.试论《千金方》清热解毒法对于恶性肿瘤治疗的指导意义[J].中国中医急症,2010,19(8):1378-1379.
[12] 黄海福.以毒攻毒法治疗肿瘤的认识与思考[J].现代诊断与治疗,2015,26(23):5495-5496.
