加温湿化高流量鼻导管吸氧联合枸橼酸咖啡因治疗早产儿呼吸暂停
2017-02-06左晓晓薛爱梅
左晓晓,薛爱梅,那 利
早产儿呼吸暂停(apnea of prematurity,AOP)是目前新生儿重症监护中面临的主要临床问题之一,是早产儿呼吸管理中较为常见的问题。对于AOP,临床多采用甲基黄嘌呤类药物联合无创辅助呼吸治疗[1-2]。无创呼吸支持国内以往多采用经鼻持续气道正压通气(nasal continuous positive airway pressure,nCPAP),疗效确切,但存在着不足之处。近些年将加温湿化高流量鼻导管吸氧(heated humidified high-flow nasal cannula,HHFNC)技术应用在AOP的治疗上,取得了良好效果,现报道如下。
1 资料与方法
1.1一般资料采用前瞻性随机对照研究方法,按照入院单双次序,并征得患儿家属知情同意,将我院新生儿/儿童重症监护病房自2014年10月至2016年10月收治的64例AOP患儿分为观察组和对照组,每组32例。纳入标准:①出生胎龄小于37周;②频发呼吸暂停:1 h内呼吸暂停发作超过2~3次。排除标准:①生后重度窒息;②严重呼吸窘迫综合征(需要气管插管机械通气支持者);③重度高胆红素血症(总胆红素大于340 μmol·L-1);④吸吮与吞咽不协调;⑤吸吮与呼吸不协调。观察组给予HHFNC,对照组给予nCPAP。观察组32例,男性20例,女性12例,胎龄(31.5±3.3)周、体质量(1.56±0.42) kg、呼吸暂停发作起始日龄(6.5±4.3) d;对照组32例,男性18例,女性14例,胎龄(32.1±4.0)周、体质量(1.66±0.48) kg、呼吸暂停发作起始日龄(7.1±5.3) d。两组一般情况比较,差异均无统计学意义(P>0.05)。
1.2方法
1.2.1治疗方法两组均监测心率、呼吸、血氧饱和度等生命体征,同时给予保暖,保持呼吸道通畅,肠内喂养(肠内喂养量不足时给予部分肠道外营养支持治疗)等,枸橼酸咖啡因注射液首剂20 mg·kg-1·d-1,维持量5 mg·kg-1·d-1应用等治疗。观察组采用斐雪派克MR810(Fisher & Paykel,新西兰)加温湿化器,设置:体质量1 000~1 999 g时气体流量为3 L·min-1,体质量2 000~2 999 g时为4 L·min-1,每组气体流量在基线水平最大可增加3 L·min-1;利用空氧混合仪吸氧浓度控制在21%~40%之间,目标使血气分析中氧分压在正常范围内或经皮血氧饱和度在90%~94%之间;对照组采用Sophie新生儿呼吸机(Stephan,德国)nCPAP治疗。观察两组临床症状改善[3](显效:治疗后24 h内未再出现呼吸暂停;有效:治疗后72 h内未再出现呼吸暂停;无效:治疗后72 h仍出现呼吸暂停或病情加重),氧暴露时间(排除治疗中转为有创机械通气病例),胃潴留(胃残余超过上次喂养量的1/3,或24 h胃残余量超过喂养总量的1/4,或持续喂养时超过1 h的量),鼻中隔及鼻部局部皮肤损伤和气胸发生率,患儿舒适度(观察呼吸支持时患儿有无烦躁及抗拒动作)和患儿家属接受度(出院前设计一个针对患儿父母的统计表,内容主要介绍HHFNC和nCPAP两种呼吸支持方案:包括适应证、优点及不良反应等,由患儿父母对自己患儿所选方案做一次再选择,在面对两种方案时依旧认可并愿意选择原方案者,投认可票,会选择另一种方案者投否定票,然后计算出认可票在本组总例数中的构成比,作为其接受度)。
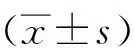
2 结果
2.1两组治疗效果比较观察组临床症状改善较对照组比较无明显差异(Z=-0.330,P=0.741)。观察组氧暴露时间(16.30±2.98) d与治疗组的(16.30±2.98) d比较,差异无统计学意义(P>0.05),见表1。
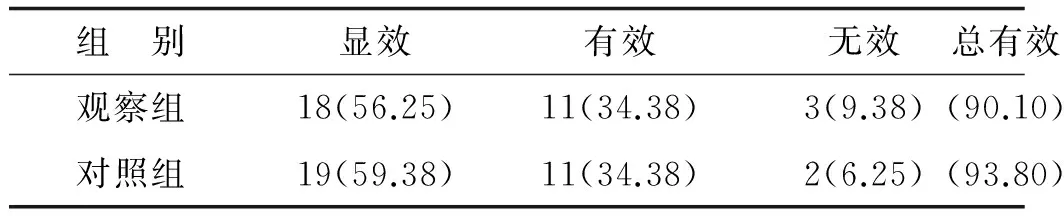
表1 临床症状改善情况比较(n=32) 例(%)
2.2两组并发症情况比较观察组胃潴留、鼻中隔及鼻部局部皮肤损伤发生率明显低于对照组,两组均无气胸出现,见表2。

表2 两组并发症情况比较(n=32) 例(%)
2.3两组舒适度及家属接受度比较观察组舒适度及家属接受度明显高于对照组,见表3。

表3 两组舒适度及家属接受度比较(n=32) 例(%)
3 讨论
呼吸暂停是呼吸停止时间>20 s,伴有心率减慢(<100次·min-1),或出现青紫、血氧饱和度降低和肌张力低下,是早产儿的常见症状;AOP发病机制仍不清楚,胎龄越小发病率越高,胎龄<30周发生率>80%,胎龄30~31周为50%,如不及时发现和处理,可致脑缺氧损伤,甚至猝死[4]。AOP治疗除给氧和药物治疗外,很多学者还发明了其他一系列治疗方法。姚仁芬等[5]自行设计制作的振动式水囊床,以及金淑芹[6]等提出的简易水床及体位护理等,通过这种特殊设计的治疗床产生的机械振动波,达到兴奋呼吸中枢和刺激呼吸肌的效应。
在药物和无创辅助呼吸应用方面,早期国内多采用氨茶碱+nCPAP方案。但氨茶碱使用时有效血药浓度与中毒浓度接近,需严密监测,且临床疗效欠佳[7]。咖啡因的作用机制主要是通过兴奋呼吸中枢,其脂溶性高,渗透入脑脊液更迅速,早产儿易于耐受,咖啡因的临床效应浓度为5~20 mg·L-1,低于50 mg·L-1时很少出现不良反应。nCPAP是减少呼吸暂停发作频率的一种有效的气道支持方法,其原理为给氧时通过持续气流产生的气道正压,使肺泡保持开放,防止肺不张、改善肺换气及提高氧合能力的作用,同时增加跨肺压和气道直径、减少气道阻力,更有利于自主呼吸,从而减少呼吸暂停的发生[8-9]。但其也存在一些较常见的并发症,如:鼻中隔损伤及鼻部局部皮肤损伤等。由于咖啡因的不良反应发生率较氨茶碱相对低,在AOP治疗上逐渐替代氨茶碱,取得良好疗效。HHFNC在国外较广泛应用,但国内应用尚不太多[10]。本研究显示HHFNC联合枸橼酸咖啡因在AOP治疗方面,疗效满意,与nCPAP联合枸橼酸咖啡因疗效相当,在鼻中隔及鼻部局部皮肤损伤、胃潴留、患儿舒适度及家属认可度等方面,均明显优于后者。
HHFNC是把加温湿化的空氧混合气体通过特制双孔鼻导管直接经鼻输入,可产生类似于nCPAP的气道正压,从而帮助肺容量恢复[11],也可减少nCPAP所致的分泌物聚集、气道变冷和水分流失等情况。减轻或避免对患儿鼻部的刺激,从而减轻鼻前庭受压、鼻中隔损伤,同时减少死腔、减低鼻咽阻力、降低呼吸功、利于肺复张。另外,HHFNC固定简单,无需像nCPAP需借助特殊固定帽将管道固定于头部患儿,患儿舒适度提高,便于护理。Osman等应用早产儿的疼痛评估项目观察了60例患儿,结果显示HHFNC组疼痛评分明显低于nCPAP组[12]。本研究中采取问卷调查法,结果显示患儿家属的接受度与nCPAP相比具有明显优势。
本研究两组中均无气胸发生,这与Campbell的研究相吻合[13],但HHFNC气道压力不恒定,是否会增加气胸的发生,还需大样本临床观察。有报道HHFNC混合气体在输出时已按需要的浓度进行稀释,吸入氧浓度不随患者呼吸状态改变,氧浓度可控,不加重早产儿视网膜病和支气管肺发育不良的发生[14]。综上所述,HHFNC联合枸橼酸咖啡因治疗AOP效果满意,方法简单易行,便于基层医院开展,并发症较nCPAP减轻或减少,是一种较好的治疗方法,值得推广。
[1] 赵婧,母得志.早产儿呼吸暂停诊疗进展[J].临床儿科杂志,2012,30(3):291-294.
[2] Schoen K,Yu T,Stockmann C,et al.Use of methylxanthine therapies for the treatment and prevention of apnea of prematurity[J].Paediatr Drugs,2014,16(2):169-177.
[3] 杨庆南,朱建幸,谢利娟,等.不同PEEP水平的鼻塞持续正压通气对早产儿反复呼吸暂停的疗效观察川[J].上海交通大学学报(医学版),2010,30(7):871-873.
[4] 邵肖梅,叶鸿瑁,丘小汕.实用新生儿学[M].4版.北京:人民卫生出版社,2011:245-247.
[5] 姚仁芬,金慧珠,胡婷,等.简易自制振动式水囊床在早产儿呼吸暂停中的应用[J].中外医疗,2010,29(31):186.
[6] 金淑芹,刘金秀,杜占彩,等.简易水床及体位护理对早产儿呼吸暂停的干预效果分析[J].全科护理,2014,12(29):2710-2711.
[7] Abu-Shaweesh JM,Martin RJ.Neonatal apnea:what’s new[J].Pediatr Pulmonol,2008,43(10):937-944.
[8] De Paoli AG,Davis PG,Lemyre B.Nasal continuous positive airway pressure versus nasal intermittent positive pressure ventilation for preterm neonates: a systematic review and meta-analysis[J].Acta paediatrica,2003,92(1):70-75.
[9] De Paoli AG,Morley CJ,Davis PG,et al.In vitro comparison of nasal continuous positive airway pressure devices for neonates[J].Arch Dis Child Fetal Neonatal Ed,2002,86(17):42-45.
[10]武荣,封志纯,刘石.新生儿诊疗技术进展[M].北京:人民卫生出版社,2016:138-142.
[11]Corley A,Caruana LR,Barnett AG,et al. Oxygen delivery through high-flow nasal cannulae increase end-expiratory lung volume and reduce respiratory rate in post-cardiac surgical patients[J].Br J Anaesth,2011,107(6):998-1004.
[12]Osman M,Elsharkawy A,Abdel-Hady H.Assessment of pain during application of nasal-continuous positive airway pressure and heated,humidified high-flow nasal cannulae in preterm infants[J].J Perinatol,2015,35(4):263-267.
[13]Campbell DM,Shah PS,Shah V,et al.Nasal continuous positive airway pressure from high flow cannula versus infant flow for preterm infants[J].J Perinatol,2006,26(9):546-549.
[14]Poets CF.Apnea of prematurity:what can observational studies tell us about pathophysiology[J].Sleep Med,2010,11(7):701-707.
