55株鸡胚源沙门菌的耐药性分析及ESBLs基因检测
2017-02-06徐耀辉邓同炜齐亚如韩文龙韩雨奇蒋增海卢建洲
徐耀辉 , 邓同炜 , 齐亚如 , 韩文龙 , 韩雨奇 , 蒋增海 , 卢建洲
(河南牧业经济学院动物医学院 , 河南 郑州 450046)
禽沙门菌病是一类重要的禽传染病,可以造成幼雏大量死亡、蛋鸡产蛋率下降、种蛋孵化率、出雏率下降,弱雏率增加,该病具有水平传播和垂直传播的特性,对家禽业危害巨大。该类病分为3种类型:鸡白痢、禽伤寒、禽副伤寒,对应的病原分别为鸡白痢沙门菌、鸡伤寒沙门菌,以及由鸡白痢沙门菌与鸡伤寒沙门菌之外的其他沙门菌。其中鸡白痢沙门菌和禽伤寒沙门菌有宿主特异性,主要感染家禽,而禽副伤寒能广泛感染各种动物和人,在自然界中家禽是其重要的贮存宿主。同时沙门菌也是世界上食源性腹泻最常见的病原菌之一,在引起人类食源性肠胃炎的细菌中,沙门菌占第一或第二位[1]。
我国是抗菌药物最大的生产和使用国。抗菌药物在养殖领域对于防治动物疫病和提高养殖效益等方面发挥重要作用。但近年来细菌耐药事件频频发生,细菌耐药已成为一个严峻的全球性问题。超广谱β-内酰胺酶(ESBLs),是一种丝氨酸蛋白酶衍生物,能灭活三代头孢菌素和氨曲南等β-内酰胺类药物,但对酶抑制剂、碳青霉烯类和头霉烯类抗生素敏感,根据质粒编码基因和ESBLs优先水解底物的不同可将其分为TEM型、SHV型、CTX-M型、OXA型和其他型等,其中以TEM、SHV、CTX-M型最为常见。本研究对河南某种鸡场自带孵化场在孵化后期死亡的鸡胚进行调查,了解沙门菌在鸡胚中的感染情况,并对所分离的沙门菌耐药性和ESBLs基因进行检测,分析ESBLs阳性菌株的耐药表型与基因型的关系,为沙门菌的ESBLs分子流行特征的研究及有效防制禽沙门菌病提供依据。
1 材料
1.1 主要试剂TaqDNA聚合酶、dNTP、DNA Marker DL-2 000,均购自南京诺唯赞生物科技有限公司;普通营养肉汤、营养琼脂,均购自北京奥博星有限责任公司;MH琼脂,购自英国Oxoid公司;沙门菌属诊断血清,购自宁波天润生物药业有限公司;麦氏比浊管,购自广东环凯微生物科技有限公司;所用引物由上海生工生物工程技术服务有限公司合成。
1.2 药敏纸片 试验所用的药敏纸片有氨基糖苷类的卡那霉素(K)、庆大霉素(CN)、阿米卡星(AK),青霉素类的氨苄西林(AMP),β内酰胺抑制物类的阿莫西林克拉维酸(AMC),头孢菌素类的头孢他啶(CAZ)、头孢唑林(KZ)、头孢噻呋(EFT),碳青霉烯类的美罗培南(MEM)、亚胺培南(IPM),单环β内酰胺类的氨曲南(ATM),四环素类的四环素(TE)、土霉素(OT),多肽类的多粘菌素B(PB),酰胺醇类的氯霉素(C),喹诺酮类的恩诺沙星(ENR)、环丙沙星(CIP),磺胺类的磺胺甲恶唑(SXT)、磺胺异恶唑(SF),硝基呋喃类的呋喃妥因(F),均购自英国Oxoid公司;头孢噻肟、头孢噻肟/克拉维酸,头孢他啶、头孢他啶/克拉维酸,均购自北京天坛药物生物技术开发公司。
1.3 标准菌株 大肠杆菌ATCC25922,鸡白痢标准株C79-13,肠炎沙门菌标准株50041由扬州大学人兽共患病学江苏省重点实验室惠赠。
2 方法
2.1 细菌的分离与PCR鉴定 从河南省某父母代麻鸡孵化场采集死胚共120份,无菌取鸡胚肝脏、脾脏、卵黄液在S.S.琼脂平板上划线,37 ℃培养18~24 h,挑取疑似沙门菌菌落进行纯化、培养;然后运用煮沸法提取细菌DNA,针对沙门菌肠毒素STN基因设计引物[2]进行PCR鉴定,将PCR鉴定为阳性的细菌再用全自动细菌鉴定仪进一步鉴定。
2.2 血清型鉴定 将鉴定为阳性的沙门菌进行动力学试验,以肠炎沙门菌和鸡白痢标准株为对照,可知无动力的分离株为鸡白痢或鸡伤寒沙门菌,有动力的为禽副伤寒沙门菌,对于禽副伤寒沙门菌可通过玻片凝集法进行血清型分型,根据Kauffmann-White抗原表[3]检索沙门菌分离株的血清型。以生理盐水为阴性对照,排除自凝现象。
2.3 药敏试验 根据K-B纸片扩散法进行药敏试验,具体参照美国临床实验室标准化协会 (Clinical and Laboratory Standards Institute,CLSI)手册进行[4],以E.coli(ATCC25922)为质控菌株,测定分离菌株的药物敏感性。
2.4 产ESBLs菌株的筛选及确证试验 参照药敏试验结果,筛选出抑菌圈直径,头孢他啶≤22 mm,氨曲南≤27 mm,头孢曲松≤25 mm,3种药物符合任意一种的菌株,然后对筛选出来的菌株,运用双纸片协同测试法[5],将头孢噻肟、头孢噻肟/克拉维酸,头孢他啶、头孢他啶/克拉维酸4个药敏纸片贴于涂有待检菌的MH琼脂培养基上,37 ℃培养 16~18 h后,测量抑菌圈直径,两个药物中任何一个,在加克拉维酸后,抑菌圈直径与不加克拉维酸时的抑菌圈直径相比,增大值≥5 mm时,判定该菌产ESBLs。
2.5 ESBLs基因的PCR检测 根据文献上[6]已发表的沙门菌的12对ESBLs基因序列,在NCBI数据库上进行BLSAT比对,确保引物序列正确无误,分别合成了12对特异性引物。PCR反应体系20 μL,常规PCR反应条件,各个基因的退火温度见表1,扩增产物经琼脂糖凝胶电泳检测。若与预期条带大小一致即为阳性。将PCR阳性产物均送至上海生工生物工程技术服务有限公司测序,将测序结果再次进行BLAST比对,确认所检测的基因。

表1 PCR扩增反应条件及引物
3 结果
3.1 细菌分离鉴定结果 从120枚死胚共分离到55株沙门菌,分离率为45.83%;经血清学鉴定,共有6种血清型(见表2)。

表2 55株沙门菌血清分型结果及其分离率
3.2 药敏试验结果 55株沙门菌分离株对磺胺异恶唑耐药率最高(76.36%),所有菌株对美罗培南、亚胺培南均敏感;对氯霉素、环丙沙星、恩诺沙星较敏感(耐药率1.82%);且副伤寒沙门菌的耐药情况明显严重于鸡白痢沙门菌,见表3。
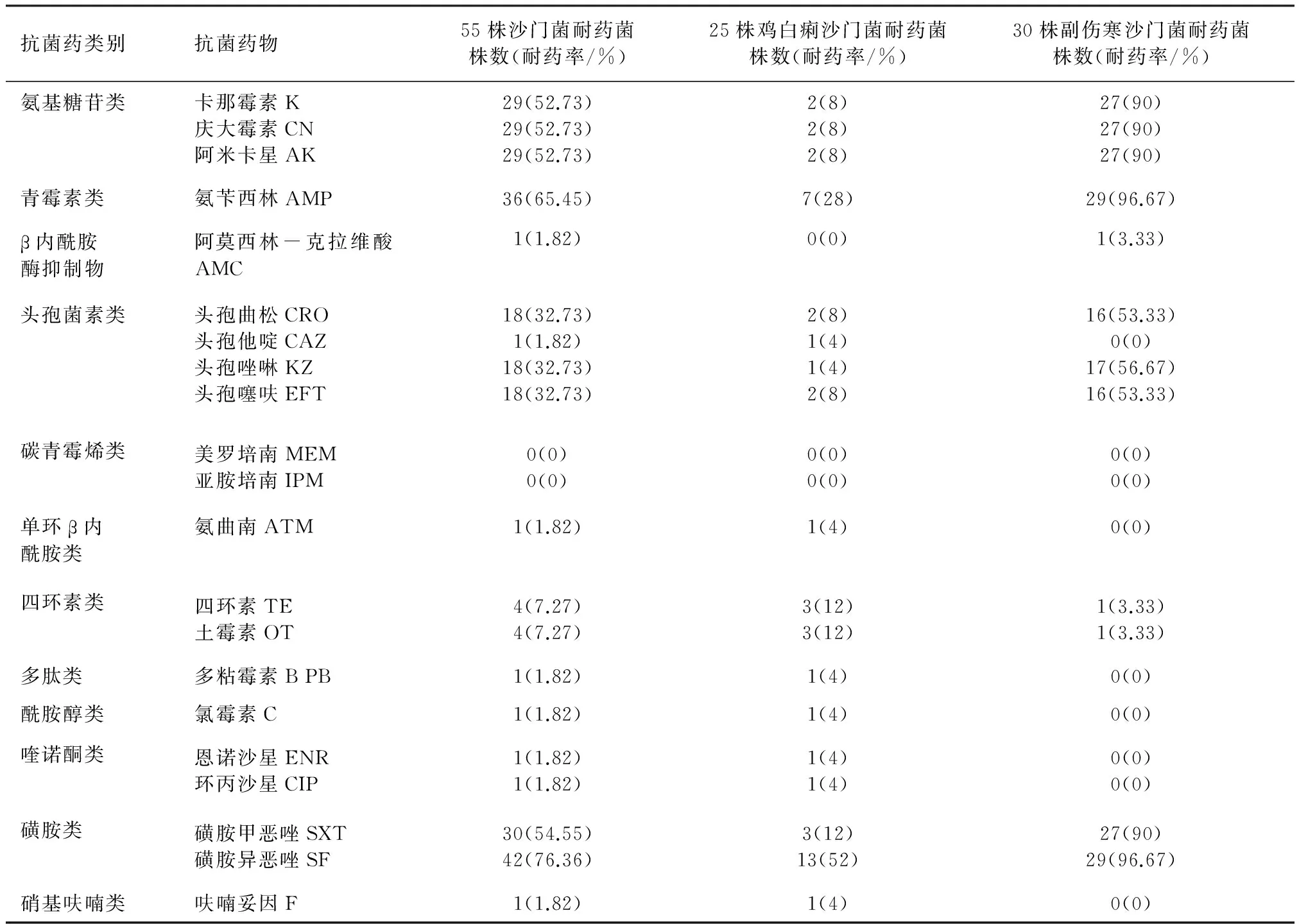
表3 沙门菌药敏试验结果
由表4可以看出,55株沙门菌分离株的多重耐药情况严重,最多可对八类15种抗菌药物耐药,其中二耐、三耐菌株的耐药率为1.82%~20%,最为严重的是耐氨基糖苷类-青霉素类-头孢类-磺胺类的四耐菌株,所占比例高达30.91%。
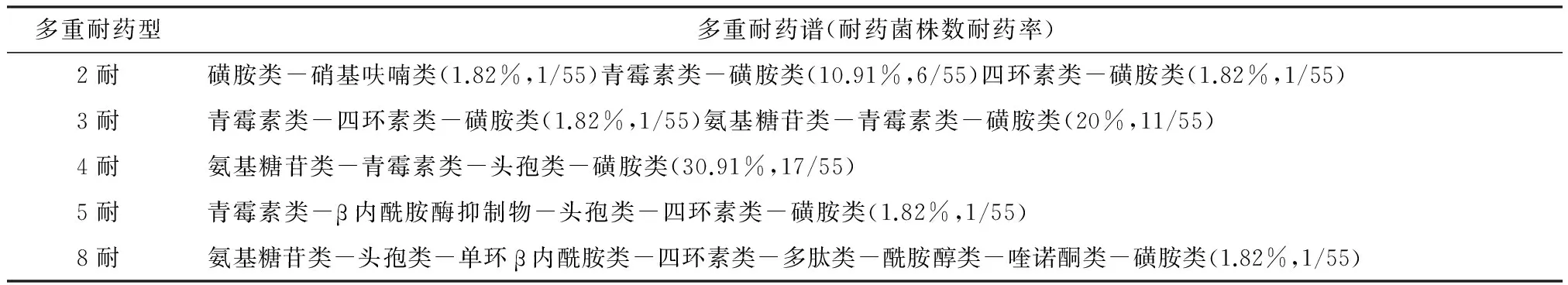
表4 沙门菌的耐药谱
3.3 ESBLs菌株的耐药情况及其基因的检出情况 运用双纸片协同法进行ESBLs筛选和确证试验,结果表明,产ESBLs菌株为16株,阳性率(29.09%)较高,且ESBLs阳性菌株对氨基糖苷类、青霉素类、头孢菌素类和磺胺类的耐药率均为100%,其耐药情况明显严重于ESBLs阴性菌株,详见表5。经PCR扩增和测序、序列比对,16株ESBLs阳性菌株只检出TEM一种耐药基因,检出率为100%,其余11种均未检出。
4 讨论
4.1 沙门菌的分离情况及耐药性分析 试验从某自带孵化场的种鸡场采集120个死胚,共分离鉴定出55株沙门菌,检出率为45.83%,包含6种血清型,表明该场的沙门菌病流行严重且血清型复杂。其中鸡白痢沙门菌25株,占45.45%;禽副伤寒沙门菌30株,占54.55%;副伤寒沙门菌不仅对鸡只危害大,污染了鸡肉、鸡蛋后,对人的潜在威胁也很大,需要引起重视。
药物的选择性压力是造成细菌耐药的主要原因。鸡场抗菌药物的大量使用,使沙门菌的抗药性日益严重。本研究中,分离的鸡白痢沙门菌与禽副伤寒沙门菌均产生了较严重的耐药性,但二者对不同药物的耐药程度不同。在21种药物中,副伤寒沙门菌对9种药物的耐药率显著超过鸡白痢沙门菌,分别为卡那霉素、庆大霉素、阿米卡星、氨苄西林、头孢噻呋、头孢曲松、头孢唑啉、磺胺甲恶唑、磺胺异恶唑,两者间耐药差异可能与副伤寒沙门菌的传播宿主更广泛,循环更复杂有关。本研究中所有沙门菌对四环素、土霉素的耐药率不高,可能与用药习惯的不同有关;对氨基糖苷类、青霉素类及磺胺异恶唑耐药率较高,在51.85%~75.93%之间,临床上应减少使用这些药物,避免产生更加严重的耐药性;对于畜禽禁止使用的氯霉素、氨曲南、美罗培南、亚胺培南耐药率低,其中氯霉素是由于副作用过大,世界各国在所有食品动物上几乎都已禁止使用,氨曲南、美罗培南、亚胺培南只允许在人医上使用,在兽医上为禁用药。表明加强兽药管理可以减少细菌耐药性的产生。
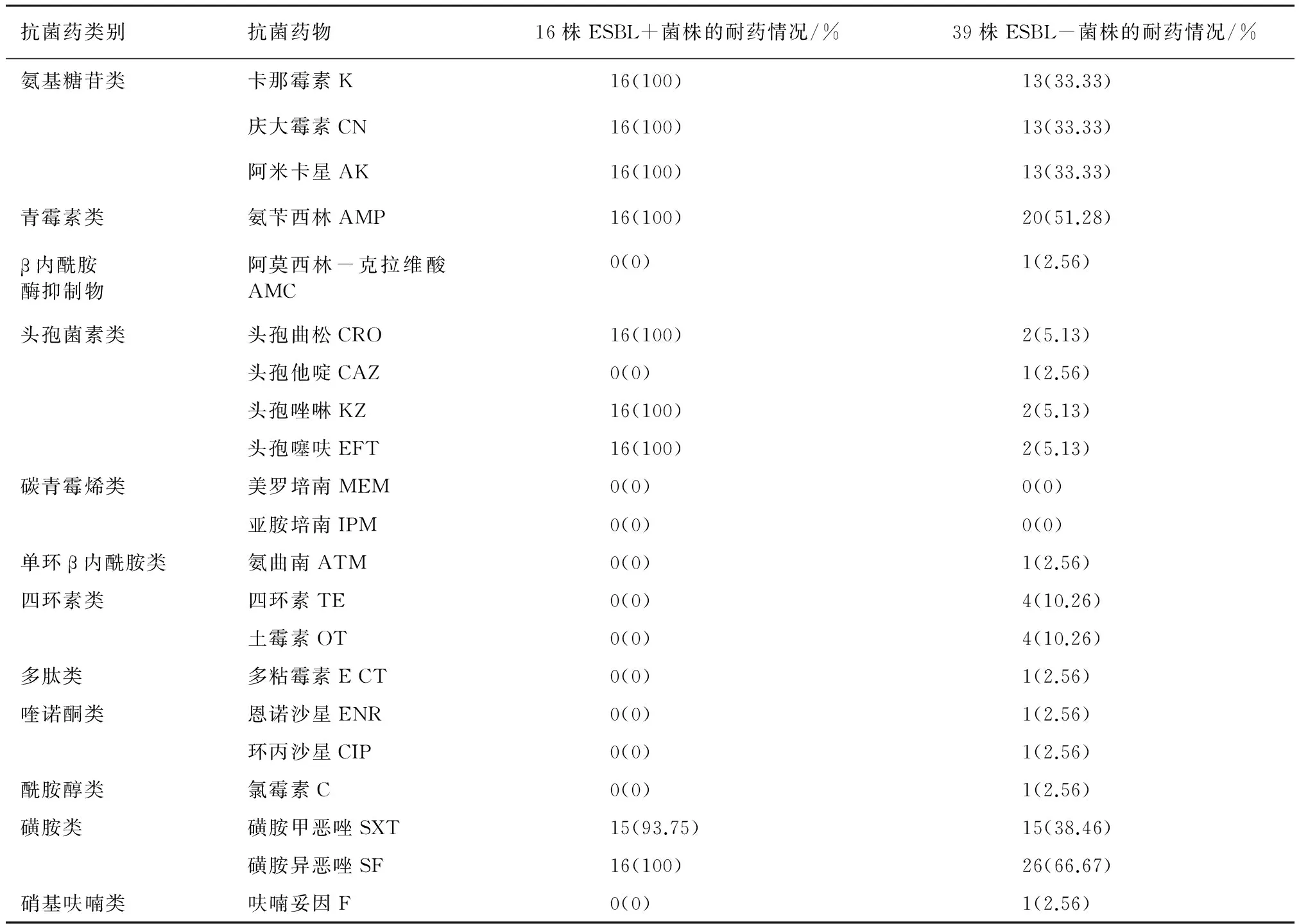
表5 产ESBLs和不产ESBLs菌株的耐药情况的比较
4.2 ESBLs阳性菌株耐药性分析及ESBLs基因流行特征 通过ESBLs的初筛和确证试验可知,ESBLs阳性菌有16株,占分离总沙门菌株数量的29%,比杨玲报道的从猪肉中分离到的沙门氏菌中ESBLs阳性菌占17.46%高[7]。ESBLs阳性菌的耐药情况明显比ESBLs阴性菌严重,其中差别最大的是头孢菌素类抗菌药,除头孢他啶外,ESBLs阳性菌对其他3种头孢类的耐药率为100%,而ESBLs阴性菌的耐药率仅为5.13%,其次是青霉素类的氨苄西林,耐药率相差50%左右,对其余β-内酰胺类抗菌药物的耐药率差异不明显,且耐药率均比较低,这些药可能为该养殖场不常用的抗菌药。ESBLs阳性菌株不仅对头孢菌素类、青霉素类耐药,还对氨基糖苷类、磺胺类交叉耐药,对这四类药物的多重耐药率为100%;与有关文献[8]报道的ESBLs阳性菌株往往表现为严重的多重耐药性相符。ESBLs可水解碳青霉烯类以外的β-内酰胺酶类抗生素,比如能水解青霉素类、头孢菌素类、单环β-内酰胺类及β内酰胺酶抑制物类,降低它们的疗效;因此,即使体外药敏试验敏感,对于ESBLs阳性菌也不可使用青霉素、一、二、三代头孢菌素、氨曲南和阿莫西林克拉维酸[9]。因此,在临床用药时,为了更加高效的治疗疾病,需要药敏试验与ESBLs确证试验相结合,合理选用抗菌药物;同时,应注意临床不能长期固定使用某几种抗菌药物,应交替轮换用药;当一种药物无效时不应更换使用同类药物,以避免交叉耐药。
动物源沙门菌中的ESBLs基因型众多,在全球范围内流行,不同国家、地区的基因型流行特征存在差异。北美国家食品动物源性沙门菌以TEM和PSE型ESBLs基因为主,欧洲国家以CTX-M型为主,而中国则以TEM、CTX-M、CMY-2及OXA型为主,SHV型检出率相对较低[10]。国内报道的ESBLs基因流行特征的相关研究大多数为大肠杆菌的检出情况,而本研究中16株ESBLs表型阳性的菌株均检测出TEM (100%) ESBLs基因,其余11种ESBLs基因均未检出,表明本场沙门菌ESBLs阳性菌株以TEM基因型为主。由于本次研究只调查了河南省一个麻鸡种鸡场,有一定的局限性,不能代表整个河南省沙门菌的耐药情况及ESBLs基因的流行特征,但从此次调查可以看出,ESBLs阳性菌株检出率较高,耐药情况已十分严重,由于ESBLs可水解碳青霉烯类以外的β-内酰胺酶类抗生素,有极强的耐药性,且耐药细菌可通过食物链传播给人类,在临床用药时应谨慎用药,切莫为了短期效益使用禁用兽药,给人类带来巨大威胁。
[1] Majowicz S E, Musto J, Scallan E,etal. International Collaboration on Enteric Disease “Burden of Illness” Studies. The global burden of nontyphoidal Salmonella gastroenteritis. Clin[J]. Infect Dis, 2010,50:882-889.
[2] 刘蓓蓓. 沙门菌 PCR 检测方法的建立及其初步应用[D]. 扬州:扬州大学,2009:26-28.
[3] 朱超,许学斌.沙门菌属血清型诊断[M].上海:同济大学出版社, 2009:145-292.
[4] CLSL. M100-S25 Performance standards for antimicrobial susceptibility testing [S]. Wayne,P A: Clinical and LaboratoryStandards Institute, 2015:44-60.
[5] 匡秀华. 华中地区三种畜禽病原菌耐药和毒力的流行性及分子特征研究[D]. 武汉:华中农业大学, 2015:38-128.
[6] 杨玲, 江桂泽, 李湾,等. 屠宰场猪肉中产CTX-M沙门氏菌传播分子特征[C]中国畜牧兽医学会兽医药理毒理学分会会员代表大会暨第十三次学术讨论会与中国毒理学会兽医毒理专业委员会第五次学术研讨会.2015:188-189.
[7] Livermore D M, Canton R, Gniadkowski M,etal. CTX-M: changing the face of ESBLs in Europe[J]. Journal of Antimicrobial Chemotherapy, 2007, 59(2):165-174.
[8] 姜森, 张正, 杨朵,等. 2 062株大肠杆菌ESBL测定及耐药分析[J]. 中国实验诊断学, 2008, 12(9):1 134-1 136.
[9] 赵俊利, 石瑞丽, 李志芳,等. 内蒙古地区奶牛源致病性沙门氏菌耐药性分析及ESBLs基因检测[J]. 中国畜牧兽医, 2015, 42(8):2 150-2 159.
