基于16S/18S rRNA基因文库技术研究酿醋大曲固态发酵过程中微生物群落结构演变
2017-01-19刘雄甘兴罗立新
刘雄,甘兴,罗立新
(华南理工大学,生物科学与工程学院,广东广州510006)
基于16S/18S rRNA基因文库技术研究酿醋大曲固态发酵过程中微生物群落结构演变
刘雄,甘兴,罗立新
(华南理工大学,生物科学与工程学院,广东广州510006)
针对酿醋大曲发酵过程中不同阶段样品,以16S/18S rRNA基因为目的片段,采用16S/18S rRNA克隆文库法分析大曲中细菌、真菌微生物群落的组成,并通过丰度和多样性分析剖析发酵过程中微生物群落的演变。整个固态发酵过程中,细菌类共检测到4个目14个属,真菌类共检测到3个目11个属。大曲固态发酵过程中微生物群落结构呈现明显动态变化。其中,片球菌(Pediococcus),乳杆菌(Lactobacillus),明串珠菌(Leuconostoc)以及毕赤酵母(Pichia)为固态发酵前期优势菌;泛菌属(Pantoea),肠杆菌属(Enterobacter),阪崎肠杆菌(Cronobacter)以及淀粉霉(Amylomyces),根霉(Rhizopus)为固态发酵中后期优势菌;而芽孢杆菌(Bacillus)以及Rasamsonia,曲霉菌(Eurotium)为固态发酵后期优势菌。PCA分析表明,酿醋大曲固态发酵过程中不同阶段的微生物种群多样性不一,发酵1 d、3 d,发酵7 d、13 d,发酵19 d、25 d、30 d各分为一类。研究大曲制作过程中菌群结构演变,对提高食醋品质具有重大意义。
酿醋大曲;克隆文库;微生物群落;固态发酵;动态演变
大曲中的微生物组成主要分为细菌、酵母菌、霉菌3种,其群落组成对后续的酿造生产起着关键作用且各自扮演着不同角色。在酿造中,细菌主要产生蛋白酶、淀粉酶及多种有机酸[2];酵母菌主要合成一系列的酯类、酸类、醇类、醛类等风味物质[3];霉菌则是主要的糖化微生物群,并且还形成部分酯类和其他物质来改善风味[4]。
目前对大曲的研究主要集中在酿酒大曲,而对醋用大曲微生物多样性研究较少。本研究采用16S/18S rRNA基因克隆文库法对酿醋大曲微生物菌群进行种类和丰度的分析,该方法被广泛应用于各种环境样品或食品中的微生物生态分析,且不需要微生物的纯培养,能更全面地揭示各种生态环境样品中的微生物多样性[5]。
1 材料与方法
1.1 样品采集
根据陕西某食醋厂大曲固态发酵过程中传统的成熟阶段,分别取发酵1 d(室温)、3 d(35~38℃)、7 d(40~50℃)、13 d(53~60℃)、19 d(35~40℃)、25 d(28~34℃)和30 d(室温)的大曲样品。粉粹后保存至-20℃下,用于后续分析。
1.2 样品基因组提取
样品预处理如下:取0.5 g大曲样品,置于2m L离心管中,再加入1m L PBS缓冲液,浸泡30m in,12000 r/m in离心2m in,弃上清液,收集菌体。之后采用Omega soil DNA kit提取微生物基因组DNA,详细提取步骤参见操作说明书。用1%的琼脂糖凝胶电泳对提取后的基因组DNA进行检测(98 V,25min),同时采用核酸蛋白测定仪测定样品基因组DNA的浓度。基因组于-20℃下保存。
1.3 16S/18S rRNA基因克隆文库构建
(4)技术力量在突破人类中心论中扮演了重要角色。因为技术力量对人类行为及其后果的改变,使得伦理学研究范畴超越了传统的时间和空间范围,因此,势必将打破大部分早期伦理体系中的人类中心论地位。与早期伦理学关注人、人的行为和行为后果不同,技术时代的伦理视域已经扩展开来,并逐渐呈现出一种宏大的、整体的视角。人的伦理学不仅关注人,而且关注人类整体,关注人类处于其中的自然。此外,从一种存在主义的视角看,人类的独断的情感和态度,与人类自身生存的未来已经不相符合,对人类自身,尤其是大自然的认识需要调整适应,建立一种突破人类中心论的伦理学势在必行。
1.3.1 16S/18S rRNA基因扩增与纯化
分别采用细菌通用引物27F/1492R,真菌通用引物NS1/FR1[6]扩增16S/18S rRNA基因。扩增的目的基因利用OMEGA胶回收试剂盒进行纯化回收。
1.3.2 16S/18SrRNA基因TA克隆
纯化后的PCR产物与载体PMD 18-T vector在16℃连接1 h,然后转化到E.coil DH5α-感受态细胞后培养1.5 h,最后取适量菌液均匀涂布在有氨苄青霉素的LB平板,37℃过夜培养。在平板上随机挑选菌落为模板,M 13F和M 13R[7]为引物进行菌落PCR,保证每个目的基因阳性克隆不少于80个。
1.3.3 阳性克隆子的RFLP分析
将菌落PCR验证为阳性克隆子的16S/18S rRNA基因PCR产物分别用内切酶HinfI和MspI(Justéet al. 2014),HinfI和Hae III[8]进行双酶切。再用浓度为10%的中性PAGE胶,于150 V电压下电泳70m in分析酶切产物,最后分析酶切产物的电泳图谱,分类不同类型的图谱,并计算每种图谱出现的频率,挑选每种图谱具有代表性的阳性克隆子送往广州艾基生物有限公司进行测序分析。
1.4 数据分析
序列相似性大于97%视作同一OTU。将每个OTU序列与NCBI数据库比对并且挑选同源性最高的序列。再选取与OTU序列相近的序列与OTU序列一起通过MEGA6.0软件中的Neighbor-Joining构建系统发育树[9]。根据每个样品中OTU数量和种类的不同,分析微生物的多样性,并用SPSS17.0软件进行主成分分析,对大曲制作过程中微生物群落结构的变化进行剖析。
2 结果与分析
2.1 16S/18S rRNA基因克隆文库
部分阳性克隆子菌落PCR琼脂糖凝胶检测图见1,目的条带明显,阳性克隆率较高。对菌落PCR产物双酶切后用中性PAGE胶检测,部分分型琼脂糖凝胶检测图见图2,分型效果较好,易于OTU分类。

图1 部分阳性克隆子菌落PCR电泳图

图2 部分RFLP中性PAGE电泳图
通过对阳性克隆子测序结果和不同OTU数目计数,分析了大曲样品中微生物种类与丰度。通过聚类分析,16S rRNA基因克隆文库共发现32个OTU,分属于14个属,见图3。在大曲发酵前期,Pediococcus、Lactobacillus、Leuconostoc为优势菌属,随即在中后期呈下降趋势,最后相对丰度降低甚至检测不出。其中,Pediococcus在1 d时丰度为40%,随着发酵时间的增长,丰度逐渐降低,最后在30 d时,甚至未检测出。不同于Pediococcus在整个发酵过程中相对丰度呈现出逐渐降低的趋势,Lactobacillus与Leuconostoc只在第1天和第3天检测到。Lactobacillus丰度从第1天的37%降低至第3天的33%,随后至发酵结束并未检测出。Leuconostoc丰度从第1天的13%明显降低至第3天的1%,随后至发酵结束并未检测出。而在大曲发酵中期,Pantoea、Enterobacter、Cronobacter为主要的优势菌属。其中,Pantoea的相对丰度从第3天的12%迅速增长至第7天的61%,Enterobacter的相对丰度从第3天的20%增长至第7天的31%,并分别于第7天达到该属在整个发酵过程中的最高丰度;Pantoea相对丰度从第7天的61%逐渐降低,在第25天降低至17.5%,随即在第30天迅速增长至52%,并成为成熟大曲中的主要优势菌之一。在大曲后期,Bacillus成为优势菌属,其相对丰度从第19天的30%明显增加至第25天的70%,随后在第30天降低至25%。在第30天时,成熟大曲中检测的主要细菌属主要为Pantoea(52%),Bacillus(25%),Enterobacter(10%),Thermoactinomyces sanguinis(7%)。
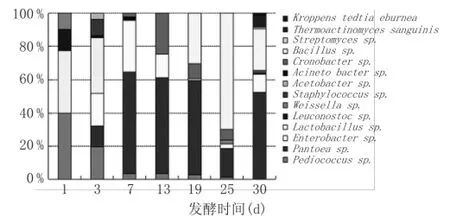
图3 16S rRNA基因文库
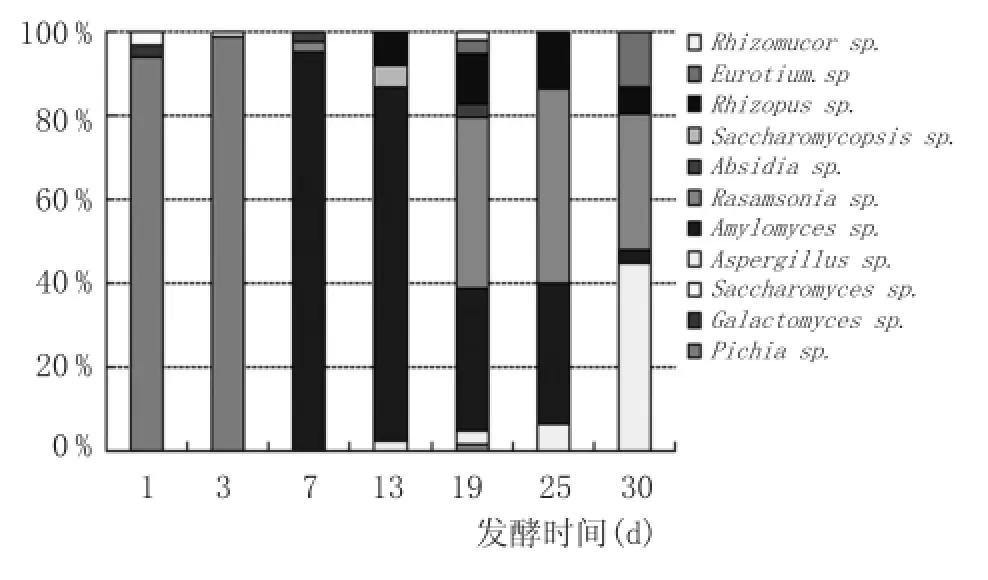
图4 18S rRNA基因文库
通过18S rRNA基因文库构建,共发现13个OTU,分属于11个属,见图4。在大曲前期,Pichia anomala为绝对优势菌属,在第3天时相对丰度为99%,而其在中后期基本没有检测到,只有在第19天时检测到2%。惠丰立等[10]在分析某中温大曲酵母群落结构时,共发现Pichia、Saccharomyces、Debaryomyces、Zygosaccharomyces、Endomyces、Candida、Hanseniaspora、Rhodotorula、Issatchenkia等9个已知酵母菌属。本研究所发现的酵母属种类相对较少且单一,且在前期占据真菌类的主导地位,与报导的文献有一定区别。在大曲发酵中期,Amylomyces、Rasamsonia、Rhizopus为优势菌属,其中Amylomyces相对丰度在第7天高达95%,Rasamsonia从第7天开始检测出,相对丰度在第25天达到最高的47%,且在成熟大曲中的显示依然占有很大比重。Rhizopus只有在发酵过程中的第13天至第30天有检测到,其丰度一直在10%左右上下浮动,最后在第30天稳定在6%;在大曲发酵后期,Aspergillus有增长趋势。主要的优势菌属为Aspergillus(45%),Rasamsonia(32%),Eurotium(12%),Rhizopus (6%)。
通过对测序结果比对,选出最相近和次相近的序列构建进化树,见图5和图6。其中,16S rRNA基因文库进化树(图5)显示,细菌类微生物主要可分为4大类:Enterobacteriales,Actinomycetales,Bacillales和Lactobacillales。18S rRNA基因文库进化树(图6)显示,真菌类微生物主要分为3大类,Eurotiales,Saccharomycetales和Mucorales。
2.2 16S/18S rRNA基因克隆文库PCA分析
细菌和真菌微生物的多样性主成分分析见图7。PCA分析表明,发酵1 d、3 d可聚为一类,发酵7 d、13 d可聚为一类,而19 d、25 d、30 d可聚为一类。微生物多样性的聚类与大曲整个制作过程的温度变化保持一定的相关性,在传统大曲制作过程中,大曲发酵前7 d温度持续上升,发酵7 d以后进入大火阶段,温度达到峰值;后期温度逐步下降,证明温度对大曲微生物多样性的影响是一个比较重要的因素[11]。
根据16S/18S rRNA基因克隆文库中每个OTU阳性克隆子的数量,结果见表1。每个大曲样品的阳性克隆子最少的有159,最高的有206,满足文库标准。文库覆盖率在92%以上,最高98%。从指数H、J和D可以看出,大曲微生物的多样性是先升后降又升的趋势,在大曲发酵前3 d,最高温度不到40℃,适合绝大多数的微生物生长,所以微生物多样性增加。发酵3~7 d之间温度持续升高至55℃,微生物多样性略有下降。发酵19 d以后,温度也降到38℃左右,微生物多样性又开始逐渐增加。
3 讨论
大曲微生物群落组成复杂,不同的微生物群落组成使得大曲种类不一。在白酒生产过程中,不同类型的大曲使用的生产目标不一,可见大曲对于产品特色与质量的重要性,本实验以陕西某醋厂生产使用的大曲为研究对象,基于16S/18S rRNA基因为目的片段,采用微生物指纹图谱分析技术16S/18S rRNA克隆文库法分析了大曲中微生物群落的组成,共发现37个细菌菌种,分属于16个属,其中,Pediococcus、Lactobacillus、Leuconostoc、Pantoea、Enterobacter、Cronobacter、Bacillus为大曲中的主要的细菌类群。共发现13个真菌菌种,分别属于11个属,其中,Amylomyces、Rasamsonia、Rhizopus、Aspergillus、Eurotium、Pichia为大曲中主要的真菌类群。
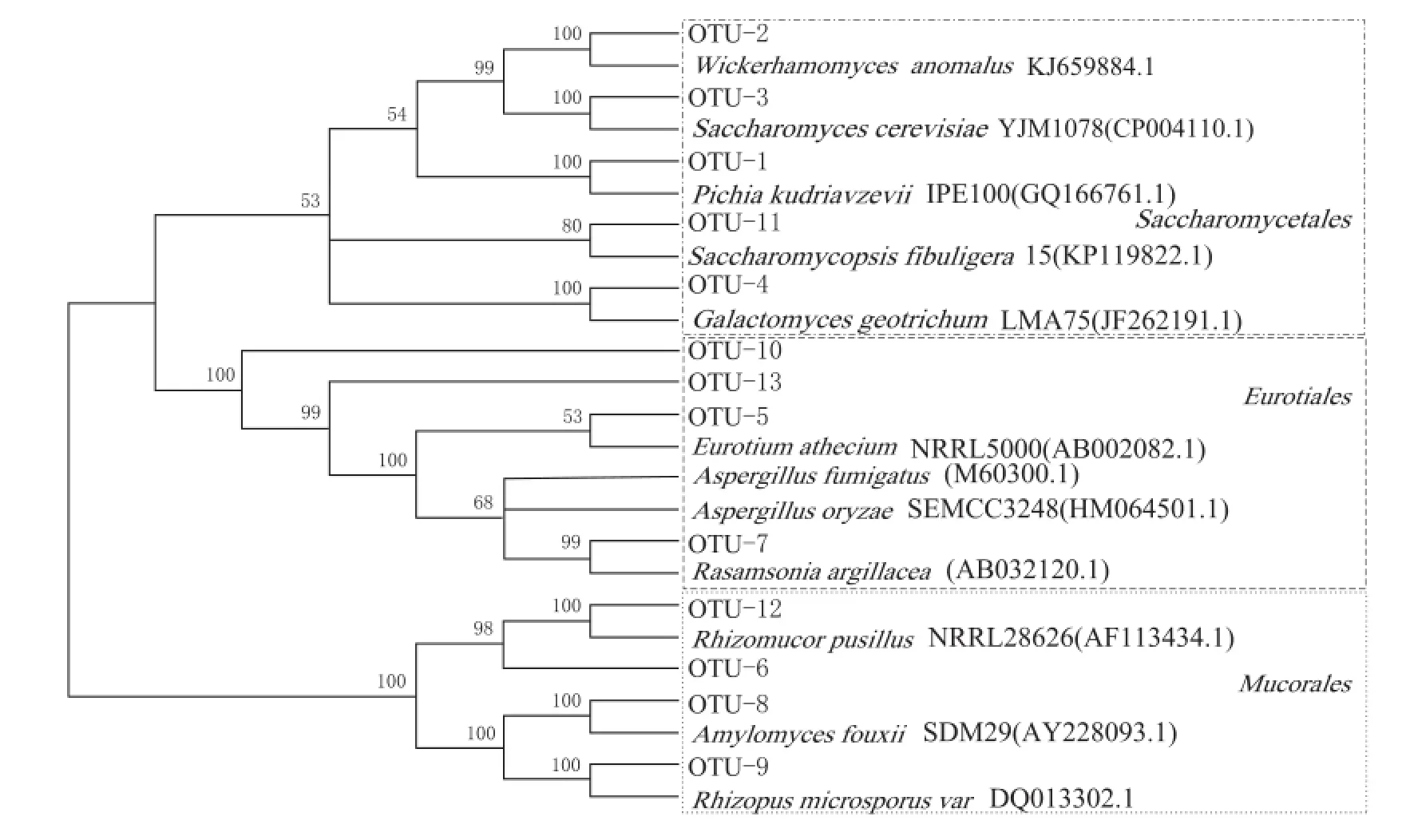
图6 18S rRNA基因文库系统发育树
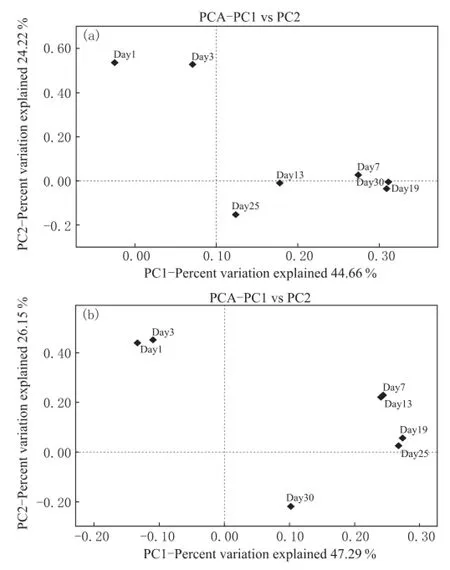
图7 16S/18S rRNA基因克隆文库PCA分析
目前,国内学者采用多种生态学技术手段研究并阐述了各类大曲中微生物多样性。陈玲等[12]利用克隆文库法与高通量测序法得出浓香型大曲优势细菌群落分别为Bacillus、Lactobacillaceae、Pseudomonas、Streptomyces、Erwinia和unclassified Enterobacteriaceae;汤斌等[13]通过构建16S rDNA克隆文库,得出大曲中细菌微生物主要为Lactobacillaceae和Bacillus;罗惠波等[14]利用可培养真菌的分离鉴定方法得出大曲中Aspergillus、Monascus、 Rhizomucor、Lichtheimia、Saccharomycescerevisiae、Wickerhamomycesanomala、Sporidioboluspararoseus为主要优势真菌类群;王海燕等[15]通过PCR-DGGE技术比较了不同香型大曲中的细菌、酵母及霉菌组成差异,结果表明,大曲内酵母优势类群为Saccharomycopsisfibuligera和Pichiaanomala,还存在其他非酵母菌科的酵母如Hanseniaspora guilliermondii、Debaryomyceshansenii、Issatchenkiaorientalis、Trichosporonasahii等。
从以上研究报道与本次克隆文库实验检测的优势菌落结果可以得出Lactobacillaceae、Bacillus、Rhizopus、Aspergillus、Pichia为大曲比较常见的优势群落。Bacillus可产生吡嗪、芳香族类、有机酸类物质,它们可能对白酒的风味产生重要作用[16]。乳酸作为食醋中含量仅次于醋酸的一种有机酸,其不仅是食醋中不挥发酸的重要组成成分,也是食醋的重要呈味物质[17],乳酸菌能利用碳水化合物在发酵过程中产生乳酸[18],所以Lactobacillaceae对食醋的风味贡献突出;霉菌是我国传统发酵食品的菌种,Rhizopus能产生丰富的葡萄糖淀粉酶,因而可能将原料中的淀粉直接降解为酵母菌可利用的还原糖,进而刺激酵母菌的生长,同时,促进原料中的碳源向发酵终产物酒精的代谢流[19],Aspergillus产生糖化酶、淀粉酶,Pichia产酒精与乳酸菌联合作用生成酯类物质等丰味物质[20]。本次对微生物群落的研究中,除了检测到其他大曲研究中检测到的常见功能种群外,整个微生物群落组成和演变与其他大曲研究不同,造成这种区别的原因可能是本实验研究的大曲为制醋大曲,而非制酒大曲。
本研究中,乳酸菌Pediococcus、Lactobacillus、Leuconostoc及酵母菌Pichia为固态发酵前期优势菌;细菌Pantoea、Enterobacter、Cronobacter及真菌Amylomyces、Rhizopus为固态发酵中后期优势菌;而细菌Bacillus及真菌Rasamsonia,Eurotium为固态发酵后期优势菌。其演变规律与汾酒大曲微生物群落结构演变规律相类似[21]。Bacillus为大曲发酵后期的绝对优势菌种与江东材[22]的研究中芽孢杆菌在片高温大曲发酵过程的演变相似。而大曲固态发酵过程中,发酵温度被认为是影响大曲微生物群落结构动态演变的重要因素[23]。下一步,将集中研究大曲固态发酵过程中微生物群落结构与环境因子间内在联系,以期对环境因子胁迫下食醋大曲固态发酵过程微生物演变规律有一个更全面的认识。
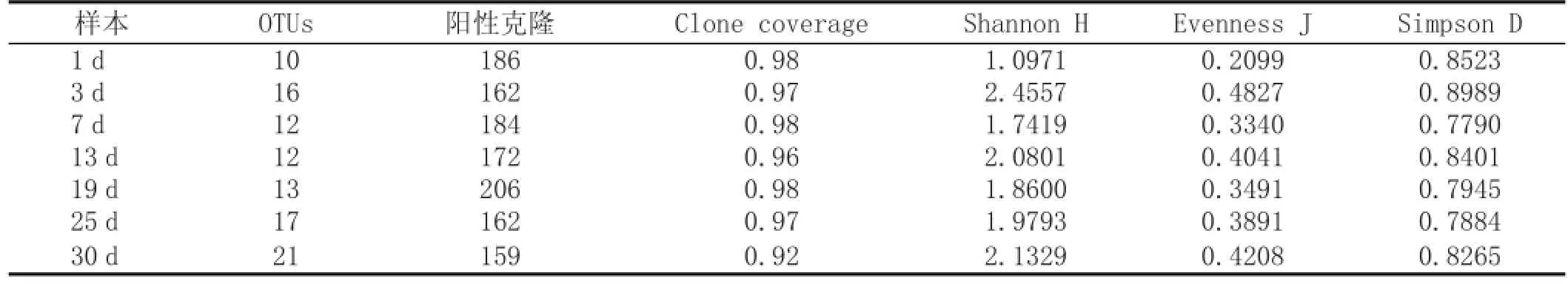
表1 16S/18S rRNA基因克隆文库多样性指数分析
[1]LIP,LIS,CHENG L,et al.Analyzing the relation between the microbial diversity of Daqu and the turbidity spoilage of traditional Chinese vinegar[J].Applied microbiology and biotechnology,2014,98(13):6073-6084.
[2]雷振河.汾酒发酵主要有机酸成分分析与产酸细菌的鉴定[J].酿酒,2011,38(4):24-28.
[3]WUQ,XU Y,CHEN L.Diversity of yeast species during fermentative process contributing to Chinese Maotai-flavour liquor making[J].Letters in applied microbiology,2012,55(4):301-307.
[4]杨跃寰,叶光斌,边名鸿,等.泸曲中两株高产糖化酶菌的分离鉴定与初步应用[J].酿酒科技,2013(10):65-68.
[5]OLINE D K.Phylogenetic comparisons of bacterial communities from serpentine and nonserpentine soils[J]. Applied and environmental microbiology,2006,72(11):6965-6971.
[6]VAINIO E J,HANTULA J.Direct analysis of wood-inhabiting fungi using denaturing gradient gel electrophoresis of amplified ribosomal DNA[J].Mycological research,2000,104 (08):927-936.
[7]STUBNER S.Enumeration of 16S rDNA of Desulfotomaculum lineage1 in rice field soil by real-time PCR with SybrGreen™detection[J].Journal of microbiological methods,2002,50(2):155-164.
[8]KIM TW,LEE JH,KIM SE,et al.Analysis of microbial communities in doenjang,a Korean fermented soybean paste, using nested PCR-denaturing gradient gel electrophoresis[J]. International journal of food microbiology,2009,131(2/3):265-271.
[9]LIANG B,WANG LY,MBADINGA SM,et al. Anaerolineaceae and Methanosaeta turned to be the dominant microorganisms in alkanes-dependent methanogenic culture after long-term of incubation[J].AMB Express,2015,5:37.
[10]惠丰立,柯涛,褚学英,等.大曲中酵母菌种群结构及多样性分析[J].食品与生物技术学报,2009,28(1):102-106.
[11]WANG H Y,XU Y.Effect of temperature on microbial composition of starter culture for Chinese light aroma style liquor fermentation[J].Lett appl microbiol,2015,60(1):85-91.
[12]陈玲,袁玉菊,曾丽云,等.16S rDNA克隆文库法与高通量测序法在浓香型大曲微生物群落结构分析中的对比研究[J].酿酒科技,2015(12):33-36.
[13]汤斌,刘金英,周庆武,等.免培养技术对浓香型白酒大曲中细菌多样性的影响[J].食品与发酵工业,2011,37(9):36-40.
[14]罗惠波,杨晓东,杨跃寰,等.浓香型大曲中可培养真菌的分离鉴定与系统发育学分析[J].现代食品科技,2013(9):2047-2052.
[15]WANG HY,GAO Y B,FAN Q W,et al.Characterization and comparison of microbial community of different typical Chinese liquor Daqus by PCR-DGGE[J].Lett appl microbiol, 2011,53(2):134-140.
[16]YAN Z,ZHENG XW,HAN B Z,et al.Monitoring the ecology of Bacillus during Daqu incubation,a fermentation starter,using culture-dependent and culture-independent methods[J].J microbiol biotechnol,2013,23:614-622.
[17]蒋忠,冯文利,王伟,等.乳酸菌和酵母菌共酵改善食醋品质的研究[J].中国酿造,2015,34(9):104-108.
[18]侯小歌,杜小波,李学思,等.中温大曲中乳酸菌的分离鉴定及产酸特性[J].酿酒科技,2010(9):17-20.
[19]乔晓梅,赵景龙,杜小威,等.高通量测序法对清香大曲真菌群落结构的分析[J].酿酒科技,2015(4):28-31.
[20]ZHENG XW,YAN Z,HAN B Z,et al.Complex microbiota of a Chinese"Fen"liquor fermentation starter(Fen-Daqu), revealed by culture-dependent and culture-independent methods[J].Food microbiol,2012,31(2):293-300.
[21]ZHENG X W,YAN Z,NOUT M R,et al.Microbiota dynamics related to environmental conditions during the fermentative production of Fen-Daqu,a Chinese industrial fermentation starter[J].Int j food microbiol,2014,182:57-62.
[22]江东材,周瑞平,陈云宗,等.偏高温大曲发酵过程中芽孢杆菌的演替[J].酿酒科技,2012(9):62-65.
[23]WANG HY,XU Y.Effect of temperature on microbial composition of starter culture for Chinese light aroma style liquor fermentation[J].Lett appl microbiol,2015,60(1):85-91.
Analysis of Dynamic Change in Microbial Groups during Solid-State Fermentation of Daqu for Vinegar Brewing on the Basis of 16S/18S rRNA Clone Library
LIU Xiong,GAN Xing and LUO Lixin
(College of Bioscience and Engineering,South China University of Technology,Guangzhou,Guangdong 510006,China)
In this study,16S/18S rRNA clone library was used to analyze microbial groups and fungi groups in Daqu for vinegar brewing in different fermenting stage,and the dynamic change in microbial groups in abundance and diversity was further analyzed.A total of 14 bacterial genera within 4 orders and 11 fungal genera within 3 orders were detected during solid-state fermentation of Daqu.A succession of microbial assemblages was observed during the fermentation of Daqu.Bacterial genera of Pediococcus,Lactobacillus,Leuconostoc and yeast of Pichia were dominant bacteria in prior fermentation period.Bacterial genera of Pantoea,Enterobacter,Cronobacter and fungal genera of Amylomyces, Rhizopus were considerably accelerated during medium fermentation stage and were dominant bacteria until the end of the fermentation.However,bacterial genus of Bacillus and fungal genera of Rasamsonia,Eurotium were prevailing bacteria in late fermentation stage.In addition, PCA analysis indicated that microbial groups diversity varied in different fermenting stages(1 d and 3 d of the fermentation different from 7 d and 13 d of the fermentation,and 19 d,25 d,and 30 d of the fermentation).These exploratory findings were of great significance in improving the quality of edible vinegar.
Daqu for vinegar brewing;clone library;microbial community;solid-state fermentation;dynamic evolution
TQ925.7;Q93-3;TS264.22
A
1001-9286(2017)01-0042-06
10.13746/j.njkj.2016331
2016-11-09
刘雄(1991-),男,硕士研究生,研究方向为食品微生物发酵。
罗立新,教授,博士生导师,研究方向:工业微生物学,发酵工程,微生物分子生态学。
优先数字出版时间:2016-11-25;地址:http://www.cnki.net/kcms/detail/52.1051.TS.20161125.1423.011.html。
