滴鼻大肠杆菌对高脂诱导肥胖小鼠糖脂代谢的影响*
2017-01-19王正义甘霖莉贾义平崔恒敏邓俊良左之才
王正义, 甘霖莉, 贾义平, 崔恒敏, 邓俊良, 左之才
(四川农业大学动物医学院,四川 温江 611130)
滴鼻大肠杆菌对高脂诱导肥胖小鼠糖脂代谢的影响*
王正义, 甘霖莉, 贾义平, 崔恒敏, 邓俊良, 左之才△
(四川农业大学动物医学院,四川 温江 611130)
目的: 探讨滴鼻大肠杆菌对高脂诱导肥胖小鼠糖脂代谢的影响。方法: 选取48只高脂诱导的肥胖小鼠作为肥胖组,48只非肥胖小鼠作为对照组,滴鼻40 μL含4×109CFUs大肠杆菌菌液,于感染前及感染后1、2、3、4 d检测2组小鼠血清糖脂代谢相关指标及肝脏脂质沉积情况。结果: 与感染前比较,肥胖小鼠体质量、附睾脂肪组织质量及指数在感染后1~4 d显著降低(P<0.05);血清空腹血糖(FBG)、空腹胰岛素(FINS)水平以及胰岛素抵抗指数(HOMA-IR)在2~4 d显著升高(P<0.05);血清游离脂肪酸(FFA)、甘油三酯(TG)和极低密度脂蛋白(VLDL)水平在1~4 d显著升高,总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)和高密度脂蛋白胆固醇(HDL-C)水平在1~3 d显著降低(P<0.05);肝脏质量、指数及TG含量在1~4 d显著升高(P<0.05),肝细胞脂滴蓄积在感染后2和4 d明显增多。与对照组比较,肥胖组小鼠血清TC、LDL-C和HDL-C水平在感染后显著降低,其余指标均明显升高(P<0.05)。结论: 滴鼻大肠杆菌可加剧肥胖小鼠糖脂代谢紊乱程度,促进其胰岛素抵抗及肝脏脂肪化的发生、发展。
肥胖; 感染; 糖脂代谢
随着生活水平的提高,肥胖已经成为全球性的公共卫生问题。肥胖不仅是非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)、2型糖尿病(type 2 diabetes mellitus,T2DM)等代谢综合征的高危发病因子,还影响机体免疫防御应答,使宿主对感染性疾病更易感[1-2]。研究发现,每增加40磅体重会使社区获得性肺炎的易感性增加2倍,且肺部感染病原菌主要以G-杆菌(肺炎克雷伯菌和大肠埃希氏菌)多见[3-5]。同时,感染对机体代谢也起到重要调控作用,细菌脂多糖(lipopolysaccharide,LPS)、脂磷壁酸(lipoteichoic acid,LTA)及一些细胞因子等均可引起机体糖脂代谢紊乱,从而促进T2DM、冠心病的发生[6]。然而,近年来关于肥胖与感染的研究多集中于肥胖对机体免疫系统的影响,少有关于感染对肥胖机体代谢影响的报道。课题组前期研究表明,鼻内滴注40 μL含4×109CFUs大肠杆菌菌液可导致小鼠出现肺部感染及全身炎症反应,且肥胖小鼠表现出更强烈的炎症应答,能够诱导更多炎性细胞、细胞因子、脂肪因子表达[7]。在此基础上,本实验通过鼻内滴注大肠杆菌感染高脂诱导的肥胖小鼠构建肺部感染模型,检测血液及肝脏中糖脂代谢相关指标的变化,初步探讨肺部感染对肥胖机体糖脂代谢的影响。
材 料 和 方 法
1 菌株
大肠杆菌从患水肿病竹鼠腹腔积液中分离,由四川农业大学兽医内科实验室保存。
2 试剂和仪器
游离脂肪酸(free fatty acid,FFA)、极低密度脂蛋白(very-low-density lipoprotein,VLDL)、葡萄糖(glucose,GLU)和胰岛素(insulin,INS)ELISA试剂盒均购自R&D;甘油三酯(triglycerides,TG)、总胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)和高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)测定试剂盒均购自南京建成生物研究所;酶标仪为Thermo产品。
3 实验动物
SPF级昆明雄鼠120只,3~4周龄,体重14~16 g,购于成都达硕动物科技有限公司(动物合格证号:0001683)。
4 主要方法
4.1 小鼠肥胖模型的建立 随机选取60只小鼠饲喂常规饲料,60只饲喂高脂饲料[7],连续饲喂8周,实验期间小鼠自由摄食及饮水,每周称量1次体重。根据人类肥胖标准,将肥胖度大于20%视为肥胖模型建立成功,肥胖度(%)=(实验组实际体重-对照组平均体重) /对照组平均体重×100%[8]。
4.2 实验动物的分组与处理 饲喂8周后,从高脂饲喂组中选取造模成功的小鼠48只作为肥胖组,从常规饲喂组中选取48只小鼠作为对照组,两组小鼠鼻内滴注40 μL含4×109CFUs的大肠杆菌菌液,构建肺部感染模型[7],连续观察4 d。实验期间各组小鼠按常规饲养管理,自由摄食和饮水。
4.3 样本采集与指标检测 于感染前及第1、2、3、4天,每组随机选取6只小鼠,称重,经眼球采血并分离血清,用相应的试剂盒检测空腹血糖(fasting blood glucose,FBG)、空腹胰岛素(fasting blood insulin,FINS)、FFA、TG、TC、HDL、LDL和VLDL含量,并计算胰岛素抵抗指数(homeostasis model of assessment for insulin resistance,HOMA-IR),计算公式为:HOMA-IR=FBG (mmol/L)×FINS (mIU/L)/22.5;取附睾脂肪和肝脏称重,计算脏器指数(脏器指数=脏器重量/体重×100%);取部分肝脏进行组织匀浆并按照试剂盒说明书检测TG含量,另一部分制作冰冻切片,经油红O染色后在光学显微镜下观察肝脏脂质情况。
5 统计学处理
采用Excel软件和SPSS 22.0软件对实验数据进行统计分析。以单因素方差分析(one-way ANOVA)比较同组各时点间的差异,以独立样本t检验比较相同时点的组间差异。结果以均数±标准差(mean±SD)表示,以P<0.05为差异有统计学意义。
结 果
1 小鼠体质量、附睾脂肪组织质量及指数的变化
从图1可见,高脂饲喂8周,肥胖组小鼠体质量、附睾脂肪组织质量及指数显著高于对照组(P<0.05),表明营养性肥胖模型造模成功。
滴鼻大肠杆菌后,2组小鼠体质量、附睾脂肪组织质量及指数呈先下降后稍有回升的趋势。与感染前比较,对照组小鼠体质量在感染后2~4 d、附睾脂肪组织质量在感染后3~4 d显著降低(P<0.05),且均于第3天达到低谷,而附睾脂肪指数无显著性变化;肥胖组小鼠体质量、附睾脂肪组织质量及指数在感染后1~4 d均显著降低(P<0.05),在第3天降至最低。2组间比较,肥胖小鼠体质量、附睾脂肪组织质量及指数在整个实验期间均显著高于对照组(P<0.05)。

Figure 1.The effects of intranasalEscherichiacolion body weight, fat mass and fat index in high-fat diet-induced obese mice. Mean±SD.n=6.*P<0.05vscontrol group at the same time point;#P<0.05vs0 d in obese group;△P<0.05vs0 d in control group.
图1 滴鼻大肠杆菌对高脂诱导肥胖小鼠体重、附睾脂肪组织质量及指数的影响
2 小鼠FBG、FINS水平及HOMA-IR的变化
由图2可知,高脂饲喂8周,肥胖组小鼠FBG、FINS及HOMA-IR显著高于对照组(P<0.05)。滴鼻大肠杆菌后,2组小鼠FBG、FINS及HOMA-IR先升高后稍有降低。与感染前比较,对照组FBG、FINS及HOMA-IR在感染后1~4 d显著升高(P<0.05),其中FBG在2 d,FINS及HOMA-IR在1 d升到峰值;肥胖组FGB、FINS及HOMA-IR在感染后2~4 d显著升高(P<0.05),且均于3 d达到顶峰。与对照组比较,肥胖组FBG在感染后3~4 d,FINS及HOMA-IR在感染后2~4 d显著升高(P<0.05)。
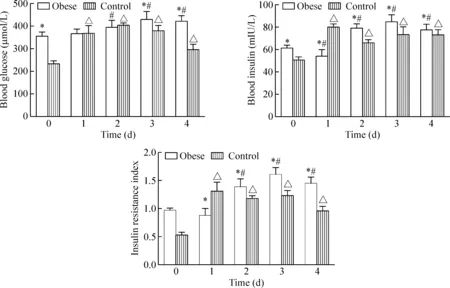
Figure 2.The effects of intranasalEscherichiacolion the levels of FBG, FINS and HOMA-IR in high-fat diet-induced obese mice. Mean±SD.n=6.*P<0.05vscontrol group at the same time point;#P<0.05vs0 d in obese group;△P<0.05vs0 d in control group.
图2 滴鼻大肠杆菌对高脂诱导肥胖小鼠FBG、FINS水平及HOMA-IR的影响
3 小鼠血清中脂代谢相关指标的变化
如图3所示,高脂饲喂8周,肥胖组小鼠血清FFA、TG、TC、VLDL和LDL-C水平均显著高于对照组,HDL-C水平显著低于对照组(P<0.05),表明高脂饮食导致肥胖小鼠出现血脂代谢紊乱。
滴鼻大肠杆菌后,2组小鼠血清FFA、TG和VLDL水平呈先升高后降低的趋势,除对照组FFA仅在感染后3~4 d,其余指标均在感染后1~4 d显著高于感染前(P<0.05);其中对照组血清FFA和TG在第3天,VLDL在第2天达到峰值,肥胖组血清FFA、TG和VLDL水平则均在第3天升到最高。2组间比较,肥胖组血清FFA、TG和VLDL水平在各个时点均显著高于对照组(P<0.05)。
2组小鼠血清TC、LDL-C和HDL-C水平则在感染后先下降再缓慢回升。与感染前比较,对照组血清TC仅在感染后1 d, LDL-C和HDL-C在感染后1~4 d显著降低(P<0.05),其中LDL-C在第4天,HDL-C在第1天最低;肥胖组TC和LDL-C在感染后1~4 d显著降低(P<0.05),第2天降到最低,HDL-C在感染后1~3 d显著降低(P<0.05),第1天最低。与对照组比较,肥胖组小鼠TC在第2天,LDL-C在第1~3天,HDL-C在第1~2天显著降低,LDL-C和HDL-C在第4天显著升高(P<0.05)。

Figure 3.The effects of intranasalEscherichiacolion the levels of serum lipid metabolism parameters in high-fat diet-induced obese mice. Mean±SD.n=6.*P<0.05vscontrol group at the same time point;#P<0.05vs0 d in obese group;△P<0.05vs0 d in control group.
图3 滴鼻大肠杆菌对高脂诱导肥胖小鼠血清中脂代谢相关指标的影响
4 小鼠肝脏组织脂质沉积的变化
从图4可见,高脂饲喂8周,肥胖组小鼠肝脏质量及指数、TG含量显著升高(P<0.05),油红O染色结果(图5)也显示,感染前肥胖组小鼠肝细胞有少量橘红色脂滴蓄积,说明高脂饮食可导致小鼠肝细胞脂质积聚。
滴鼻大肠杆菌后,2组小鼠肝脏质量、指数及肝脏TG含量呈先升高后降低的趋势。与感染前比较,对照组小鼠肝脏质量在第2天,肝脏指数在第2~4天,肝脏TG含量在第1~4天均显著升高(P<0.05),其中肝脏质量和指数在第2天,肝脏TG含量在第1天最高;肥胖组肝脏质量、肝脏指数及TG含量在感染后1~4 d均显著升高(P<0.05),其中肝脏质量和指数在第3天,肝脏TG含量在第2天达最高。油红O结果也显示,感染后2和4 d,2组小鼠肝脏橘红色脂滴均明显增多。与对照组比较,肥胖组小鼠肝脏质量及TG含量在整个实验期间均显著升高(P<0.05),但肝脏指数的差异无统计学显著性。

Figure 4.The effects of intranasalEscherichiacolion hepatic steatosis in high-fat diet-induced obese mice. Mean±SD.n=6.*P<0.05vscontrol group at the same time point;#P<0.05vs0 d in obese group;△P<0.05vs0 d in control group.
图4 滴鼻大肠杆菌对高脂诱导肥胖小鼠肝脏脂肪化的影响

Figure 5.The changes of hepatic lipid accumulation (oil red O staining,×400).
图5 肝脏脂质沉积的变化
讨 论
随着物质生活水平的提高,肥胖已成为继心血管病和肿瘤之后的第三大非传染性疾病,对人类健康带来了严重的威胁。随着对肥胖的关注与重视,人们发现肥胖不仅是一种机体代谢异常状态,也是一种系统慢性低度炎症,而牙周炎等慢性炎性疾病也被证明有利于肥胖大鼠胰岛素抵抗及T2DM的发生[9]。本研究显示鼻内滴注大肠杆菌诱导急性肺部感染也可加剧肥胖小鼠糖脂代谢紊乱,促进胰岛素抵抗及肝脏脂质沉积的发生。
通过持续8周饲喂高脂饲料成功建立小鼠肥胖模型,其体质量、附睾脂肪组织质量及指数均显著高于对照组小鼠。感染大肠杆菌后,肥胖小鼠体质量、附睾脂肪组织质量及指数在感染后1 d急剧下降,直到第4天才稍有回升,对照组小鼠体质量及附睾脂肪组织质量在第3天显著下降,但脂肪指数没有明显变化,可见在相同感染情况下肥胖小鼠更先动用脂肪组织以满足体能的消耗,表现出更强的脂解能力。但倪佳[10]研究表明牙周炎感染对肥胖大鼠体质量和脂肪质量均无影响,与我们的结果相矛盾。这可能与实验动物以及建立肥胖感染模型的方法不一致有关,本实验采用鼻内滴注大肠杆菌的方式构建小鼠肺部急性感染模型,刺激较大,而倪佳是通过皮下注射谷氨酸钠溶液构建大鼠肥胖模型,并以4种牙周炎特异性致病菌混合液以埋线的方式诱导牙周炎造成慢性感染。
胰岛素抵抗与肥胖紧密相关,是冠心病、T2DM、NAFLD等疾病的共有特征。本实验中,高脂饲喂8周后肥胖小鼠FGB、FINS水平及HOMA-IR均显著升高,这与董明等[11]的研究一致。感染后,对照组小鼠FGB、FINS及HOMA-IR在1 d内显著升高甚至达到肥胖小鼠水平,这可能与感染刺激下动物能量消耗急剧增加,升糖激素大量分泌,肝脏糖异生作用增强有关[12]。而肥胖组小鼠FGB及HOMA-IR在感染后1 d并无显著性变化,这可能是由于肥胖小鼠本身具有高浓度的FGB,且脂肪组织的大量分解可以快速为受到损害的靶器官提供能量,从而在急性炎症早期没有大幅升高;此外,高脂饲喂使肥胖小鼠处于一种慢性炎症状态,由于对慢性炎症的适应性,因此对急性炎症可能表现出一定的耐受性。章瑶等[13]研究膳食诱发肥胖的非糖尿病(Wistar大鼠)对急性炎症刺激的反应能力时发现,LPS注射后,Wistar大鼠血糖浓度无明显变化,与我们的研究结果一致。在感染后2~4 d肥胖小鼠血液中FGB、FINS快速上升,HOMA-IR极显著高于非肥胖小鼠,出现胰岛素抵抗,与郑世霞[5]对2型糖尿病合并肺炎患者入院后第2天的检测结果相似。研究表明[8, 14-15],抵抗素、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、白细胞介素6(interleukin-6,IL-6)、FFA及TG的代谢产物二酰甘油等不仅增加肝脏糖异生升高血糖水平,还阻碍胰岛素信号通路,一方面使胰岛素促进糖原合成的功能减弱,另一方面阻止胰岛素介导的GLUT4移位到细胞表面,降低细胞对葡萄糖的摄取诱导胰岛素抵抗。课题组的前期研究显示,鼻内滴注40 μL含4×109CFUs大肠杆菌菌液可导致肥胖小鼠血清中TNF-α、IL-6和抵抗素等炎症因子水平显著升高[7]。因此,肥胖小鼠在感染后期出现胰岛素抵抗可能与其炎症应答反应更为强烈有关,但其具体相关性还需进一步研究。
营养性肥胖往往伴随着脂代谢紊乱,经8周高脂饲喂,肥胖小鼠血液中FFA、TG、TC、LDL和VLDL水平显著升高,HDL显著降低,与邱烈峰[16]的研究一致。慢性感染如肺炎衣原体感染[17]、牙周炎等,由于与肥胖机体低度炎症状态类似,可诱导高脂血症进而参与NAFLD、动脉粥样硬化等疾病的慢性进程。但Mohammad[18]指出急性呼吸道感染也是心血管事件的主要促发因子,急性感染也可在几天或一周左右通过引起突发性的严重炎症应答,造成急性动脉综合征。本实验中,非肥胖及肥胖小鼠血清FFA、TG和VLDL水平在感染后均显著升高,肝脏质量、指数及肝脏TG含量明显增加,肝细胞脂质浸润加剧,且肥胖小鼠的升高幅度明显大于非肥胖小鼠,可见肺部感染进一步加剧了肥胖小鼠血脂紊乱及肝脏脂质沉积程度。阳琰等[19]在探讨牙周病对T2DM患者糖脂代谢的影响时也得出相似的结论,即T2DM合并牙周患者血清中TG和TC均明显高于单独的牙周患者或T2DM患者。这可能与感染刺激下肥胖机体脂肪组织大量分解,血液中FFA及一些脂肪因子和炎症因子分泌增加有关[20-21]。与之相反的是,2组小鼠血清TC、LDL-C及HDL-C水平在感染后均呈下降趋势,其中HDL-C下降幅度最大。Tiirola等[22]通过滴鼻5.3×105IFU肺炎衣原体感染NIH/S鼠造成急性呼吸道感染,发现在感染后3 d小鼠血清TC水平降低,与我们的研究一致。HDL-C作为一种脂蛋白,不仅具有促进胆固醇逆转运的作用,其在抗感染的过程中也十分重要。研究显示在急性期HDL可以中和LPS及一些急性期反应蛋白如CRP、SAA等,减弱炎症应答[23]。因此在感染刺激下小鼠血液中HDL水平下降也许是机体对炎症刺激的保护性应答,另一方面,其水平的降低也许进一步加剧了肥胖小鼠血脂代谢紊乱的状态。
[1] Pi-Sunyer FX. The medical risks of obesity[J]. Postgrad Med, 2009, 121(6):21-33.
[2] Dhurandhar NV, Bailey D, Thomas D. Interaction of obesity and infections[J]. Obes Rev, 2015, 16(12):1017-1029.
[3] Baik I, Curhan GC, Rimm EB, et al. A prospective study of age and lifestyle factors in relation to community-acquired pneumonia in US men and women[J]. Jama Inter Med, 2000,160(20): 3082-3088.
[4] Peter M, Andrew G, Phare SM, et al. Leptin-deficient mice exhibit impaired host defense in Gram-negative pneumonia[J]. J Immunol, 2002, 168(8):4018-4024.
[5] 郑世霞. 2型糖尿病患者社区获得性肺炎的临床特征分析[J]. 检验医学与临床, 2012, 9(15):1885-1886.
[6] Khovidhunkit W. Effects of infection and inflammation on lipid and lipoprotein metabolism: mechanisms and consequences to the host[J]. J Lipid Res, 2004, 45(7):1169-1196.
[7] 万涛梅. 肥胖对鼻内滴注大肠杆菌昆明小鼠肺脏炎症的影响研究[D]. 四川: 四川农业大学, 2016.
[8] Itani SI, Ruderman NB, Schmieder F, et al. Lipid-induced insulin resistance in human muscle is associated with changes in diacylglycerol, protein kinase C, and IκB-α[J]. Diabetes, 2002, 51(10):2005-2011.
[9] 闫艳梅, 贺 涛, 刘 琪. 肥胖与牙周炎相互作用机制的研究进展[J]. 牙体牙髓牙周病学杂志, 2016, 26(7):443-447.
[10]倪 佳. 牙周炎影响肥胖大鼠胰岛素抵抗机制的初步研究[D]. 广州: 南方医科大学, 2012.
[11]董 明, 刘 东, 梁运海, 等. 高脂饮食喂养肥胖模型小鼠的构建:分析营养因素和代谢综合征的关系[J]. 中国组织工程研究, 2015, 19(40):6542-6546.
[12]Archana D, Dwarakanath CD, Gayatri G, et al. Evaluation of serum resistin levels in periodontal health and di-sease and effects of non surgical periodontal therapy on its levels[J]. Dis Markers, 2012, 32(5):289-294.
[13]章 瑶, 韩亭亭, 苏布德格日乐, 等. 肥胖的非糖尿病大鼠对急性炎症刺激的耐受性研究[J]. 上海交通大学学报:医学版, 2013, 33(4):400-403.
[14]郭江红, 韩德五, 郭建红,等. 内毒素诱发大鼠非酒精性脂肪性肝炎和胰岛素抵抗[J]. 中国病理生理杂志, 2010, 26(5):1009-1011.
[15]王正义, 甘霖莉, 左之才. 抵抗素诱导肥胖机体胰岛素抵抗的炎症机制[J]. 动物营养学报, 2016, 28(6):1670-1676.
[16]邱烈峰. 高脂饮食诱导肥胖大鼠脂代谢相关指标的变化[J]. 中国老年学杂志, 2014, 34(10): 2815-2818.
[17]Marangoni A, Fiorino E, Gilardi F, et al. Chlamydia pneumoniae acute liver infection affects hepatic cholesterol and triglyceride metabolism in mice[J]. Atherosclerosis, 2015, 241(2): 471-479.
[18]Mohammad M. Acute infections, vaccination and prevention of cardiovascular disease[J]. Can Med Assoc J, 2008, 179(8):749-750.
[19]阳 琰, 高 琳, 郝 涛, 等. 糖尿病合并牙周病与糖脂代谢的关系[J]. 重庆医学, 2011, 40(5): 443-444, 447.
[20]张超贤, 郭李柯. 抵抗素基因启动子-420C/G、细胞色素P4501A1-MspI多态性与吸烟的交互作用对非酒精性脂肪性肝病的影响[J]. 中国病理生理杂志, 2015, 31(3):485-491.
[21]Hassan W, Ding L, Gao R, et al. Interleukin-6 signal transduction and its role in hepatic lipid metabolic disorders[J]. Cytokine, 2014, 66(2):133-142.
[22]Tiirola T, Erkkilä L, Laitinen K, et al. Effect of acuteChlamydiapneumoniaeinfection on lipoprotein metabolism in NIH/S mice[J]. Scand J Clin Lab Invest, 2002, 62(6): 477-484.
[23]Wendel M, Paul R, Heller AR. Lipoproteins in inflammation and sepsis. II. Clinical aspects[J]. Intensive Care Med, 2007, 33(1):25-35.
(责任编辑: 林白霜, 罗 森)
Effects of intranasal Escherichia coli on glucolipid metabolism in high-fat diet-induced obese mice
WANG Zheng-yi, GAN Lin-li, JIA Yi-ping, CUI Heng-min, DENG Jun-liang, ZUO Zhi-cai
(CollegeofVeterinaryMedicine,SichuanAgriculturalUniversity,Wenjiang611130,China.E-mail:zzcjl@126.com)
AIM: To study whether the pulmonary infection ofEscherichiacoli(E.coli) interferes the glucolipid metabolism in high-fat diet-induced obese mice. METHODS: High-fat diet-induced obese mice (n=48) and normal chow-fed control mice (n=48) were intranasally infused with 40 μL fluid containing 4×109CFUsE.coli. The serum, periepididymal adipose tissue and liver were obtained at 0 d, 1 d, 2 d, 3 d and 4 d after infection. The body mass, periepididymal adipose tissue and liver were weighed, and the levels of fasting blood glucose (FBG), fasting blood insulin (FINS), free fatty acid (FFA) and very-low-density lipoprotein (VLDL) were measured by ELISA. The serum total cholesterol (TC), triglycerides (TG), high-density lipoprotein cholesterol (HDL-C) and low-density lipoprotein cholesterol (LDL-C), and hepatic TG contents were detected, and the hepatic steatosis was observed under microscope with oil red O staining. RESULTS: Compared with day 0, the body mass, fat mass and fat index were decreased significantly from day 1 to day 4 after infection (P<0.05). The levels of FBG, FINS and HOMA-IR were apparently raised from day 2 to day 4 after infection (P<0.05). The contents of serum FFA, TG and VLDL were increased markedly from day 1 to day 4 after infection (P<0.05). However, the concentrations of serum TC, LDL-C and HDL-C were decreased obviously from day 1 to day 3 (P<0.05). The liver mass, liver index and TG content were significantly increased from day 1 to day 4 (P<0.05). Consistently, the lipid droplet accumulation in the liver cells was increased obviously at day 2 and day 4 after infection. Compared with control group, except the levels of serum TC, LDL-C and HDL-C in obese group substantially decreased, the other indexes were increased by different degrees during the whole experiment period (P<0.05). CONCLUSION: Pulmonary infection ofEscherichiacoliexacerbates the disorder of glucose and lipid metabolism in high-fat diet-induced obese mice, which contributes the development of insulin resistance and hepatic steatosis.
Obesity; Infection; Glucolipid metabolism
1000- 4718(2017)01- 0060- 07
2016- 09- 07
2016- 11- 01
四川省科技厅支撑项目(No. 2013NZ0032)
R363
A
10.3969/j.issn.1000- 4718.2017.01.010
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 028-86291162; E-mail: zzcjl@126.com
