甲状腺球蛋白基因外显子33单核苷酸多态性与Graves病停药后复发的相关性分析*
2017-01-19卢洪文张银环刘长山李发梅王雪松黄灵玉
卢洪文, 张银环, 刘长山, 李发梅, 王雪松, 黄灵玉, 张 颖, 柳 林△
(潍坊市人民医院 1内分泌科, 2心内二科, 山东 潍坊 261041; 3潍坊医学院研究生部, 山东 潍坊 261053)
甲状腺球蛋白基因外显子33单核苷酸多态性与Graves病停药后复发的相关性分析*
卢洪文1, 张银环2, 刘长山1, 李发梅3, 王雪松1, 黄灵玉1, 张 颖3, 柳 林1△
(潍坊市人民医院1内分泌科,2心内二科, 山东 潍坊 261041;3潍坊医学院研究生部, 山东 潍坊 261053)
目的: 探究甲状腺球蛋白基因外显子33单核苷酸多态性(E33SNP)与Graves病(GD)复发的相关性,为临床预测GD抗甲状腺药物(ATD)治疗后的复发提供合理性依据。方法: 选取健康对照者232例以及GD治疗后停药的患者243例,且根据GD停药患者的复发情况将观察组分为A、B、C 3个亚组:77例治疗后1年内复发者为A组,86例治疗后1~2年内复发者为B组,80例治疗后2年内未复发者为C组。利用RT-PCR检测对照组和观察组的E33SNP进行分型,对比分析对照组和观察组不同基因型的比率及观察组不同甲状腺球蛋白基因型患者的游离三碘甲状腺原氨酸(FT3)、游离甲状腺素(FT4)、促甲状腺激素(TSH)和促甲状腺激素受体抗体(TRAb)水平,以及眼征、甲状腺肿大程度等临床资料,且对观察组不同基因型患者在治疗后2年内的累积有效率进行对比分析。结果: 观察组与对照组E33SNP的基因型差异无统计学显著性,但观察组各个亚组间E33SNP基因型差异具有统计学显著性(P<0.05)。对观察组的A、B、C 3个亚组间不同基因型患者各项甲状腺功能相关指标进行对比分析表明,不同基因型患者的TSH、FT3、FT4水平及甲状腺肿大程度的差异无统计学显著性,而TRAb水平和眼征发生率的差异具有统计学显著性(P<0.05)。此外,E33SNP T/T型GD患者ATD治疗后2年内的累积有效率为61.8%,E33SNP T/C型患者为42.6%,E33SNP C/C型患者为21.3%,差异具有统计学显著性(P<0.05)。结论: E33SNP C/C型GD患者停药后的TRAb水平以及眼征发生率明显偏高,在ATD治疗后更加容易复发,E33SNP T/T型患者则呈现相反的趋势,复发率明显偏低,因此E33SNP C/C型GD患者采用其它治疗方式或者联合治疗方式可能更加合理。
Graves病; 甲状腺球蛋白; 单核苷酸多态性; 复发
Graves病(Graves’ disease,GD)为临床上常见的自身免疫性甲状腺疾病(autoimmune thyroid disease,AITD)之一,主要是由于促甲状腺激素受体抗体(thyrotropin receptor antibody,TRAb)分泌增加而导致甲状腺机能亢进所致[1]。目前GD的发病机制尚不完全明确,但研究者普遍认为[2],机体的免疫异常如T细胞功能缺陷,免疫耐受、识别和调节功能减退等与GD的发生有非常重要的关系。临床上常用治疗GD的方法主要包括抗甲状腺药物(antithyroid drug,ATD)、131I及手术治疗。ATD作为最主要的治疗方法,其最大的缺点就是复发率高。近来已有研究[3]表明复发率可以高达60%。GD运用ATD治疗后的复发与甲状腺肿大程度、TRAb的水平等很多因素相关[4],同时近年来很多研究表明不少基因如细胞毒T淋巴细胞相关抗原4(cytotoxic T-lymphocyte-associated antigen 4,CTLA-4)、CD40和促甲状腺激素受体(thyroid-stimulating hormone receptor,TSHR)的多态性与GD复发都存在着密切的关系。甲状腺球蛋白(thyroglobulin,Tg)是自身免疫性甲状腺疾病中最为主要的抗原,其抗原表位至少为40个,研究表明其外显子33单核苷酸多态性(single nucleotide polymorphism in exon 33, E33SNP)与GD的发病有关,但是其与ATD治疗后的缓解及复发的相关性研究甚少。本研究旨在探究山东中部汉族人群中GD患者的E33SNP与ATD治疗后复发的相关性,为临床预测GD的复发提供合理的依据。
材 料 和 方 法
1 临床资料
观察组共收集病例243例(男49例,女194例),平均年龄为(43.2±13.6)岁,均为2011年~2013年间在我院接受ATD正规治疗在1年半以上,且用药至少在6个月以上且不包括其它治疗方式及联合治疗的GD初发患者,根据停药后的复发时间将观察组分为3个亚组。A组:77例,男16例,女61例,平均年龄为(40.7±11.8)岁,为停药后1年内复发患者;B组:86例,男18例,女68例,平均年龄为(44.0±9.8)岁,为停药后1~2年间复发患者;C组:80例,男15例,女65例,平均年龄为(43.2±13.6)岁,为停药后2年内未复发患者。对照组232例,男性42例,女性190例,平均年龄(43.6±13.7)岁,为我体检中心收集的健康体检者,均无自身免疫性甲状腺疾病,且性别和年龄与观察组的差异无统计学显著性。
2 基因型鉴定
采集研究对象的外周血2 mL,枸橼酸抗凝,采用血液基因组提取试剂盒(试剂盒购自北京天根生化科技有限公司)完全按照说明书流程对研究对象的血液基因组DNA进行提取,提取获得的基因组DNA均采用NanoDrop 2000超微量核酸蛋白定量仪测定其浓度,样本DNA纯度A260/A280均介于1.8~2.0之间,提取完成后将样本DNA置于-20 ℃保存。采用RT-PCR技术对研究样本E33SNP多态性进行基因分型,上游引物为5’-GGACAGTATTCCTGAGAGGAG-3’,下游引物为5’-GAACGAGGATAGGAGATGCTG-3’。引物由上海生工生物工程有限公司合成。PCR反应体系为:模板1 μL,上、下游引物各1 μL,2×HS Taq MasterMix 10 μL(购自北京天根生化科技有限公司),20×EvaGreen 1 μL(购自Biotium),加 ddH2O 至20 μL。PCR反应条件:94 ℃ 5 min; 94 ℃ 10 s, 65 ℃ 30 s, 72 ℃ 30 s,循环35次;72 ℃ 10 min。仪器为LightCycler 480 PCR仪(购自Roche)。PCR反应后利用GeneScanning软件进行分型,并将样本DNA经 PCR反应后的产物进行琼脂糖凝胶电泳,回收后送至上海生工生物工程有限公司进行基因测序,根据测序峰谱图,判断GD患者E33SNP的基因型。
3 停药和复发标准
停药标准:高代谢的体征和症状得到明显缓解,药物的最小维持量可以保持血清游离三碘甲状腺原氨酸(free triiodothyronine,FT3)、游离甲状腺素(free thyroxine,FT4)和促甲状腺激素(thyroid-stimulating hormone,TSH)在正常水平≥1年,TRAb的水平恢复正常。GD复发标准为停药后患者再次出现甲状腺功能异常,即FT3、FT4和TSH水平的升高都考虑为复发。
4 随访及观察
所有GD患者在停药后的2年内每3个月进行1次甲状腺功能的复查,详细记录患者停药后的TRAb、FT3、FT4和TSH的水平(采用Liaison Analyzer免疫化学发光分析仪进行测定)、甲状腺的肿大程度、眼征、GD复发的状况及时间。甲状腺肿大程度:甲状腺看不到但可以触及为Ⅰ°;甲状腺可以看到和触及为Ⅱ°;甲状腺肿大超过胸锁乳突肌外缘为Ⅲ°。眼征判定采用Werner 1969年提出NOSPECT标准,当NOSPECT评分≥2时,判定为有眼症。
5 统计学处理
全部数据应用SPSS 19.0软件进行统计分析。各组基因型频率及等位基因频率采用基因计数法进行计算,各组间等位基因频率及各基因型频率的比较采用2检验;组间突眼征发生程度比较采用Kruskal-WalisH秩和检验;正态分布定量数据用均数±标准差(mean±SD)表示,组间定量数据采用完全随机设计的单因素方差分析;参考Liu等[5]的方法采用Kaplan-Meier生存分析方法绘制不同基因型患者的累积有效率。以P<0.05为差异有统计学意义。
结 果
1 各组间基因型频率及等位基因频率的对比性分析
根据测序峰谱图,对2组患者的E33SNP进行基因分型,E33SNP C/C型对应蓝色单峰,为纯合子;E33SNP C/T型对应蓝红色相兼的双峰,代表杂合子;E33SNP T/T型对应红色单峰,为纯合子,具体见图1~3。对观察组和对照组的基因型频率及等位基因频率进行对比性分析的结果表明,2组患者的基因型频率及等位基因频率的差异无统计学显著性,而观察组各亚组间的基因型频率及等位基因频率的差异具有统计学显著性,A组CC型患者显著多于B组和C组,而CT型患者显著少于B组和C组(P<0.05),B组CC型患者显著多于C组,CT型患者显著少于C组(P<0.05),B组和C组的TT型患者数量间的差异无统计学显著性,见表1。

Figure 1.The sequencing analysis of E33SNP C/C genotype.
图1 E33SNP C/C型序列图谱分析

Figure 2.The sequencing analysis of E33SNP C/T genotype.
图2 E33SNP C/T型序列的图谱分析

Figure 3.The sequencing analysis of E33SNP T/T genotype.
图3 E33SNP T/T型序列图谱分析

表1 基因型频率及等位基因频率的对比性分析
*P<0.05,**P<0.01vscontrol group;#P<0.05,##P<0.01vsA group;$P<0.05,$$P<0.01vsB group.
2 停药后不同基因型患者甲状腺功能相关指标的对比分析
检测观察组不同基因型患者在停药后的各项甲状腺功能相关指标,并对其进行对比分析,结果表明停药后A、B、C 3组中不同基因型患者的TSH、FT3和FT4水平及甲状腺肿大程度的差异无统计学显著性,而A、B、C 3组中不同基因型患者TRAb水平的差异具有统计学意义,CC型患者明显偏高(P<0.05)。不同基因型患者眼征发生率的差异也具有统计学显著性,CC基因型患者眼征的发生率显著偏高(P<0.05),见表2。
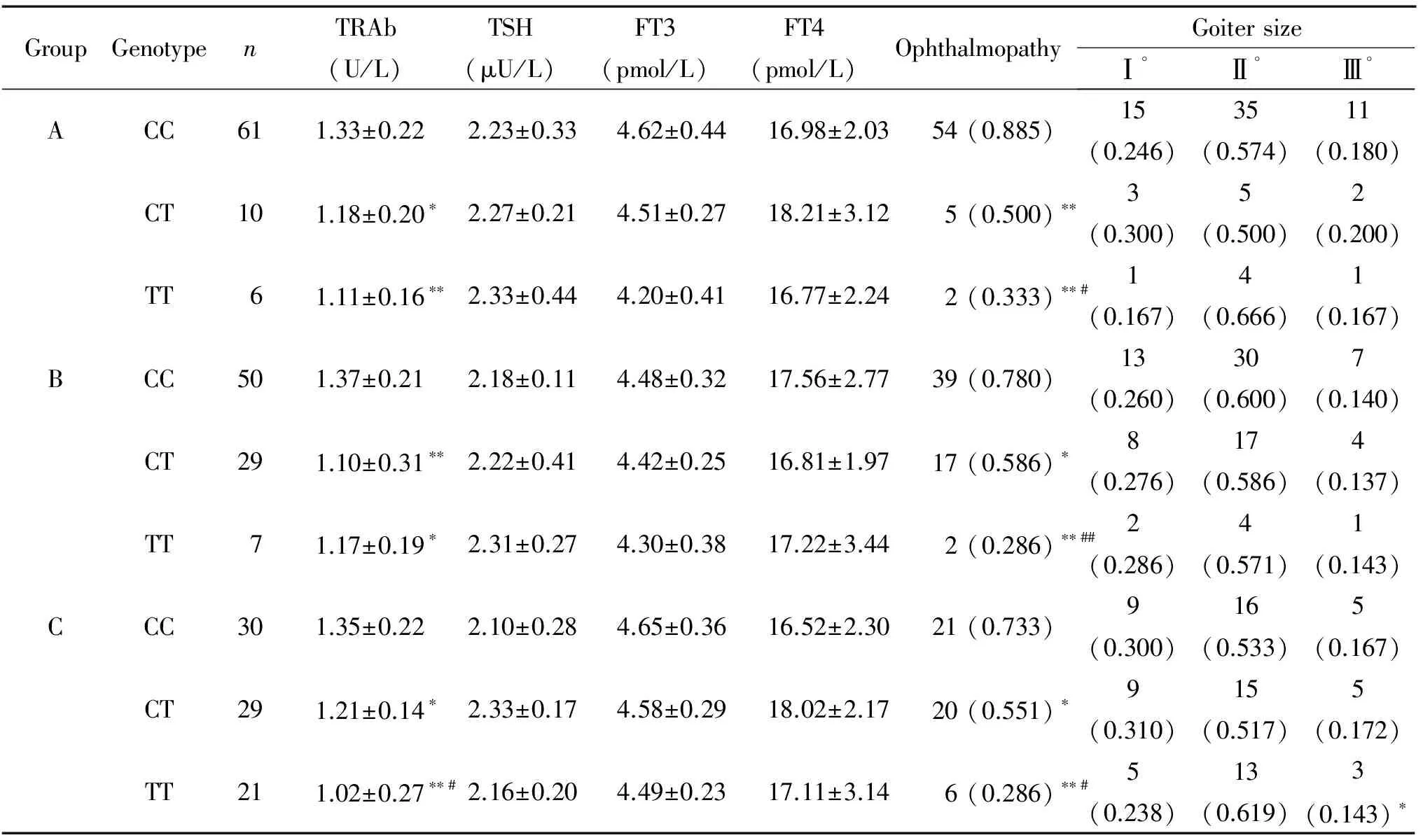
表2 不同基因型患者甲状腺功能相关指标的对比分析
*P<0.05,**P<0.01vsCC genotype in the same group;#P<0.05,##P<0.01vsCT genotype in the same group.
3 各基因型患者停药后累积有效率的对比分析
对观察组不同基因型患者的复发状况进行详细记录,采用Kaplan-Meier生存分析的方法绘制不同基因型患者的累积有效率,结果表明CC型患者2年内的累积有效率为21.3%,CT型患者2年内的累积有效率为42.6%,TT型患者2年内的累积有效率为61.8%,3组差异具有统计学显著性(P<0.05),见图4。
讨 论
研究者认为GD为遗传因素与多种复杂非遗传因素共同作用的结果[6],如有研究表明,凋亡相关蛋白Fas、FasL及Bcl-2也能促进GD的发生[7]。目前公认的与GD发生相关的基因主要分为两类:一类为与免疫调节相关的基因,主要包括人白细胞抗原(human leukocyte antigen,HLA)基因[8]、CTLA-4基因[9]以及CD40基因[10]等,另一类为甲状腺特异性基因即Tg基因。免疫调节相关基因不仅与GD具有重要的关系,对机体其它的自身免疫性疾病也有重要影响,因此该类基因对GD发生的影响通常是错综复杂且相互关联的[11],而Tg基因作为甲状腺特异性基因与AITD具有更加直接和重要的关系。目前,有关Tg基因与AITD相关性的研究已有不少,但是由于样本地域的差异性,使得不同研究的结果具有较大的差异。E33SNP为甲状腺球蛋白基因研究比较多的多态性位点,近来Wang等[12]系统性地研究了中国汉族人群Tg基因多态性与AITD的相关性,结果发现河南北部人群E33SNP与AITD无相关性,而陕西西安人群的E33SNP与AITD呈统计学相关,早前张进安等[13]对中国北部汉族人群的研究也发现E33SNP与AITD无相关性,但是与桥本甲状腺炎呈统计学相关。本实验研究结果表明,在山东中部人群中E33SNP与GD发生无相关性,这与上述研究具有一定的相似性。但是 Hsiao等[14]研究发现在台湾北部人群中E33SNP与GD发生具有统计学相关性,因此,不同区域的人群其E33SNP各基因型频率、等位基因频率及其是否与GD相关具有一定的差异。

Figure 4.Cumulative efficiency curves of the patients with diffe-rent genotypes after drug withdrawal.
图4 不同基因型GD患者停药后的累积有效率曲线
影响GD复发的因素很多,临床上研究多为非遗传因素对GD复发的影响,而与GD复发相关的遗传因素却研究甚少,目前有人报道过的基因仅为CTLA-4[15]、CD40[16]及TgE33SNP[14],且Kim等[16]的研究表明在韩国人群中CTLA-4与CD40基因多态性与GD的复发无显著相关性,这一研究结果与张京玲等[15]对中国北方人群的研究结果具有一定差异,可能与样本地域差异性有关。本研究通过研究停药后不同时段复发的GD患者(A、B、C 3组)的E33SNP发现,不同时段复发的GD患者其E33SNP基因型差异具有统计学显著性,E33SNP C/C型患者在A组中的比率较B组和C组明显偏高,而E33SNP T/T型患者在A组中的比率较B组和C组明显偏低,表明E33SNP T/T型的GD患者治愈后会有更低的复发率,这一研究结果与Hsiao等[14]的研究结果存在一定的相似性,但是与Sevda等[17]的研究结果却存在着一定的差异。本研究对不同基因型患者甲状腺功能相关指标进行对比性分析发现,A、B、C 3组中不同基因型患者的TRAb水平以及眼征的发生率存在着显著性差异,E33SNP T/T型患者TRAb的水平较E33SNP C/T型和E33SNP C/C型患者明显偏低,而眼征的发生率呈现E33SNP T/T>E33SNP C/T>E33SNP C/C的趋势。Hsiao等[14]在台湾人群中也得出了类似的结论,并且发现E33SNP不同基因型的GD患者甲状腺肿大程度具有一定的差异,而本研究尚未得出这一结论。Sevda等[17]的研究结果也未表明不同基因型GD患者的甲状腺肿大程度具有一定的差异。此外,本研究参考Liu等[5]的方法,绘制了不同基因型GD患者停药后的累积有效率曲线,结果发现E33SNP T/T型治疗后2年内的累积有效率为61.8%,E33SNP T/C型累积有效率为42.6%,E33SNP C/C型累积有效率为21.3%,累积有效率在不同基因型间的差异具有统计学显著性,这也表明E33SNP C/C的患者容易在停药后的较短时间内复发。
GD患者药物治疗后的复发除了有遗传因素的影响外,非遗传因素如年龄、治疗前后的TRAb水平、停药后无碘盐的摄取等对其的影响也相当复杂[18]。近年来的研究表明抗甲状腺药物给药方式对GD患者治疗后的复发具有重要意义,长期低剂量给药可以显著降低GD患者治疗后的复发率[5,19]。本实验在此方面存在着一定的不足,尚未讨论非遗传因素对GD患者治疗后复发率的影响,以及E33SNP基因型与患者其它临床资料的相关性,如Hsiao等[14]的研究就表明GD患者的吸烟率在E33SNP不同基因型间差异具有统计学显著性。由于研究样本基本是山东中部潍坊及周边地区的GD患者,样本的地域来源并不宽泛;本研究对样本的随访时间仅为2年,延长随访观察时间,对样本进行更长时间的观察可以使研究结果更加确切;本研究仅探讨了E33SNP这一个多态性位点对GD患者药物治疗后复发的影响,但目前已经证明Tg基因存在多个多态性位点,多个位点是否存在着协同作用这一点尚未得到证实,因此本研究也存在一定的局限性。
综上所述,本研究通过对山东中部汉族人群的243例GD患者进行比较系统性的研究,发现E33SNP在健康人群和GD患者中的差异无统计学显著性,但是不同阶段的GD停药复发患者E33SNP基因型之间的差异具有统计学显著性,E33SNP C/C型患者在第1年内复发的比率显著高于第2年内复发率或2年内未复发的比率,而E33SNP T/T型患者在2年内未复发的比率却显著偏高,与E33SNP C/C型呈现相反的趋势,同时本研究还发现E33SNP T/T型患者的眼征发生率和TRAb的水平较E33SNP C/C型患者偏低。总之本实验研究结果初步显示在山东中部GD患者人群中,E33SNP T/T型GD患者在ATD治疗后复发率较低而E33SNP C/C型GD患者ATD治疗后复发率较高,但是本研究也存在着一些上述提出的局限性,因此应更加全面系统地研究E33SNP及其它基因多态性位点与GD患者ATD治疗后复发的相关性,为临床预测GD患者ATD停药后复发提供有力的临床依据。
[1] DeGroot LJ, Quintans J. The causes of autoimmune thyroid disease[J]. Endocr Rev, 1989, 10(4):537-562.
[2] Inaba H, Martin W, De Groot AS, et al. Thyrotropin receptor epitopes and their relation to histocompatibility leukocyte antigen-DR molecules in Graves disease[J]. J Clin Endocrinol Metab, 2006, 91(6):2286-2294.
[3] Bartalena L. Diagnosis and management of Graves disease: a global overview[J]. Nat Rev Endocrinol, 2013, 9(12):724-734.
[4] Cooper DS. Antithyroid drugs for the treatment of hyperthyroidism caused by Graves’ disease[J]. Endocrinol Metab Clin North Am, 1998, 27(1):225-247.
[5] Liu XM, Qiang W, Liu XJ, et al. A second course of antithyroid drug therapy for recurrent Graves’ disease: an experience in endocrine practice[J]. Eur J Endocrinol, 2015, 172(3):321-326.
[6] Marino M, Latrofa F, Menconi F, et al. Role of genetic and non-genetic factors in the etiology of Graves’ disease[J]. J Endocrinol Invest, 2015, 38(3):283-294.
[7] 陈慎人,郑志超,罗毅平,等. 凋亡相关因子参与自身免疫性甲状腺疾病发病的研究[J]. 中国病理生理杂志,2004,20(3):440-444.
[8] Yanagawa T, Mangklabruks A, Chang YB, et al. Human histocompatibility leukocyte antigen-DQA1*0501 allele associated with genetic susceptibility to Graves’ disease in a Caucasian population[J]. J Clin Endocrinol Metab, 1993, 76(6):1569-1574.
[9] Tomer Y, Greenberg DA, Barbesino G, et al. CTLA-4 and not CD28 is a susceptibility gene for thyroid autoantibody production[J]. J Clin Endocrinol Metab, 2001, 86(4):1687-1693.
[10]Kim TY, Park YJ, Hwang JK, el al. A C/T polymorphism in the 5’-untranslated region of the CD40 gene is associated with Graves’ disease in Koreans[J]. Thyroid, 2003, 13(10):919-925.
[11]Chena XM, Hua ZQ, Li W, et al. Synergistic combined effect betweenCD40 -1C>T andCTLA-4 +6230G>A polymorphisms in Graves’ disease[J]. Gene, 2015, 567(2):154-158.
[12]Wang LQ, Wang TY, Sun QL, et al. Correlation between thyroglobulin gene polymorphisms and autoimmune thyroid disease[J]. Mol Med Rep, 2015, 12(3): 4469-4475.
[13]张进安,买尔哈巴,于志云,等. 甲状腺球蛋白基因多态性与自身免疫性甲状腺病的相关性[J]. 第四军医大学学报,2006, 27(19):1748-1750.
[14]Hsiao JY, Hsieh WC, Tien KJ, et al. Association between a C/T polymorphism in exon 33 of the thyroglobulin gene is associated with relapse of Graves’ hyperthyroidism after antithyroid withdrawal in Taiwanese[J]. J Clin Endocr Metab, 2007, 92(8):3197-3201.
[15]张京玲, 阎胜利. CTLA-4基因49A/G多态性与Graves病复发相关[J]. 中华内分泌代谢杂志, 2008, 24(2):192-193.
[16]Kim KW, Park YJ, Kim TY, et al. Susceptible alleles of the CD40 and CTLA-4 genes are not associated with the relapse after antithyroid withdrawal in Graves’ disease[J]. Thyroid, 2007, 17(12):1229-1234.
[17]Sevda T, Yesim E, Evin A, et al. The predictive value of CTLA-4 and Tg polymorphisms in the recurrence of Graves’ disease after antithyroid withdrawal[J]. Endocrine, 2006, 30(3):377-381.
[18]徐海龄,冉建民,劳干诚,等. Graves’病患者抗甲状腺药物治疗停药后复发相关临床因素分析[J]. 中华临床医师杂志,2014, 8(3):380-384.
[19]Laurberg P, Krejbjerg A, Andersen SL. Relapse following antithyroid drug therapy for Graves’ hyperthyroidism[J]. Curr Opin Endocrinol, 2014, 21(5): 415-421.
(责任编辑: 林白霜, 罗 森)
Association between single nucleotide polymorphism in exon 33 of thyroglobulin gene and Graves’ disease relapse after antithyroid drug withdrawal
LU Hong-wen1, ZHANG Yin-huan2, LIU Chang-shan1, LI Fa-mei3, WANG Xue-song1,HUANG Ling-yu1, ZHANG Ying3, LIU Lin1
(1DepartmentofEndocrinology,2DepartmentofNo.2Cardiology,WeifangPeople’sHospital,Weifang261041,China;3DepartmentofPostgraduate,WeifangMedicalUniversity,Weifang261053,China.E-mail: 15908029097@163.com)
AIM: To explore the association between single nucleotide polymorphism in exon 33 (E33SNP) of thyroglobulin gene and Graves’ disease (GD) relapse after antithyroid drug (ATD) withdrawal. METHODS: The healthy controls (232 cases) and GD patients with discontinued treatment (243 cases) were selected. According to the time of relapse, the GD patients were divided into A, B and C subgroups. The A group contained 77 cases of relapse within 1 year, B group contained 86 cases of relapse 1~2 years after treatment and C group contained 80 cases without recurrence within 2 years. The genotypes of E33SNP were identified by RT-PCR. The genotype ratio of thyroglobulin between control group and observation group was comparatively analyzed, and the levels of thyroid-stimulating hormone (TSH), free triiodothyronine (FT3), free thyroxine (FT4) and thyrotropin receptor antibody (TRAb), ophthalmopathy and goiter size in A, B and C subgroups in different genotype GD patients were investigated. Moreover, cumulative efficiency for patients with different genotypes in the observation group after ATD treatment within 2 years were analyzed. RESULTS: The genotype of E33SNP between observation group and control group had no significant difference, but a significant difference between A, B and C subgroups was observed (P<0.05). The levels of TSH, FT3 and FT4, and goiter size of the patients with different genotypes had no significant difference, while the TRAb levels and ophthalmopathy presented a significant difference (P<0.05). In addition, the cumulative efficiency within 2 years for GD patients with E33SNP T/T, E33SNP T/C and E33SNP C/C genotypes was 61.8%, 42.6% and 21.3%, respectively, all with significant differences (P<0.05). CONCLUSION: The GD patients with E33SNP C/C genotype have significantly higher TRAb level and ophthalmopathy rate than those in the patients with E33SNP C/T and E33SNP C/C genotypes, and are more likely to relapse after ATD treatment. The GD patients with E33SNP T/T genotype show a lower recurrence rate. Therefore, combination treatment or other treatment modalities may be more reasonable for the GD patients with E33SNP C/C genotype.
Graves’ disease; Thyroglobulin; Single nucleotied polymorphism; Relapse
1000- 4718(2017)01- 0143- 06
2016- 04- 14
2016- 10- 31
卫生部卫生公益性行业科研基金(No. 201202008)
R363
A
10.3969/j.issn.1000- 4718.2017.01.024
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 0536-8192237; E-mail: 15908029097@163.com
