新型锂盐氟代磺酰亚胺锂电解液对锂离子电池性能的影响
2017-01-18邱景义张松通余仲宝廖红英
李 萌 邱景义 张松通 余仲宝 饶 蕾 廖红英
新型锂盐氟代磺酰亚胺锂电解液对锂离子电池性能的影响
李 萌1,2邱景义1,2张松通1,2余仲宝1,2饶 蕾3廖红英4
(1中国人民解放军防化研究院,2先进化学蓄电技术与材料北京市重点实验室,北京100191;3广东产品质量监督检验研究院,广东 广州510330;4北京化学试剂所,北京102607)
采用新型锂盐双(氟代磺酰)亚胺锂(LiFSI)代替六氟磷酸锂(LiPF6)作为锂离子电池的电解液锂盐,配制不同浓度的LiFSI/EC+EMC+DMC(质量比1∶1∶1)电解液,用循环伏安、电化学阻抗(EIS)、恒流充放电等实验并结合Li+迁移数、电导率和黏度等物化参数的测试,研究新型锂盐浓度和电解液物化参数对电池倍率性能的影响。结果表明与同浓度的LiPF6电解液相比,LiFSI电解液具有更高的离子传导能力和电导率及锂离子迁移数;在0.8~1.6 mol/L的浓度范围内,含LiFSI电解液的电池相对含LiPF6电解液的电池表现出更好的电化学性能,更适用于高性能锂离子电池;1.2 mol/L为LiFSI电解液的最优浓度,此时其电导率和锂离子迁移数均达到最大值(=12.39 ms/cm,+=0.6327),制备的锂离子电池电化学阻抗最小,倍率性能最佳。
LiFSI;锂盐浓度;Li+迁移数;电导率;锂离子电池
锂离子电池因较高的能量密度和功率密度被广泛地应用于便携式电子设备和电动汽车领域。作为连接正负极的桥梁,电解液对电池的容量、倍率、安全以及寿命等电化学性能有重要作用。电解质锂盐是锂离子电池电解液的重要组成部分,目前市场上广泛应用的是LiPF6-碳酸酯电解液。LiPF6具有溶解性好、离子传导能力高、离子解离度高等优点,但是它热稳定性差、易水解生成HF,而HF是造成电池性能衰减的重要原因[1]。因此,近些年人们一直在努力寻求性能更优异的新型锂盐来替代传统锂盐LiPF6。LiFSI是最近出现的比较热门的新型锂盐,因其具有比LiPF6更好的热稳定性、导离子能力以及更高的锂离子迁移数,成为最有希望取代LiPF6应用于高性能锂离子电池中的锂盐[2]。
本文通过改变锂盐LiPF6和LiFSI的浓度,对比研究了不同锂盐电解液性能,同时全面系统地分析了锂盐浓度和电解液物化参数的关系,研究了锂盐浓度和电解液物化参数对锂离子电池倍率性能的影响。
1 实验材料和方法
1.1 电解液的配制及参数测定
将碳酸乙烯酯(EC、北京化学试剂所、电池级),碳酸二甲酯(DMC、北京化学试剂所、电池级),碳酸甲乙酯(EMC、北京化学试剂所、电池级),六氟磷酸锂(LiPF6、北京化学试剂所)以及氟代磺酰亚胺锂(LiFSI,杉杉电池材料有限公司)在氩气气氛[(H2O)<1×10-4%,(O2)<1×10-4%]的手套箱中配制浓度分别为0.8 mol/L、1.0 mol/L、1.2 mol/L、1.4 mol/L、1.6 mol/L的LiPF6或LiFSI/EC+EMC+ DMC(质量比1∶1∶1)电解液。用METTLER TOLEDO DL32卡尔费休水分测定仪(瑞士万通)测试电解液的水含量,达到电池级使用标准[(H2O)£1.5×10-3%]的电解液才用于后续实验。
用乌氏黏度计(图1)(= 0.5~0.6 mm,乌式黏度计常数为0.006668 mm2/s2,上海耶茂仪器厂)连续测试电解液的运动黏度3次,具体操作方法是:用10 mL移液管取10 mL待测电解液沿乌式黏度计的A管内壁流入D球。将乌式黏度计垂直固定于(25±1)℃的恒温油浴锅中,使油浴的液面高于缓冲球(B管上端的小球),放置15 min,将B管和C管各接一根乳胶管,夹住C管的胶管,自B管管口处抽气;使电解液液面缓缓升高至缓冲球中部,先放开B管口,再放开C管口,使电解液在管内自然下落,用秒表准确记录液面自测定线a下降至测定线b处的流出时间,重复测定三次,取平均值为流出时间,则电解液的运动黏度由流出时间乘以乌式黏度计常数得到;用DDS-307型电导率仪(上海雷磁仪器厂)测试置于(25±1)℃的恒温油浴锅中的电解液的电导率。为保证测试过程中电解液不吸水,黏度和电导率测试全程在干燥间中进行,干燥间露点达到-40℃。
在氩气气氛的手套箱内,以金属锂(天津中能锂业有限公司、电池级)为正、负极,Celgard 2400膜(美国)为隔膜,添加自制电解液,组装两端Li不闭塞电池:Li|电解液|Li电池。参照恒电位极化 法[3-4],,用英国输力强(Solartron)公司产SL 1287+1260型联用电化学工作站测试电解液的Li+迁移数(+)。对电池施加10 mV的电压D,起始电流0下降至稳定状态的电流ss,极化前、后电池电极电荷转移阻抗与钝化膜阻抗之和分别为0、ss。按式(1)计算+。
1.2 LiFePO4/Li半电池的组装与性能测试
按质量比8∶1∶1将磷酸铁锂(LiFePO4/天津斯特兰能源科技有限公司、电池级),导电剂超级碳黑Super P(上海产,电池级)和聚偏氟乙烯(PVDF、比利时苏威有限公司、电池级)混合均匀,再加入-甲基吡咯烷酮(NMP、北京益利精细化学品有限公司、电池级),搅拌成均匀的浆料,涂覆在20 μm厚的铝箔(河南中发实业,99.9%)集流体上,在120 ℃下真空(-0.1 MPa,下同)干燥24 h,再进行分切(=14 mm),制成LiFePO4电极(含4.32 mg活性物质)。
在氩气气氛手套箱中,以金属锂片(天津中能锂业有限公司、电池级)为负极、LiFePO4电极为正极,组装CR2025型扣式半电池,用CHI 660C型电化学工作站(上海振华仪器有限公司)进行循环伏安和交流阻抗测试。循环伏安测试的电位为2.5~4.0 V,扫描速率为0.1 mV/s;交流阻抗测试的频率为105~10-2Hz,交流扰动电压为5 mV。
1.3 18650型电池的组装与性能测试
按质量比91.0∶1.0∶2.0∶1.5∶4.5将LiFePO4、超级碳黑Super P,导电石墨KS6(密特高石墨有限公司、电池级),碳纳米管(CNT、天奈纳米科技有限公司、电池级)和PVDF混匀,然后加入NMP,搅拌成均匀的浆料。用转移式涂布机涂覆在铝箔集流体上,在120 ℃下真空干燥24 h,再以8 MPa的压力压成137 μm厚,分切成80 cm×5.3 cm的LiFePO4电极(含8.5 g活性物质)。
按质量比93∶2∶5将天然石墨(AGP、深圳贝特瑞新材料有限公司、电池级)、超级碳黑Super P和PVDF混匀,然后加入NMP,搅拌成均匀的浆料,用转移式涂布机涂覆在12 μm厚的铜箔(河南灵宝华鑫铜箔有限责任公司,99.9%)集流体上,在120 ℃下真空干燥24 h,再以11.5 MPa的压力压成82 μm厚,分切成86 cm×5.4 cm的AGP电极(含5.0 g活性物质)。
根据LiFePO4和AGP的比容量,设计正负极活性物质的质量配比及相应的电池工艺参数(负极容量约过量3%)。将制好的电极与Celgard 2400膜卷绕成电芯,经装壳焊接、滚槽、85 ℃真空干燥24 h、注液(6 g)及密封等工艺,制成18650型实验电池。
用5 V/10 A自动充放电仪(深圳新威新能源技术有限公司)对电池进行化成,以0.5 A恒流充电至3.65 V,转恒压充电至0.1 A,静置10 min后,以0.5 A恒流放电至2.30 V,循环3次。用恒流限压、恒压限流的充放电制度,在5 V/20 A自动充放电仪(深圳新威新能源技术有限公司)上进行倍率特性测试,电压为3.65~2.00 V。
2 实验结果与讨论
2.1 电解液电导率、黏度与锂盐的关系
电导率是体现电解液离子传导能力的一个重要物化参数,在一定程度上反映了电解质中电流的传输速度和电池内部阻抗。在一定的温度下,电解液电导率与其黏度、锂盐的溶解度等因素直接相关。LiPF6和LiFSI电解液电导率、黏度与锂盐浓度的关系如图2所示。
从图2可知,两种锂盐电解液的电导率及黏度随锂盐浓度的变化规律一致:电导率随浓度的增大先增大、后减小,峰值均出现在1.2 mol/L附近;黏度则随着浓度的增加而上升,而在低浓度范围内电解液的黏度随浓度的增加趋势较为平缓,当浓度大于1.2 mol/L后LiPF6电解液黏度的增加幅度明显大于LiFSI。这种变化趋势是因为:当锂盐浓度较低时,电解液黏度较低,电导率大小主要取决于游离的离子的多少,因此电导率随着锂盐浓度的增加而增大;随着锂盐浓度的增大,黏度进一步变大,逐渐成为制约离子迁移的主导因素,电导率的增加逐渐缓慢,到达极大值后,开始下降。当锂盐浓度相同时,LiFSI电解液的电导率明显高于LiPF6电解液,而其黏度则低于同浓度的LiPF6,这说明LiFSI在EC/DMC/EMC混合溶剂中的解离度更高,其电解液黏度较小也更利于离子移动,进而使其离子传导能力强于LiPF6。
2.2 Li+迁移数+与锂盐的关系
离子迁移数反映了某种离子运载的电流与通过溶液的总电流之比。在充放电过程中,锂离子电池的电极反应所需要的电荷转移主要由Li+承担,而高的Li+迁移数能减轻电极反应的浓差极化,使电池产生高的能量密度和功率密度[5]。本文采用恒电位极化法对Li+迁移数进行测试。以1.6 mol/LLiPF6电解液电池为例,图3为其测试结果。
响应电流同时间的关系曲线见图3(a)。对电极体系加上10 mV电势差,初始时浓度梯度为零,流过电池两端的电流为正负离子在电场力作用下的电迁移所决定,其初始电流为0,随后电流下降并达到稳态,稳态时负离子的运动对电流的贡献为零,即体系的电流都是由正离子的运动所贡献的[6],稳态电流为ss。当电池极化前后,电极表面电荷转移阻抗以及钝化膜阻抗发生了变化,其值对应于图3(b)第一个半圆直径。根据式(1)计算不同浓度的LiPF6以及LiFSI电解液的+见表1。
对于LiPF6和LiFSI,其电解液的Li+迁移数均随着锂盐浓度的上升,呈现先增加、后减小的趋势,而且LiFSI电解液的Li+迁移数均大于同浓度的LiPF6电解液。LiPF6电解液的Li+迁移数的最大值数值用全角括号起来出现在浓度为1.4 mol/L,数值用全角括号起来,而此浓度下的电导率并不是最大;而LiFSI电解液的最大值0.6327则是当浓度为 1.2 mol/L时出现,此时其电导率也是最大值。这表明电解液的Li+迁移数与电导率不存在必然的正比例关系,电导率大的电解液,其Li+迁移数不一定大。
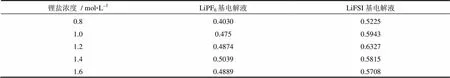
表1 室温下不同浓度的LiPF6以及LiFSI电解液的t+
2.3 电化学阻抗及循环伏安分析
为了解不同锂盐对LiFePO4电极表面形成SEI膜的影响,测试了LiFePO4/Li半电池循环3次前后放电状态的阻抗变化,实验电池的电化学阻抗谱见图4。电化学阻抗谱的Nyquist曲线由高、中频区的半圆和低频区的斜线组成,高、中频区的半圆对应于工作电极表面SEI膜阻抗以及电解液/电极界面电荷转移阻抗之和,低频区的斜线为Li+在电极中的扩散阻抗[7-8]。对于LiPF6和LiFSI两种锂盐,循环3圈后电池的阻抗均明显减小,这说明二者在LiFePO4电极表面均形成了阻抗较小、有利于Li+通过的SEI膜;而分别对比循环前后的LiPF6和LiFSI电池,LiFSI电解液的电池循环前后的阻抗均低于LiPF6电解液的电池,这也进一步印证了LiFSI电解液具有更高的离子传导能力。
不同浓度LiPF6和LiFSI电解液电池的循环伏安曲线见图5。二者的循环伏安曲线均由位于3.6 V附近的氧化峰和位于3.3 V附近的还原峰组成,氧化峰与还原峰的电位差体现了电极反应的可逆程度,电位差越小,电极反应的极化越小,可逆性越高。从CV曲线可以看出LiFSI电解液电池的氧化还原峰的电位差明显小于LiPF6电解液,这说明LiFSI电解液更有利于锂离子的传导,从而减小了浓差极化,使电极反应可逆程度更高。
2.4 倍率性能与锂盐的关系
电解液的离子传导能力直接影响电池的倍率性能。制备了18650型电池以考察不同浓度、不同种类锂盐对电池倍率性能的影响,电池以1C充电、0.5~20C倍率放电,倍率性能见图6。
如图6(a)所示,LiFSI电池的放电比容量均高于LiPF6电池,0.8~1.6 mol/L的浓度范围内,20C放电时的比容量均能保持在100 mA·h/g以上,其中锂盐浓度为1.2 mol/L时的电池倍率性能最佳,如图6(c)所示,20C放电比容量为108 mA·h/g,与0.5C放电相比,容量保持率为90%,当浓度进一步增大时,电池20C放电比容量有些微下降;而对于LiPF6电解液,只有在1.4 mol/L和1.6 mol/L浓度时,电池20C放电时的比容量保持在100 mA·h/g以上,从图6(b)也能看出LiPF6浓度为0.8 mol/L、1.0 mol/L的电池在20C时几乎无放电平台,随着锂盐浓度增大,电池倍率性能有所改善。
综上所述,LiFSI锂盐电解液比LiPF6更适用于电池的高倍率放电,最优浓度为1.2 mol/L,此时电解液具有最大的电导率和锂离子迁移数,离子传导能力最强,能有效减轻浓差极化。
2.5 循环性能与锂盐的关系
另外考察了10C电流放电下,不同锂盐电解液的电池的循环性能,如图7所示。表2记录了不同循环次数下电池的容量保持率。从图中可知,无论是LiPF6或是LiFSI,当电解液中不加任何添加剂时,电池在高倍率10C下放电的循环性能均不佳,前100次循环过程中容量迅速衰减,但不同锂盐、不同浓度的电解液电池的循环稳定性仍有所不同。由图7(a)可知,对于LiPF6电解液,随着锂盐浓度的增大,电池的循环性能变好[9],1.6 mol/L时,300次循环容量保持率为56.2%;而对于LiFSI电解液,由图7(b)可知,浓度为1.2 mol/L时,电池的循环性能相较于1.0 mol/L和0.8 mol/L有明显改善,300次循环容量保持率达到59.1%;当锂盐浓度进一 步增加时,循环性能提高的幅度有限。由表2数 据对比可知,当锂盐浓度相同时,LiFSI电解液电池的大倍率放电的循环性能总体优于LiPF6电解液电池。
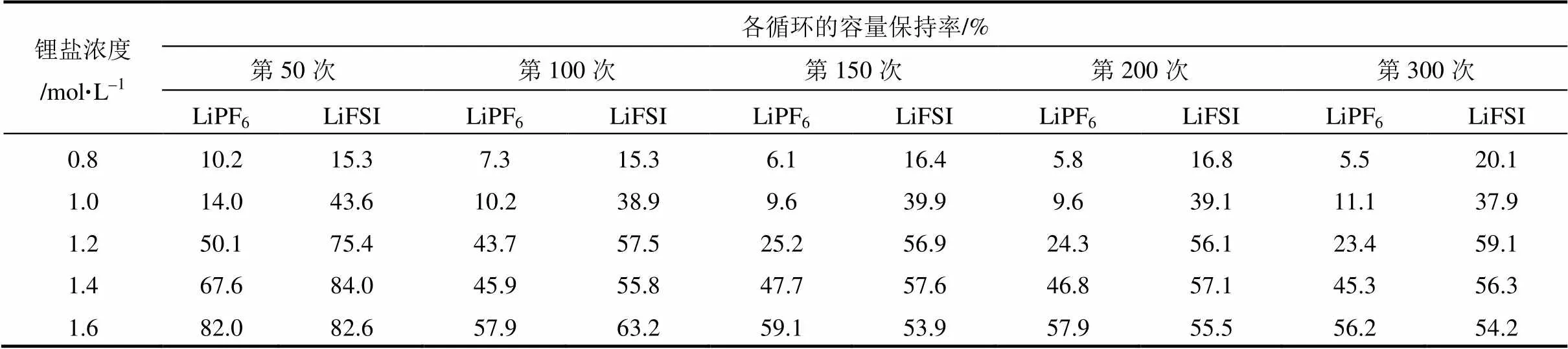
表2 电池的容量保持率与循环次数的关系
3 结 论
研究表明,LiFSI具有比LiPF6更优异的离子传导能力,更适用于电池的高倍率放电。锂盐浓度直接影响电解液的电导率、黏度以及锂离子迁移数,对电池的倍率性能和循环性能也影响显著。浓度为1.2 mol/L的LiFSI电解液具有最大的电导率 (12.39 ms/cm),最大的Li+迁移数(0.6327)以及最好的倍率放电性能,20C放电时具有最高容量保持率(90%),10C放电循环300次容量保持率为59.1%。但是LiFSI对Al集流体的腐蚀问题,本文实验尚未涉及,待进一步深入研究。
[1] 李萌, 邱景义, 余仲宝. 高功率锂离子电池电解液中导电锂盐的新应用[J]. 电源技术, 2015, 39(1): 191-193.
LI M, QIU J Y, YU Z B. New use of conducting salts in electrolytes of high power Li ion batteries[J]. Chinese Journal of Power Sources, 2015, 39(1): 191-193.
[2] HAN H B, ZHOU S S, ZHANG D J, et al. Lithium bis(fluorosulfonyl)imide (LiFSI) as conducting salt for nonaqueous liquid electrolytes for lithium-ion batteries: Physicochemical and electrochemical properties[J]. Journal of Power Sources, 2011, 196: 3623-3632.
[3] MAURO V, APRANO A , CROCE F, et al. Direct determination of transference numbers of LiClO4solutions in propylene carbonate and acetonitrile[J]. Journal of Power Sources, 2005, 141: 167-170.
[4] ZUGMANN S, FLEISCHMANN M, Amereller M, et al. Measurement of transference numbers for lithium ion electrolytes via four different methods, a comparative study[J]. Electrochim Acta, 2011, 56(11): 3926-3933.
[5] 黄峰, 周运鸿. 锂离子电池电解质现状与发展[J]. 电池, 2001, 31(6): 290-293.
HUANG F, ZHOU Y H . Review of electrolytes for lithium-ion batteries[J]. Battery Bimonthly, 2001, 31(6): 290-293.
[6] 唐致远, 薛建军, 李建刚, 等. 聚合物电解质离子迁移数的测定方法[J]. 化学通报, 2001(5): 312-315.
TANG Z Y, XUE J J, LI J G, et al. The test methods of ion transference number of polymer electrolyte[J]. Chemistrymag, 2001(5): 312-315.
[7] 贾铮, 戴长松, 陈玲. 电化学测量方法[M]. 北京: 化学工业出版社, 2006: 100-101.
JIA Z, DAI C S, CHEN L. The instrumental methods in electrochemistry[M]. Beijing: Chemical Industry Press, 2006: 100-101.
[8] 曹楚南, 张鉴清. 电化学阻抗谱导论[M]. 北京: 科学出版社, 2002: 2l-24.
CAO C N, ZHANG J Q. An introduction to electrochemical impedance spectroscopy[M]. Beijing: Science Press, 2002: 2l-24.
[9] 饶蕾, 李萌, 余仲宝, 等. 六氟磷酸锂浓度对锂离子电池性能的影响[J]. 电池, 2015, 45(1): 6-9.
RAO L, LI M, YU Z B, et al. Effects of LiPF6 concentration on the performance of Li-ion battery[J]. Battery Bimonthly, 2015, 45(1): 6-9.
The effect of lithium bis(fluorosulfonyl)imide salt on the performance of Li-ion battery
LI Meng1,2, QIU Jingyi1,2, ZHANG Songtong1,2, YU Zhongbao1,2,RAO Lei3, LIAO Hongying4
(1Research Institute of Chemical Defense,2Beijing Key Laboratory of Advanced Chemical Energy Storage Technology and Materials, Beijing 100191, China;3Guangdong Testing Institute of Product Quality Supervision, Guangzhou 510330, Guangdong , China;4Beijing Institute of Chemical Reagents, Beijing 102607, China)
LiPF6salt was substituted by new salt LiFSI in the electrolyte and comparing researches between them were done. LiFSI/ EC+EMC+DMC (mass ratio was 1∶1∶1) with different concentrations (0.8—1.6 mol/L) were prepared. The effect of lithium salt concentration and electrolyte physicochemical parameters on the rate performance was studied by cyclic voltammetry (CV), electrochemical impedance spectroscopy(EIS), galvanostatic charge-discharge testing, along with physicochemical parameters testing of Li+transference number, conductivity and viscosity. It was found that the electronic conductivity and Li+transference number of LiFSI electrolytes are both larger than LiPF6electrolyte with same salt concentration. In the range of 0.8 mol/L to 1.6 mol/L, Li-ion batteries using LiFSI electrolytes show better electrochemical performances than those with LiPF6 electrolytes. The optional concentration of LiFSI electrolyte is 1.2 mol/L, when ionic conductivity and Li+transference number are both the maximum(=12.39 ms/cm,+=0.6327). Li-ion batteries with 1.2 mol/L LiFSI electrolyts have best rate performance.
LiFSI; lithium salt concentration; Li+transference number; conductivity; Li-ion battery
10.12028/j.issn.2095-4239.2016.0033
TQ 028.8
A
2095-4239(2017)01-101-07
2016-06-29;
2016-08-03。
李萌(1988—),女,助理研究员,研究方向为锂离子电池及其关键材料,E-mail:limengfighting@163.com;
余仲宝,高级工程师,研究方向为锂二次电池单体及其系统集成,E-mail:zhongbaoyu1@sina.com。
