高效液相色谱法测定痤疮患者皮脂中亚油酸和角鲨烯的含量
2017-01-18程丽雪李雅琴刘亦伟王路润
程丽雪,李雅琴,纪 超,刘亦伟,王路润,程 波,俞 洁
(1.福建医科大学附属第一医院 福建 福州 350000;2.福建中医药大学 福建 福州 350000)
高效液相色谱法测定痤疮患者皮脂中亚油酸和角鲨烯的含量
程丽雪1,李雅琴1,纪 超1,刘亦伟1,王路润1,程 波1,俞 洁2
(1.福建医科大学附属第一医院 福建 福州 350000;2.福建中医药大学 福建 福州 350000)
目的:建立利用高效液相色谱法同时测定皮肤病患者皮脂中亚油酸和角鲨烯的分析方法,为各种与体表脂谱有关的皮肤病的研究奠定基础。本文对比了痤疮患者和正常人面部皮脂分泌量、皮脂中亚油酸和角鲨烯的含量,探讨亚油酸和角鲨烯所反映的皮脂腺功能。方法:研究对象为2015年10月-2016年2月在我院皮肤科门诊就诊的寻常型痤疮患者60例,正常人62例。收集、称重和处理标本,样本中亚油酸和角鲨烯采用正己烷液相萃取后,用反相柱以梯度洗脱分离,并在210nm处分析两组亚油酸和角鲨烯的含量。结果:亚油酸在(53.4~1708.8)μg/ml,角鲨烯在(46.8~5616.0)μg/ml范围内线性关系良好(r>0.99,n=6)。两者方法回收率均在(90%~110%);日内、日间精密度均小于15%(n均=5)。正常组和痤疮组中男性皮脂分泌量都显著高于女性,女性和男性痤疮组皮脂分泌量和角鲨烯均显著高于正常组,亚油酸含量均显著低于正常组。结论:建立的检测法可同时测定皮脂中亚油酸和角鲨烯的含量,且灵敏度高,操作简便、准确。寻常痤疮的患者皮脂分泌水平升高、亚油酸含量下降、角鲨烯含量上升。
寻常痤疮;皮脂;亚油酸;角鲨烯
近来国内外研究皮脂脂谱在多种炎症性皮肤病发病中所起的作用,以及据此延伸出的刺激皮脂腺功能来调控皮脂对治疗的助益。寻常痤疮是一类累及毛囊皮脂腺的炎症性皮肤病,发病率高,主要见于青少年期。目前公认的发病机制主要有四大类:雄激素诱导的皮脂分泌增加;角化作用异常;炎症反应;以及P. acnes(Propionibacterium acnes,痤疮丙酸杆菌)的定植[1-2]。既往的研究主要是利用薄层色谱分析,而利用高效液相色谱法测定皮脂成分的研究较少。在本研究中,我们采用高效液相色谱法同时测定皮脂中亚油酸和角鲨烯的含量,以期建立一种方便快捷,灵敏度高的测定方法,为各种与皮脂脂谱有关的皮肤病的研究奠定基础。
1 材料和方法
1.1 临床资料:2015年10月-2016年2月在我院皮肤科门诊就诊的寻常型痤疮患者共60例,女40例,男20例,年龄11~40岁,平均年龄(22.32±5.92)岁。符合《中国临床皮肤病学(第一版)》的诊断标准,以及痤疮Pillsbury分类法中的II、III、IV级痤疮[1]。所有病例组患者均未在近3个月内进行过抗痤疮治疗,包括口服和外用药物。对照组为62例正常志愿者,均为本机构学生,女38例,男24例,年龄17~26岁,平均(22.26±2.55)岁。两组均排除合并其他影响皮脂分泌的因素或系统性疾病以及对酒精过敏不能耐受者。两组年龄和性别差异均无统计学差异,所有患者均告知并签署知情同意书,且均在适宜光线下采集正面及侧面照片共3张。
1.2 材料
1.2.1 仪器:Waters 高效液相色谱仪(包括 1525 Binary高压输液泵、717自动进样器和2998紫外阵列检测器等)(美国Waters公司);AE-240双量程电分析天平(梅特勒-托利多仪器有限公司);KQ3200E型超声波清洗器(昆山市超声仪器有限公司);HERAEVS PICO 21离心机(美国赛默飞世尔科技公司);Vortex-Genie 2 涡旋振荡器(美国Scientific Industries公司)。
1.2.2 药品和试剂:亚油酸对照品(美国Sigma公司,批号:BCBN6404V,纯度≥ 98.5%);角鲨烯对照品(美国Sigma公司,批号:MKBQ5948V,纯度≥ 98%);正己烷、甲醇(分析纯,上海阿拉丁试剂公司);乙腈、甲醇(色谱纯,山东禹王化工公司),水为自制去离子水。
1.3 方法
1.3.1 色谱条件:色谱柱为Ultimate XB C18(4.6mm×250mm,5μm);流动相为乙腈(A)-甲醇(C)(梯度洗脱,起始,A∶C(90∶10);9.0min时,A∶C(100∶0,v/v);24.0min 时A∶C(90∶10,v/v););流速为梯度洗脱,起始,1.0ml/min;9.0min 3.0ml/min;24.0min时,1.0ml/min. 检测波长为210nm;柱温为30℃;进样量为20μl。
1.3.2 标准溶液配制:用分析天平精密称取亚油酸对照品53.4mg置于10ml容量瓶中,用甲醇溶解并定容,配成浓度为5.34mg·ml-1的亚油酸储备液;再稀释成534μg·ml-1的亚油酸工作液;精密称取角鲨烯对照品23.4mg置于10 ml容量瓶中,用甲醇溶解并定容,配成2.34mg·ml-1的角鲨烯储备液,再稀释成234μg·ml-1的角鲨烯工作液。工作液置于4℃冰箱保存备用,储备液置于-20℃冰箱保存备用。
1.3.3 样本处理:将样本置于2.5l 冻存管中,加入1.5ml正己烷萃取,超声15min,吸取充分溶解后的有机相1.0ml,置于36℃水浴氮气流吹干;残渣加入150μl 流动相(乙腈-甲醇90∶10)复溶,涡旋3min,离心5min,经0.45μm滤膜过滤,取20 μl进样分析。
1.4 方法学考察
1.4.1 特异性实验:分别取亚油酸,角鲨烯,亚油酸和角鲨烯混合物(1∶1)混匀,用标准溶液制作,模拟取样滤纸同方法3操作后进样,在本文色谱条件下分析,确保流动相中的杂质不会干扰亚油酸和角鲨烯的浓度测定;取空白滤纸按上述步骤操作进样分析,确保空白滤纸中的杂质不会干扰亚油酸和角鲨烯的浓度测定。
1.4.2 标准曲线制备:用分析天平精密量取亚油酸标准储备液或工作液适量加至空白滤纸中,配制53.4、106.8、213.6、427.2、854.4、1708.8μg·ml-1浓度系列的标准样品,角鲨烯标准储备液或工作液适量加至同一张空白滤纸中,配制46.8、234.0、936.0、1872.0、3744.0、5616.0 μg·ml-1浓度系列的标准样品,均按“方法3”操作进样分析。以亚油酸或角鲨烯色谱峰面积为应变量(y),亚油酸或角鲨烯浓度为自变量(x),进行线性回归分析,得到亚油酸或角鲨烯浓度标准曲线回归方程。
1.4.3 方法回收率:用分析天平精密称取亚油酸标准储备液或工作液适量,加至空白滤纸中,配制成低、中、高(106.8、427.2、854.4μg·ml-1)三种浓度的质控(QC)样品各5份,角鲨烯标准储备液或工作液适量,加至同一张空白滤纸中,配制成低、中、高(140.4、1872.0、3744.0μg·ml-1)三种浓度的质控(QC)样品各5份,均按“方法3”操作进样分析,以“2.4”项下所得标准曲线回归方程计算实测浓度,考察方法回收率。方法回收率公式为:
1.4.4 精密度试验:用分析天平精密称取亚油酸标准储备液或工作液适量,加至空白滤纸中,配制成低、中、高(106.8、427.2、854.4μg·ml-1)三种浓度的质控(QC)样品,角鲨烯标准储备液或工作液适量,加至同一张空白滤纸中,配制成低、中、高(140.4、1872.0、3744.0μg·ml-1)三种浓度的质控(QC)样品,均按“方法3”操作进样分析。在1 日内不同时间测定5 次,考察日内精密度。同法每日操作和测定一次,连续5d,考察日间精密度。
1.4.5 标本收集、称重和处理
1.4.5.1 标本收集:环境温度17~22℃,湿度(40~54)%。取材对象洁面后15min,用显微镜擦镜纸(10cm×15cm)取每片5cm×3.75cm大小,用70%乙醇浸润后敷于取材对象的额头二片,双侧脸颊各一片,下巴一片,共五片,期间70%乙醇挥发至干时,用棉签沾70%乙醇补充。15min后折起存入密封小瓶中。置-80℃冰箱中保存。
1.4.5.2 标本称重:环境温度17~22℃,湿度(40~54)%。分别于取材当天称取空白滤纸和吸取皮脂后的滤纸重量,可精确到0.0001g。皮脂分泌量计算见公式(1):
皮脂重量(g)=吸取皮脂后的滤纸重量(g)-空白滤纸重量(g) 1.4.5.3 标本处理 将吸取皮脂后的滤纸放至2.5 ml 冻存管中,按“方法3”操作进样分析,得到皮脂中亚油酸和角鲨烯的浓度(μg·ml-1)。
1.4.5.4 亚油酸和角鲨烯含量的计算见公式(2)。

1.5 统计学处理:采用SPSS19.0统计软件,对于计量资料的统计分析,若资料服从正态分布,则采用t检验比较各组之间的差异,反之,则采用秩和检验。对于计数资料的统计分析则采用χ2检验。所有P值基于双侧检验,统计学显著性水平设定为0.05(P<0.05)。
2 结果
2.1 建立HPLC法测定皮脂中亚油酸和角鲨烯含量
2.1.1 亚油酸和角鲨烯的色谱行为和特异性:在本法色谱条件下,亚油酸和角鲨烯HPLC色谱图如图1所示。亚油酸和角鲨烯完全分离,保留时间分别为7.007min和22.847 min。通过比较标准样品、溶剂(乙腈-甲醇90∶10)和空白滤纸的色谱图检测信号可知流动相和空白滤纸的杂质不会影响皮脂中亚油酸和角鲨烯的浓度测定。
2.1.2 标准曲线:亚油酸皮脂浓度标准曲线回归方程为Y=3390·X+34500,r2=0.99,n=6定量下限为53.4μg·ml-1(S/N>10),表明亚油酸在范围(53.4~1708.8)μg·ml-1线性关系良好;角鲨烯皮脂浓度标准曲线回归方程为Y=8400·X-41600,r2=0.99,n=6,定量下限为46.8μg·ml-1(S/N>10),表明角鲨烯在范围(46.8~5616.0)μg·ml-1线性关系良好;
2.1.3 方法回收率和精密度:亚油酸和角鲨烯方法回收率和精密度实验数据见表2。
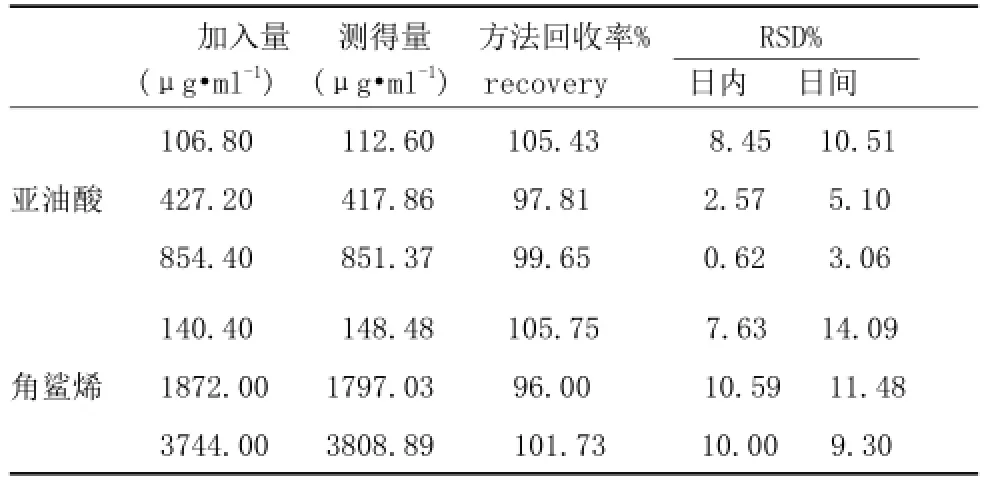
表2 测定皮脂中亚油酸和角鲨烯的方法回收率 (n=5)
2.2 皮脂分泌量比较:正常组和痤疮组(男性和女性)的皮脂分泌量差异见表3、表4,有统计学意义,P均<0.05,痤疮组的皮脂分泌量(g)高于正常组。

表3 正常组和痤疮组女性的皮脂分泌量比较

表4 正常组和痤疮组男性的皮脂分泌量比较
2.3 亚油酸含量比较:正常组和痤疮组(男性和女性)的亚油酸含量差异见表5、表6,有统计学意义,P均<0.05,正常组男性亚油酸含量高于痤疮组。

表5 正常组和痤疮组女性的亚油酸含量比较

图1 亚油酸和角鲨烯的HPLC色谱图

表6 正常组和痤疮组男性的亚油酸含量比较
2.4 角鲨烯含量比较正常组和痤疮组(男性和女性)角鲨烯含量差异见表7、表8,有统计学意义,P均小于0.05,痤疮组男性角鲨烯高含量于正常组男性。

表7 正常组和痤疮组女性的角鲨烯含量比较

表8 正常组和痤疮组男性的角鲨烯含量比较
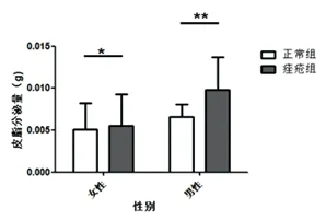
图2 皮脂分泌量比较,*P<0.05;**P<0.05

图3 正常组与痤疮组的亚油酸含量比较,*P<0.05;**P<0.05
3 讨论
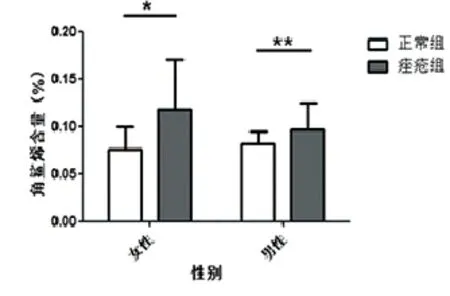
图4 正常组与痤疮组的角鲨烯含量比较,*P<0.05;**P<0.05
目前提取体表脂类的方法主要是溶剂提取分离法,这种方法应用范围广且操作简便,常用于化妆品功效评价和皮肤科临床研究[8-9]。随着科技快速发展和社会不断进步,不断创新并应用各种高科技,目前脂类分析方法主要是采用 HPLC技术,该方法方便快捷,灵敏度更高,还可与质谱分析仪联用,在脂类检测方面前景广阔。既往的研究主要是使用薄层色谱分析,自从HPLC的出现,脂类分析的效率和精确度得到了显著提升,Camera等[11]在2010年使用HPLCMS法进行了20例正常人的皮脂成分分析,其所使用的流动相异丙醇缩短高效色谱分析柱使用年限,仪器昂贵,方法重复、推广有难度,但是其比较了多种取样方法较为实用,应用良好。其白种人正常人皮脂成分HPLC测定,有一定参考价值。本文建立了HPLC法同时测定皮脂中亚油酸和角鲨烯的浓度,具有灵敏度高、操作简便、快捷、准确等优点,适用于检测皮脂中亚油酸和角鲨烯的浓度。
长期以来认为皮脂溢出量增多是痤疮发病机制中的主要原因,P.acnes的大量繁殖可将皮脂中的甘油三酯代谢为游离脂肪酸,皮脂分泌速率加快,P. acnes的浓度也会随之增高[12]。男性相比女性皮脂溢出量更多,可能与雄激素水平高及雌激素水平低有关,而雄激素与皮脂腺的数量及活性关系密切,可促进皮脂腺分泌皮脂,推测雌激素的作用机制可能为皮脂腺内局部直接对抗雄激素效应,通过负反馈抑制性腺生成雄激素以及调节基因对皮脂腺生长或油脂生成起负影响作用[12-13]。一项早期的研究证实痤疮患者相比非痤疮患者皮脂分泌率更高,且可促进痤疮的炎症反应过程[14]。另一项近期的研究也证实皮脂产量在痤疮发展中起到了重要作用[15]。
目前研究提示皮脂组成可在痤疮发病机制中发挥更重要的作用。亚油酸是人类表皮含量最多的脂肪酸,同样也是神经酰胺的前体,而神经酰胺是组成角质层渗透屏障中细胞间基质的主要成分。亚油酸是一种必需脂肪酸,从食物中摄取,已有研究表明饮食中摄入的脂肪酸和胆固醇可被传递到皮肤角质层。PUFA对角质形成细胞中的脂肪酸转移蛋白具有更高的选择性。当饮食中的PUFA如亚油酸缺乏时,MUFA如油酸,会取代它的位置,导致角质层渗透性异常,经表皮水分丢失增多[5]。另一方面, PUFA如亚油酸缺乏,将会诱导增殖蛋白(K6和K16)和炎症相关角蛋白(K17)激活,从而诱导炎症反应发生[6]。这些研究都强调了饮食中脂肪酸的重要性,尤其是亚油酸,对维持表皮动态平衡和角质层渗透屏障起到了重要作用[7]。
角鲨烯是胆固醇的前体,是一类天然合成的聚丙烯复合物,大部分哺乳动物可合成胆固醇,参与组成细胞膜的双层结构。角鲨烯在大部分的组织器官中含量不高,主要是由于存在较长的不饱和碳氢链,可迅速转变为羊毛甾醇以及胆固醇。人类皮脂中角鲨烯可积聚到较高水平,面部和躯干上部分泌的皮脂中含量大约为10%~15%,而皮脂中胆固醇的含量仅仅不到2%,对人类来说是具有特征性的[16-17]。角鲨烯作为自然中较长且高度不饱和的碳氢化合物,除了可合成胆固醇,也是一类具有高度渗透力的润滑剂、保湿剂。角鲨烯在皮肤表面的氧化具有诸多层面的重要意义,一方面角鲨烯的氧化在紫外线保护中发挥重要,另一方面在紫外线等作用下氧化的角鲨烯可导致细胞毒性、促炎症反应、免疫学反应事件,并可能加速皮肤的老化进程[16-18]。近来一项研究证实角鲨烯过氧化物可促进HaCaT角质形成细胞中炎症因子的释放,促进炎症反应,诱导痤疮发生[19]。角鲨烯是皮脂中最无极性和最不饱和的分子,其含量改变可影响皮脂的流变学特性,角鲨烯含量在痤疮患者皮脂中显著增高,因而也可作为易患痤疮的脂类标志。
既往的研究主要是利用薄层色谱分析,操作复杂,对于皮肤科临床医师的可重复性差,阻碍了对皮脂脂谱在各种皮肤病中的研究的进展。本研究建立了同时测定皮脂中亚油酸和角鲨烯含量的高效液相色谱法,其中包括配制标准溶液,摸索色谱条件,特异性实验,标准曲线制备以及方法回收率和精密度实验。进行标本收集、称重和处理,样本中亚油酸和角鲨烯采用正己烷液相萃取后,用反相柱以梯度洗脱分离,并在210nm处分析两组亚油酸和角鲨烯的含量。近来国内外陆续有了研究皮脂脂谱在多种炎症性皮肤病发病中所起的作用,以及据此延伸出的刺激皮脂腺功能来调控皮脂对治疗的助益,恰当的医学护肤品用来抗脂质氧化[6]。希望通过本研究,可以建立一种方便快捷,灵敏度高的测定方法,为各种与皮脂脂谱有关的皮肤病的研究奠定基础。
[1]赵辨.中国临床皮肤病学[M].南京∶ 江苏科学出版社, 2010:1165-1166.
[2]Aydemir EH.Acne vulgaris[J].Turk Pediatri Ars, 2014, 49(1): 13-16.
[3]Williams HC, Dellavalle RP, Garner S.Acne vulgaris[J].Lancet, 2012, 379(9813): 361-372.
[4]Akiyama M, Sugiyama-Nakagiri Y, Sakai K, et al.Mutations in lipid transporter ABCA12 in harlequin ichthyosis and functional recovery by corrective gene transfer[J].J Clin Invest, 2005, 115(7): 1777-1784.
[5]Meguro S, Arai Y, Masukawa Y, et al.Relationship between covalently bound ceramides and transepidermal water loss (TEWL) [J].Arch Dermatol Res, 2000, 292(9): 463-468.
[6]Ekanayake-Mudiyanselage S, Aschauer H, Schmook F P, et al.Expression of epidermal keratins and the cornified envelope protein involucrin is infuenced by permeability barrier disruption[J]. J Invest Dermatol, 1998, 111(3): 517-523.
[7]Schurer N Y, Stremmel W, Grundmann J U, et al.Evidence for a novel keratinocyte fatty acid uptake mechanism with preference for linoleic acid: comparison of oleic and linoleic acid uptake by cultured human keratinocytes, fbroblasts and a human hepatoma cell line[J].Biochim Biophys Acta, 1994, 1211(1): 51-60.
[8]Ottaviani M, Alestas T, Flori E, et al.Peroxidated squalene induces the production of infammatory mediators in HaCaT keratinocytes: a possible role in acne vulgaris[J].J Invest Dermatol, 2006, 126(11): 2430-2437.
[9]谈益妹,王学民,周玉田.一种皮脂分泌量定量测定方法的建立[J].日用化学工业, 2002, 32(5): 69-71.
[10]Clarys P, Barel A.Quantitative evaluation of skin surface lipids[J]. Clin Dermatol, 1995, 13(4): 307-321.
[11]Camera E, Ludovici M, Galante M, et al.Comprehensive analysis of the major lipid classes in sebum by rapid resolution highperformance liquid chromatography and electrospray mass spectrometry[J].J Lipid Res, 2010, 51(11): 3377-3388.
[12]Al J B e.Dermatology[M].Dutch: Elsevier Press, 2012.545-547.
[13]Chen W C, Zouboulis C C.Hormones and the pilosebaceous unit[J]. Dermatoendocrinol, 2009, 1(2): 81-86.
[14]Harris H H, Downing D T, Stewart M E, et al.Sustainable rates of sebum secretion in acne patients and matched normal control subjects[J].J Am Acad Dermatol, 1983, 8(2): 200-203.
[15]Mourelatos K, Eady E A, Cunliffe W J, et al.Temporal changes in sebum excretion and propionibacterial colonization in preadolescent children with and without acne[J].Br J Dermatol, 2007, 156(1): 22-31.
[16]Kelly G S.Squalene and its potential clinical uses[J].Altern Med Rev, 1999, 4(1): 29-36.
[17]Smith T J.Squalene: potential chemopreventive agent[J].Expert Opin Investig Drugs, 2000, 9(8): 1841-1848.
[18]Pham D M, Boussouira B, Moyal D, et al.Oxidization of squalene, a human skin lipid: a new and reliable marker of environmental pollution studies[J].Int J Cosmet Sci, 2015, 37(4): 357-365.
[19]Huynh T T.Burden of Disease: The Psychosocial Impact of Rosacea on a Patient's Quality of Life[J].Am Health Drug Benefits, 2013, 6(6): 348-354.
Determine content of linoleic acid and squalene of acne patients sebum by HPLC
CHENG Li-xue1, LI Ya-qin1, JI Chao1, LI Yi-wei1, WANG Lu-run1, CHENG Bo1, YU Jie2
(1.The First Affliated Hospital of Fujian Medical University, Fuzhou 350000,Fujian,China; 2. Fujian University of Traditional Chinese Medicine,Fuzhou 350000,Fujian,China)
Objective To establish a method to simultaneously determine squalene and linoleic acid in patients with acne by HPLC, to lay the foundation for the study of a variety of surface lipid composition and spectrum-related skin diseases. This article compares the facial acne patients and normal people secretion of sebum linoleic acid and squalene content of sebum, explore the linoleic acid and squalene refected sebaceous gland function.MethodsAnalysis included 122 subjects,60 cases of acne vulgaris patients were from our hospital dermatology clinic from October 2015 to February 2016, 62 cases of normal people. Collection, weighing, handling specimens,and last analyzed by HPLC, to obtain the content of linoleic acid and squalene in both groups at 210 nm. Results Linoleic acid had a good linear relationship in the range of 53.4-1708.8μg/ml; Squalene had a good linear relationship in the range of 46.8-5616 μg / ml; Recoveries were 90%-110%. Precision (intra and inter-day) were less than 15%. Sebum weight and squalene levels both in women and men were higher in acne group. Linoleic acid levels both in women and men were lower in acne group. Conclusions The established HPLC method for simultaneous determining content of linoleic acid and squalene has the characteristics of high sensitivity, easy manipulation, rapidity and accuracy. The skin surface lipid composition of acne vulgaris is elevated levels of sebum secretion, decreased content of linoleic acid, increased content of squalene.
acne vulgaris; sebum; linoleic acid; squalene
R758.73
A
1008-6455(2016)12-0044-05
2016-07-11
2016-10-10
编辑/张惠娟
2013-2016年度福建省中医药科研项目( WZPW 201311)
程波,男,第三军医大学皮肤性病学博士,美国Georgetown大学高级访问学者。现任福建医科大学附属第一医院副院长、福建医科大学第一临床学院副院长、皮肤科主任、教研室主任、福建省皮肤病性病防治研究所所长、教授、主任医师、硕士生导师、福建省百千万人才;E-mail:chengbo630415@126.com
