林蛙油活性肽对小鼠免疫功能的影响1)
2017-01-17刘仁杰王春凤王刚陈光
刘仁杰 王春凤 王刚 陈光
(吉林农业大学,长春,130118)
林蛙油活性肽对小鼠免疫功能的影响1)
刘仁杰 王春凤 王刚 陈光
(吉林农业大学,长春,130118)
以林蛙油蛋白双酶水解超滤后获得的2种不同分子质量区间的活性肽BPOR1及BPOR2为试验原料,体外通过脾淋巴细胞增殖试验,分别加入不同剂量的BPOR1、BPOR2和ConA诱导,观察淋巴细胞的增殖情况,体内通过灌胃不同剂量BPOR1及BPOR2(100、300、600 mg·kg-1·d-1)30 d,以脾脏指数和胸腺指数的变化来观察2种活性肽对小鼠免疫器官的影响,利用流式细胞仪检测小鼠T淋巴细胞亚群的变化情况。结果表明:BPOR1可明显地促进小鼠脾淋巴细胞增殖,且具有对ConA诱导的脾淋巴细胞增殖的协同刺激作用。2种混合肽对小鼠脾脏指数和胸腺指数比均有影响,并且都能影响小鼠CD3+、CD4+、CD8+T淋巴细胞亚群的分布。可见,林蛙油活性肽能增加小鼠的免疫能力,且BPOR1的作用效果比BPOR2明显。
林蛙油;活性肽;免疫功能
With BPOR1 and BPOR2, two kinds of bioactive peptides from the oviductus ranae by enzymatic hydrolysis and ultrafiltration, we studied the effects of immunologic function in mice to observe the proliferation by adding different contents of ConA and BPOR1 or BPOR2 in culture of spleen lymphocytes, respectively. Then, we administrated mice intragastrically by different doses of BPOR1and BPOR2 (100, 300 and 600 mg/(kg·d)) for 30 d, and observed effect of BPOR on the immune organs by SI and TI. The change of T lymphocyte subsets were detected by flow cytometry. BPOR1 can obviously promote the proliferation of spleen lymphocytes in mice, and with ConA the synergistic effect was gained. SI and TI were influenced by BPOR1 and BPOR2, and the distribution of CD4+, CD8+and CD3+T lymphocyte subsets also were influenced. Therefore, BPOR1 and BPOR2 had the potential to enhance mice immunity, and the effect of BPOR1 was more obvious than that of BPOR2.
中国林蛙(Ranachensinensis)俗称田鸡、哈什蚂等,多分布于东北三省,属于药、食、补于一体的珍贵蛙种。林蛙油是雌性林蛙的输卵管,含有多种人体所需的营养物质,包括丰富的蛋白质、多糖、微量元素以及维生素等[1],具有滋阴养颜、调节内分泌、延缓衰老、增强免疫力等作用[2]。林蛙油中蛋白质经酶水解后,可产生具有多种生理功能的林蛙油活性肽(BPOR)[3]。研究表明,活性肽是一种重要的生物活性物质,可通过免疫刺激及调节微生态活性来实现免疫调节功能[4]。本研究中的林蛙油活性肽已经过试验验证,具有抗氧化活性。为证实林蛙油活性肽的免疫活性,首先进行体外细胞培养,检测不同分子质量区间的林蛙油活性肽BPOR1(1~5 ku)及BPOR2(≥5~8 ku)对脾淋巴细胞增殖的作用效果,再通过体内试验进一步验证2种林蛙油混合肽的免疫保健功效,为林蛙油功能性食品的开发利用及提高机体免疫功能保健品的创制提供理论支持。
1 材料与方法
1.1 试验材料
6周龄昆明雄性小鼠80只,SPF级,平均体质量(20±2)g,购自吉林大学实验动物中心。
林蛙油取自吉林省长白山区;CD3、CD4、CD8等单克隆荧光抗体均购于BD公司。RPMI-1640细胞培养液、胎牛血清磷酸盐缓冲液(PBS)、红细胞裂解液、FACS buffer均购于BD公司。
ACCURIC6流式细胞仪,美国BD公司;ALPHA1-4 LD plus型真空冷冻干燥机,德国CHRIST公司;3K18型冷冻离心机,美国Sigma公司;超滤装置,Millipore Labscale TFF;荧光倒置显微镜EVOS F1EVOS F1,美国AMG公司;Infinite200酶标仪,TECAN公司。
1.2 试验方法
1.2.1 林蛙油活性肽的制备
林蛙油蛋白分别以木瓜蛋白酶和中性蛋白酶水解,钝化酶后以8 000 r·min-1离心40 min取上清,经密理博超滤系统超滤、透析及Sephadex G-25葡聚糖凝胶过滤层析分离后得到BPOR1(1~5 ku)及BPOR2(≥5~8 ku)2种活性肽,冻干备用。
1.2.2 试验动物分组和给药
将小鼠随机分为BPOR1和BPOR2低、中、高剂量组、对照组及细胞增殖试验组,每组10只,分别给予100、300、600 mg·kg-1·d-1的BPOR1和BPOR2溶液,每天灌胃给药1次,连续30 d。对照组给以蒸馏水。各组小鼠均自由饮水、摄食。
1.2.3 小鼠脾脏淋巴细胞增殖试验
小鼠无菌取脾、制脾细胞悬液,用RPMI1640完全培养液调整脾细胞的密度为107个·mL-1,96孔细胞培养板中加细胞悬液100 μL·孔-1。对照组,PRMI1640培养液110 μL·孔-1;试验组,PRMI1640培养液10 μL·孔-1+100 μL·孔-1的BPOR1或BPOR2(终质量浓度分别为20、40、60、80、100 mg·L-1),50 mg·L-1的ConA液10 μL·孔-1+100 μL·孔-1的BPOR1或BPOR2(终质量浓度分别为20、40、60、80、100 mg·L-1);ConA诱导组,PRMI1640培养液100 μL·孔-1+50 mg·L-1的ConA液10 μL·孔-1。每个处理6个平行,混匀后置37 ℃、5% CO2培养箱中培养40 h,轻吸弃上清100 μL·孔-1,加MTT液40 μL·孔-1并继续培养4 h,离心弃上清,加DMSO 150 μL·孔-1,振荡混匀2 min,静置20 min,酶标仪570 nm测OD值。
1.2.4 林蛙油活性肽对小鼠免疫器官脏体比的影响
小鼠饲喂30 d后,称质量,处死,取其脾和胸腺,吸干表面血污,称质量,记录数据。按照公式(1)和(2)进行计算。对各剂量组结果与对照组进行方差分析。
脾脏指数=(脾质量/体质量)×10。
(1)
胸腺指数=(胸腺质量/体质量)×10。
(2)
1.2.5 流式细胞仪检测小鼠T淋巴细胞亚群
连续灌胃30 d,小鼠眼球采血后颈椎脱臼处死,无菌取小鼠脾脏,制取脾淋巴细胞单细胞悬液,计数、调整细胞密度至106个·mL-1;将上述单细胞悬液分管,每管加入10 μL CD3、CD4和CD8荧光表面抗体,充分混匀,4 ℃避光孵育1 h后,每管加入1 mL FACS buffer,4 ℃,2 000 r·min-1离心5 min,弃上清;以用150 μL FACS buffer轻轻地重悬细胞沉淀;将细胞液用70 μm尼龙膜过滤转移至流式管中,上机检测。
1.2.6 数据分析
利用CELLQUEST软件分析流式细胞仪上获取的数据,CD3+,CD4+和CD8+T淋巴细胞分别以其占T淋巴细胞的比例计算,软件SPSS 18对数据进行统计学分析。
2 结果与分析
2.1 小鼠脾淋巴细胞增殖情况
按照分组方案培养脾淋巴细胞至40 h,于倒置显微镜下观察细胞的增殖情况,结果如图1所示。各组脾淋巴细胞的增殖情况差异明显。与对照组相比,ConA阳性对照组的脾淋巴细胞明显增加,而ConA+BPOR1(60 mg·L-1)协同刺激组淋母细胞数量明显多于ConA阳性对照组。

a.对照组;b.ConA刺激组;c.ConA+BPOR1(60 mg·L-1)协同刺激;d.ConA+BPOR2(60 mg·L-1)协同刺激。
图1 小鼠脾淋巴细胞不同刺激物培养40 h的结果
通过MTT法检测各组脾淋巴细胞的增殖情况,结果以吸光度值衡量。由表1可知:在无ConA刺激下,与对照组相比,40~100 mg·L-1的BPOR1均能明显地促进小鼠脾淋巴细胞增殖,而BPOR2各剂量组效果不明显。在ConA刺激下,20~100 mg·L-1的BPOR1和ConA联合作用诱导的淋巴细胞增殖显著,且60 mg·L-1的刺激效果最好。BPOR2组中仅20 mg·L-1剂量作用下,ConA诱导的淋巴细胞增殖显著高于对照组,其他各剂量组作用效果不明显。表明BPOR1对脾淋巴细胞的增殖效果比BPOR2明显,且BPOR1具有对ConA诱导的脾淋巴细胞增殖的协同刺激作用。

表1 BPOR1和BPOR2对脾淋巴细胞增殖能力的影响(n=6)
注:表中数据为平均值±标准差;*为差异显著(P<0.05),** 为差异极显著(P<0.01)。
脾脏淋巴细胞是机体的免疫活性细胞,其增殖是反映细胞免疫最直接的指标。本研究发现,BPOR1对小鼠淋巴细胞的促增殖作用显著,与ConA协同作效果更加明显。可能是由于BPOR1中主要成分为小分子活性肽,在淋巴细胞增殖中作为致有丝分裂原促进DNA的复制、蛋白的翻译表达、多酶系统的合成分泌等直接提供营养和能量需求,具有促进淋巴细胞增殖的作用,对增强机体的免疫功能具有重要的意义[5]。
2.2 免疫器官脏/体比
以2种的林蛙油活性肽BPOR1和BPOR2为原料来研究对小鼠免疫器官的影响。小鼠灌胃结束后,按照脏体比测定方法及公式(1)和(2)计算给药30 d后的脏体比,结果见表2。由表2可知,2种林蛙油活性肽对小鼠脾脏指数和胸腺指数均有影响。BPOR1 3个剂量组的脾脏指数及胸腺指数均高于对照组,且呈现一定的剂量效应关系,高剂量组的脾脏指数与对照组差异显著(P=0.048),其胸腺指数与对照组存在显著性差异(P=0.045)。BPOR2组中只有低剂量组的脾脏指数略高于空白对照组,其他中、高剂量组脾脏指数和胸腺指数均低于对照组,各组间差异不显著(P>0.05)。

表2 BPOR1和BPOR2对小鼠免疫器官质量的影响(n=10)
注:表中数据为平均值±标准差;*为差异显著(P<0.05)。
生物体内细胞分化、神经激素递质调节、免疫调节等均与活性肽密切相关。肽分子质量越小,越容易通过细胞膜以原形直接进入细胞内,直接介入新陈代谢[6]。本试验中的BPOR1分子质量为1~5 ku,而BPOR2分子质量≥5~8 ku,在BPOR1中含有更为丰富的小分子活性肽。研究表明:在机体内小分子活性肽可以修复缺损,排除细胞内毒素,激活多种酶系统,具有更强的生物活性来调节靶器官的状态及功能,活跃和增强免疫系统[7]。因此,本研究中2种林蛙油活性肽均能提高脾脏指数和胸腺指数,且BPOR1的作用明显优于BPOR2。与相关研究报道[8]相符。
2.3 小鼠T淋巴细胞亚群分群
二维散点图以双参数确定淋巴细胞群,每个点表示一个或多个细胞。全图划分为4个象限,以区分阴性细胞、单阳性细胞以及双阳性细胞。经不同剂量林蛙油活性肽给药30 d后,在淋巴细胞亚群周围通过合理的设门P,以单独分析指定的亚群细胞[9]。如图2所示,不同剂量林蛙油活性肽灌胃30 d后的CD3+、CD4+和CD8+T淋巴细胞亚群均可明显地分群。
2.4 林蛙油活性肽对小鼠T淋巴细胞亚群的影响
以BPOR1和BPOR2经口灌胃正常小鼠30 d,以此来研究二者对小鼠T淋巴细胞亚群的影响。由表3可见,与空白对照组相比,林蛙油活性肽BPOR1和BPOR2对小鼠T淋巴细胞亚群均有一定的影响。BPOR1的3个剂量组的CD3+、CD4+及CD4+/CD8+值,与对照组相比,高剂量组的T淋巴细胞比例增加最大,中剂量组次之,低剂量组则最小。3个剂量组的CD3+、CD4+及CD4+/CD8+值均高于对照组,但各组差异均无统计学意义,同时也不呈现剂量效应关系;BPOR1各组相对应的CD8+值均略低于对照组,各组差异不显著。BPOR2的中、高剂量组的T淋巴细胞比例均高于对照组,但差异不明显,同时2剂量组的CD8+值均高于对照组,各组间差异均无统计学意义(表3)。
表3 BPOR1和BPOR2对小鼠T淋巴细胞亚群的影响(n=10)

处理剂量/mg·kg-1·d-1CD3+/%CD4+/%CD8+/%(CD4+/CD8+)/%对照组 040.18±6.0452.15±4.2315.88±2.363.37±0.62BPOR110041.28±3.4652.85±6.4315.03±1.673.55±0.5130041.70±4.4953.43±2.1015.63±1.613.46±0.4460042.46±3.6754.74±7.0415.40±1.833.59±0.64BPOR210036.62±4.6751.08±6.5115.32±1.443.36±0.5230040.24±5.6052.95±4.8617.40±1.353.04±0.1460040.82±1.3253.36±5.5715.98±2.113.40±0.67
注:表中数据为平均值±标准差。
T淋巴细胞是机体免疫系统重要的一群细胞,具有抵抗病毒和调节免疫系统功能的作用。细胞膜表面的CD3+为成熟T细胞表面标志,反映了总T淋巴细胞水平。CD4+是免疫反应的核心细胞,CD8+是免疫反应的效应细胞,CD4+、CD8+两个亚群相互协作和制约,二者的比值维持在一定水平,达到免疫平衡,实现机体正常免疫功能。当CD3+、CD4+及CD4+/CD8+数量减小或CD8+数量增加则免疫失衡,反映了机体免疫能力的下降,则易引发一系列疾病[10]。因此,T淋巴细胞亚群的免疫分型能够提供机体状态的重要信息。
灌胃30 d不同剂量的BPOR1和BPOR2后,检测T淋巴细胞亚群的变化情况,最终结果并没有引起CD3+、CD4+、CD8+T淋巴细胞数量的显著变化。可能是由于BPOR1和BPOR2被机体吸收利用后,激活脾脏多酶系统,参与淋巴细胞的新陈代谢,促使CD3+、CD4+、CD8+T淋巴细胞活性增强,提高了小鼠免疫器官的功能。由于生物系统存在T淋巴细胞的游走、迁移和归巢,使其在体内处于动态循环状态,由血液进入组织,再从组织进入血液;随着试验时间的增加,T淋巴细胞各亚群的平衡逐渐趋于正常[11-12],故与空白对照组差异不显著。试验结果与本研究的预期相符。在此基础上,明确BPOR1和BPOR2对免疫功能低下小鼠的作用效果及机制,尚需进一步的研究验证。
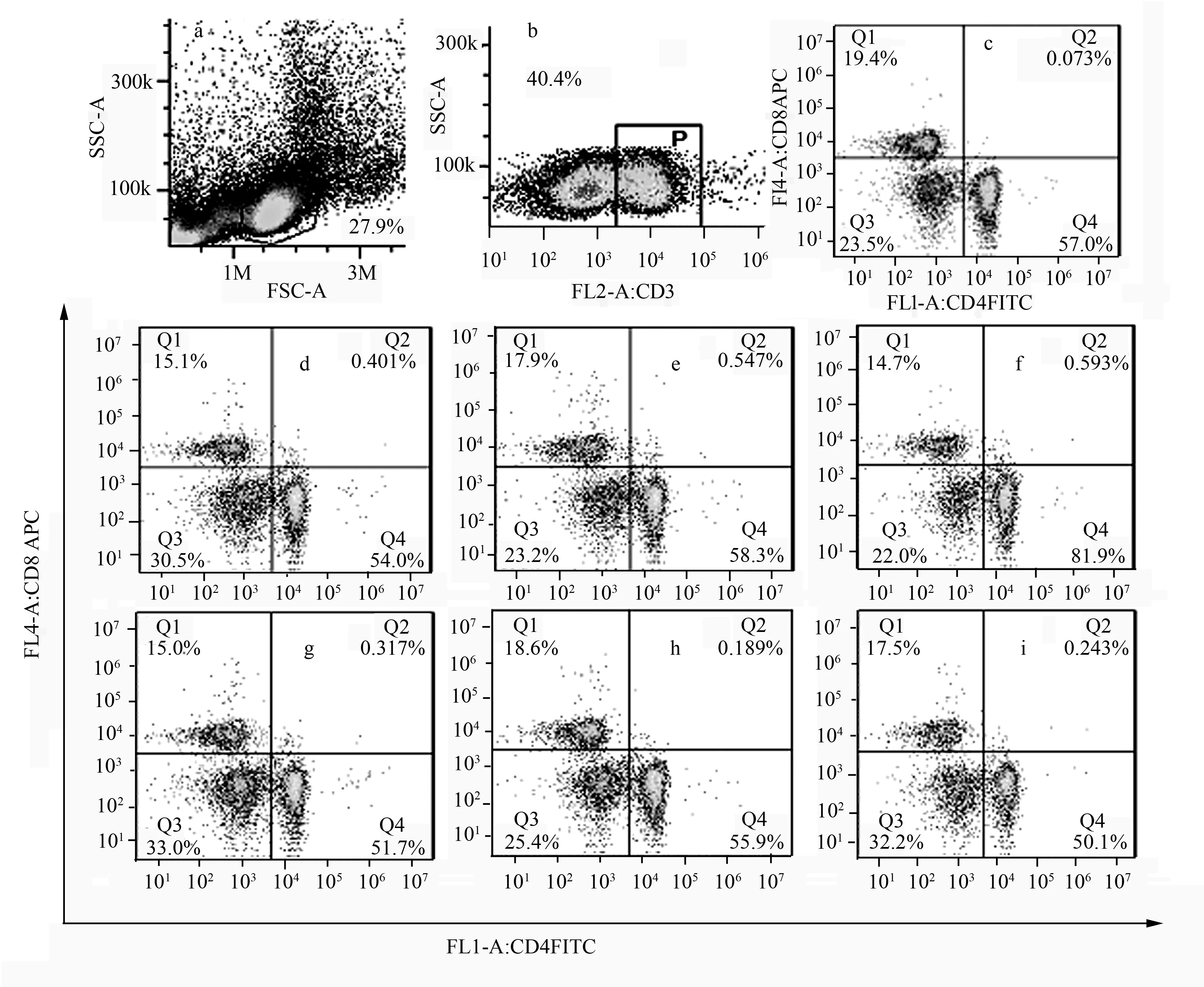
a.空白对照淋巴细胞群的FS/SS散点图;b.P门内区域为加入荧光单抗后CD3+T淋巴细胞群散点图;c.空白组小鼠T淋巴细胞亚群,十字门右下方CD4+T淋巴细胞散点图,十字门左上方CD8+T淋巴细胞散点图;d-f.分别为BPOR1低、中、高剂量组T淋巴细胞亚群分群情况;g-i.分别为BPOR2低、中、高剂量组T淋巴细胞亚群分群情况。
图2 不同剂量BPOR对小鼠T淋巴细胞群影响的流式分析散点图
3 结论
在小鼠脾淋巴细胞增殖试验中,BPOR1可明显地促进小鼠脾淋巴细胞增殖,且具有对ConA诱导的脾淋巴细胞增殖的协同刺激作用。体内试验以林蛙油活性肽BPOR1及BPOR2的3个剂量组(100、300、600 mg·kg-1·d-1)分别灌胃小鼠30 d,结果表明,2种活性肽对小鼠脾脏指数和胸腺指数均有影响,其中BPOR1的效果更为明显。流式细胞术检测BPOR1及BPOR2对正常小鼠T淋巴细胞亚群的影响,统计结果可见BPOR1和BPOR2都能影响小鼠T淋巴细胞亚群的分布,尤其BPOR1的3个剂量组的CD3+、CD4+及CD4+/CD8+值均高于对照组,但与对照组差异不显著。综上得出:2种林蛙油活性肽均能增加小鼠脾淋巴细胞功能,提高机体免疫力,且BPOR1的作用效果比BPOR2明显。
[1] 范玉林,崔香顺,姚玉霞,等.哈士蟆油成分研究的进展[J].吉林农业大学学报,1996,18(3):105-111.
[2] 康岚,李娜,姜大成.林蛙油的雌激素样作用研究[J].现代食品科技,2015,31(8):25-30.
[3] 车宇飞.林蛙油多肽口服液的免疫及毒理评价[D].长春:吉林大学,2014.
[4] 赵谋明,任娇艳.食源性生物活性肽结构特征与生理活性的研究现状与趋势[J].中国食品学报,2011,11(9):69-81.
[5] WADA Y, LÖNNERDAL B. Bioactive peptides released by in vitro digestion of standard and hydrolyzed infant formulas[J]. Peptides,2015,73:101-105.
[6] 杨春花,王冬梅,赵怀升,等.生物活性肽的营养生理功能及其应用[J].畜牧与饲料科学,2011,32(5):37-39.
[8] 宋琳琳,陈立,陈五岭.食源性生物活性肽对小鼠免疫功能的影响[J].西北大学学报(自然科学版),2009,39(4):612-616.
[9] ZHANG L N, QIAN W D, CHEN Q M, et al. Imbalance in circulating T lymphocyte subsets contributes to Hu antibody-associated paraneoplastic neurological syndromes[J]. Cellular Immunology,2014,290(2):245-250.
[10] ABDIN A A, HASBY E A. Modulatory effect of celastrol on Th1/Th2 cytokines profile, TLR2 and CD3+T-lymphocyte expression in a relapsing-remitting model of multiple sclerosis in rats[J]. European Journal of Pharmacology,2014,742:102-112.
[11] 张丽,姚晓英.T淋巴细胞归巢过程中分子机制的研究进展[J].细胞与分子免疫学杂志,2012,28(1):99-101.
[12] EDELBLUM K L, SINGH G, ODENWALD M A, et al. Intraepithelial lymphocyte migration limits transepithelial pathogen invasion and systemic disease in mice[J]. Gastroenterology,2015,148(7):1417-1426.
Effect of Bioactive Peptides from the Oviductus Ranae on Immunologic Function of Mice//
Liu Renjie, Wang Chunfeng, Wang Gang, Chen Guang
(Jilin Agricultural University, Changchun 130118, P. R. China)//Journal of Northeast Forestry University,2017,45(1):82-85,89.
Oviductus ranae; Bioactive peptide; Immunity
刘仁杰,女,1974年8月生,吉林农业大学食品科学与工程学院,副教授。E-mail:lrjem@126.com。
陈光,吉林农业大学生命科学学院,教授。E-mail:chg61@163.com。
2016年1月5日。
R285.5;R931.74
1)吉林省科技发展计划项目(20130303045NY)。
责任编辑:程 红。
