CYP450氧化还原酶基因多态性对CYP酶影响的研究进展
2017-01-17杜雪,刘涛
杜 雪,刘 涛
(1.川北医学院第二临床医学院,四川 南充 637000; 2.川北医学院第二临床学院南充市中心医院心血管内科,四川 南充 637000)
·综 述·
CYP450氧化还原酶基因多态性对CYP酶影响的研究进展
杜 雪1*,刘 涛2
(1.川北医学院第二临床医学院,四川 南充 637000; 2.川北医学院第二临床学院南充市中心医院心血管内科,四川 南充 637000)
DOI 10.14009/j.issn.1672-2124.2016.12.051
肝药酶CYP即细胞色素P450氧化酶(CYP450),属于单加氧酶(monooxygenase),也称肝微粒体混合功能氧化酶,多位于内质网和线粒体内膜上,参与药物、致癌物、类固醇激素和脂肪酸等多种内、外源性物质代谢。肝药酶CYP氧化还原酶(POR)是所有肝微粒体酶的唯一电子供体,通过还原型烟酰胺腺嘌呤二核苷酸磷酸(reduced nicotinamide adenine dinucleotide phosphate,NADPH)将电子传递给CYP 450酶,CYP 450酶得到电子后再与底物发生氧化还原反应,从而发挥代谢活性[1]。POR基因具有遗传多态性,POR基因突变导致CYP450酶活性差异,进而对药物代谢与疗效造成显著影响。
1 POR的结构与功能
人POR分子量约78 Ku,包含680个氨基酸,属黄素蛋白,主要分布于滑面内质网。从N端至C端,共有5个结构域,分别为N端膜连接域,黄素单核苷酸(FMN)结合域,中间连接域,黄素腺嘌呤二核苷酸(FAD)和NADPH结合域,肝药酶CYP(底物)结合域;以及3个功能域为FMN结合域,FAD连接域和NADPH结合域。POR参与CYP450酶对底物的代谢过程,并且是CYP450酶氧化还原反应过程中唯一的电子供体,其电子传递过程如图1[2]所示。POR的2种黄素还原酶FAD和FMN依次承接来自NADPH的电子,传递给CYP450酶的亚铁离子,以完成对底物的代谢作用。Hedison等[3]通过改进荧光能量共振转移试验装置(FRET system),进一步研究了CYP450氧化还原反应的过程,并且对POR与CYP450之间完整的电子传递循环过程进行实时分析,验证了两者在内质网上电子传递的机制,由此可见,POR在CYP450对底物的代谢过程中有着不可替代的重要作用。
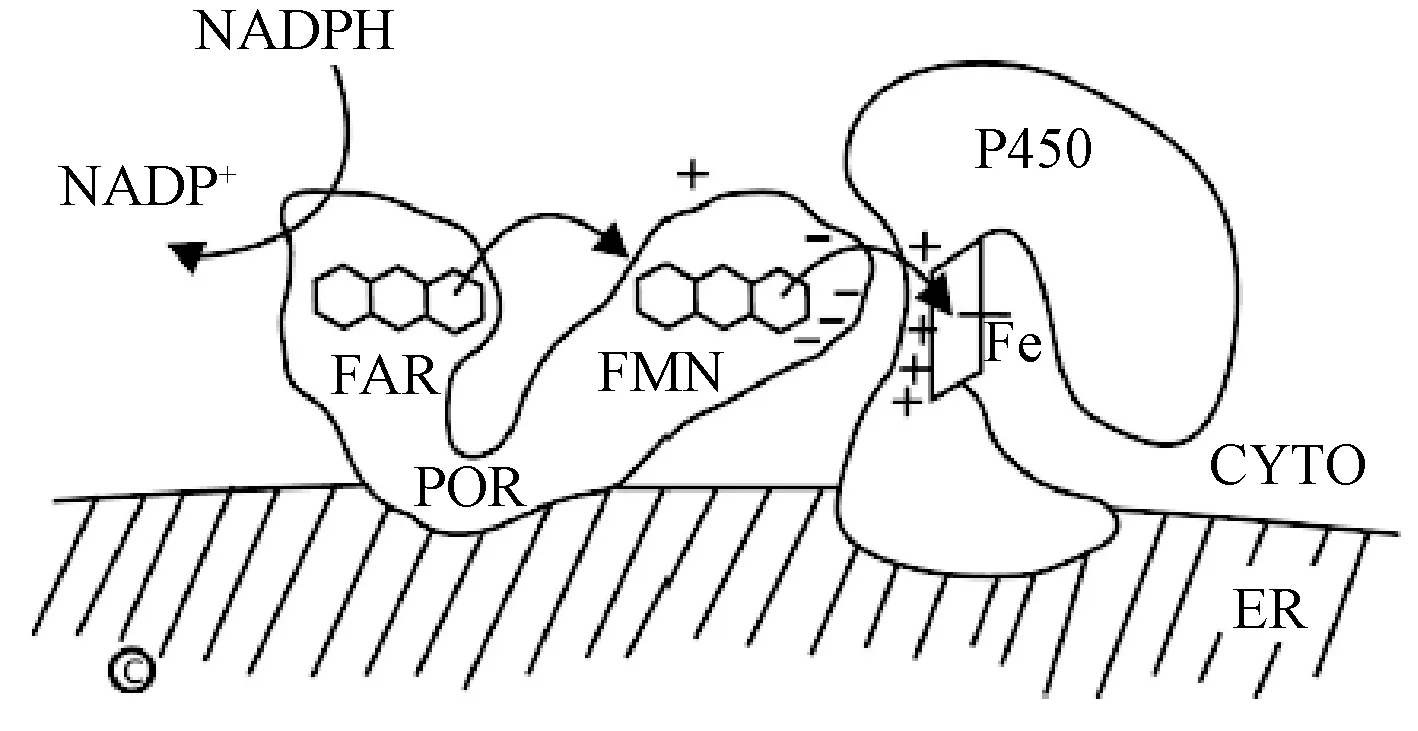
NADPH →FAD→FMN→CYP;ER.内质网;CYTO.细胞质图1 POR与CYP450之间的电子传递过程
POR不仅是CYP450的电子供体,同时还是体内多种代谢酶的电子供体,如亚铁血红素酶、鲨烯单加氧酶、7-脱氢胆固醇酶、细胞色素b 5等,还参与多种内、外源物质的代谢,其中包括90%以上的临床药物代谢。研究结果表明,POR可能是低氧激活的抗肿瘤药物潜在的高敏标记,还能调控人体造血干细胞的功能与分化[4-5];另有研究结果表明,POR与骨质发育连接蛋白Cx43的表达相关[6];Panda[7]以小鼠为模型研究证实POR在骨骼发育的过程中发挥重要功能,并且与成纤维细胞生长因子(FGF)信号通路存在重要关联。
2 POR的基因多态性
人POR基因位于7号染色体(7qll.2)上,全长73.2 kb,包含16个外显子,其中15个能编码蛋白质。据报导美国国立生物技术信息中心数据库已收录超过800个POR单核苷酸多态性(SNP)和48个POR等位基因位点,并且个体和种群差异明显。Huang等[8]通过对842例来自4个不同种族的健康人群进行POR基因检测,共发现140个POR SNPs,其中POR*28(A503V)在各族人群中具有较高的等位基因频率(非洲裔美国人为19.1%,高加索人为26.4%,墨西哥美国人为31.0%,美籍华人为36.7%,汉族人群中高达72.4%[8-9])。徐彬彬等[10]检测123例人肝样本POR基因,发现8个SNP位点,突变频率最高的4个SNPs为rs1135612A>G4 8.8%,rs10954732G>A5 0.8%,rs4732515T>C 86.2%,rs4732516C>G 86.2%,其单倍体分析结果显示对POR的表达与活性具有明显影响。Zhang等[11]研究结果发现,POR基因突变可影响其的表达与活性。其中POR 2286822C>T,2286823G>A和3823884A>C 杂合子携带者POR蛋白表达水平比纯合子高;286823G>,1135612A>G和10954732G>A突变纯合子携带者POR的活性较野生型和杂合子均更低;而其常位突变位点POR*28对能够显著增加POR的活性。越来越多新的有意义的POR SNPs被研究报道,随着研究进展,这些有意义的POR基因突变位点将可能对未来药理学毒理学的研究起到指导性的意义。
3 POR基因多态性与CYP450氧化还原酶缺陷
POR基因突变对其表达水平及活性具有显著影响,并且POR是所有CYP450酶的电子供体,一旦POR基因缺陷将导致自身表达和活性的改变并造成CYP450酶活性缺失,从而引发严重后果。研究报道POR基因敲除对胚胎期小鼠具有致死性[12];严重的POR基因突变将导致CYP450氧化还原酶缺陷(cytochrome P450 oxidoreductase deficiency, PORD),其为一种少见的先天性疾病,可导致严重的并发症,包括以骨骼肌发育异常为特点的安特利-比克斯勒综合征(antley-Bixler syndrome,ABS)、先天性肾上腺皮质增生症、性发育异常疾病、威廉斯综合征等。其致病因素可能是影响了代谢酶如:CYP21A2、CYP17A1、CYP19A1、CYP51A1和CYP26A1-C1等的电子传递过程,从而影响人体内正常的类固醇激素代谢过程,造成人体发育异常[13]。另有研究报道,Q153R、A287P、R457H和Y181D突变均与ABS的发病相关[14-16],其中R457H在患有激素紊乱病史的日本人群中分布频率高达62.5%,而在其他人群中分布频率较低;A287在欧洲人群中突变频率较高约40%[17],但是其发病机制尚未解释清楚。目前研究结果显示,PORD常固定发生在特定的POR基因突变的个体,通过产前基因检测,可以预防部分PORD的发生[18]。Xiao等[19]研究结果发现,POR A503V突变可以减少膀胱癌的风险,称其可作为预测膀胱癌的生物标记标记。Haiman等[20]研究结果显示,同义突变G5G只存在于非洲裔美国人群中,并且其突变纯合子会增加女性乳腺癌患病风险。
4 POR基因多态性对CYP酶的影响
POR是所有肝微粒体肝药酶CYP的电子供体,参与CYP450的药物代谢过程;CYP450酶亚家族以CYP1、CYP2和CYP3为主,而药物在体内的代谢过程分2个时相,分别为I相反应和Ⅱ相反应,其中I相反应包括氧化、还原和水解;Ⅱ相反应为结合反应;药物分子结构中的极性基团在体内经共价结合后易于排除体外。约80%左右药物代谢的I相反应是通过CYP450酶亚家族1、2和3;POR基因突变影响CYP450酶的活性进而对药物代谢产生影响。研究证实POR众多突变位点对CYP450酶的活性均有影响。以下将分别总结POR基因多态性对CYP450酶三个亚家族代谢活性的影响。
CYP19A1能将人体内雄激素代谢为雌激素,Fluck等[21]研究POR基因突变(Q153R、Y181D、P228L、R316W、G413S、G504R、G539R、Y607C、R616X、V6311、delF646)对CYP19A1活性的影响,其中Q153R能增加CYP19A1的活性为野生型的2倍,Y181D和R616X导致CYP19A1活性完全丧失,G539R、Y607C、V6311、delF646致CYP19A1丧失60%~90%的活性,其余突变与原来相似,可见POR不同基因突变对于CYP19A1活性的影响差异较大;Dhir等[22]研究结果表明,Y181D、H628P、S244C基因突变,可同等程度地降低CYP17A1和CYP21A2的代谢活性;A287P可降低CYP17A1代谢活性,但对CYP21A2代谢活性与野生型差异不大;以氢化可的松为底物,通过气相色谱-质谱法分析尿液中代谢产物发现,A287P纯合子携带个体有较高的氢化可的松代谢率。另有研究结果表明,A503V突变能降低CYP21的活性[23]。
CYP1A2占肝脏CYP酶总量的13%,能代谢包括咖啡因、华法林、环苯扎林、萘普生、对乙酰氨基酚、茶碱等20多种药物,同时还负责一些内源性激素的羟化过程;经CYP2C19代谢的药物包括环磷酰胺、氯吡格雷、质子泵抑制剂和孕酮等。Agrawal等[24]研究发现35个POR突变位点,其中A287P、R457H可减弱CYP1A2 和CYP2C19的代谢活性致几乎无法检测的水平,Q153R能够显著增加CYP1A2 和CYP2C19的代谢活性为野生型的144%和284%,而A503V对CYP1A2和CYP2C19代谢活性的影响与野生型差异不大,分别为85%和113%[25];Hatta等[26]研究瑞士和朝鲜人群POR*28等位基因频率分别为29%和44%,瑞士人群中POR*28等位基因携带者CYP2C9酶的代谢活性较野生型者高1.4倍,而在朝鲜人群中未发现这种改变。研究证实CYP2C9基因突变与氯吡格雷抵抗相关[27];此外,CYP2C9.2和CYP2C9.35与POR突变基因(C-173A、C-208T、rs2868177)相互作用对华法林的临床疗效影响显著[28-29]。
CYP2B6是外源性毒物代谢酶之一,参与多种毒物(如农药)的代谢,并且还参与约7%左右临床药物的代谢;检测安非他酮代谢产物,Lv等[30]发现POR g.6593A>G对CYP2B6的代谢活性具有显著影响,Chen等[31]报道A287P、Y181D突变体致CYP2B6的代谢活性降低为野生型的70%,A115V和G413S对其代谢活性的影响与野生型差异无统计学意义。由此,基因检测对于量化药酶底物临床剂量具有重要意义。El-SerafiI等[32]体外重建POR/CYP表达体系,发现POR基因表达水平影响CYP2B6对环磷酰胺的生物代谢。
CYP2D6含量较少,在肝脏总量中仅占约2%左右,但却参与临床约25%左右的药物代谢过程,包括β受体阻断剂、抗抑郁药、抗心律失常药、镇痛药、止吐药、抗肿瘤药等;Sandee等[33]在大肠杆菌中表达Q153R、A287P、R457H和A503V等4个POR突变体和CYP2D6重组蛋白,其研究结果显示POR基因突变对CYP2D6活性的影响具有底物依赖性:以EMOCC作为底物时,A287P,R457H突变体几乎完全抑制CYP2D6活性;以右美沙芬和丁呋洛尔为底物时,A287P基因突变减弱CYP2D6的活性约为原来的25%。Q153R突变体对CYP2D6的活性具有显著影响,在分别以EMOCC、右美沙芬和丁呋洛尔作底物时,其代谢活性能分别增加至原来的128%、198%和153%;而A503V以上述三种底物检测CYP2D6的活性结果显示,分别减弱为野生型的85%,62%和53%。
CYP3A酶是临床药物的主要代谢酶,参与50%以上的药物代谢;Agrawal等[34]通过体外重建CYP3A4和POR 4个突变体(Q153R、A287P、R457H、A503V)重组蛋白,并以睾酮、咪达唑仑、奎尼丁和红霉素作为CYP3A4酶的代谢底物,其研究结果发现,以红霉素和咪达唑仑为底物时,Q153R减弱CYP3A4的活性为野生型的76%~94%,但是以睾酮和奎尼丁为底物时,Q153R增加CYP3A4的活性为野生型的129%~150%;以睾酮和咪达唑仑为底物时,A503V减弱CYP3A4的活性为野生型的61%~77%,以奎尼丁和红霉素为底物时对CYP3A4活性的影响与野生型无明显差异,分别以上述4种物质为底物时,A287P和R457H均能使CYP3A4活性减弱;由此可见,POR 4个突变体对CYP3A4酶的代谢均有底物依赖性,分析可能与不同突变体与CYP3A4相结合时所引起的空间构象变化不同相关。Chen等[31]研究发现,POR突变体A287P、Y181D在一定的浓度范围内完全抑制了CYP3A4对睾酮的代谢活性,检测结果显示未生成任何代谢产物;而突变体K49N、A115V和G413S则能显著增加CYP3A4对睾酮的代谢活性31%、36%和65%。其常位突变位点POR*28(c.1508C>T,A503V,rs1057868)位于FAD-结合域。Zhang等[35]研究在能够表达CYP3A5代谢酶的个体中POR*28基因突变与他克莫司剂量使用的关系,结果显示POR*28基因突变能够减少肾移植个体他克莫司的剂量,共变体CYP3A5-POR*28基因型可作为临床调整药物剂量的监测标记;Oneda等[36]评价高加索人POR基因多态性对CYP酶影响的研究显示,c.1508TT(POR*28*28)较c.1508C等位基因携带者可增加1.6倍的CYP3A酶活性;付志敏等[37]研究结果表明,POR*28基因突变可降低CYP3A4酶的活性,亦可增加CYP3A5酶的活性。由此可见,检测POR*28突变基因可用于了解CYP3A酶活性情况,有助于调整临床个体化用药方案。
综上所述,POR基因多态性对于CYP450酶的代谢活性具有显著影响,但目前多数研究主要针对单个基因位点,在临床工作中应系统性地评价POR多个基因位点对CYP450酶影响的相互效应;发现更多的新位点,建立完整的基因多态性数据库,并将体外实验与临床实际相结合,寻求新药研发的完善;根据基因信息指导临床用药,获得最理想的药物效应,可为实现临床个体化治疗起到指导性的作用,并具有重要的现实意义。
[1]Huang R,Zhang M,Rwere F,et al.Kinetic and structural characterization of the interaction between the FMN binding domain of cytochrome P450 reductase and cyt-ochromec[J].J Biol Chem,2015,290(8):4843-4855.
[2]Miller WL,Agrawal V,Sandee D,et al.Consequences of POR mutations and polymorphisms[J].Mol Cell Endocrinol,2011,336(1-2):174-179.
[3]Hedison TM,Hay S,Scrutton NS.Real-time analysis of confor-mational control in electron transfer reactions of human cytochrome P450 reductase with cytochromec[J].FEBS J,2015,282(22):4357-4375.
[4]Su J,Gu Y,Pruijn FB,et al.Zinc finger nuclease knock-out of NADPH:cytochrome P450 oxidoreductase (POR) in human tumor cell lines demonstrates that hypoxia-activated prodrugs differ in POR dependence[J].J Biol Chem,2013,288(52):37138-37153.
[5]张燕.细胞色素P450氧化还原酶(CPR)及其它氧化还原酶对造血干细胞功能调控的研究[D].北京:北京协和医学院,2012.
[6]Polusani SR,Kar R,Riquelme MA,et al.Regulation of gap junction function and Connexin 43 expression by cytochrome P450 oxidore-ductase (CYPOR)[J].Biochem Biophys Res Commun,2011,411(3):490-495.
[7]Panda SP,Guntur AR,Polusani SR,et al.Conditional deletion of cytochrome p450 reductase in osteoprogenitor cells affects long bone and skull development in mice recapitulating antley-bixler syndr-ome: role of a redox enzyme in development[J].PLoS One,2013,8(9):e75638.
[8]Huang N,Agrawal V,Giacomini KM,et al. Genetics of P450 oxidoreductase: sequence variation in 842 individuals of four ethnicities and activities of 15 missense mutations[J].Proc Natl Acad Sci U S A,2008,105(5):1733-1788.
[9]Zhang W,Yuan JJ,Kan QC,et al.Influence of CYP3A5*3 polymorphism and interaction between CYP3A5*3 and CYP3A4*1G polymorphisms on post-operative fentanyl analgesia in Chinese patients undergoing gynaecological surgery[J].Eur J Anaesthesiol,2011,28(4):245-250.
[10] 徐彬彬.细胞色素P450氧化还原酶基因多态性对其mRNA及活性的影响[D].郑州:郑州大学,2014.
[11] Zhang HF,Li ZH,Liu JY,et al.Correlation of cytochrome P450 oxidoreductase expression with the expression of 10 isoforms of cytochrome P450 in human liver.Drug Metab Dispos[J].Drug Metab Dispos,2016,44(8):1193-1200.
[12] Shen AL,O’Leary KA,Kasper CB.Association of multiple develo-pmental defects and embryonic lethality with loss of microsomal NADPH-cytochrome P450 oxidoreductase[J].J Biol Chem,2002,277(8):6536-6541.
[13] Fukami M,Ogata T.Cytochrome P450 oxidoreductase deficiency: rare congenital disorder leading to skeletal malformations and stero-idogenic defects[J].Pediatr Int,2014,56(6):805-808.
[14] Moutinho D,Marohnic CC,Panda SP,et al.Altered human CYP3A4 activity caused by Antley-Bixler syndrome-related variants of NAD-PH-cytochrome P450 oxidoreductase measured in a robust in vitro system[J].Drug Metab Dispos,2012,40(4):754-760.
[15] Miller WL.P450 oxidoreductase deficiency: a disorder of steroid-ogenesis with multiple clinical manifestations[J]. Sci Signal,2012,5(247):pt11.
[16] Marohnic CC,Panda SP,McCammon K,et al.Human cytochrome P450 oxidoreductase deficiency caused by the Y181D mutation: molecular consequences and rescue of defect[J].Drug Metab Dispos,2010,38(2):332-340.
[17] Scott RR,Miller WL.Genetic and clinical features of P450 Oxidoreductase deficiency[J].Horm Res,2008,69(5):266-275.
[18] Xia C,Panda SP,Marohnic CC,et al.Structural basis for human NADPH-cytochrome P450 oxidoreductase deficiency[J].Proc Natl Acad Sci USA,2011,108(33):13486-13491.
[19] Xiao X,Ma G,Li S,et al.Functional POR A503V is associated with the risk of bladder cancer in a Chinese population[J].Sci Rep,2015,5:11751.
[20] Haiman CA,Setiawan VW,Xia LY,et al.A variant in the cytochrome p450 oxidoreductase gene is associated with breast cancer risk in African Americans[J].Cancer Res,2007,67(8):3565-3568.
[21] Flück CE,Pandey AV.Impact on CYP19A1 activity by mutations in NADPH cytochrome P450 oxidoreductase[J].J Steroid Biochem Mol Biol,2016,pii: S0960-0760(16)30078-4.
[22] Dhir V,Ivison HE,Krone N,et al.Differential inhibition of CYP17A1 and CYP21A2 activities by the P450 oxidoreductase mutant A287P[J].Mol Endocrinol,2007,21(8):1958-1968.
[23] Gomes LG,Huang N,Agrawal V,et al. The common P450 oxido-reductase variant A503V is not a modifier gene for 21-hydroxylase deficiency[J].J Clin Endocrinol Metab,2008,93(7):2913-2916.
[24] Agrawal V,Huang N, Miller WL.Pharmacogenetics of P450 oxidoreductase: effect of sequence variants on activities of CYP1A2 and CYP2C19[J].Pharmacogenet Genomics,2008,18(7):569-576.
[25] Subramanian M,Agrawal V,Sandee D,et al.Effect of P450 oxidoreductase variants on the metabolism of model substrates mediated by CYP2C9.1, CYP2C9.2, and CYP2C9.3[J].Pharmacogenet Genomics,2012,22(8): 590-597.
[26] Hatta FH,Aklillu E.P450 (Cytochrome) Oxidoreductase Gene (POR) Common Variant (POR*28) Significantly Alters CYP2C9 Activity in Swedish, But Not in Korean Healthy Subjects[J].OMICS,2015,19(12):777-781.
[27] Shirasaka Y,Chaudhry AS,McDonald M,et al.Interindividual variability of CYP2C19-catalyzed drug metabolism due to differences in gene diplotypes and cytochrome P450 oxidoreductase content[J].Pharmacogenomics J,2016,16(4):375-387.
[28] Lee MY,Borgiani P,Johansson I,et al. High warfarin sensitivity in carriers of CYP2C9*35 is determined by the impaired interaction with P450 oxidoreductase[J]. Pharmacogenomics J,2014,14(4):343-349.
[29] Zhang X,Li L,Ding X,et al.Identification of cytochrome P450 oxidoreductase gene variants that are significantly associated with the interindividual variations in warfarin maintenance dose[J]. Drug Metab Dispos,2011,39(8):1433-1439.
[30] Lv J,Hu L,Zhuo W,et al. Effects of the selected cytochrome P450 oxidoreductase genetic polymorphisms on cytochrome P450 2B6 activity as measured by bupropion hydroxylation[J].Pharmacogenet Genomics,2016,26(2):80-87.
[31] Chen X,Pan LQ,Naranmandura H,et al.Influence of various polymorphic variants of cytochrome P450 oxidoreductase (POR) on drug metabolic activity of CYP3A4 and CYP2B6[J].PLoS One,2012,7(6):e38495.
[32] El-Serafi I,Afsharian,PMoshfegh A, et al.Cytochrome P450 Oxidoreductase Influences CYP2B6 Activity in Cyclophosphamide Bioactivation[J].PLoS One,2015,10(11):e0141979.
[33] Sandee D,Morrissey K,Agrawal V,et al.Effects of genetic variants of human P450 oxidoreductase on catalysis by CYP2D6 in vitro[J].Pharmacogenet Genomics,2010,20(11):677-686.
[34] Agrawal V,Choi JH,Giacomini KM,et al.Substrate-specific modulation of CYP3A4 activity by genetic variants of cytochrome P450 oxidoreductase[J].Pharmacogenet Genomics,2010,20(10):611-618.
[35] Zhang JJ,Liu SB,Xue L,et al.The genetic polymorphisms of POR*28 and CYP3A5*3 significantly influence the pharmacokinetics of tacrolimus in Chinese renal transplant recipients[J].Int J Clin Pharmacol Ther, 2015,53(9):728-736.
[36] Oneda B,Crettol S,Jaquenoud Sirot E,et al.The P450 oxidor-eductase genotype is associated with CYP3A activity in vivo as mea-sured by the midazolam phenotyping test[J]. Pharmacogenet Genomics,2009,19(11):877-883.
[37] 付志敏.POR基因多态性对CYP3A体内活性及氨氯地平人体药动学的影响[D].长沙:中南大学,2011.
R968
A
1672-2124(2016)12-1725-04
2016-07-09)
*硕士研究生。研究方向:心血管内科。E-mail:zitongss@sina.com
#通信作者:教授,硕士生导师。研究方向:心血管疾病的临床与基础研究。E-mail:nclt456@sina.com
