高效液相色谱法测定利咽口服液中绿原酸的含量
2017-01-17荆玉玲
荆玉玲
(淄博市中医医院实验室,山东 淄博 255300)
高效液相色谱法测定利咽口服液中绿原酸的含量
荆玉玲*
(淄博市中医医院实验室,山东 淄博 255300)
目的:建立利咽口服液的质量控制方法。方法:采用薄层色谱法(thin-layer chromatography,TLC)对处方中的金银花和菊花、玄参、麦冬、射干进行定性鉴别,采用高效液相色谱法(high performance liquid chromatography,HPLC)对利咽口服液中的绿原酸进行含量测定。结果:3批次利咽口服液中金银花和菊花、玄参、麦冬、射干的TLC斑点清晰,分离度良好,阴性无干扰。绿原酸进样量在0.132 7~1.326 9 μg(r=0.999 8)之间呈良好的线性关系,平均回收率为100.44%,RSD为1.14%。结论:本研究方法简便、准确可靠,可用于利咽口服液的质量控制。
利咽口服液; 薄层色谱法; 高效液相色谱法; 质量控制; 绿原酸
利咽口服液是淄博市中医医院(以下简称“我院”)自制制剂,由金银花、菊花、玄参、麦冬、射干等多味中药提取浓缩而成。该方属医院老中医专家经验方,具有利咽清喉、清除分泌物,消除异物感、咽痛、咽干、声音嘶哑的功效,适用于急慢性咽炎、急慢性喉炎及扁桃体炎。利咽口服液为纯中药制剂,并含有15%纯蜂蜜,因口感好、见效快、治愈率高的特点,深受患者欢迎。但目前除了绿原酸(金银花和菊花)薄层色谱方法之外[1],尚无科学、可控的质量标准用于鉴别利咽口服液。为了确保我院优势特色制剂的质量,提升其质量标准,本研究对利咽口服液的质量控制方法进行了系统研究。
1 材料
1.1 仪器
日本岛津LC-20A高效液相色谱仪,LC-20AT输液泵,串联双柱塞,SPD-20A检测器,SIL-20A进样器;岛津Innertsil ODS-SDC18柱;上海科哲薄层色谱成像系统;MS105DU型电子分析天平;KS-500E超声波清洗机;HH-S型水浴锅;Merck硅胶G板、GF254薄层板、聚酰胺薄膜。
1.2 试药
绿原酸对照品(批号:110753-201314,纯度:96.6%)、哈巴俄苷对照品(批号,111730-201106,纯度:97.1%)、麦冬对照药材(批号:1211013-201310)均购自中国食品药品检定研究院;利咽口服液的样品和阴性对照品均由我院制剂室提供,批号为140709、140719、140729,批准文号:鲁药制字Z03080112,每瓶装250 ml;水为娃哈哈纯净水,乙腈、甲醇为色谱纯,其余均为分析纯。
2 方法与结果
2.1 薄层色谱鉴别
2.1.1 金银花、菊花:将口服液20 ml浓缩至约5 ml,加无水乙醇20 ml,摇匀,滤过,滤液蒸干,残渣加乙醇2 ml使溶解,作为供试品溶液。另取绿原酸对照品,加甲醇制成1 ml含1 mg的溶液,作为对照品溶液。按照《中华人民共和国药典·四部》(2015年)通则中薄层色谱法部分,分别吸取供试品和对照品溶液各3 μl,点于同一聚酰胺薄膜上,用36%乙酸展开,取出晾干后,置于紫外光灯365 nm检视。结果显示,供试品色谱中在与对照品色谱相应的位置上,显相同颜色的荧光斑点,且阴性对照没有干扰[2],见图1(A)。
2.1.2 玄参:将口服液60 ml用乙醚萃取2次,1次30 ml,再用水饱和的正丁醇萃取2次,1次30 ml。正丁醇萃取液合并后,再用正丁醇饱和的水30 ml洗涤,弃去水液,蒸干正丁醇液,加甲醇1 ml溶解残渣,作为供试品溶液。另取哈巴俄苷对照品,加甲醇制成1 ml含1 mg的溶液,作为对照品溶液。分别吸取供试品和对照品溶液各5 μl,点于同一硅胶G薄层板上,用三氯甲烷-甲醇-水(V∶V∶V=12 ∶4 ∶1,下层溶液)作为展开剂,置于展开剂预饱和15 min的展开缸内展开,取出晾干后,用5%香草醛硫酸溶液显色。结果供试品色谱中在与对照品色谱相应的位置上,显相同颜色的斑点,且阴性对照没有干扰[3],见图1(B)。
2.1.3 麦冬:取口服液60 ml加入盐酸3 ml,加热煮沸5 min,趁热过滤,滤液放冷后用三氯甲烷萃取2次,1次30 ml,合并三氯甲烷萃取液,蒸干,残渣用三氯甲烷1 ml溶解,作为供试品溶液。另取1 g麦冬对照药材,加水30 ml煎煮10 min,滤过,滤液加盐酸1 ml,加热煮沸5 min,趁热过滤,同法制成对照药材溶液。分别吸取供试品和对照品溶液各5 μl,点于同一硅胶G薄层板上,用三氯甲烷-丙酮(V∶V=4 ∶1)展开,取出晾干后,用10%硫酸乙醇溶液显色。结果供试品色谱中在与对照药材色谱相应的位置上,显相同颜色的斑点,且阴性对照没有干扰[4],见图1(C)。
2.1.4 射干:将口服液60 ml浓缩至30 ml,用三氯甲烷萃取2次,1次30 ml,弃去三氯甲烷液,水液加36%盐酸2 ml,振摇5 min,用水饱和的正丁醇萃取2次,1次30 ml,将正丁醇萃取液合并后,用正丁醇饱和的水洗涤2次,1次20 ml,弃去水液,蒸干正丁醇液,用甲醇5 ml溶解残渣,作为供试品溶液。另取射干对照药材1 g,加入水30 ml,煎煮10 min,滤过,滤液用三氯甲烷萃取2次,1次30 ml,弃去三氯甲烷液,水液加36%盐酸1 ml,同法制成对照药材溶液。分别吸取供试品和对照品溶液各10 μl,点于同一硅胶GF254薄层板上,用三氯甲烷-丁酮-甲醇(V∶V∶V=3 ∶1 ∶1)展开,取出晾干后,置于紫外光灯254 nm下检视。结果供试品色谱中在与对照药材色谱相应的位置上,显相同颜色的斑点,且阴性对照没有干扰[5],见图1(D)。

A.金银花和菊花(1—3为供试品;4为绿原酸对照品;5为阴性对照品);B.玄参(1—3为供试品;4为哈巴俄苷对照品;5为阴性对照品);C.麦冬(1—3为供试品;4为麦冬对照药材;5为阴性对照品);D.射干(1—3为供试品;4为射干对照药材;5为阴性对照品)A. Lonicerae japonicae flos and Chrysanthemi flos (1-3 are test samples; 4 is chlorogenic acid reference substance; 5 is negative reference substance); B.Scrophulariae radix (1-3 are test samples; 4 is harpagoside reference substance; 5 is negative reference substance); C. Ophiopogonis radix (1-3 are test samples; 4 is Ophiopogonis radix reference substance; 5 is negative reference substance); D. Belamcandae rhizoma (1-3 are test samples; 4 is Belamcandae rhizoma reference substance; 5 is negative reference substance)图1 利咽口服液的薄层色谱图Fig 1 TLC of Liyan oral liquid
2.2 含量测定
2.2.1 色谱条件与系统适用性试验:色谱柱为岛津Inertsil ODS-SD C18(4.6 mm×250 mm,5 μm);流动相为乙腈-0.4%磷酸溶液(V∶V=10∶90);流速为1.0 ml/min;进样量为10 μl;检测波长为327 nm;柱温30 ℃。
2.2.2 对照品溶液的制备:精密称取绿原酸对照品17.17 mg,用50%甲醇制成质量浓度为0.331 7 mg/ml的对照品贮备液。从贮备液中精密量取1 ml置于5 ml棕色容量瓶中,加50%甲醇溶解并稀释至刻度,摇匀,即得到质量浓度为66.344 8 μg /ml的对照品溶液。
2.2.3 供试品溶液的制备:精密量取本品2 ml,置于10 ml棕色容量瓶中,用50%甲醇稀释至刻度,摇匀,滤过,取续滤液,即得。
2.2.4 阴性对照溶液的制备:取处方中除去金银花、菊花的其他药味,按处方比例制成缺金银花和菊花的阴性对照口服液。精密量取阴性对照口服液2 ml,按照“2.2.3”项下方法,制成阴性对照溶液。
2.2.5 专属性试验:分别精密吸取对照品溶液、供试品溶液及阴性对照溶液各10 μl,注入液相色谱仪进行测定,见图2。绿原酸对照品的保留时间为17.561 min,供试品色谱中在与对照品色谱保留时间相同的位置上,有相应色谱峰,绿原酸与其相邻峰达到基线分离,分离度为1.507,而阴性对照色谱中无相应色谱峰,说明处方中其他药味对绿原酸的含量测定不产生干扰。

A.对照品溶液;B.供试品溶液;C.阴性对照溶液A. reference solution; B. test solution; C. negative reference solution图2 利咽口服液的高效液相色谱图Fig 2 HPLC of Liyan oral liquid
2.2.6 线性关系的考察:分别精密量取“2.2.2”项下适量的绿原酸对照品贮备液,加入50%甲醇,制成质量浓度为13.269 0、33.172 4、66.344 8、99.517 3、132.689 6 μg/ml的一系列溶液。分别精密吸取10 μl,注入液相色谱仪,测定峰面积。以绿原酸对照品的进样量(X)为横坐标,峰面积(Y)为纵坐标,得回归方程Y=30 042.6X-78 797.7,相关系数r=0.999 8。结果表明,绿原酸进样量在0.132 7~1.326 9 μg之间呈良好的线性关系。
2.2.7 精密度试验:精密吸取10 μl对照品溶液,按“2.2.1”项下色谱条件连续进样6次,计算绿原酸峰面积的RSD为0.41%,结果表明仪器的精密度良好。
2.2.8 稳定性试验:精密吸取供试品溶液10 μl(批号:140709),按“2.2.1”项下色谱条件每3 h进样1次,测定绿原酸的峰面积积分值,共考察18 h,计算绿原酸峰面积的RSD为0.90%,结果表明供试品溶液中绿原酸在18 h内稳定性良好。
2.2.9 重复性试验:取同一份供试品(批号:140709),按“2.2.3”项下方法平行制备6份供试品溶液,按“2.2.1”项下色谱条件测定。结果表明,该批口服液中绿原酸的平均含量为0.318 4 mg/ml,RSD为0.93%,提示本方法重复性良好。
2.2.10 加样回收率试验:取已测知含量的本品1 ml(批号:140709,绿原酸含量为0.318 4 mg/ml),置于10 ml棕色容量瓶中。精密加入绿原酸对照品溶液(质量浓度为0.331 7 mg/ml)1 ml至上述10 ml容量瓶中,加50%甲醇至刻度,摇匀,滤过,取续滤液,即得。平行制备6份供试品溶液,分别精密吸取对照品溶液与供试品溶液各10 μl,注入液相色谱仪,测定,计算。试验结果表明本方法的回收率良好,见表1。
表1 加样回收率试验结果
Tab 1 Results of recovery test
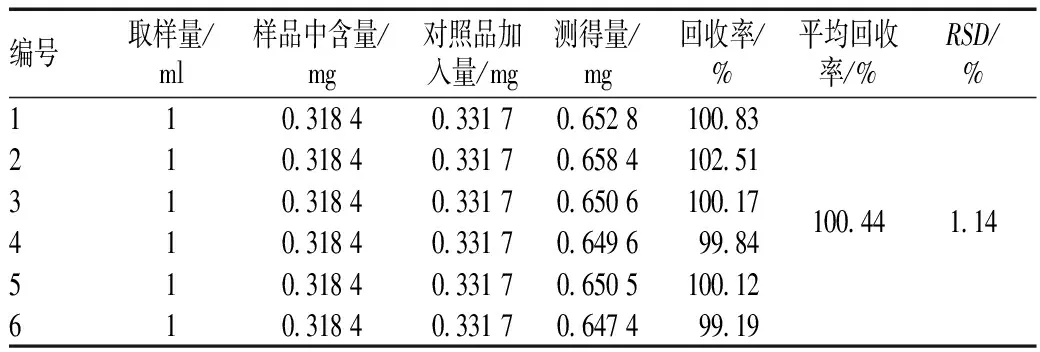
编号取样量/ml样品中含量/mg对照品加入量/mg测得量/mg回收率/%平均回收率/%RSD/%110 31840 33170 6528100 83210 31840 33170 6584102 51310 31840 33170 6506100 17410 31840 33170 649699 84510 31840 33170 6505100 12610 31840 33170 647499 19100 441 14
2.2.11 样品含量测定:取3个批次(140709,140719,140729)的利咽口服液,每批次各3份,按照“2.2.3”项下方法制备供试品溶液,按照“2.2.1”项下色谱条件进样10 μl,计算各批次的绿原酸含量。结果表明3批次利咽口服液绿原酸含量稳定,见表2。
表2 绿原酸含量测定结果
Tab 2 Content determination of chlorogenic acid

批号平均含量/(mg/ml)RSD/%1407090 31850 931407190 32440 921407290 30350 91
3 讨论
中医认为,金银花和菊花可清热解毒,疏风清热。药理研究结果表明,两者共有的活性成分为绿原酸,具有抗炎抗菌作用,对金黄色葡萄球菌等多种细菌及流感病毒有抑制作用,临床上常用于治疗呼吸道感染、流行性感冒、扁桃体炎等[6-8]。为更好地控制制剂质量,对利咽口服液中的绿原酸(君药金银花和菊花)进行含量测定[1],具有重要意义。
在预试验中,参考了金银花和菊花中绿原酸的HPLC含量测定方法,采用乙腈-0.4%磷酸溶液(V∶V=13 ∶87)作为流动相[9]。但由于利咽口服液为中药复方制剂,成分复杂,干扰大,造成绿原酸的分离效果不理想。根据实验结果,综合考虑流动相及绿原酸的极性,对流动相进行了调整,通过比较乙腈-0.4%磷酸溶液(V∶V=12 ∶88)[10]、乙腈-0.4%磷酸溶液(V∶V=11 ∶89)[11]、乙腈-0.4%磷酸溶液(V∶V=10 ∶90)、乙腈-0.4%磷酸溶液(V∶V=9 ∶91)[12]的分离效果,发现乙腈与0.4%磷酸溶液体积比为10 ∶90时分离度为1.017,绿原酸对照品的保留时间为 17.561 min,阴性几乎无干扰,效果最好。因此,采用乙腈-0.4%磷酸溶液(V∶V=10 ∶90)作为流动相进行绿原酸的含量测定[13-14]。
HPLC测定3批利咽口服液中绿原酸平均含量为0.315 5 mg/ml。《中华人民共和国药典·一部》(2015年版)规定:金银花按干燥品计算,含绿原酸不得少于1.5%,菊花含绿原酸不得少于0.20%[15]。考虑回收率等因素,建议标准定为0.300 0 mg/ml。综上所述,本研究为制定利咽口服液中绿原酸定量指标提供了参考依据,方法简便,准确、可靠。
[1]国家药典委员会.中华人民共和国药典:四部[S].2015年版.北京:中国医药科技出版社,2015:57,59.
[2]周欣,陈旭,宋洪涛.连花解毒颗粒的质量标准研究[J].解放军药学学报,2011,27(5):431-434.
[3]张璐,翁立冬.金嗓散结丸质量标准的研究[J].山西医科大学学报,2011,42(8):641-644.
[4]张志亮,吕杨.健脾润肺片的质量标准研究[J].中国药房,2011,22(27):2567-2570.
[5]董占军,韩桂茹,安丽娜,等.小儿咽扁颗粒质量控制方法的简化研究[J].河北中医,2011,33(8):1224-1226.
[6]王勖.中药金银花药用成分及药理作用分析[J].亚太传统医药,2015,11(18):30-31.
[7]陈菲菲,钱冬女.菊花新认识[J].中国医药指南,2011,9(32):405-406.
[8]庞瑞.金银花有效成分的药理学研究进展[J].陕西中医学院学报,2011,34(3):77-79.
[9]戴涌,乔蓉霞,罗定强.金嗓开间胶囊质量标准改进[J].西北药学杂志,2011,26(6):415-417.
[10] 彭家钢,杨瑞芬,朱江,等.反相高效液相色谱法测定小儿咳喘灵口服液中绿原酸的含量[J].湖北中医药大学学报,2011,13(3):44-46.
[11] 刘彬果,任涛,王媛.用HPLC法测定急扁颗粒中绿原酸和连翘苷的含量[J].药学服务与研究,2015,15(3)193-195.
[12] 郑笑为,刘燕,戴忠.HPLC法测定痰热清注射液中绿原酸的含量[J].中国药事,2011,25(12):1233-1234.
[13] 胡晓琴,李进,陈涛,等.暑热宁合剂中绿原酸HPLC测定条件的优化[J].天津中医药大学学报,2011,30(1):43-44.
[14] 马宏达,崔英宇,何静,等.小儿退热镇惊口服液的质量标准研究[J].解放军药学学报,2015,31(3):228-230.
[15] 国家药典委员会.中华人民共和国药典:一部[S].2015年版.北京:中国医药科技出版社,2015:221,311.
Content Deterrmination of Chlorogenic Acid in Liyan Oral Liquid by HPLC
JING Yuling
(Dept.of Labouratory, Zibo Traditional Chinese Medicine Hospital, Shandong Zibo 255300, China)
OBJECTIVE:To establish the method for quality control of Liyan oral liquid. METHODS: Thin layer chromatography (TLC) was applied in the qualitative identification of Lonicerae japonicae flos, Chrysanthemi flos, Scrophulariae radix, Ophiopogonis radix, and Belamcandae rhizoma in oral liquid. High performance liquid chromatography (HPLC) was applied in the quantification of chlorogenic acid in Liyan oral liquid. RESULTS: Spots in TLC for Lonicerae japonicae flos, Chrysanthemi flos, Scrophulariae radix, Ophiopogonis radix, and Belamcandae rhizoma from three batches of Liyan oral liquid were clear and had a good separation, and the negative control had no interruption. In HPLC determination, the injection volume and peak area of chlorogenic acid showed good linear relationship (r=0.999 8) within the concentrations of 0.132 7-1.326 9 μg. The average recovery rate was 100.44%,andRSDwas 1.14%. CONCLUSIONS: The established TLC and HPLC methods were simple, precise and accurate, and can be applied in the control quality of Liyan oral liquid.
Liyan oral liquid; TLC; HPLC; Quality control; Chlorogenic acid
R927.2
A
1672-2124(2016)12-1675-03
2016-07-15)
*副主任中药师。研究方向:制剂标准研究和药品检验。E-mail:jingyuling@126.com
DOI 10.14009/j.issn.1672-2124.2016.12.035
