伴基因断裂的小圆细胞软组织肉瘤3例穿刺组织活检结果分析
2017-01-17缑向楠刘秋雨关会娟
缑向楠,刘秋雨,关会娟
(河南省人民医院病理科,河南 郑州 450003)
伴基因断裂的小圆细胞软组织肉瘤3例穿刺组织活检结果分析
缑向楠,刘秋雨,关会娟
(河南省人民医院病理科,河南 郑州 450003)
目的 探讨伴基因断裂的小圆细胞软组织肉瘤的临床病理特征和分子遗传学改变。方法 3例小圆细胞软组织肉瘤穿刺组织,对其临床特征、组织形态、免疫表型和荧光原位杂交结果进行分析。结果 患者发病年龄21~70岁,主要临床表现为无痛性实性肿块。例1为存在FKHR基因断裂的腺泡状横纹肌肉瘤,镜下瘤细胞主要为未分化的小圆形或卵圆形细胞,被不规则的纤维血管分割成巢状、腺泡状、管状或裂隙状,无基膜,免疫组化染色示Vimentin、CD56、Desmin、MyoD1和Myogenin(+);例2为存在CHOP基因断裂的黏液样脂肪肉瘤或圆形细胞脂肪肉瘤,镜下瘤细胞由形态较为一致的小圆细胞组成,排列紧密,背靠背,呈片状或团块状,有时呈梁索状或腺样排列,瘤细胞核质比大,核仁不明显,核分裂相易见,免疫组化染色示Vimentin、S-100(+);例3为存在EWSR1基因断裂的尤文氏肉瘤,镜下瘤细胞由紧密成片或呈小叶状分布的小圆细胞组成,小叶间为宽窄不等的纤维结缔组织间隔,瘤细胞核圆形或卵圆形,核膜清楚,染色质细致,呈粉尘状,核仁小而不明显,核分裂相易见,免疫组化染色示Vimentin、CD99、CD56、SCLC、D2-40和FLI-1(+),AE1/AE3(部分+)。以上病例均通过荧光原位杂交法证实。结论 应用荧光原位杂交法等分子手段检测特异性标记为小圆细胞软组织肉瘤的诊断提供新的思路和视野。
小圆细胞软组织肉瘤;穿刺组织活检;荧光原位杂交;基因断裂
小圆细胞软组织肉瘤是一组光镜形态缺乏特异性的肿瘤,但其临床进展快,致畸、致死率极高,一直以来是病理诊断中的难点[1-3]。随着精准医疗和微创技术的开展,穿刺标本越来越多,由于组织少而局限,对病理诊断提出了更大的挑战。本文选取3例穿刺组织病例,采用组织形态学、免疫组化及分子生物学相结合的方法来检测确定诊断为小圆细胞软组织肉瘤,为肿瘤的诊断提供了新的诊断思路,同时为临床精准靶向治疗提供了依据[4]。
1 材料与方法
1.1 临床资料 例1:男,21岁,因“右侧腰部疼痛伴小便困难1月余,加重1周”入院。患者无明显诱因出现右侧腰部疼痛,未给予重视,随后出现小便困难,伴尿频,无尿痛、尿血等不适。MRI:考虑前列腺占位性病变,前列腺肉瘤可能并精囊腺受累,右侧盆壁及盆腔转移可能。实验室检查:TPSA<0.03 ng·mL-1,FPSA 0.013 ng·mL-1。例2:男,28岁,因“发现颈部肿块4月余,加重1周”入院。肿块约鸡蛋大小,质韧,固定,随吞咽上下活动,伴吞咽困难、胸闷、呼吸困难,无局部红肿、发热、疼痛等不适。彩超:甲状腺右侧叶后外侧不均质回声包块。例3:女,70岁,因“胸闷,右侧肢体无力半月”入院。在当地行胸水引流术,引流出血性液,后患者突发右侧上肢不能活动。入院诊断:1)脑梗塞;2)脑动脉硬化;3)肺癌,胸腔引流术后;4)冠状动脉硬化。CT示:右肺下叶肺癌并右侧胸膜、右肺门及纵隔淋巴结、左肺上叶转移可能性大,不除外以上部位均为转移瘤。
1.2 方法 标本经质量分数4%中性甲醛固定,常规取材、石蜡包埋,切片厚4 μm,HE染色,光镜下观察。采用免疫组化S-P法进行指标检测。所用抗体:AE1/AE3、Vimentin、CD99、CD56、Desmin、MyoD1、Myogenin、Myoglobin、SCLC、D2-40、FLI-1和S-100,均购自福州迈新生物技术开发有限公司。
荧光原位杂交(FISH)是一项在体外直接观察细胞中特定核酸的技术。杂交包括以下几个步骤:首先需要将石蜡包埋的组织切片进行老化,预处理;其次将DNA变性为单链,再与探针杂交;杂交完成后,通过一系列的洗涤,将多余的未结合探针洗去,再用DAPI将细胞核复染成蓝色;最后用荧光显微镜在合适的滤镜下观察DAPI及探针发出的荧光信号。FKHR基因断裂检测探针及EWSR1基因断裂检测探针均购自广州安必平医药科技有限公司。
2 结果
2.1 大体观 例1:前列腺穿刺组织:送检碎组织,直径约0.3 cm。例2:前上纵隔肿块穿刺组织:送检灰白色穿刺组织3条,长1.8~2.3 cm,直径0.1 cm。例3:胸腔穿刺组织:送检碎组织,直径0.3 cm。
2.2 组织学形态 例1为存在FKHR基因断裂的腺泡状横纹肌肉瘤,镜下瘤细胞主要为未分化的小圆形或卵圆形细胞,被不规则的纤维血管分割成巢状、腺泡状、管状或裂隙状,无基膜;例2为存在CHOP基因断裂的黏液样脂肪肉瘤或圆形细胞脂肪肉瘤,镜下瘤细胞由形态较为一致的小圆细胞组成,排列紧密,背靠背,呈片状或团块状,有时呈梁索状或腺样排列,瘤细胞核质比大,核仁不明显,核分裂相易见;例3为存在EWSR1基因断裂的尤文氏肉瘤,镜下瘤细胞由紧密成片或呈小叶状分布的小圆细胞组成,小叶间为宽窄不等的纤维结缔组织间隔,瘤细胞核圆形或卵圆形,核膜清楚,染色质细致,呈粉尘状,核仁小而不明显,核分裂相易见。见图1。
2.3 免疫组化 例1:免疫组化染色示Vimentin、CD56、Desmin、MyoD1和Myogenin(+);例2:免疫组化染色示Vimentin、S-100(+);例3:免疫组化染色示Vimentin、CD99、CD56、SCLC、D2-40和FLI-1(+),AE1/AE3(部分+)。
2.4 荧光原位杂交 例1为腺泡状横纹肌肉瘤,存在FKHR基因断裂;例2为黏液性脂肪肉瘤,存在CHOP基因断裂;例3为尤文氏肉瘤,存在EWSR1基因断裂。见图2。
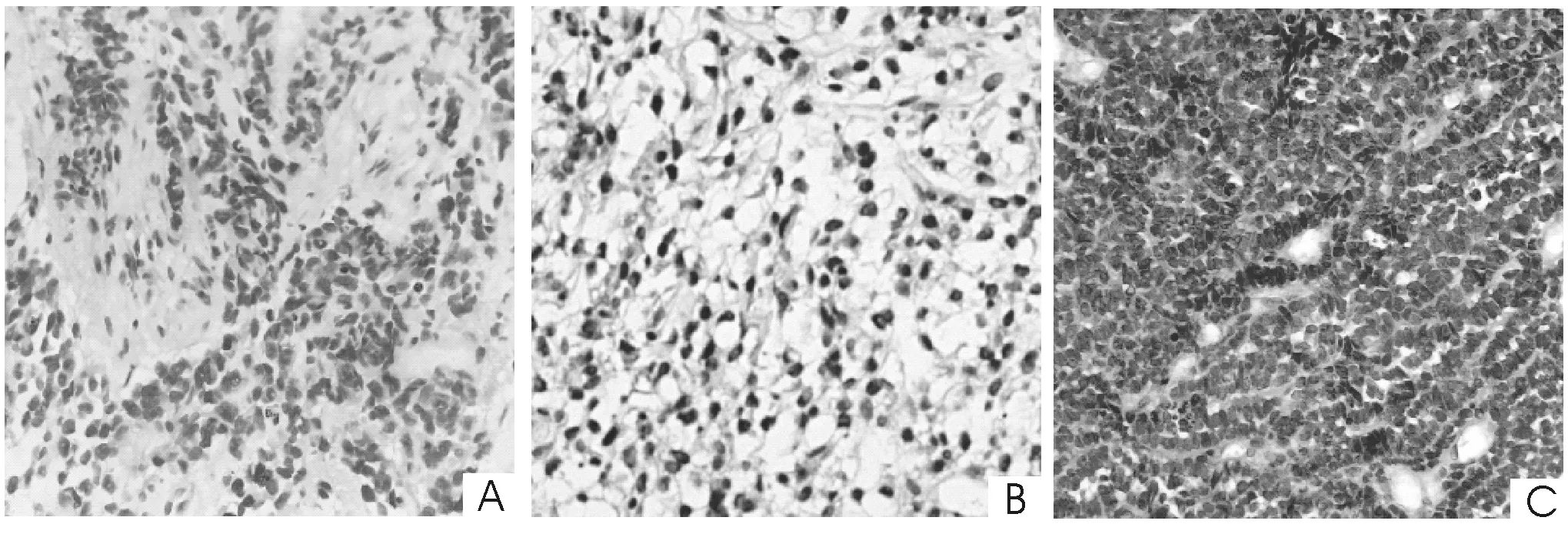
图1 3例小圆细胞软组织肉瘤穿刺组织活检常规病理检查结果
A:腺泡状横纹肌肉瘤,瘤细胞主要为未分化的小圆形或卵圆形细胞,被不规则的纤维血管分割;B:黏膜样脂肪肉瘤或圆形细胞脂肪肉瘤,瘤细胞由形态较为一致的小圆细胞组成,瘤细胞核质比大,核仁不明显;C:尤文氏肉瘤,瘤细胞由紧密成片或呈小叶状分布的小圆细胞组成,小叶间为宽窄不等的纤维结缔组织间隔

图2 3例小圆细胞软组织肉瘤穿刺组织活检荧光原位杂交检查结果
A:腺泡状横纹肌肉瘤,存在FKHR基因断裂;B:黏膜样脂肪肉瘤或圆形细胞脂肪肉瘤,存在CHOP基因断裂;C:尤文氏肉瘤,存在EWSR1基因断裂
2.5 治疗与随访 例1:进行双侧髂内动脉造影+化疗栓塞术;例2:肿物切除术后进行化疗;例3:因合并脑部疾病及肺部感染,全身情况差,患者出院。
3 讨论
病理诊断主要根据组织学特点,对于穿刺组织,由于其病变较少,此时引入辅助诊断手段显得尤为重要[5-6]。形态学特点不典型时,可用免疫组化染色、分子生物学、电镜检查和特殊染色等手段协助诊断。鉴别诊断:1)非霍奇金淋巴瘤,肿瘤细胞弥漫分布,肿瘤细胞表达相关的淋巴细胞性(T细胞、B细胞等)标记;2)腺癌,肿瘤细胞表达AE1/AE3和CEA,不表达Desmin;3)透明细胞肉瘤,透明细胞型腺泡状横纹肌肉瘤表达Desmin和Myogenin,而透明细胞肉瘤表达HMB45和S-100等;4)神经母细胞瘤,富于细胞的肿瘤,由成片的均一的小圆形原始细胞构成,细胞核深染,但该肿瘤常见Homer-Wright假菊形团,NSE、嗜铬素和突触素免疫染色阳性。
大多数的软组织肉瘤中存在克隆性的细胞和分子遗传学异常,表现为染色体数目、结构的异常以及相应基因的突变、扩增,或表现为染色体易位产生融合基因。细胞遗传学及分子生物学研究显示,在70%~80%的腺泡状横纹肌肉瘤中可检测到特异性染色体易位:t(2;13)(q35;q14)易位和t(1;13)(p36;q14)易位,FKHR可与PAX3和PAX7基因家族发生相互易位,2种易位分别形成相应的融合基因PAX3-FKHR或PAX7-FKHR[7-8]。而胚胎性横纹肌肉瘤却无这2种染色体易位。CHOP位于染色体12q13.3,是转录因子C/EBP家族的一个成员,在正常组织中广泛表达,累及该基因的染色体易位t(12;16)(q13;p11)和t(12;22)(q13;q12)导致TLS/FUS-CHOP和EWS/CHOP融合基因形成,与黏液样脂肪肉瘤和黏液性脂肪肉瘤或圆形细胞脂肪肉瘤的发生密切相关。大于95%黏液样脂肪肉瘤存在特异性t(12;16)(q13;p11)染色体易位,由此产生的TLS/FUS-CHOP融合基因被认为是黏液样脂肪肉瘤的一个诊断标记。在大于90%尤文肉瘤患者中,EWSR1基因可出现断裂及与多种基因融合,如与FLI1基因融合(85%)、与ERG基因融合(10%)。
通过这3例我们可以看到,小圆细胞软组织肉瘤诊断主要依据组织形态及免疫组化染色,借助分子生物学方法进行相应细胞遗传学检测,能够有效地辅助临床病理诊断[9]。同时,融合基因对预后有提示作用,融合基因PAX7-FKHR型阳性的肿瘤比PAX3-FKHR型者预后好[10],后者已发生广泛转移,特别是转移到骨髓。
[1] Downs-Kelly E,Shehata BM,López-Terrada D,et al.The utility of FOXO1 fluorescence in situ hybridization (FISH) in formalin-fixed paraffin-embedded specimens in the diagnosis of alveolar rhabdomyosarcoma[J].Diagn Mol Pathol,2009,18(3):138-143.
[2] 邱向南,赖日权.软组织小圆形细胞肿瘤的诊断和鉴别诊断[J].临床与实验病理学杂志,2002,18(2): 204-207.
[3] 刘秋雨,史玉洁,贺慧,等.宫颈粒细胞肉瘤临床病理研究[J].肿瘤基础与临床,2013,26(6):471-475.
[4] Xing PY,Shi YK,Feng FY,et al.Clinical characteristics and treatment of desmoplastic small round cell tumor[J].Zhonghua Zhong Liu Za Zhi,2010,32(2):139-142.
[5] Rajwanshi A,Srinivas R,Upasana G.Malignant small round cell tumors[J].J Cytol,2009,26(1):1-10.
[6] Meis-Kindblom JM,Stenman G,Kindblom LG.Differential diagnosis of small round cell tumors[J].Semin Diagn Pathol,1996,13(3):213-241.
[7] Hayes-Jordan A,Anderson PM.The diagnosis and management of desmoplastic small round cell tumor: a review[J].Curr Opin Oncol,2011,23(4):385-389.
[8] 刘咏梅,陈卉娇,许峰.促结缔组织增生性小圆细胞瘤的临床病理特征[J].中国癌症杂志,2004,14(2): 139-142.
[9] Cohn SL.Diagnosis and classification of the small round-cell tumors of childhood[J].Am J Pathol,1999,155(1):11-15.
[10]Sorensen PH,Lynch JC,Qualman SJ,et al.PAX3-FKHR and PAX7-FKHR gene fusions are prognostic indicators in alveolar rhabdomyosarcoma: a report from the children's oncology group[J].J Clin Oncol,2002,20(11):2672-2679.
缑向楠(1986-),女,硕士,主要从事肿瘤病理研究。E-mail:gouxiangnan@163.com
关会娟(19 -),女,硕士,副主任医师,主要从事肿瘤病理研究。E-mail:guanhuijuan1314@163.com
10.3969/j.issn.1673-5412.2016.06.023
R738.6
B
1673-5412(2016)06-0525-03
2016-05-12)
