miRNA-26a抑制ox-LDL介导的HAECs凋亡作用的机制研究
2017-01-16李勇,杨特,沈怡
李 勇, 杨 特,沈 怡
(重庆市中医院心血管内科 400011)
miRNA-26a抑制ox-LDL介导的HAECs凋亡作用的机制研究
李 勇, 杨 特,沈 怡
(重庆市中医院心血管内科 400011)
目的 探究miR-26a在ox-LDL介导内皮细胞HAECs凋亡中的作用及其调控机制。方法 采用不同浓度的氧化低密度脂蛋白(ox-LDL)在体外作用于HAECs细胞,噻唑蓝(MTT)和TUNEL染色检测ox-LDL作用HAECs后细胞的活性与凋亡率,定量实时聚合酶链反应(qRT-PCR)检测ox-LDL作用HAECs后细胞中miR-26a的表达水平。在HAECs中过表达miR-26amimic,MTT和TUNEL染色检测ox-LDL作用后细胞的活性和凋亡率。构建荧光素酶报告载体pMIR-PTEN的3′UTR,利用荧光素酶活性检测鉴定miR-26a的预测靶基因。qRT-PCR和蛋白质印迹法(Westernblot)分别检测PTEN的mRNA和蛋白表达水平。结果ox-LDL能够介导HAECs细胞的毒性死亡和细胞凋亡,并且降低了HAECs细胞中miR-26a的表达水平。过表达miR-26amimic能够抑制ox-LDL作用HAECs后细胞的毒性和凋亡。转染miR-26amimic显著抑制荧光素酶的活性(P<0.05)。转染miR-26amimic显著下调HAECs细胞中PTEN的mRNA和蛋白表达水平(P<0.05)。结论miR-26a能够抑制抑制ox-LDL作用HAECs后细胞的毒性和凋亡,其可能的作用机制是下调了PTEN的表达。miR-26a可能成为治疗凋亡相关的动脉粥样硬化的潜在靶点。
微RNAs;人类主动脉内皮细胞;第10号染色体缺失的磷酸酶和张力蛋白同源基因;细胞凋亡;动脉粥样硬化
动脉粥样硬化是引起死亡和残疾的主要原因之一[1]。内皮细胞的凋亡被认为是动脉粥样硬化发生、发展的一个关键进程。由于内皮细胞的凋亡,内皮组织将失去调控脂质稳态,免疫及炎症的能力。内皮细胞的损伤打破了内皮组织完整的屏障功能,利于脂质体的沉积,而导致动脉粥样硬化的发生[2-4]。此外,内皮细胞的凋亡也会引起斑块的不稳定,而引起急性心肌梗死和猝死。然而现阶段内皮细胞的凋亡机制研究还并不清楚。
MicroRNAs(miRs)是近年来新发现的一类长度较短的非编码RNA分子,长度约为22个核苷酸,与靶mRNAs或靶mRNAs的3′非翻译区互补结合,诱导靶mRNAs降解或抑制靶mRNAs的翻译,从而实现转录后基因的表达调控作用[5-6]。新近研究发现,miR-26a在多种心血管疾病中表达是失调的,其中包括心脏肥大、心房纤维性颤动和心肌缺血[7]。芯片数据分析发现,miR-26a的表达在主动脉瓣狭窄患者的主动脉瓣中下调了65%,而具体的分子生物学机制尚未阐明[8]。
本研究旨在探究miR-26a在氧化低密度脂蛋白(ox-LDL)介导内皮细胞HAECs凋亡中的作用机制。明确miR-26a在内皮细胞凋亡中与PTEN表达的调控关系及其在动脉粥样硬化发生、发展中的作用。
1 材料与方法
1.1 材料
1.1.1 细胞株 人类主动脉内皮细胞系HAECs及转染用工具细胞HEK293均购自上海细胞研究所。
1.1.2 试剂 胎牛血清、DMEM培养基(美国hyclone公司),反转录试剂盒(日本Taraka公司),RNA 提取试剂Trizol,LipofectamineTM2000试剂盒(美国Invitrogen 公司),miR-26a 逆转录引物(广州锐博公司),ox-LDL(上海生工),细胞活性测定试剂噻唑蓝(MTT,上海碧云天公司), TUENL凋亡检测试剂(美国Roche公司)。野生型PTEN的3′UTR及突变型PTEN的 3′UTR寡核苷酸(上海英骏公司)。PTEN、GAPDH一抗(美国Abcam公司),辣根过氧化物酶标记山羊抗小鼠IgG(北京中杉金桥公司)。
1.2 方法
1.2.1 细胞培养 人类主动脉内皮细胞系HAECs和HEK293细胞用含10%胎牛血清的DMEM/H培养基在37 ℃、5% CO2条件下培养。
1.2.2 定量实时聚合酶链反应(qRT-PCR) 按照TaqMan miRNA Reverse Transcription Kit说明书加入逆转录反应所需试剂,miR-26a逆转录引物,总RNA进行逆转录反应。反转录条件:42 ℃15 min,85 ℃ 5 s。合成的cDNA作为模板进行qRT-PCR扩增,根据Premix ExTaq试剂盒说明加入Premix、miR-26a正向引物和miR-26a反向引物进行反应。qRT-PCR条件:95 ℃ 1 min; 95 ℃ 15 s、60 ℃ 20 s,共行39次循环;反应结束后得到Ct值,根据Ct值进行相对定量分析。
1.2.3 MTT测定细胞活性 取对数期的HAECs细胞接种于96孔板中,接种密度为1×105/mL,加入不同浓度的(0、1、10、25、50 μg/mL)ox-LDL处理后,共培养24 h,后去掉上清,加入含有10%MTT的新鲜培养基继续培养4 h。最后加入DMSO溶解所形成的甲瓒晶体,在570 nm波长处测定吸光度值,根据对应的吸光度值,计算细胞的相对活性。在过表达miR-26a抑制了ox-LDL对HAECs细胞活性能力MTT测定中共分为4组:Control组、ox-LDL组、ox-LDL+miR-26a mimic组、ox-LDL+miR-NC组,各组培养24 h后,处理方法同前。
1.2.4 TUNEL法检测细胞的凋亡 6孔板中处理作用后的HAECs细胞,加入磷酸盐缓冲液(PBS)洗涤1 次,加4%多聚甲醛固定1 h,PBS 洗涤1 次,加入含0.1%Triton X-100 的PBS 冰浴2 min,室温下在含0.3%过氧化氢的甲醇溶液中孵育20 min,PBS 洗涤3 次,加入50 μL TUNEL检测液,37 ℃避光孵育1 h。PBS洗涤3次后用抗荧光淬灭封片液封片后荧光显微镜下拍照并计数。在过表达miR-26a抑制了ox-LDL对HAECs细胞凋亡测定中共分为4组:Control组、ox-LDL组、ox-LDL+miR-26a mimics组、ox-LDL+miR-NC组,各组培养24 h后,处理方法同前。
1.2.5 pMIR-PTEN的3′UTR荧光报告载体构建及荧光素酶活性检测 合成野生型PTEN的 3′UTR及突变型PTEN的 3′UTR寡核苷酸经退火,双酶切后插入荧光素酶报告基因载体pMIR-REPORT,在含有miR-26a结合位点的PTEN的3′UTR片段,构建pMIR-PTEN的 3′UTR载体。HEK293细胞接种于96孔板,24 h后细胞贴壁达70%时进行转染。转染分为4组,分别是miR-NC和pMIR-PTEN的 3′UTR 组,miR-26a mimic和pMIR-PTEN的 3′UTR转染组,miR-NC和突变型pMIR-PTEN的3′UTR组,miR-26a和突变型pMIR-PTEN的3′UTR组,再与质粒pRL-TK共转染HEK293细胞。转染24 h后,使用双荧光素酶报告基因检测系统处理裂解细胞, GloMax20/20 Luminometer检测荧光强度。
1.2.6 蛋白质印迹法(Western blot) 将转染miR-26a mimics和miR-NC后的两组HAECs细胞使用细胞裂解缓冲液裂解,12 000 r/min离心15 min,收集上清并行蛋白浓度测定。取20 μg蛋白经10% SDS-PAGE胶分离后,湿转印至PVDF膜上,5%脱脂奶粉封闭,分别采用PTEN的一抗(1∶1 000稀释), GAPDH的一抗(1∶ 2 000稀释)孵育过夜,再与辣根过氧化物酶标记山羊抗小鼠IgG孵育1 h,采用Supersignal West Dura Extended Duration Substrate 试剂处理并曝光显色。
1.3 统计学处理 采用SPSS18.0软件进行数据处理。采用非配对t检验分析组间差异。以P<0.05为差异具有统计学意义。
2 结 果
2.1 ox-LDL对HAECs细胞活性、凋亡及miR-26a的影响 结果表明,ox-LDL的10、25、50 μg/mL浓度能够显著抑制HAECs细胞的活性(图1A),显著促进HAECs细胞的凋亡发生(图1B),显著抑制HAECs细胞中miR-26a的表达水平(图1C)。
2.2 过表达miR-26a抑制ox-LDL对HAECs细胞活性和凋亡的作用 体外转染实验表明,转染miR-26a 模拟物显著提高了miR-26a在HAECs细胞中的表达水平(图2A)。MTT检测发现,转染miR-26a mimics组较转染miR-NC组显著增强了ox-LDL作用HAECs细胞后的活性(图2B)。TUNEL凋亡检测发现,转染miR-26a mimics组较转染miR-NC组显著抑制了ox-LDL作用HAECs细胞后的凋亡发生(图2C)。

A:MTT检测不同浓度ox-LDL作用HAECs后的细胞活性;B:TUNEL检测不同浓度ox-LDL作用HAECs后的细胞的凋亡率;C:qRT-PCR检测不同浓度ox-LDL作用HAECs后的细胞中miR-26a的相对表达水平;a:P<0.05,与0 μg/mL ox-LDL比较。
图1 ox-LDL对HAECs细胞活性、凋亡及miR-26a的影响
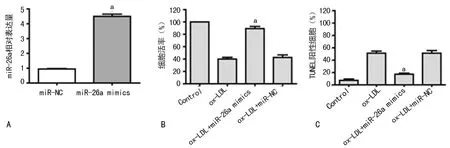
A:转染miR-26a mimic后HAECs细胞中miR-26a的相对表达水平;B:不同处理组作用HAECs后的细胞活性;C:不同处理组作用HAECs后的细胞凋亡率;a:P<0.05,与转染miR-NC组比较。
图2 过表达miR-26a抑制ox-LDL对HAECs细胞活性和凋亡的作用
2.3 pMIR-PTEN的 3′UTR荧光报告载体构建及荧光素酶活性检测 采用生物信息学软件(Targetscan)预测miR-26a的靶基因PTEN,同时构建PTEN3′UTR及突变型3′UTR的荧光素酶报告基因载体(图3A)。荧光素酶活性检测结果显示,转染miR-26a mimics和pMIR-PTEN的 3′UTR的荧光强度较转染miR-NC和pMIR-PTEN的 3′UTR显著降低(P<0.05),miR-26a对pMIR-PTEN的 3′UTR的表达具有抑制作用,并且该抑制功能通过miR-26a与pMIR-PTEN的 3′UTR区结合实现,提示PTEN是miR-26a的靶基因(图3B)。
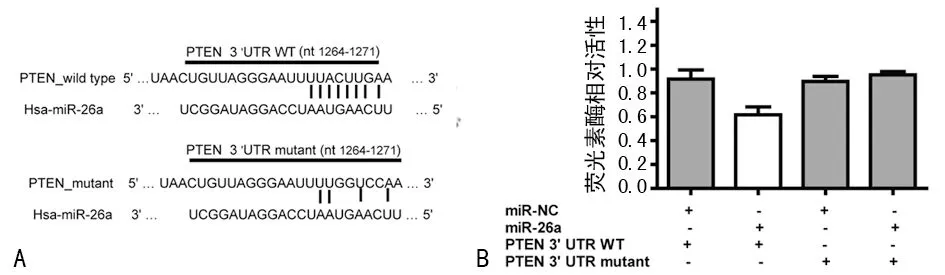
A:Targetscan预测miR-26a的靶基因;B:检测不同转染组的相对荧光素酶活性。
图3 pMIR-PTEN的 3′UTR荧光报告载体构建及荧光素酶活性检测
2.4 PTEN的mRNA和蛋白表达水平 转染miR-26a mimics后PTEN mRNA和蛋白水平较转染miR-NC显著降低。见图4。
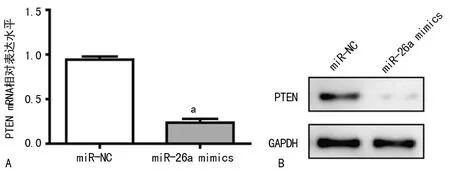
A:qRT-PCR检测转染miR-26a mimic后HAECs细胞中PTEN的相对表达水平;B:Western blot检测转染miR-26a mimic后HAECs细胞中PTEN的蛋白表达水平。
图4 PTEN的mRNA和蛋白表达水平
3 讨 论
动脉粥样硬化是一种复杂的免疫炎性疾病。内皮细胞、巨噬细胞及平滑肌细胞在动脉粥样硬化的发生、发展中都发挥重要的作用。重要的是血管内皮细胞的损伤通常被认为是动脉粥样硬化发生的起始步骤。促动脉粥样硬化的危险因素包括,高血糖、血管紧张素Ⅱ、ox-LDL,这些因素均能介导内皮细胞的凋亡[9]。ox-LDL在损伤形成,刺激内皮细胞的自杀性程序死亡发挥关键的作用,其主要的机制是通过caspase依赖和caspase非依赖的途径介导的。miRNAs的异常表达参与调控了多种内皮细胞的存活与死亡,新近的研究报道了miR-126影响了内皮细胞的重建,同时也有研究表明miR-21、miR-223、miR-29b等参与了内皮细胞的凋亡[10]。miR-26被报道在心血管疾病中发挥不同的功能,miR-26a的过表达能够减少房颤的发生率[11],另外miR-26a能够发挥抗血管生成因子的作用,miR-26a在内皮细胞中表达的降低能够促进血管的生成。本研究发现了miR-26a在内皮细胞发挥着抗细胞凋亡的重要作用。
PTEN起初被鉴定发挥肿瘤抑制子的功能,主要通过PI3K依赖的信号通路[12]。凋亡是细胞的一种程序性死亡,而在这个过程中线粒体和内质网都发挥了重要的作用。有文献报道,用凋亡诱导剂staurosporine处理细胞后,能够使PTEN定位聚集于线粒体[13]。更进一步的研究表明抑制PTEN的表达能够显著降低活性氧族(ROS)的增加水平,同时也有研究表明PTEN的沉默表达损伤了雌激素受体(ER)钙离子的释放功能,这就降低了细胞质和线粒体中钙离子的浓度,也就降低了细胞对钙离子介导的凋亡刺激信号的敏感性[14]。这些研究均表明了PTEN在促凋亡发生过程中发挥重要的作用。
在本研究中,证实了miR-26a是体外内皮细胞凋亡过程中的关键因子。miR-26a的过表达能够抑制逆转ox-LDL介导的HAECs凋亡作用。其主要的作用机制是miR-26a抑制了其靶向调控基因PTEN及PTEN相关的凋亡信号通路。本研究为血管性疾病(如动脉粥样硬化)的治疗提供了新的治疗靶点和研究策略。
[1]Shah NR,Mahmoudi M.The role of DNA damage and repair in atherosclerosis:A review[J].J Mol Cell Cardiol,2015,86(2):147-157.
[2]De Lorenzo A,Moreira AS,Souza EG,et al.Insulin-like growth factor-1 in early-onset coronary artery disease:Insights into the pathophysiology of atherosclerosis[J].Int J Cardiol,2015,202(6):1-2.
[3]Hovland A,Jonasson L,Garred P,et al.The complement system and toll-like receptors as integrated players in the pathophysiology of atherosclerosis[J].Atherosclerosis,2015,241(2):480-494.
[4]Moss ME,Jaffe IZ.Mineralocorticoid receptors in the pathophysiology of vascular inflammation and atherosclerosis[J].Front Endocrinol (Lausanne),2015,6(3):153.
[5]Jansen F,Yang X,Nickenig G,et al.Role,function and therapeutic potential of microRNAs in vascular aging[J].Curr Vasc Pharmacol,2015,13(3):324-330.
[6]Menghini R,Stöhr R,Federici M.MicroRNAs in vascular aging and atherosclerosis[J].Ageing Res Rev,2014,17(8):68-78.
[7]Zhang ZH,Li J,Liu BR,et al.MicroRNA-26 was decreased in rat cardiac hypertrophy model and May be a promising therapeutic target[J].J Cardiovasc Pharmacol,2013,62(3):312-319.
[8]Luo X,Pan Z,Shan H,et al.MicroRNA-26 governs profibrillatory inward-rectifier Potassium current changes in atrial fibrillation[J].J Clin Invest,2013,123(5):1939-1951.
[9]Dimmeler S,Haendeler J,Galle J,et al.Oxidized low-density lipoprotein induces apoptosis of human endothelial cells by activation of CPP32-like proteases.A mechanistic Clue to the ′response to injury′ hypothesis[J].Circulation,1997,95(7):1760-1763.
[10]Zhu HQ,Li Q,Dong LY,et al.MicroRNA-29b promotes high-fat diet-stimulated endothelial permeability and apoptosis in apoE knock-out mice by down-regulating MT1 expression[J].Int J Cardiol,2014,176(3):764-770.
[11]Icli B,Wara AK,Moslehi J,et al.MicroRNA-26a regulates pathological and physiological angiogenesis by targeting BMP/SMAD1 signaling[J].Circ Res,2013,113(11):1231-1241.
[12]Hopkins BD,Parsons RE.Molecular pathways:intercellular PTEN and the potential of PTEN restoration therapy[J].Clin Cancer Res,2014,20(21):5379-5383.
[13]Zhu Y,Hoell P,Ahlemeyer B,et al.PTEN:a crucial mediator of mitochondria-dependent apoptosis[J].Apoptosis,2006,11(2):197-207.
[14]Bononi A,Bonora M,Marchi S,et al.Identification of PTEN at the ER and MAMs and its regulation of Ca2+signaling and apoptosis in a protein phosphatase-dependent manner[J].Cell Death Differ,2013,20(12):1631-1643.
Study on the mechanism of miRNA-26a inhibiting ox-LDL-mediated apoptosis of HAECs
LiYong,YangTe,ShenYi
(DepartmentofCardiovascularMedicine,ChongqingTraditionalChineseMedicineHospital,Chongqing400011,China)
Objective To investigate the role of miR-26a in ox-LDL-mediated apoptosis of HAECs in endothelial cells and its mechanism.Methods Various concentrations of ox-LDL were added in HAECs culture.Cell cytotoxicity and apoptosis were monitored by MTT and TUNEL assay,and expression level of miR-26a examined by qRT-PCR.Overexpression of miR-26a mimic in HAECs,MTT and TUNEL staining were used to detect the activity and apoptosis of ox-LDL.The 3′UTR of luciferase reporter vector pMIR-PTEN was constructed and the predicted target gene of miR-26a was identified by luciferase activity assay.QRT-PCR and Western blot were used to detect the mRNA and protein expression of PTEN.Results ox-LDL could mediate the toxic death and apoptosis of HAECs cells,and decrease the expression level of miR-26a in HAECs cells.Overexpression of miR-26a mimic could inhibit the cytotoxicity and apoptosis of ox-LDL cells after HAECs.Transfection of miR-26a mimics significantly inhibited luciferase activity (P<0.05).The expression of mRNA and protein in HAECs cells was significantly down regulated by transfection of miR-26a analog (P<0.05).Conclusion MiR-26a can inhibit the cytotoxicity and apoptosis of ox-LDL cells after HAECs inhibition,and the possible mechanism of action is to down regulate the expression of PTEN.The study suggests that miR-26a may be a potential target for the treatment of atherosclerosis related to apoptosis.
microRNAs;HAECs;PTEN;apoptosis;atherosclerosis
李勇(1972-),副主任医师,硕士,主要从事冠心病基础与临床研究。
��·基础研究
10.3969/j.issn.1671-8348.2016.36.004
R
A
1671-8348(2016)36-5052-04
2016-08-11
2016-10-06)
