SOCS3基因转染对小鼠CD4+Th细胞分化及炎症细胞因子表达的影响及机制研究
2017-01-16董念国刘金平
张 沛,董念国,刘金平△
(1.重庆医科大学附属第二医院胸心外科 400010;2.华中科技大学同济医学院附属协和医院心脏大血管外科,武汉 410030)
SOCS3基因转染对小鼠CD4+Th细胞分化及炎症细胞因子表达的影响及机制研究
目的 观察SOCS3基因对小鼠CD4+Th细胞分化及细胞因子表达的影响。方法 分离、培养并转染小鼠CD4+Th细胞,以植物血凝素(PHA)刺激靶细胞,采用逆转录聚合酶链反应(RT-PCR)检测相应细胞因子基因表达;蛋白质印迹法(Western blot)检测目的细胞因子蛋白表达。结果 与对照组相比较,转染组T-bet、白细胞介素(IL)-2、干扰素-γ(IFN-γ)、信号转导及转录激活因子(STAT)4、IL-12Rβ2基因表达明显下调,细胞因子信号抑制物(SOCS)3、GATA-3、IL-4、IL-6、IL-10、STAT6基因表达明显上调,T-bet、IL-2、IFN-γ、STAT4、IL-12Rβ2蛋白表达明显下调,SOCS3、GATA-3、IL-4、IL-6、IL-10、STAT6蛋白表达明显上调,差异均有统计学意义(P<0.01)。结论 SOCS3基因转染可上调小鼠CD4+Th细胞SOCS3基因表达,下调STAT4活化和磷酸化,抑制Th1细胞分化,并下调炎症细胞因子基因和蛋白表达,同时间接促进Th2细胞分化,并上调相应炎症细胞因子基因和蛋白表达。
T淋巴细胞,辅助诱导;细胞因子信号转导蛋白抑制因子;细胞分化;细胞因子类
移植物血管病(CAV)的典型病理表现是移植物内血管内膜增生,引起弥漫性和向心性的冠状动脉狭窄,最终导致移植物缺血和失功能。在移植物内局部浸润的炎症细胞及其所表达的炎性细胞因子、生长因子是调控内膜增生的重要因素[1]。而在这些炎症细胞中,Th1细胞及其所表达的细胞因子,对内膜增生最为重要。因此,Th1细胞是对移植物血管病研究中的重要靶细胞[2]。
细胞因子信号抑制物(SOCS)蛋白家族具有广泛的功能和复杂的调控机制,SOCS3作为其中功能最强大的一员,通过调控细胞因子和激素表达,可以对多种疾病产生调控作用[3]。目前认为,由于SOCS3蛋白功能强大,可以调节多条信号通路,在疾病进程中,能够通过不同的信号通路协作或拮抗性地调节同一目的信号因子或靶细胞,因此,研究中有时会得到与预期不符的效果[4]。但是,SOCS3基因对Th细胞的作用和机制尚不明确,本实验利用植物血凝素(phytohemagglutinin,PHA)刺激诱导小鼠脾脏来源CD4+Th细胞分化,观察重组小鼠SOCS3基因腺病毒载体转染对其分化和炎症细胞因子表达的影响。利用该体外实验,进一步研究移植物血管病中SOCS3对Th细胞分化的影响和机制。
1 材料与方法
1.1 实验动物及试剂 8周大雄性SPF级C57BL/6小鼠(H-2b)购于武汉大学动物实验中心。小鼠SOCS3基因重组腺病毒载体由(苏州)赛业生物科技有限公司构建,行空斑形成实验,检测鉴定病毒滴度为1×1010pfu/mL。磁珠分选装置及CD4+Th细胞磁珠分选试剂盒购于德国Miltenyi Biotec公司。SOCS3、信号转导及转录激活因子(STAT)4、P-STAT4抗体购于美国Bioworlde公司,干扰素-γ(IFN-γ)、白细胞介素(IL)-2抗体购于美国Santa Cruz公司,重组抗小鼠IL-4抗体、FITC-抗小鼠CD4抗体、FITC-抗小鼠IFN-γ抗体、FITC-抗小鼠GATA-3抗体、重组小鼠IL-12购于加拿大eBiosience公司。PHA购于美国sigma公司,其他试剂均为国产分析纯。引物合成、测序均由南京金斯瑞生物技术公司完成。
1.2 方法
1.2.1 小鼠脾脏CD4+Th细胞原代培养 90只C57BL/6小鼠随机分为3个组:对照组、Ad-SOCS3组、Ad-GFP组,每组30只。脱颈椎法处死小鼠,无菌获取C57BL/6小鼠脾脏,制成单个细胞悬液。加入无菌磷酸盐缓冲液(PBS)稀释至总体积2 mL,加入同等体积的淋巴细胞分离液,以密度梯度离心法2 000 r/min条件下离心15 min,RPMI 1640培养基重悬,加CD4微珠,混匀,2~8 ℃避光孵育15 min,洗涤后,PBS重悬,将细胞置入事先用RPMI 1640培养基润洗过的MS柱中,收集MS柱吸附的细胞,即为CD4+细胞。
1.2.2 小鼠SOCS3基因重组腺病毒载体体外转染小鼠脾脏CD4+Th细胞 以无血清的RPMI 1640培养基,使待转染细胞同步化。收集细胞悬液,1 000 r/min条件下离心10 min,调整细胞浓度为2×106/mL。2×105/孔接种于12孔细胞培养板。每孔中加入含10%胎牛血清(FBS) RPMI 1640培养基1 mL,同时加入不同感染复数(MOI)值的Ad-SOCS3,然后在5%CO2、37 ℃培养箱内继续培养。培养2 h后,收集细胞悬液,1 000 r/min条件下离心10 min,重悬,加入10%FBS RPMI 1640培养基,于5%CO2、37℃继续培养。分别在不同时点于荧光显微镜下观察转染效果,观察不同MOI和不同时间点的Ad-SOCS3对小鼠脾脏CD4+Th细胞转染效果的影响。
1.2.3 细胞制备及转染 根据实验分组,在Ad-SOCS3组、Ad-GFP组和对照组中,根据上一步实验结果所得出的最佳MOI值及最佳转染时间,分别照上一步方法转染Ad-SOCS3、Ad-GFP和100 μL无菌PBS,荧光显微镜下直接观察细胞感染效率,并用于后续部分实验。
1.2.4 小鼠脾脏CD4+Th细胞的体外诱导分化 重组腺病毒载体转染小鼠巨噬细胞成功后,在3组细胞培养瓶中,分别加入浓度10 μg/mL的PHA,在37 ℃、5%CO2条件下培养48 h,刺激诱导小鼠脾脏CD4+Th向Th1型细胞分化。收集细胞悬液,离心,弃上清液,得到分化后的CD4+Th细胞,用于下一步检测。
1.2.5 逆转录聚合酶链反应(RT-PCR) 检测Ad-SOCS3、Ad-GFP和100 μL无菌PBS干预后,各组小鼠脾脏CD4+Th细胞 SOCS3 mRNA表达,以及体外诱导Th分化后的小鼠脾脏CD4+Th细胞的SOCS3、STAT4、IFN-γ、IL-2 mRNA表达。
1.2.6 Western blot 检测各组体外诱导分化后的小鼠脾脏CD4+Th细胞的SOCS3、STAT4、P-STAT4、IFN-γ、IL-2蛋白表达。
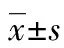
2 结 果
2.1 小鼠脾脏CD4+Th细胞的获取及鉴定 成功获取小鼠脾脏CD4+Th细胞,细胞形态多为圆形,悬浮生长,随培养时间延长,可聚拢呈团块状生长,流式细胞学检测证实为CD4+Th细胞,且纯度大于95%,适用于后续实验。
2.2 腺病毒载体转染小鼠脾脏CD4+Th细胞的条件 转染后不同时间点,荧光显微镜下分别观察各组不同MOI值转染效果。其中MOI=160转染细胞组,转染72h后,转染效果佳,荧光显微镜下观察见90%以上的小鼠脾脏CD4+Th细胞均表达绿色荧光蛋白,转染效率高,满足后续实验要求。后续实验即按照MOI为160感染小鼠脾脏CD4+Th细胞72h条件进行。
2.3 重组腺病毒感染小鼠脾脏CD4+Th细胞效率 分别将感染复数MOI为160的Ad-SdCS3及Ad-GFP感染小鼠脾脏CD4+Th细胞,10%FBSRPMI1640培养液中继续培养72h。荧光显微镜下观察发出绿色荧光信号的细胞数占细胞总数90%以上,说明小鼠SOCS3基因重组腺病毒载体感染效率高。见图1、2。

图1 光镜下小鼠CD4+Th细胞(×200)

图2 荧光显微镜下小鼠CD4+Th细胞转染效果图(×200)
2.4 各组小鼠CD4+Th细胞SOCS3mRNA表达Ad-SOCS3组SOCS3mRNA表达较Ad-GFP组及对照组明显上调(P<0.01),而Ad-GFP组与对照组比较无明显差异(P>0.05)。见图3。
2.5SOCS3基因转染对小鼠脾脏CD4+Th细胞各种炎症细胞因子mRNA表达的影响 与对照组和Ad-GFP组相比较,Ad-SOCS3组T-bet、IL-2、IFN-γ、STAT4、IL-12Rβ2基因表达明显下调(P<0.01),SOCS3、GATA-3、IL-4、IL-6、IL-10、STAT6基因表达明显上调(P<0.01)。Ad-GFP组与对照组比较,差异均无统计学意义(P>0.05)。见图4。
2.6SOCS3基因转染对小鼠脾脏CD4+Th细胞各种炎症细胞因子蛋白表达的影响Ad-SOCS3组与对照组比较,T-bet、IL-2、IFN-γ、STAT4、IL-12Rβ2蛋白表达明显下调,SOCS3、GATA-3、IL-4、IL-6、IL-10、STAT6蛋白表达明显上调,差异均有统计学意义(P<0.01)。Ad-GFP组与对照组比较,差异无统计学意义(P>0.05)。见图5。

*:P<0.05,与对照组、Ad-GFP组比较。
图3 各组SOCS3mRNA表达
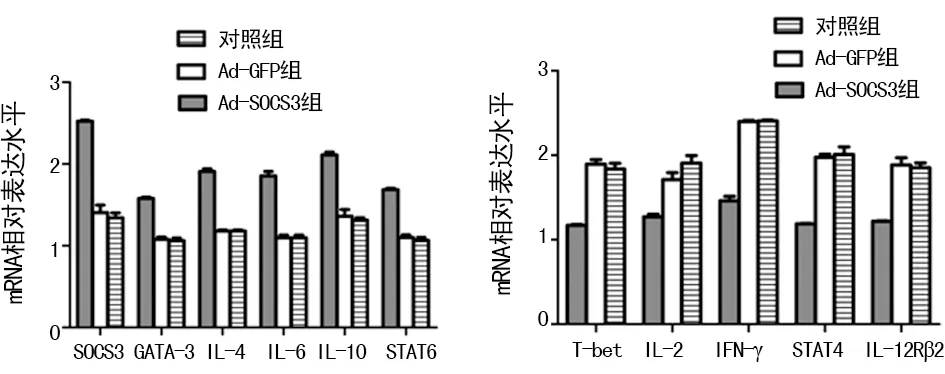
图4 各组小鼠脾脏CD4+Th细胞中炎症因子mRNA相对表达量
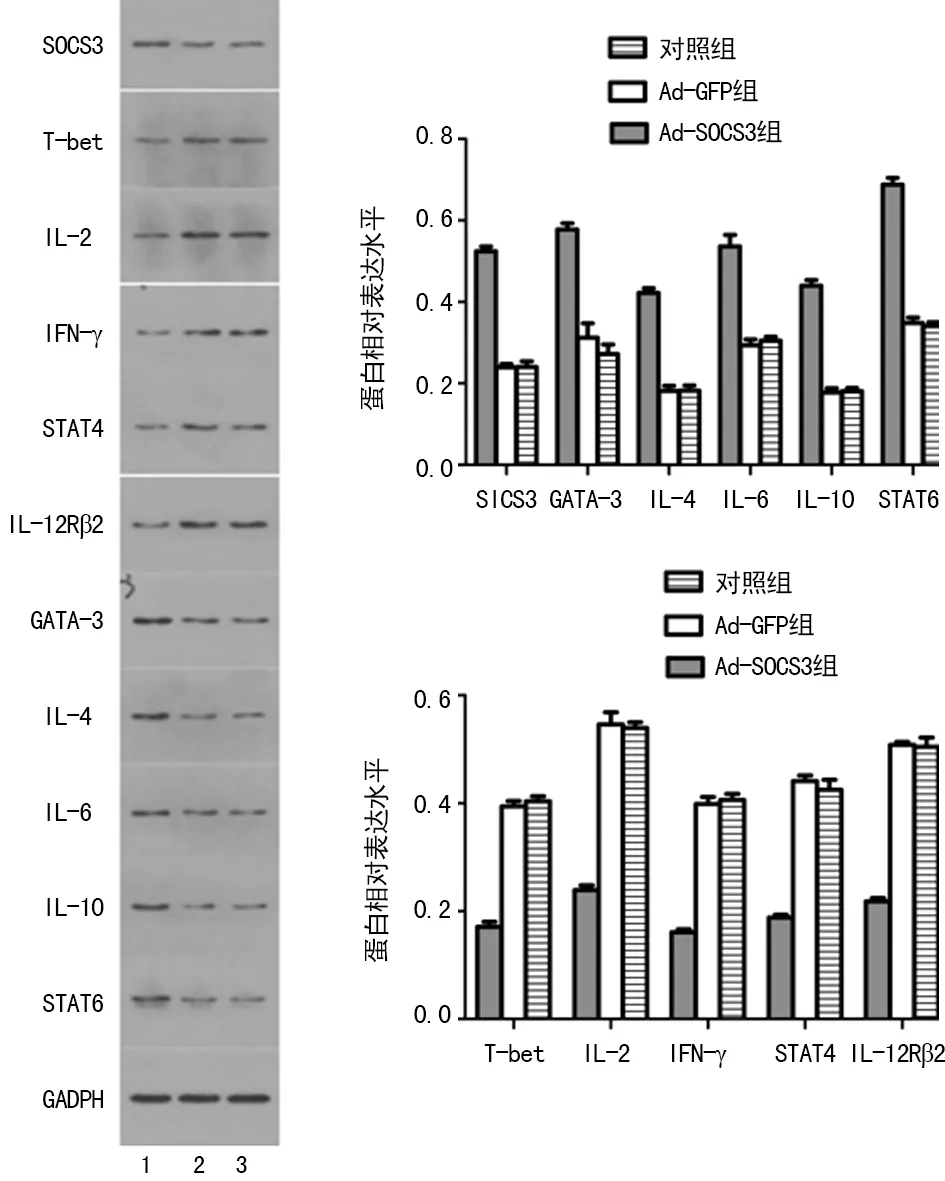
1:Ad-SOCS3组;2:Ad-GFP组;3:对照组。
图5 各组小鼠脾脏CD4+Th细胞中炎症因子蛋白表达
3 讨 论
Th细胞是机体中一类重要的免疫细胞,其正常功能表达依赖它在免疫器官内或作用靶点的外周分化的正常进行。本实验利用PHA刺激诱导小鼠脾脏来源CD4+Th细胞分化,观察重组小鼠SOCS3基因腺病毒载体转染对其分化和炎症细胞因子表达的影响。结果发现小鼠脾脏来源CD4+Th细胞内SOCS3基因过表达,可抑制其在促炎因素诱导下的Th1型炎症因子表达,与此同时,上调Th2型炎症因子表达。
在抗原刺激、细胞因子等微环境的协同作用下,CD4+Th细胞可分化成为不同的亚群以发挥特定的生理学作用[5]。Th1细胞主要分泌IL-2、IFN-γ和TNF-β等细胞因子,介导细胞免疫应答,在对抗病原体、肿瘤中起重要作用[6]。自然杀伤细胞表达的IFN-γ和抗原呈递细胞(APCs)表达的IL-27可激活信号通路STAT1,APCs表达的IL-12可激活信号通路STAT4,以上3种途径,可以分别启动Th1细胞分化。其中前两条途径,主要通过上调IFN-γ表达,使Th1细胞分化随细胞数量增加而稳定保持。后一条途径,一方面通过上调IFN-γ表达,保持Th1细胞分化数量,另一方面可以通过抑制IL-4负向调节Th2细胞分化,维持Th1细胞分化的方向[7]。在本实验中,利用PHA刺激诱导小鼠脾脏来源CD4+Th细胞分化,结果发现T-bet、IL-2和IFN-γ表达增加,说明该条件下,CD4+Th细胞向Th1细胞分化。同时,STAT4和IL-12Rβ2基因和蛋白表达均增加,磷酸化上调,说明IL-12/STAT4信号通路在极化过程中被激活,并发挥信号转导作用。
SOCS蛋白是先天和获得性免疫反应系统中关键的生理性调节物质[8]。SOCS家族成员广泛参与并调节了Th细胞的分化,以及干预炎症因子的产生和炎症反应的程度,从而在免疫性疾病中发挥重要作用[9]。其中SOCS3的调节功能与Th细胞分化关系密切。在胸腺细胞发育的最早阶段,也就是其分化成为不同T细胞受体表型的阶段,SOCS3即有表达[10]。而此时在选择性敲除SOCS3基因动物模型中,会发现不同亚群T细胞比例改变。而在这之后,T细胞发育的多个阶段中,SOCS3都高水平表达,尤其在CD4+、CD8+Th细胞中,有着相对更高的表达量[11]。本实验中,利用腺病毒载体转染小鼠脾脏来源CD4+Th细胞,使SOCS3过表达,可下调STAT4基因和蛋白表达,抑制其磷酸化,从而抑制Th1分化中IL-12/STAT4信号通路活性,负向调节Th1细胞分化,继而降低IFN-γ、IL-2等细胞因子表达水平。因为SOCS3不能直接调节STAT4信号通路,而STAT4通路活性下调在实验中被观察到,笔者认为SOCS3通过间接抑制STAT4通路活性作用达到这一效果。
Th2细胞是另一种重要的T细胞亚群。其主要表达IL-4、IL-5、IL-6、IL-9、IL-10等细胞因子,主要在机体内参与体液免疫的调节作用[12]。Th2细胞分化主要通过STAT6通路调控,而SOCS3基因不能直接作用该通路,因此,SOCS3基因不能直接调控Th2分化。但是在Th细胞分化过程中,Th1/Th2细胞亚群可以通过各自表达的细胞因子相互作用,产生竞争和抑制的关系。Th1细胞特异性表达的IFN-γ、IL-2可抑制Th2细胞的增殖和功能,而同样Th2细胞表达的IL-4和IL-10也可以抑制Th1细胞分化。外源性增加SOCS3基因表达,通过作用于IL-12/STAT4通路,减弱Th1细胞分化作用,使IFN-γ、T-bet、IL-2等细胞因子表达下调,从而间接性减弱了对Th2分化的抑制作用。一定程度上促进了Th2细胞分化。本实验中,Th2细胞亚群活化通路STAT6及特异性细胞因子GATA-3、IL-4、IL-6、IL-10表达上调,证实了这一结论。而Th2细胞分化增强,IL-4、IL-10细胞因子表达上调,又可以进一步抑制Th1细胞分化。最终达到调节Th1/Th2亚群比例的效果。在本研究中,外源性增加SOCS3基因表达,导致的IFN-γ、IL-2下调和IL-4、IL-10上调,均对抑制炎症反应和CAV进程起到了关键作用,对术后排斥反应起到了保护作用。
本实验证明腺病毒载体介导的供体SOCS3基因转染能够通过调控Th1/Th2细胞分化,抑制其促炎功能。在该研究方向上继续深入挖掘,可能会获得更多信息。进一步明确SOCS3对移植物血管病的影响和机制,可能会在慢性排斥反应的治疗方面取得新的突破口。
[1]Schmauss D,Weis M.Cardiac allograft vasculopathy-recent developments[J].Circulation,2008,117(16):2131-2141.
[2]Tamiya T,Kashiwagi I,Takahashi R,et al.Suppressors of cytokine signaling(SOCS) proteins and JAK/STAT pathways regulation of T-Cell inflammation by SOCS1 and SOCS3[J].Arterioscler Thromb Vasc Biol,2011,31(5):980-985.
[3]Gelpi C,Roldan C,Mirabet S,et al.Correlation of immunological markers with graft vasculopathy development in heart transplantation[J].J Heart Lung Tran,2012,31(4S):S167.
[4]Baumjohann D,Ansel KM.MicroRNA-mediated regulation of T helper cell differentiation and plasticity[J].Nat Rev Immunol,2013,13(9):666-678.
[5]Frey O,Kamradt T.Effector function plasticity of T helper lymphocytes[J].Z Rheumatol,2009,68(10):834-835.
[6]Zhu JF,Paul WE.Heterogeneity and plasticity of T helper cells[J].Cell Res,2010,20(1):4-12.
[7]Xu W,Di Santo JP.Taming the beast within:regulation of innate lymphoid cell homeostasis and function[J].J Immunol,2013,191(9):4489-4496.
[8]Bernink JM,Spits H.Th1-and Th2-like subsets of innate lymphoid cells[J].Immunol Rev,2013,252(1):133-138.
[9]Klose SC.A T-bet gradient controls the fate and function of CCR6-RORgammat+innate lymphoid cells[J].Nature,2013,494(7436):261-265.
[10]Carow B,Reuschl AK,Gavier-Widen DA,et al.Critical and Independent role for SOCS3 in either myeloid or T cells in resistance to mycobacterium tuberculosis[J].PLoS Pathog,2013,9(7):e1003442.
[11]Issa FS,Wood KJ.Role of T cells in graft rejection and transplantation tolerance[J].Expert Rev Clin Immunol,2010,6(1):155-169.
[12]Safinia N.T-cell alloimmunity and chronic allograft dysfunction[J].Kidney Int Suppl,2010(119):S2-12.
The effects and mechanism of SOCS3 gene transfection in CD4+Th cell differentiation and expression of inflammatory cytokines of mouse*
ZhangPei1,DongNianguo2,LiuJinping2△
(1.DepartmentofCardiothoracicSurgery,theSecondAffiliatedHospitalofChongqingMedicalUniversity,Chongqing400010,China;2.DepartmentofCardiovascularSurgery,UnionHospital,TongjiMedicalCollege,HuazhongUniversityofScienceandTechnology,Wuhan,Hubei410030,China)
Objective To investigate the effect and mechanism of adenovirus vector mediated SOCS3 gene transfection in CD4+Th cell differentiation and expression of inflammatory cytokines of mouse.Methods The CD4+Th cells were isolated from spleen of C57bl/6 mouse and cultured.Ad-SOCS3 were transfected into the CD4+Th cells.PHA was used for culturing with the CD4+Th cells.RT-PCR were used to detect the mRNA expression,and Western blot were used to detect the protein expression of cytokines.Results Compared with the control group,the gene and protein expression of T-bet,IL-2,IFN-γ,STAT4 and IL-12Rβ2 in the transfected group were significantly down-regulated,the gene and protein expression of SOCS3,GATA-3,IL-4,IL-6,IL-10 and STAT6 were significantly up-regulated(P<0.01).Conclusion The results indicate that SOCS3 gene transfection can up-regulate SOCS3 mRNA and protein expression in the CD4+Th cells,down-regulate the JAK/STAT pathway,inhibition of Th1 cell differentiation,and down regulation of inflammatory cytokine gene and protein expression,and indirectly promote Th2 cell differentiation,and up the corresponding inflammatory cytokine gene and protein expression.
T-lymphocytes,helper-inducer;suppressor of cytokine signaling proteins;cell differentiation;cytokines
��·基础研究
10.3969/j.issn.1671-8348.2016.36.003
国家自然科学基金资助项目(81270322)。 作者简介:张沛(1982-),主治医师,讲师,博士,主要从事心脏移植研究。△
张 沛1,董念国2,刘金平2△
(1.重庆医科大学附属第二医院胸心外科 400010;2.华中科技大学同济医学院附属协和医院心脏大血管外科,武汉 410030)
R392.4
A
1671-8348(2016)36-5049-03
2016-07-18
2016-09-06)
