兔同种异体新鲜半月板移植后组织学变化
2017-01-16杨渝平张继英段小宁胡晓青孟庆阳刘振龙史尉利敖英芳北京大学第三医院运动医学研究所北京100191
杨渝平 张继英 段小宁 胡晓青 孟庆阳 刘振龙 史尉利 敖英芳北京大学第三医院运动医学研究所(北京100191)
兔同种异体新鲜半月板移植后组织学变化
杨渝平 张继英 段小宁 胡晓青 孟庆阳 刘振龙 史尉利 敖英芳
北京大学第三医院运动医学研究所(北京100191)
目的:探讨兔同种异体新鲜半月板移植后,移植物形态结构的组织学衍变过程。方法:成年新西兰大白兔12只,分为3组:6周组、12周组和24周组,每组4只。每次2只兔同时接受手术,将2只兔实验侧的内侧半月板互换,进行同种异体新鲜内侧半月板移植。术后6周、12周、24周处死,观察大体半月板愈合情况,并行HE染色、天狼星红染色等组织学检查。结果:术后6周半月板移植物与周围组织愈合情况良好,但存在明显异物反应表现。12周和24周时,每组各有50%的半月板出现肉眼可见的明显皱缩,镜下可见基质松散。HE染色显示3组均存在血管增生、纤维化和淋巴细胞浸润等表现。天狼星红染色显示:6周组75%的标本Ⅲ型胶原占比少于1/3;12周组50%的标本Ⅲ型胶原占比介于1/3和2/3之间;24周组全部标本Ⅲ型胶原占比均超过2/3。6周组有25%出现胶原纤维少量松散;12周组100%出现少量松散,且主要位于中心区;24周组50%出现大量松散,而且这种松散的表现扩展到整个半月板区域。三组间差异均有统计学意义(P<0.05)。结论:兔同种异体新鲜半月板移植术后6周愈合良好,但存在明显异物反应表现,12周和24周部分移植物会出现明显肉眼可见的皱缩和镜下可见的基质松散现象。而且随着时间推移,内部胶原纤维从Ⅰ型胶原为主逐渐转变为Ⅲ型胶原为主。这种变化先从中心区开始,范围逐渐扩大,使移植物的结缔组织结构逐渐弱化,可能最终导致移植物的失效。
同种异体半月板;移植;胶原;组织学
半月板是膝关节的重要功能结构,因其承载力量大、力学功能复杂,因此成为膝关节中最易导致运动损伤的结构之一。如果膝关节失去半月板的保护,会导致过早的、进行性的关节软骨退变,最终导致膝关节骨性关节炎的发生[1]。虽然临床上随着手术技术和手术器械的发展,部分半月板撕裂可以被缝合修补[2,3],但仍有大量严重的或复杂的半月板损伤,无法进行缝合修复,位于非血供丰富区的严重撕裂的半月板往往还免不了要接受部分切除、次全切除和全切除手术。为了避免半月板缺失后膝关节退变的发生,很多学者都采用不同种类的半月板移植手术,试图重建膝关节力学秩序,恢复半月板功能。
近年来,同种异体半月板移植作为国际上已经比较成熟的手术方式,其临床疗效和预后已经被证实[4-6]。Jiang等[7]和李学金等[8]分别在人体和动物实验中还发现了半月板切除的同时进行半月板移植效果更好。但是,临床和实验室的研究发现也有很多不满意的结果:谢兴等[9]采用深低温冷冻处理的猪半月板进行兔的异种异体半月板移植,结果发现移植物在半年以内逐渐溶解吸收;Hommen等[10]和Verdonk等[11]发现移植物的生存率会随着时间的延长越来越低。
鉴于此,我们设计了本实验,用以观察新鲜移植的同种异体半月板是否会随着时间推移,组织结构逐渐弱化而导致移植物的失效。
1 材料与方法
1.1 半月板移植手术
12只成年新西兰白兔,雌性,体重2.8~3.2 kg。准备接受同种异体半月板移植的一侧膝关节作为实验侧,另一侧不接受任何手术作为对照侧。麻醉后后腿脱毛,消毒铺单。于膝关节内侧切长度4 cm的切口,逐层分离,暴露内侧副韧带,从近端横行切开关节囊。注意保护内侧副韧带完整性,如果关节间隙过紧,难以完成半月板切除和移植操作,则部分切断内侧副韧带于上止点附近,操作完成后,再良好吻合韧带断端。每次2只序号相邻的兔同时接受手术,将实验侧的内侧半月板互换,即刻进行同种异体新鲜内侧半月板移植。植入时,将被植入的半月板的前角缝合于前交叉韧带胫骨平台止点,后角缝合于后交叉韧带胫骨平台止点内侧后方的关节囊上,体部则缝合于内侧副韧带上。中间加固缝合几针于胫骨平台周边组织及关节囊上。然后缝合关节囊和皮肤。术后青霉素80万单位每天1次肌肉注射,共3天,分笼饲养。于术后第6周、第12周、第24周分别处死新西兰兔,每个时间段处死4只。取两侧膝内侧半月板备用。
本研究的所有动物实验设计和手术方法都经过北京大学第三临床医学院实验动物伦理委员会批准。
1.2 组织学观察
将半月板组织按常规脱水、透明、石蜡包埋后,5微米厚的连续切片,分别采用HE、天狼星红染色法染色。其中,天狼星红染色的标本采用带偏振光功能的光学显微镜下观察组织结构情况。
采用Kurth等[12]和Kon等[13]的评分方法,评估移植后半月板大体情况和组织学变化。针对半月板组织天狼星红染色结果目前尚无统一的评估方法,故本研究将代表退变的Ⅲ型胶原占比、主要分布区域和有无结缔组织结构松散作为三个主要的观察指标。将Ⅲ型胶原占比分为少于1/3、多于1/3少于2/3和多于2/3三组;将Ⅲ型胶原主要分布区域分为周边区和中心区两组;将有无结缔组织结构松散分为不明显、少量和大量三组,观察其结果并进行统计学分析。
1.3 统计学处理
研究数据采用SPSS 23.0软件进行统计分析,计数资料采用例数(百分率)进行统计描述,不同组间构成比的差异检验采用Fisher’s Exact Test,所有检验以双侧P<0.05为差异具有统计学意义。
2 结果
所有结果按照动物取材周数进行自然时间分组,分为6周组、12周组和24周组。
2.1 大体观察
移植术后动物患肢切口均愈合良好,未采用特殊外固定。无1例感染,无1例下肢活动受限,3周内所有动物活动完全恢复正常。
2.2 移植后半月板大体情况评估结果
术后第6周,关节内半月板前角与体部愈合均良好,有滑膜包绕,完全愈合并且连接紧密。仅有2例为后角不完全愈合并且连接处比较松弛。该组术后6周时半月板位置良好,形态基本正常,但颜色略发黄。术后第12周,其中2例移植的内侧半月板明显变小接近消失。术后第24周,2例形态基本正常,颜色略黄,2例体积明显变小。但整体半月板位置良好(参见图1)。各组间结果差异无统计学意义,具体结果详见表1。
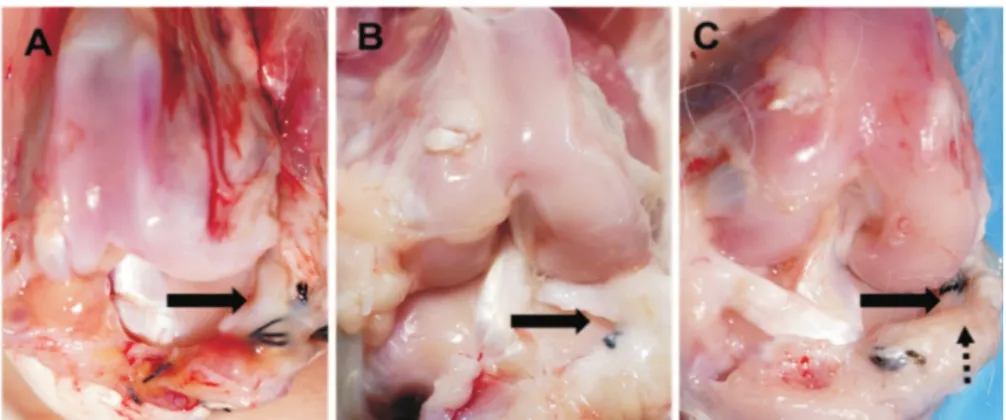
图1 同种异体内侧半月板移植术后的大体情况
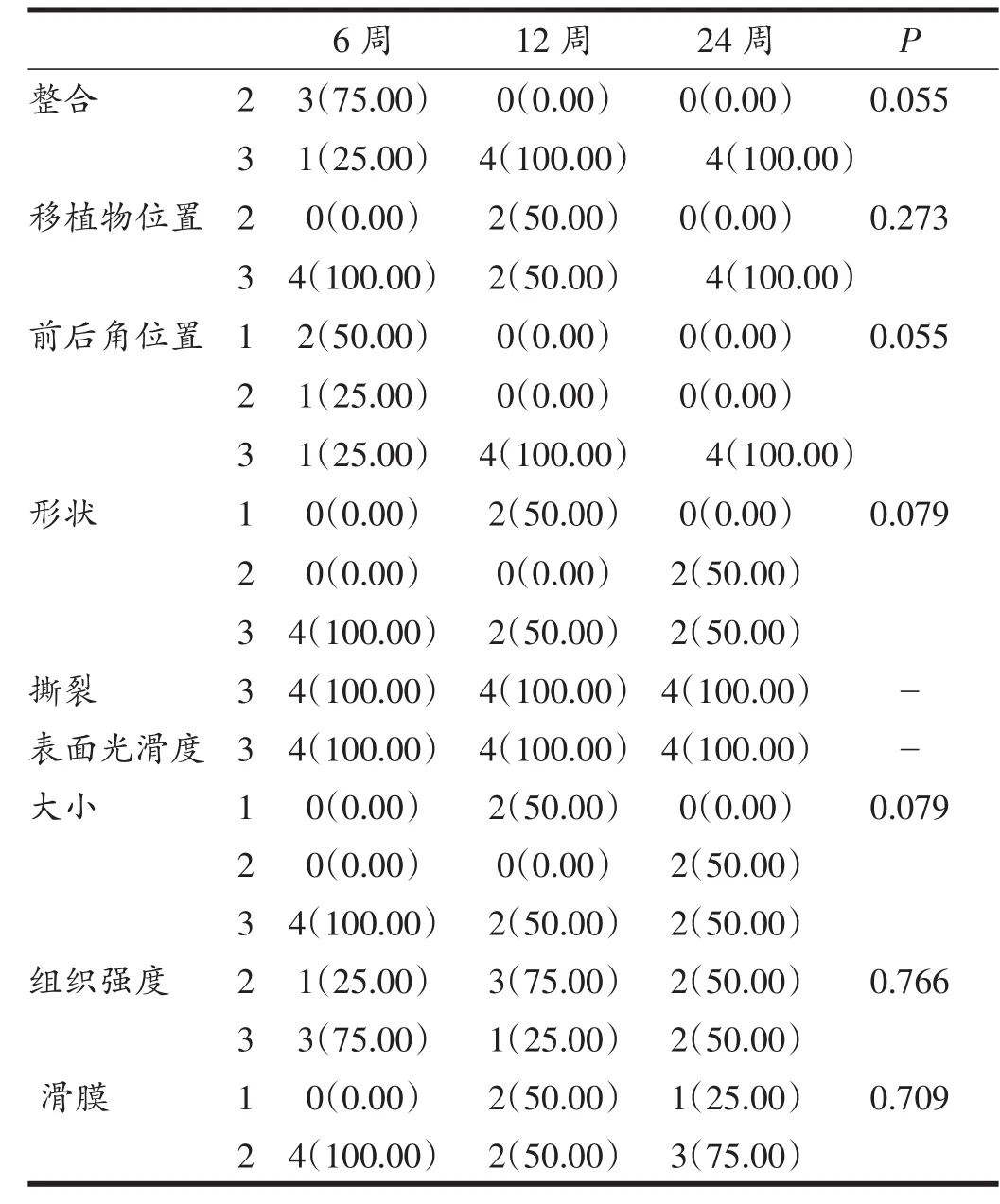
表1 同种异体移植后半月板大体情况评估结果
2.3 移植后半月板组织学情况评估结果
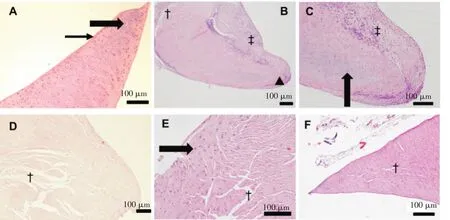
图2 标本的HE 染色结果
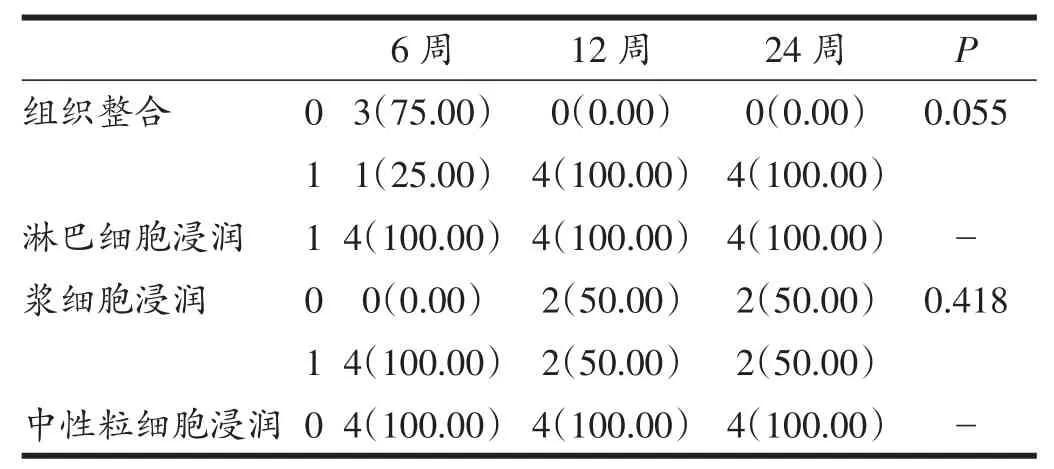
表2 同种异体移植后半月板组织学情况评估结果(HE染色)
术后3组标本的HE染色结果显示,所有移植半月板都一直存在一定的异物反应,有淋巴细胞和/或浆细胞浸润,无中性粒细胞浸润,有血管增生和部分组织纤维化。但除6周时有1例标本表现为愈合情况不佳外,其余各组所有移植半月板都表现出良好的愈合,且未见明显的细胞坏死区域或无细胞区。见图2和表2。示可能开始有退变的表现。C:B图的局部放大。可以清楚地看到尖端附近炎性细胞浸润和结构基本正常的半月板细胞。D:12周时移植的内侧半月板组织结构,尖端更加圆钝,甚至跟正常半月板的游离边缘形态有明显差异;半月板细胞中类似纤维母细胞的细胞数量明显增加,基质出现更加明显的松散(“†”指示),而且范围扩展到接近游离缘。E:24周时移植的内侧半月板组织结构,基质松散更加明显,扩展到几乎全部半月板范围。F:24周时未手术侧内侧半月板组织结构,细胞组成虽然表现接近正常,但也出现了类似于移植的半月板6周时基质松散的表现,少量松散的基质主要位于靠近中心的区域。(A、C、E图放大倍数200倍,B、D、F图放大倍数100倍)
天狼星红染色可以对半月板组织的纤维结缔组织结构组成进行很好的半定量染色显示。正常半月板90%以上为Ⅰ型胶原,仅含有微量的Ⅲ型胶原。Ⅲ型胶原一般被认为主要是在组织退变或者纤维性修复时才会出现,故正常的半月板天狼星红染色应该整体显示主要为红色,结缔组织纤维排列比较整齐,粗细均匀,而退变的半月板则会出现较多的黄绿色纤维,即Ⅲ型胶原[14]。正常半月板和3组同种异体移植术后标本的天狼星红染色结果参见图3。图3显示随着移植时间的延长,移植物中Ⅰ型胶原逐渐减少,Ⅲ型胶原逐渐增加,而且Ⅲ型胶原从中心区开始出现,范围逐渐扩大。
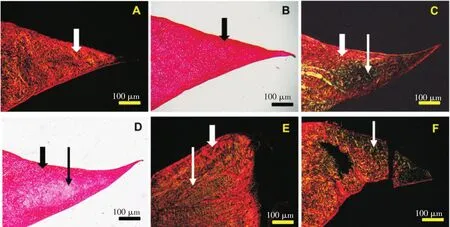
图3 标本的天狼星红染色结果
表3可见,随着移植时间的延长,移植物中代表退变和修复的Ⅲ型胶原占比逐渐增加,并逐渐由中心区扩展到周边区域。同时,还出现结缔组织结构逐渐松散的表现。各组间差异具有统计学意义(P<0.05)。
3 讨论
人类半月板的总重量的72%~77%为水分,其余基质由胶原纤维、弹性纤维、葡糖胺聚糖及少量的残余DNA和粘附分子组成,而其干重的85%~89%为胶原纤维[15]。人类的半月板内部主要有四种胶原纤维,其中90%以上为Ⅰ型胶原,Ⅱ型胶原占到半月板胶原总量的1%~2%,同时含有少量的Ⅲ、Ⅴ、Ⅵ型胶原[16-19],这与我们实验中得到的天狼星红染色的非手术侧内侧半月板染色表现一致。另外,半月板的胶原并非均匀分布,游离缘的1/3部分主要由Ⅰ型胶原和少量Ⅱ型胶原构成,靠近滑膜缘的2/3部分几乎全部由Ⅰ型胶原构成[20]。本实验中天狼星红染色的结果(参见图3)可以明显看出:随时移植时间延长,Ⅰ型胶原逐渐减少,尤其在靠近滑膜缘一侧的偏中央区域比较明显,逐渐被Ⅲ型胶原所替代。这也与HE染色所看到的表现符合,即结缔组织的松散由靠近滑膜缘一侧的中心区内先出现。
另外,病理切片结缔组织的松散,可能也会由于不恰当的制片操作引起。但是,我们对本组中所有半月板组织都进行同样的取材和制片处理,正常侧的内侧半月板在6周取材时的组织学结构并未显现出结缔组织的松散的表现,而24周取材时却出现了比较明显的结缔组织松散表现(参见图2和3)。即使是因为半月板组织相对于皮肤、肌肉等软组织更加硬韧,制片、切片时相对容易出现组织松散,但鉴于前述原因,很可能是由于随着移植时间的延长,移植的半月板内部的纤维结缔组织出现了微观上组织结构的退行性改变,引起其力学结构弱化,最终导致在病理切片上表现为更多的组织松散。
临床上应用最多的是经过消毒灭菌和低温保存的同种异体半月板,因为这种方法比较安全,来源相对比较充足。但正像Hommen等[10]、Jiang等[21]、余家阔等[22]和康晓琪等[23]的研究显示出的结果一样,他们都观察到类似的结果:移植后的同种异体半月板组织,早期都会出现明显的组织坏死表现,也就是会呈现为一个明显的宿主细胞爬行替代的过程,与膝关节前交叉韧带重建后移植物的塑性改建过程类似。其主要原因可能是他们都是采用经钴60γ射线辐照灭菌的同种异体半月板,用低温冰箱保存,移植手术时取出再用。有实验证实,γ射线辐照灭菌会对移植效果产生直接影响,并存在明显的剂量相关性[24]。另外,半月板经低温冷冻后,其内的细胞基本无存活。作为半月板重要成分的细胞外基质是靠活的纤维软骨细胞分泌的,所以冷冻半月板其生物活性会有一定程度的降低。此外还有冷冻干燥和深低温保存等处理方法。冷冻干燥方法可破坏半月板原有的结构成分,致其紧缩、基质退变[25]。同时,深低温保存的半月板其内部胶原破坏较多,生物力学性能下降,且费用高昂[26]。
于是我们这个实验采用了新鲜的同种异体半月板移植,同时对移植半月板的大体情况和组织学情况进行了观察、记录和统计。发现本组实验术后6周、12周和24周移植的同种异体半月板都有比较好的愈合能力,明显优于Hommen等、Jiang等、余家阔等和康晓琪等[10,21-23]的利用经过消毒灭菌和低温保存的同种异体半月板移植的组织学表现。这与其它应用新鲜同种异体半月板移植的文献的研究结果表现相似[27-29]。另外,Verdonk[30]用达尔伯克必需基本培养基(DMEM)加20%受者血清在37℃、95%空气和5%CO2的条件下保存异体半月板,证实该种方法可使半月板保存活性,能产生纤维软骨细胞、蛋白多糖及胶原纤维结构,并证实该种方法优于冷冻保存的半月板。当然,目前新鲜半月板移植在动物实验中应用相对较多,由于保存时限的制约,取材后最好在24小时内完成移植,所以临床广泛应用受到一定的限制。而且,新鲜半月板移植因未进行消毒,能否带来疾病传播尚未可知[11]。
同时,新鲜移植的同种异体半月板中有能分泌细胞外基质的活的纤维软骨细胞存在,而细胞膜是重要的免疫源,所以新鲜半月板移植仍可能会有轻度的免疫排斥[31,32]。我们的研究有着类似的表现,表现出持续存在的异物反应表现:在实验取材的所有时间节点上,移植的半月板周缘几乎都可以看到明显的滑膜增生、小血管增生以及淋巴细胞和/或浆细胞的浸润,半月板游离缘明显变钝等。这种现象也许就是新鲜半月板移植后的爬行替代表现,只是不像经过消毒和低温保存后的半月板移植那么明显,而且移植的半月板和周围的滑膜及其它软组织能够很快、很好地愈合在一起。李学金等[27]对兔进行新鲜半月板同种异体移植的实验观察,显示术后12个月时,移植体能够成活,而且具有正常的结构和功能,防止了膝关节退变,但这个研究并没有进行其它时间段例如术后3个月、6个月的观察,而且仅仅进行了HE染色的组织学观察。其它一些新鲜半月板移植的动物实验,例如Kelly等[28]、Szomor[29]和Rijk等[33,34]的文献都主要关注于半月板移植后对于胫骨和股骨骨软骨的保护作用,而并未对移植半月板本身的组织学变化进行病理学观察和分析。
考虑到免疫排斥的因素,也许新鲜半月板移植因为存在相对更多的免疫原性物质而更容易受到受体机体的排异,但目前无论是临床试验还是动物实验,都没有明确证实新鲜的移植的半月板比消毒保存后的移植半月板寿命更短[8,10,35,36],这可能跟半月板本身属于移植免疫优势组织有关[27,37]。即便如此,本实验的结果还是显示出,随着移植的时间推移,新鲜同种异体移植的兔半月板组织内部胶原纤维还是在不断退变,使结缔组织结构逐渐弱化,很可能最终导致移植物的失效。另外,如果要比较新鲜的同种异体半月板和经过消毒和低温保存的半月板在移植后两种移植物的病理结构、尤其是胶原结构变化的异同,显然需要进一步的对照研究来证实。
当然,我们采用的移植方法主要是将移植物进行软组织固定,而一般文献认为半月板前后角骨性固定具有良好的初步稳定性,半月板移植最好用前后骨栓进行固定[38]。但绝大多数的动物实验研究都采用软组织固定,可能跟我们同样考虑到动物尤其是兔子的半月板体积非常小,很难进行良好的前后骨栓固定。而且多位作者的研究也证实了这种固定方式可以在短期内获得满意的移植效果[21-23]。另外,文献认为移植半月板和原有半月板大小的误差在10%以内被认为是可接受的[39]。本组中所有进行同种异体移植的半月板都是采用相同月龄的兔子,而且都是采用内侧半月板移植物,故在尺寸上的差异都小于10%,基本能够保证移植物跟胫股关节的匹配。
本研究的局限性。第一,可以进一步进行扫描电镜的研究,来观察移植后半月板纤维结缔组织的微观结构变化,可能会更加直观。第二,本研究未对半月板组织进行Ⅰ型胶原和Ⅲ型胶原的特异性免疫组化染色,天狼星红染色可能会因为方法的问题,产生对胶原种类和定量观察的局限性。第三,因为本组实验动物数量不多,观察时间最长也仅仅为半年,故也许需要时间更长、样本量更大的实验来进一步验证本实验结果。第四,本组没有设置其它的对照组,今后的研究中可以设计与经过消毒和深低温保存过的同种异体半月板或者异种异体半月板进行对照研究。
4 结论
兔同种异体新鲜半月板移植术后6周愈合良好,但存在明显异物反应表现,12周和24周部分移植物会出现明显肉眼可见的皱缩和镜下可见的基质松散现象。而且随着时间推移,内部胶原纤维从Ⅰ型胶原为主逐渐转变为Ⅲ型胶原为主。这种变化先从中心区开始,范围逐渐扩大,使移植物的结缔组织结构逐渐弱化,可能最终导致移植物的失效。
[1] Fairbank TJ.Knee joint changes after menisectomy[J].J Bone Joint Surg(AM),1948,30B(4):664-670.
[2] Miao Y,Yu JK,Zhang ZZ,et al.MRI signal changes in com⁃pletely healed meniscus confirmed by second-look arthrosco⁃py after meniscal repair with bioabsorbable arrows[J].Knee Surg Sports TraumatolArthrosc,2009,17(6):622-630.
[3] Makris EA,Hadidi P,Athanasiou KA.The knee meniscus:structure-function,pathophysiology,current repair tech⁃niques,and prospects for regeneration[J].Biomaterials,2011,32(30):7411-7431.
[4] Keene GCR,Paterson RS,Teague DC.Advance in arthroscop⁃ic surgery[J].ClinOthop,1987,224:64-70.
[5] Liu C,Toma IC,Mastrogiacomo M,et al.Meniscus reconstruc⁃tion:today's achievements and premises for the future[J]. Arch Orthop Trauma Surg,2013,133(1):95-109.
[6] Rongen JJ,Van Tienen TG,Van Bochove B,et al.Biomateri⁃als in search of a meniscus substitute[J].Biomaterials,2014,35(11):3527-3540.
[7] Jiang D,AoYF,Gong X,et al.Comparative study on immedi⁃ate versusdelayed meniscus allograft transplantation:4-to 6-year follow-up[J].Am J Sports Med,2014,42(10):2329-2337.
[8] 李学金,李群,张知博,等.不同处理方法同种异体半月板移植修复兔膝关节软骨的远期效果比较[J].中国组织工程研究与临床,2010,14(7):1170-1173.
[9] 谢兴,余家阔,张继英,等.异种异体和同种异体半月板移植术后兔半月板和关节软骨中Ⅰ、Ⅱ、Ⅲ、Ⅹ型胶原表达和免疫排斥研究[J].中国运动医学杂志,2005,24(1):4-8.
[10] Hommen JP,Applegate GR,DelPizzo W.Meniscal allograft transplantation:ten-year results of cryopreserved allografts[J]. Arthroscopy,2007,23(4):388-393.
[11] Verdonk PC,Demurie A,Almqvist KF,et al.Transplantation of viable meniscal allograft.Survivorship analysis and clinical outcome of one hundred cases[J].J Bone Joint Surg(Am),2005,87(4):715-724.
[12] Kurth TB,Dell’accio F,Crouch V,et al.Functional mesen⁃chymal stem cell niches in adult mouse knee joint synovium in vivo[J].Arthritis Rheum,2011,63(5):1289-1300.
[13] Kon E,Chiari C,Marcacci M,et al.Tissue engineering forto⁃tal meniscal substitution:Animal study in sheep model[J].Tis⁃sue Eng Part A,2008,14:1067-1080.
[14] 苑志国,刘舒云,张勇.一种双相半月板支架修复兔内侧半月板缺失的实验研究[J].中华关节外科杂志(电子版),2016,10(1):61-67.
[15] Mow VC,Arnoczky SP,Jackson DW,et al.Knee Meniscus:Basic and Clinical Foundations.New York,NY:Raven Press;1992:15-28.
[16] Arnoczky S.Meniscus in injury and repair of the musculoskel⁃etal soft tissues[J].Clinical Orthopaedics and Related Re⁃search,1999,367(Supple):487-537.
[17] Murakami R.Immunohistochemical and immunoblot analyses of collagens in the developing fibrocartilage in the glans penis of the rat[J].Acta morphologica Neerlando-scandinavica,1987,25:279-282.
[18] Eyre DR,Wu JJ.Collagen of fibrocartilage:A distinctive mo⁃lecular phenotype in bovine meniscus[J].FEBS Lett,1983,158:265-270.
[19] McDevitt CA,WebberRJ.The ultrastructure and biochemistry of meniscal cartilage[J].ClinOrthop,1990,252:8-18.
[20] Cheung HS.Distribution of type I,II,III and V in the pepsin solubilized collagens in bovine menisci[J].Connect Tissue Res,1987,16(4):343-356.
[21] Jiang D,Zhao LH,Tian M,et al.Meniscus transplantation us⁃ing treated xenogeneic meniscaltissue:viability and chondro⁃protection study in rabbits[J].Arthroscopy,2012,28(8):1147-1159.
[22] 余家阔,谢兴,张继英,等.异种异体和同种异体半月板移植修复兔膝关节半月板缺失的预后研究[J].中国运动医学杂志,2004,23(6):604-608.
[23] 康晓琪.兔同种异体和自体半月板移植的实验研究.中国人民解放军军医进修学院;中国人民解放军总医院.2009.
[24] 张晋,陈星佐,宋关阳,等.不同辐照剂量下同种异体半月板移植的大体和组织学研究[J].中国运动医学杂志,2016,35(1):11-16.
[25] Milachowki KA,Weismeier K,Wirth CJ,et al.Meniscus trans⁃plantation and anterior cruciate ligament replacement-results 2-4 years postoperatively[J].Sport verletz Sports chaden,1990,4(2):73-78.
[26] SohnDH,Toth AP.Meniscus transplantation[J].J Knee Surg,2008,21(2):163-172.
[27] 李学金,李群,张知博,等.兔同种异体新鲜半月板移植的实验观察[J].中国运动医学杂志,2009,28(6):686-688.
[28] Kelly BT,Potter HG,Deng XH,et al.Meniscal allograft trans⁃plantation in the sheep knee:evaluation of chondroprotective effects[J].Am J Sports Med,2006,34:1464-1477.
[29] Szomor ZL,Martin TE,Bonar F,et al.The protective effects of meniscal transplantation on cartilage.An experimental study in sheep[J].J Bone Joint Surg Am,2000,82:80-88.
[30] VerdonkR.Alternative treatment for meniscal injuries[J].J Bone J Surg(Br),1997,79(5):866-873.
[31] Khoury Ma,Goldberg VM,Stevenson S.Demonstration of HLA and ABH antigens in fresh and frozen human menisciby immu⁃nohisto chemistry[J].J OrthopRes,1994,12:751-757.
[32]Van Ankle ER,De Boer HH.Survival analysis of human me⁃niscus transplantation[J].J Bone Joint Surg(Br),2002,84(2)227-231.
[33] Rijk PC,Tigchelaar-Gutter W,Bernoski FP,et al.Histologic changes in articular cartilage after medial meniscus replace⁃ment in rabbits[J].Arthroscopy,2004,20:911-917.
[34] Rijk PC,Tigchelaar-Gutter W,Bernoski FP,et al.Functional changes in articular cartilage after meniscal all ograft trans⁃plantation:a quantitative histochemical evaluation in rabbits [J].Arthroscopy,2006,22:152-158.
[35] Matava MJ.Meniscal allograft transplantation:a systematic re⁃view[J].Clin Orthop Relat Res,2007,455:142-157.
[36] 赵文志,陈维钧,云大真,等.同种异体新鲜半月板移植的实验研究[J].中国运动医学杂志,2001,20(4):375-377.
[37] Meyers MH,Chatterjee SN.steochondral transplantation[J].Surg Clin Noah Am,1978,58(2):429-434.
[38] Alford W,Cole BJ.The indications and technique for menis⁃cal transplant[J].Orthop Clin North Am,2005,36(4):469-484.
[39] Verma NN,Kolb E,Cole BJ,et al.The effects of medial meniscal transplantation techniques on intraarticular contact pressures[J].J Knee Surg,2008,21(1):20-26.
Macroscopic and Histological Evaluations of Allogeneic Fresh Meniscus Transplantation in Rabbits
Yang Yuping,Zhang Jiying,Duan Xiaoning,Hu Xiaoqing,Meng Qingyang,Liu Zhenlong,Shi Weili,Ao Yingfang
Institute of Sports Medicine,Peking University Third Hospital,Beijing 100191,China Corresponding Author:Ao Yingfang,Email:yingfang.ao@vip.sina.com
ObjectiveTo investigate the morphological transmutation of the allogeneic fresh meniscus trans⁃plantation in rabbits.MethodsTwelve adult New Zealand white rabbits were divided into 3 groups according to the time they were executed after transplantation:6 weeks,12 weeks and 24 weeks,each of 4.Every two rabbits underwent surgery at the same time to exchange the medial meniscus on the experimental side.The allogeneic fresh medial meniscus transplantation was thus performed.Then they were killed to get the meniscus.The heal⁃ing of the meniscus was observed and histological examination was conducted using HE staining and Sirius red staining.ResultsSix weeks after the transplantation,the transplanted meniscus and its surrounding issues healed well.In both the 12-week and the 24-week groups,50%of the menisci showed visible shrinkage and ma⁃trix loose.There were foreign body reactions in all 3 groups,such as vascular proliferation,fibrosis and lympho⁃cyte infiltration.Sirius red staining demonstrated that,in the 6-week-group typeⅢcollagen accounted for less than one third in 75%of the specimens;it accounted for between one-third and two-thirds in 50%of the speci⁃mens in the 12-week-group;in the 24-week-group,it occupied two thirds.Twenty-five percent of the collagen in the 6-week-group had a small amount of collagen fiber loose;in the 12-week-group,all had a small amount of collagen fiber loose mainly in the central part;in the 24-week-group 50%had a large amount of collagen fi⁃ber loose,covering the whole region.There were significant differences among the three groups(P<0.05).ConclusionSix weeks after transplantation of the fresh allograft meniscus,although with obvious foreign body reac⁃tion,the healing ability was good.50%of the menisci showed visible shrinkage and matrix loose at 12 weeks and 24 weeks.The internal collagen fiber transformed gradually from typeⅠcollagen to typeⅢcollagen.The change starts from the central region,expanding gradually.Subsequently it weakens connective tissue structure of the graft and may ultimately lead to transplantation failure.
allograft,meniscus,transplantation,collagen,histology
2016.10.14
敖英芳,Email:yingfang.ao@vip.sina.com
