聚唾液酸衍生物/泊洛沙姆407混合胶束中多西他赛的含量测定
2017-01-16郑锦辉宋艳志邓意辉
郑锦辉,骆 翔,宋艳志,邓意辉
聚唾液酸衍生物/泊洛沙姆407混合胶束中多西他赛的含量测定
郑锦辉,骆 翔,宋艳志,邓意辉*
(沈阳药科大学药学院,辽宁沈阳 110016)
目的建立聚唾液酸衍生物P-G/泊洛沙姆407混合胶束中多西他赛含量的测定方法。方法采用溶剂法处理样品,并用HPLC法测定混合胶束中多西他赛的含量。色谱柱为Hypersil BDS C18柱(200 mm×4.6 mm,5 μm),检测波长为230 nm,流动相为乙腈-水(体积比55∶45),流速为1.0 mL·min-1,柱温30 ℃。结果体积分数为55%乙腈水溶液可完全破坏混合胶束且多西他赛回收率较高;空白胶束载体材料与多西他赛峰分离度良好,对多西他赛含量测定无干扰;多西他赛质量浓度在0.98~117.60 mg·L-1内线性关系良好,=0.999 8;日内、日间精密度RSD均小于2.0%;低、中、高3种质量浓度样品回收率均在95%~105%内,平均回收率为98.4%,RSD小于2.0%。结论该方法可用于混合胶束中多西他赛的含量测定。
药剂学;含量测定;高效液相色谱法;多西他赛;聚唾液酸衍生物;泊洛沙姆407
多西他赛(docetaxel,DTX)又称多西紫杉醇(化学结构式见图1),是由法国罗纳普朗克·乐安公司开发的第二代紫杉烷类抗肿瘤药[1],其作用机制是通过与细胞内的微管结合、稳定并防止其解聚,将细胞阻滞于G2/M期,从而导致细胞凋亡。与第一代紫杉烷类药物紫杉醇相比,其抗癌活性提高了1.3~12倍[2],被认为是临床应用中最有效的化疗药[3]。目前,主要应用于乳腺癌、非小细胞肺癌、胃癌、头颈癌、胰腺癌、软组织肉瘤、卵巢癌以及前列腺癌等多种癌症的治疗[4]。
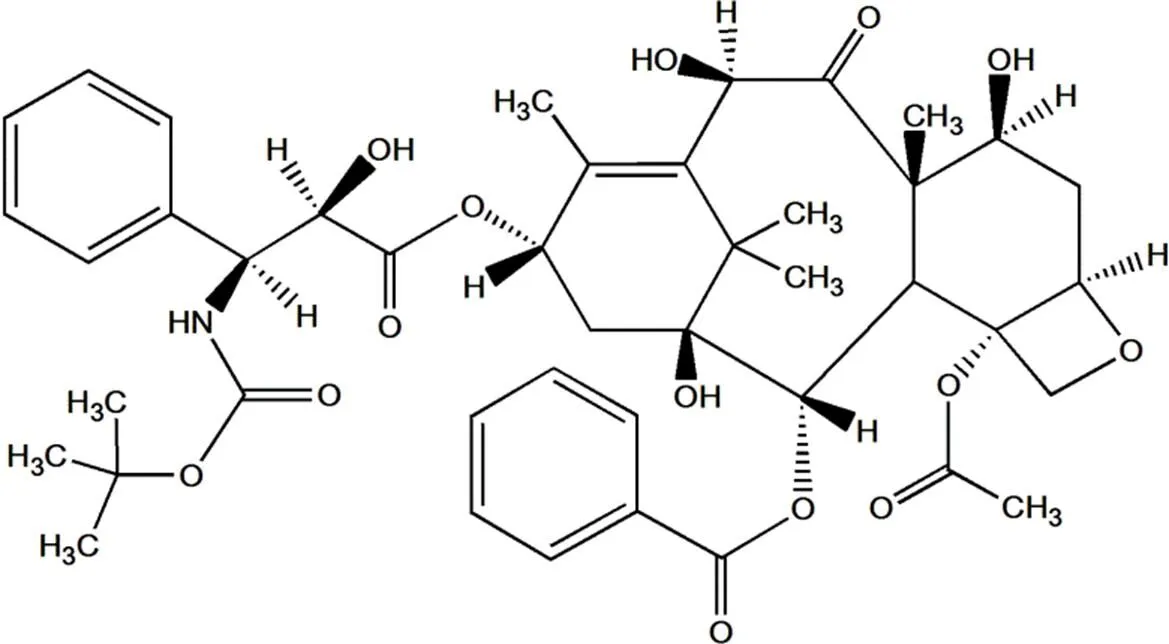
Fig. 1 Chemical structure of docetaxel
图1多西他赛化学结构式
由于DTX水溶性较差,目前上市制剂采用吐温80对其增溶,但吐温80易引起患者产生过敏、神经毒性和肾毒性等不良反应,因此有必要开发新的剂型[5]。
近年来,两亲性聚合物胶束以其独特的结构和性质在难溶性药物増溶及肿瘤药物靶向递送方面取得了显著进展。聚合物胶束通常粒径较小(一般10~100 nm),外壳具有柔韧性和亲水性,能够有效避免单核吞噬细胞系统的识别并借助实体瘤的高渗透长滞留(enhanced permeability and retention,EPR)效应达到被动靶向目的;另外,在聚合物胶束表面修饰唾液酸、甘露糖、叶酸等配体后,还可实现主动靶向功能[6-7]。
在胶束载体材料的选择方面,泊洛沙姆(Poloxamer)系列因其具有无毒、无免疫原性、生物相容性好等特点,受到广泛关注。泊洛沙姆由聚氧乙烯(poly (ethylene oxide),PEO)-聚氧丙烯(poly (propylene oxide), O)-聚氧乙烯(PEO)三嵌段构成,随着亲水EO(ethylene oxide,EO)链和疏水PO(propylene oxide,PO)链数目的不同,具有不同的亲水亲油平衡值(hydrophilic lipophilic balance,HLB)、临界胶束浓度(critical micelle concentration,CMC)和油水分配系数[8]。常见的泊洛沙姆型号包括Kolliphor®F 68(P188)、F87(P237)、F108(P338)和F127(P407),其中P188和P407以其较低的毒性已被收载入《美国药典》。与P188相比,P407的CMC值较低,更适用于胶束的制备[9-10]。
在靶向配基的选择方面,唾液酸及其衍生物具有独特的优势。实验室前期研究发现,唾液酸(sialic acid,SA)修饰的脂质体能够靶向小鼠S180 肿瘤,50%的荷瘤小鼠被治愈,并且2个月内不复发肿瘤[11]。但是由于该材料的亲水性较弱,制剂粒径较大,稳定性较差,因此,本课题组希望利用亲水性更好的聚唾液酸(polysialic acid,PSA)替代SA,首次合成了PSA两亲性衍生物(P-G),并将其修饰于P407胶束表面,以期同时实现肿瘤的被动和主动靶向功能。本文主要报道混合胶束样品的处理方法和含量测定的方法,为制剂的质量控制奠定基础。
1 仪器与材料
高效液相色谱仪(配有UV228紫外检测器、P230高压恒流泵,大连依利特分析仪器有限公司),HW-2000色谱数据处理工作站(大连依利特色谱有限公司),BS124s分析天平(德国Sartorius公司),Anke TDL80-2B台式离心机(上海安亭科学仪器厂),KQ5200B超声波清洗器(昆山超声仪器有限公司),FDU-110冻干机(日本东京理化器械股份有限公司),Hypersil BDS C18色谱柱(200 mm×4.6 mm,5 μm,大连依利特分析仪器有限公司)。
多西他赛(docetaxel,DTX,上海新先锋药业有限公司),泊洛沙姆407(Kolliphor® F 127,P 407,德国BASF公司),聚唾液酸衍生物(P-G,实验室自制),无水乙醇(分析纯,天津富宇精细化工有限公司),甲醇(色谱纯,天津大茂化学试剂厂),乙睛(色谱纯,美国Sigma公司),,-二甲基甲酰胺(DMF,分析纯,天津博迪化工股份有限公司),二甲基亚砜(DMSO,分析纯,天津大茂化学试剂厂),试验用水为二次蒸馏水。
2 方法与结果
2.1 DTX混合胶束样品处理方法的研究与确定
2.1.1 样品处理溶剂的选择
用乙腈、甲醇、DMSO、DMF、体积分数为55%的乙腈水溶液(流动相)作为破坏溶剂,分别考察溶解现象、色谱峰形及DTX的回收率。
对照溶液:精密称取DTX原料药适量,用流动相稀释制成质量浓度为192 mg·L-1的DTX溶液,作为对照溶液。
样品溶液:精密称取DTX混合胶束冻干内容物适量,分别加入乙腈、甲醇、DMF、DMSO、体积分数为55%乙腈水溶液各1 mL,涡旋3 min,1×104r·min-1离心10 min。将所得到的上清液分别用流动相稀释至质量浓度为52、52、30、30和104 mg·L-1的DTX溶液,进样检测,结果见表1和图2。
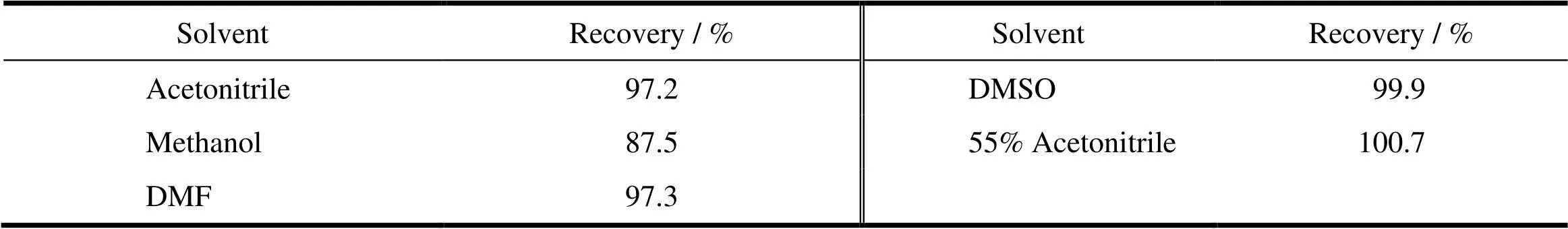
Table 1 DTX recoveries in different solvents
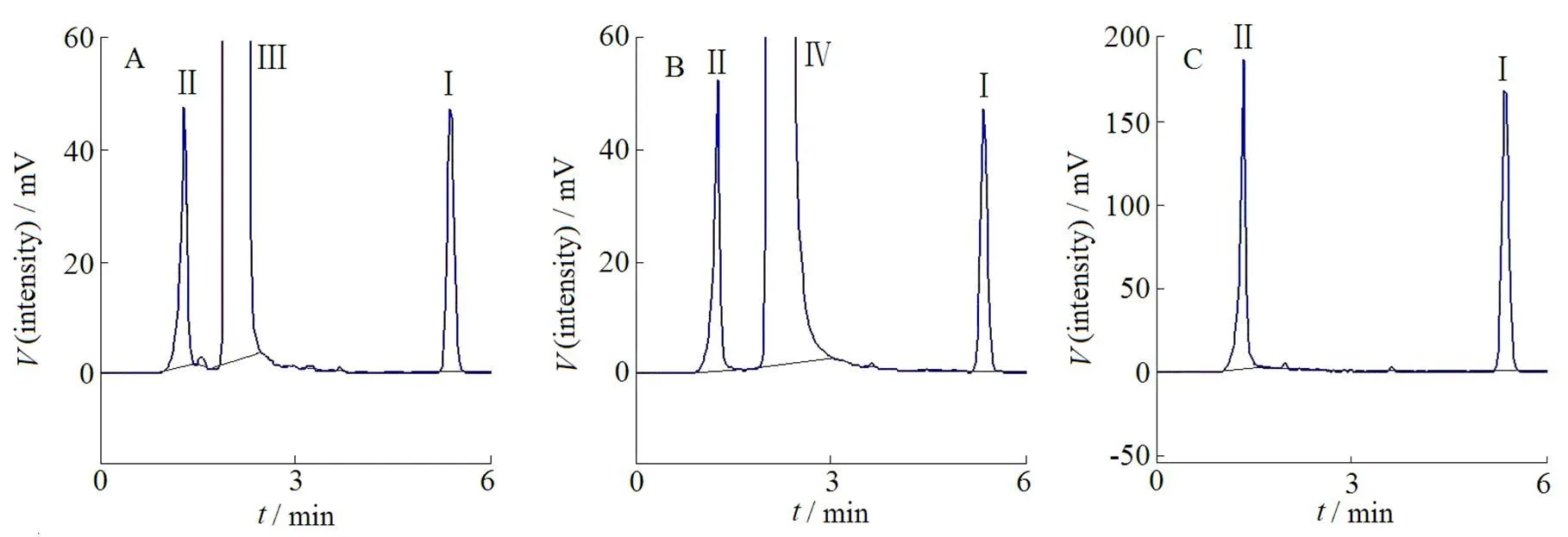
Ⅰ—DTX;Ⅱ—P-G; Ⅲ—DMSO; Ⅳ—DMF
结果表明:混合胶束在乙腈和甲醇溶液中出现白色絮状不溶物,而在DMSO、DMF和体积分数55%乙腈水溶液中可形成均一透明溶液,图2中峰形结果显示3种溶剂中DTX峰形均较好;回收率结果表明,DTX除在甲醇中回收率较低外,在其他4种溶剂中回收率均大于95%,而在DMSO和体积分数55%乙腈水溶液中有相对更好的回收率。综合考虑,选择体积分数55%乙腈水溶液作为破坏溶剂。
2.1.2 溶剂比例的考察
对照溶液:精密称取DTX原料药适量,用流动相稀释制成质量浓度为0.1 g·L-1的DTX溶液,作为对照溶液。
样品溶液:精密量取DTX混合胶束溶液适量,分别加入体积分数35%、45%、55%和75%乙腈水溶液各1 mL,涡旋3 min,1×104r·min-1离心10 min。所得到上清液分别用各溶剂稀释至质量浓度为99 mg·L-1的DTX溶液,进样检测,结果见表2。
结果表明,虽然DTX在体积分数35%乙腈水溶液中回收率略低,但在其余各浓度乙腈水溶液中回收率均大于95%,且4种溶剂中总RSD为2.8%,小于5%,表明乙腈浓度对DTX回收率影响不大。

Table 2 DTX recoveries in different concentrations of acetonitrile
2.1.3 样品处理条件的考察
对照溶液:精密称取DTX原料药适量,用流动相稀释制成质量浓度为0.1 g·L-1的DTX溶液,作为对照溶液。
涡旋时间考察:精密称取DTX混合胶束冻干品适量,加入流动相1 mL,分别涡旋1、3和5 min,再1×104r·min-1离心10 min。将所得到的上清液分别用流动相稀释至质量浓度约为0.1 g·L-1的DTX溶液,进样检测,结果见表3。
离心时间考察:精密称取DTX混合胶束冻干品适量,加入流动相1 mL,涡旋3 min后,1×104r·min-1下分别离心10、15和20 min。将所得到的上清液分别用流动相稀释至质量浓度约为0.1 g·L-1的DTX溶液,进样检测,结果见表3。
结果显示,DTX回收率随涡旋时间的延长而增大,与离心时间增长无明显趋势。另外,仅涡旋时间为1 min时回收率小于95%,其他条件下回收率均大于95%。因此,选则涡旋3 min和1×104r·min-1离心10 min作为样品的处理条件。

Table 3 DTX recoveries under different centrifugation conditions
2.2 混合胶束含量测定方法的建立
2.2.1 溶液配制
对照溶液:取DTX原料药约10 mg,精密称定。置于10 mL量瓶中,加入无水乙醇溶解并稀释至刻度,摇匀,作为对照储备液。精密量取对照储备液1 mL,置于10 mL量瓶中,用流动相稀释至刻度,摇匀,即得质量浓度为0.1 g·L-1的DTX对照溶液。
供试溶液:取DTX混合胶束冻干品约61 mg,约含DTX 1 mg,精密称定。加入体积分数55%乙腈水溶液1 mL使其溶解,涡旋3 min,1×104r·min-1离心10 min,取上清液作为供试储备液。精密量取供试储备液0.5 mL,置于5 mL量瓶中,加流动相稀释至刻度,摇匀,即得供试溶液。
物理混合溶液:按处方量称取胶束载体材料及DTX,直接用体积分数55%乙腈水溶液溶解制成质量浓度约为1 g·L-1的DTX溶液。精密量取上述溶液0.5 mL,置于5 mL量瓶中,加流动相稀释至刻度,摇匀,即得物理混合溶液。
空白溶液:精密称取不含DTX的空白混合胶束60 mg,按供试溶液配制方法配制。
2.2.2 色谱条件
色谱柱:Hypersil BDS C18柱(200 mm×4.6 mm,5 μm);流动相:体积分数55%乙腈水溶液;柱温:30 ℃;流速:1.0 mL·min-1;检测波长:230 nm;进样量:20 μL。
2.2.3 检测波长的确定
按“2.2.1”条方法配制对照溶液。精密量取对照溶液1.2 mL,置于10 mL量瓶中,用流动相稀释制成12 mg·L-1的溶液。取此溶液20 μL,在波长200~400 nm内进行紫外扫描,DTX的最大吸收波长为230 nm。
2.2.4 专属性试验
按“2.2.1”条方法配制对照溶液、空白溶液、物理混合溶液。取流动相、对照溶液、空白溶液和物理混合溶液,按“2.2.2”条色谱条件进样分析,记录色谱图(图3)。空白胶束载体材料与DTX峰分离度为4.8,分离度良好,不干扰DTX的含量测定。

Ⅰ—Carrier materials in blank micelles ;Ⅱ—Docetaxel
2.2.5 线性关系考察
精密称取DTX原料药9.8 mg,置于10 mL量瓶中,用无水乙醇溶解并稀释至刻度,摇匀作为DTX储备液。分别精密移取DTX储备液适量,用流动相稀释或逐级稀释,制成质量浓度分别为0.98、9.80、29.40、58.80、78.40、98.0和117.60 mg·L-1的DTX溶液,按“2.2.2”条色谱条件进样检测。以DTX峰面积()对质量浓度()进行线性回归,得回归方程:=1.386 8×104- 2.760 9×103,=0.999 8。结果表明,DTX质量浓度在0.98~117.60 mg·L-1内与峰面积呈良好的线性关系。
2.2.6 检测限与定量限的确定
量取“2.2.5”条下的DTX储备液,用流动相逐级稀释,至其所记录的色谱图中信号噪音比值(/)为3和10,分别为定量限和检测限。经计算,DTX的定量限和检测限分别为19.6 ng和6.9 ng。
2.2.7 精密度试验
日内精密度:称取DTX混合胶束冻干品适量,按“2.2.1”条方法分别配置对照溶液及6份供试溶液。按“2.2.2”条色谱条件,同日内进样检测,外标法计算含量。结果显示,6份样品检测平均含量为97.5%,RSD为0.4%,小于2.0%,表明该方法日内精密度良好。
日间精密度:每日称取DTX混合胶束冻干品适量,按“2.2.1”条方法分别配置对照溶液及供试溶液。按“2.2.2”色谱条件,连续进样6 d,外标法计算含量。结果显示,6次检测平均含量为97.3%,RSD为1.0%,小于2.0%,表明该方法日间精密度良好。
2.2.8 回收率试验
精密量取“2.2.1”条中对照溶液0.5、7.5和1.0 mL,分别置于10 mL量瓶中,再分别加入空白胶束溶液1.0 mL,用流动相稀释至刻度,制成低(约50 mg·L-1)、中(约75 mg·L-1)和高(约100 mg·L-1)3种质量浓度的DTX供试溶液,每个质量浓度平行配制3份。按“2.2.2”条色谱条件对上述样品进样分析,记录色谱图,计算回收率,结果见表4。高、中、低3种质量浓度的样品回收率均在95%~105%内,平均回收率为98.4%,RSD为1.9%,小于2.0%,回收率符合要求。
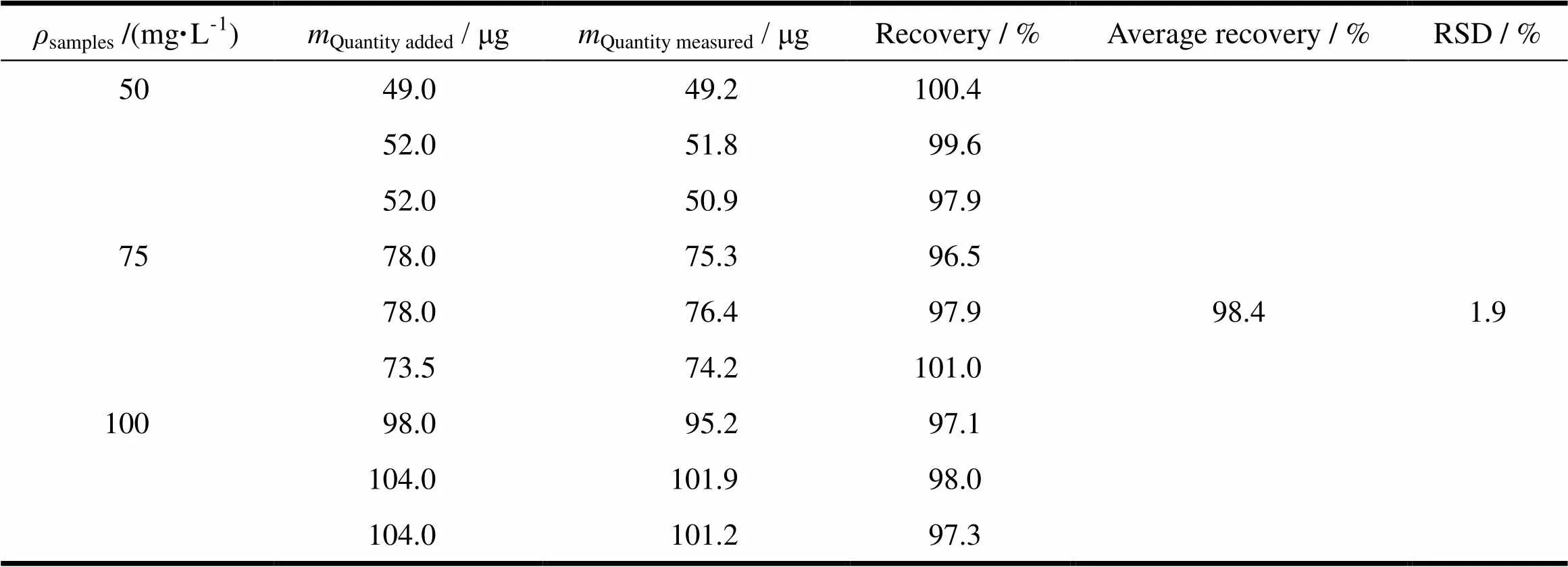
Table 4 Recoveries of DTX
2.2.9 稳定性试验
称取混合胶束适量,按“2.2.1”条方法配制供试溶液,室温放置,分别于0、6、14、24和36 h进样分析,记录色谱图,计算RSD。经计算,峰面积的RSD为1.4%,小于2.0%,表明供试溶液在室温条件下36 h内稳定性良好。
2.2.10 DTX混合胶束含量测定
取3批DTX混合胶束冻干样品,按“2.2.1”条方法配制对照溶液和3批混合胶束的供试溶液,分别进样分析,记录色谱图,外标法计算含量。3批样品的含量分别为100.0%、99.2%和97.3%。
3 讨论
3.1 混合胶束供试品处理方法的选择
由于DTX包裹入混合胶束的疏水内核中,所以在含量测定前,需要对胶束进行破坏。根据载体材料和DTX的溶解特性,作者尝试了乙腈、甲醇、DMSO、DMF和体积分数55%乙腈水溶液作为破坏溶剂。在5种溶剂中,乙腈和甲醇不能完全破坏胶束,溶液中出现白色絮状不溶物;DMSO、DMF、体积分数55%乙腈水溶液可完全破坏胶束,溶液均一透明。但HPLC色谱图显示,DMSO和DMF处理的样品,2 min左右出现较大溶剂峰(图2),虽对DTX检测无干扰,但样品中DMSO、DMF溶剂浓度过大容易损伤色谱柱;而体积分数55%乙腈水溶液无溶剂峰,且DTX峰形较好,因此最终选择体积分数55%乙腈水溶液作为破坏溶剂。
3.2 色谱条件的选择
DTX含量测定方法的文献虽有一些报道,其中纳米制剂中DTX的含量测定方法[12-15]主要采用以有机相体积分数在65%~75%内为流动相的HPLC法检测,但本品在乙腈-水体积比为65∶35条件下检测时发现,载体材料P-G 对DTX的检测会产生干扰,故在此基础上对流动相比例进行调整,当调整乙腈-水体积比为55∶45时,载体材料P-G对DTX检测无干扰,且保留时间为5.3 min,检测时间比较合理。
[1] 王丽丽, 侯建玲, 孙晓利, 等. 多西他赛纳米制剂的研究进展[J]. 中国新药与临床杂志, 2010, 29(10): 721-727.
[2] 于克炜, 刘志红, 张娜. 多西他赛PluronicF68聚合物胶束的制备与体外评价[J]. 山东大学学报, 2011, 49(11): 156-160.
[3] ZHAO P, ASTRUC D. Docetaxel nanotechnology in anticancer therapy[J]. Chem Med Chem, 2012, 7(6): 952-972.
[4] SWEETMAN S C. Martindale: The Complete Drug Reference[M]. 36th Ed. London: Pharmaceutical Press, 2009: 710-713.
[5] CLARKE S J, RIVORY L P. Clinical pharmacokinetics of docetaxel[J]. Clinical Pharmacokinetics, 1999, 36(2): 99-114.
[6] MAHMUD A, XIONG X B, ALIABADI H M, et al. Polymeric micelles for drug targeting[J]. Journal of Drug Targeting, 2007, 15(9): 553-584.
[7] KEDAR U, PHUTANE P, SHIDHAYE S, et al. Advances in polymeric micelles for drug delivery and tumor targeting[J]. Nanomedicine : NBM, 2010, 6: 714-729.
[8] 刘雯, 李娟. 泊洛沙姆混合胶束的研究进展[J]. 亚太传统医药, 2012, 8(8): 216-218.
[9] LIU Liwei, YONG K T, ROY I, et al. Bioconjugated pluronic triblock-copolymer micelle-encapsulated quantum dots for targeted imaging of cancer:andstudies[J]. Theranostics, 2012, 2(7): 705-713.
[10] HHHESCOBAR-CHÁVEZ J JHHH, HHHLÓPEZ-CERVANTES MHHH, HHHNAÏK AHHH, et al. Applications of thermo-reversible pluronic F-127 gels in pharmaceutical formulations[J]. J Pharm Pharmaceut Sci, 2006, 9(3): 339-358.
[11] SHE Zhennan, ZHANG Ting, WANG Xuling, et al. The anticancer efficacy of pixantrone-loaded liposomes decorated with sialic acideoctadecylamine conjugate[J]. Biomaterials, 2014, 35: 5216-5225.
[12] 邹瑜, 王淑君, 王思玲, 等. RP-HPLC法测定多西他赛固体脂质纳米粒中多西他赛的含量[J]. 沈阳药科大学学报, 2007, 11: 700-702.
[13] 杨秀丽, 蒲道俊, 余春梅, 等. 高效液相色谱法测定多西他赛注射液的含量和有关物质[J]. 中国医药指南, 2012, 18: 77-78.
[14] 胡波, 周郁斌, 杨艳, 等. 超滤-HPLC法测定注射用多西他赛脂质体的含量和包封率[J]. 广东药学院学报, 2012, 02: 132-134.
[15] 于克炜. 多西他赛聚合物胶束的研究[D]. 济南: 山东大学, 2012: 10-11.
(本篇责任编辑:赵桂芝)
Determination of docetaxel in mixed micelle of a polysialic acid derivative (P-G) and poloxamer 407
ZHENG Jinhui, LUO Xiang, SONG Yanzhi, DENG Yihui*
()
ObjectiveTo establish a method for determination of the content of docetaxel in polysialic acid derivatives P-G and poloxamer 407 mixed micelles.Methods AHPLC method was applied to determinate the docetaxel loaded in micelles. The separation was achieved on the Hypersil BDS CB18Bcolumn (200 mm × 4.6 mm, 5 μm). The Mobile phase consisted of acetonitrile-water (∶= 55∶45) at a flow rate of 1.0 mL·min-1and the detection wavelength was set at 230 nm. The column temperature was kept at 30℃.Results The micelles were dissolved in 55% acetonitrile to destroy the micellar structure and dissociate docetaxel from mixed micelles. Docetaxel and carrier materials of micelles could be well separated. A good linear relationship was achieved for docetaxel in the range of 0.98~117.60 mg·L-1,=0.999 8; the intra-day and inter-day precision RSD were less than 2.0%; The recoveries were between 95% and 105%. The average recovery was 98.4% and RSD less than 2.0%.ConclusionThis method can be used for the determination of docetaxel loaded in the mixed micelles.
pharmaceutics; mixed micelles; content determination; docetaxel; polysialic acid derivatives; poloxamer 407
(2016)03–0099–08
10.14146/j.cnki.cjp.2016.03.004
R94
A
2015-10-28
国家自然科学基金资助项目(81373334)
郑锦辉(1977-), 女(汉族), 辽宁盘锦人, 硕士研究生, E-mail zhengjinh@126.com;
邓意辉(1964-), 男(汉族), 湖南花坦人, 教授, 博士, 博士生导师, 主要从事药物靶向新剂型的研究, Tel. 024-23986316, E-mail dds-666@163.com。
