唾液酸修饰的地塞米松棕榈酸酯脂质体抗小鼠体内S180肿瘤作用的研究
2017-01-16黄振君宋艳志邓意辉
黄振君,李 宣,宋艳志,李 静,孙 晶,邓意辉
唾液酸修饰的地塞米松棕榈酸酯脂质体抗小鼠体内S180肿瘤作用的研究
黄振君,李 宣,宋艳志,李 静,孙 晶,邓意辉*
(沈阳药科大学药学院,辽宁沈阳 110016)
目的 将糖皮质激素(glucocorticoids,GC)靶向递送至肿瘤微环境,并抑制其中的炎性反应以实现肿瘤治疗。方法制备唾液酸(sialic acid,SA)修饰的GC类药物地塞米松棕榈酸酯脂质体,使用小鼠S180肉瘤模型,以质量分数5%葡萄糖、非靶向的乳剂和脂质体为对照,采用多个参数综合评价不同剂量SA修饰脂质体的体内抗肿瘤作用。结果非靶向乳剂和脂质体均具有一定的肿瘤抑制作用,而SA修饰的脂质体抗肿瘤疗效更优。不同剂量靶向脂质体的肿瘤治疗作用以5.0 mg·kg-1为最佳。该组的肿瘤体积抑瘤率为(83.4 ± 4.0)%,肿瘤曲线下面积抑瘤率为79.9%,试验期内小鼠生存率为83.3%。结论利用GC抗炎活性能发挥较好的肿瘤治疗作用,而肿瘤微环境和机体免疫系统是其中的两个关键因素。
药剂学;靶向脂质体;机体免疫系统;糖皮质激素;抗炎作用;肿瘤微环境
在过往的数百年中,随着人们对肿瘤认识的加深,肿瘤的治疗策略也取得了一定进展[1]。虽然目前临床形势不容乐观,但人们从未放弃对根本解决肿瘤问题的执着追求。近年来,研究者们已经逐渐将目光聚焦到与肿瘤密切相关的微环境上[2]。文献报道,肿瘤微环境一旦形成,便伴随着大量炎性相关因子的产生[3]。众多免疫细胞亦趋化而至,它们大部分是肿瘤生长的“帮凶”,甚至是主导者[3-5]。值得注意的是,肿瘤微环境与炎症部位的免疫细胞类型几乎一致,表明肿瘤与炎症关系密切[3, 6]。基于以上认识,作者提出,干预肿瘤部位炎性反应将成为极具潜力的肿瘤治疗手段。
糖皮质激素(glucocorticoids,GC)作为抗炎药物已有超过半个世纪的临床应用历史[7]。近年来,将GC包封进入长循环脂质体中用于肿瘤治疗的研究取得了一定进展[8-10]。但在临床上,GC的应用局限于肿瘤的辅助治疗[7]。究其原因,GC不仅是一个抗炎药物,还是一个强烈的免疫抑制剂;它不仅抑制了肿瘤微环境的炎性反应,还制约了机体免疫系统正常功能的发挥。该事实表明,机体免疫系统在肿瘤治疗中发挥着不可缺少的作用。因此,使用GC治疗肿瘤时应减少其对机体免疫系统功能的干扰。在此方面,靶向药物递送系统的应用或能奏效。本课题组前期研究表明,唾液酸(sialic acid,SA)修饰的马来酸匹杉琼脂质体靶向于肿瘤微环境中的肿瘤相关巨噬细胞(tumor associated macrophages,TAMs),不仅获得了良好的抗肿瘤疗效,且试验动物的生存质量得到保障[11]。基于以上成果,作者在本研究中使用SA修饰的靶向脂质体包载GC类药物地塞米松棕榈酸酯(dexamethasone palmitate,DMP),采用免疫功能正常的小鼠建立S180肿瘤模型,考察SA修饰DMP脂质体的体内抗肿瘤效应,并探究抑制肿瘤微环境炎性反应与保全机体免疫系统在肿瘤治疗中的重要作用,以期为肿瘤靶向药物递送及肿瘤免疫疗法提供新思路。
1 仪器与材料
DF-101S集热式恒温加热磁力搅拌器(巩义英峪予华仪器厂),JY92-2D超声波细胞粉碎机(宁波新芝科器研究所),NICOMP-380激光粒度测定仪(美国Particle Sizing Systems公司),BS124s电子分析天平(德国Sartorius公司),聚碳酸酯膜(上海豪夏科技有限公司),XDS-1B倒置显微镜(重庆光电仪器有限公司)。
唾液酸-十八胺(sialic acid-octadecylamine,SA-ODA,自制),地塞米松棕榈酸酯(自制),氢化大豆磷脂(hydrogenated soybean phosphatidylacholine,HSPC,德国Lucas Meyer公司),胆固醇(cholesterol,CH,南京新百药业有限公司),二硬脂酰磷脂酰乙醇胺-聚乙二醇(2000)单甲醚(-(carbonyl-methoxy polyethylene glycol-2000)-1,2-distearoyl- sn-glycero-3-phosphoethanol- amine,DSPE-PEG2000,美国Genzyme公司),利美达松®地塞米松棕榈酸酯注射液(韩国 Mitsubishi Tanabe Pharma公司),质量分数5%葡萄糖注射液(山东辰欣药业有限公司),灭菌注射用水(石家庄石药集团有限公司),其余试剂(分析纯,市售)。
小鼠肉瘤S180细胞株(中国医科大学)。昆明种小鼠,体质量18~22 g,雄性,沈阳药科大学实验动物中心提供,合格证号 211002300002467。
2 方法与结果
2.1 DMP脂质体的制备
按表1处方称取脂质体膜材及药物DMP置于10 mL西林瓶中,以处方量体积10%的无水乙醇于65 ℃水浴搅拌溶解。待膜材及药物溶解后,敞开体系,继续搅拌,以挥除大部分无水乙醇。将预热至相同温度的200 mmol·L-1柠檬酸-柠檬酸钠溶液(pH值4.0)以4 mL· min-1的速度注入膜材中。65 ℃水浴搅拌20 min,得到脂质体初品。将初品探头超声,超声功率和时间为200 W 2 min 、400 W 4 min,然后依次通过0.80、0.45和0.22 µm微孔滤膜,即得非靶向的DMP脂质体(non-targeted DMP liposome,NT-DMP-L)及SA修饰的DMP靶向脂质体(SA-modified DMP liposome,SA-DMP-L)混悬液(含DMP 2.5 g·L-1)。

Table 1 Compositions of liposomal DMPs
将NT-DMP-L以及SA-DMP-L以蒸馏水稀释至适宜浓度后,动态光散射法测定脂质体的平均粒径,测定波长为632.8 nm,测定角为90°。结果NT-DMP-L和SA-DMP-L的平均粒径分别为(127.4 ± 3.2)nm和(120.3 ± 2.5)nm。
2.2 S180瘤株的接种
将液氮中保存的S180细胞冻存管取出后迅速置于37 ℃温水中复苏。将复苏的S180细胞悬液接种于小鼠腹腔内,每只0.2 mL,7 d后,无菌条件下抽取腹水。于倒置显微镜下计数,肿瘤细胞活度大于95%,加生理盐水稀释成细胞混悬液,调整稀释倍数使混悬液的肿瘤细胞数为每毫升1.8×107个。将肿瘤细胞混悬液接种于正常小鼠右前腋窝的皮下组织,每只0.2 mL,共接种36只。
2.3 给药方案
将36只接种S180肿瘤的小鼠随机分为6组,每组6只。分别为对照组(control,质量分数5%葡萄糖注射液,10 mL·kg-1)、非靶向的利美达松市售乳剂组(NT-DMP-E,剂量为5.0 mg·kg-1DMP)、非靶向脂质体组(NT-DMP-L,剂量为5.0 mg·kg-1DMP)、靶向脂质体低剂量组(SA-DMP-L(l),2.5 mg·kg-1DMP)、靶向脂质体中剂量组(SA-DMP-L(m),5.0 mg·kg-1DMP)和靶向脂质体高剂量组(SA-DMP-L(h),10.0 mg·kg-1DMP)。各组小鼠均于肿瘤体积达到100 mm3后,即接种后第6天开始尾静脉注射给药,每3天1次,共给药4次(即接种后第6、9、12、15天)。治疗期间每天记录小鼠死亡情况,隔天称量小鼠体质量并测量肿瘤长径(a)和短径(b),计算肿瘤体积()。
2.4 评价指标
肿瘤体积(tumor volume,,mm3):=0.5´a´b2;
肿瘤生长曲线下面积(area under tumor growth curve,AUTGC,mm3·d):使用Graphpad Prism version 5.1软件的area under curve积分方法进行计算;
体积抑瘤率(tumor inhibition rate determined by tumor volume,TIRV,%):TIRV=(control groupBBBBBBB B-treated group)/control group´100%;
肿瘤生长曲线下面积抑瘤率(tumor inhibition rate determined by area under tumor growth curve,TIRAUTGC,%):TIRAUTGC=(control group-treated group)/control group´100%;
生存分析(survival analysis):使用Graphpad Prism version 5.1软件的Kaplan-Meier方法进行生存分析;
体质量(body mass,g)。
2.5 S180小鼠体内抗肿瘤效应综合评价
2.5.1肿瘤生长曲线的制备与肿瘤抑制率的测定
将各治疗组所记录的肿瘤体积对接种后天数作图,结果见图1、2。
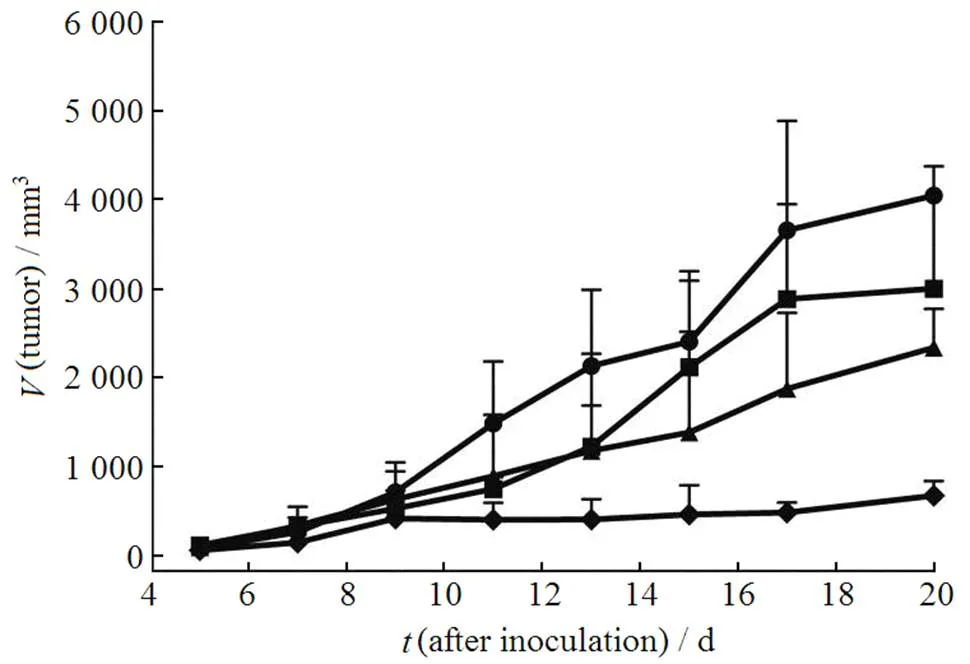
—Control; ¾—NT-DMP-E; p—NT-DMP-L; ¿—SA-DMP-L(m)
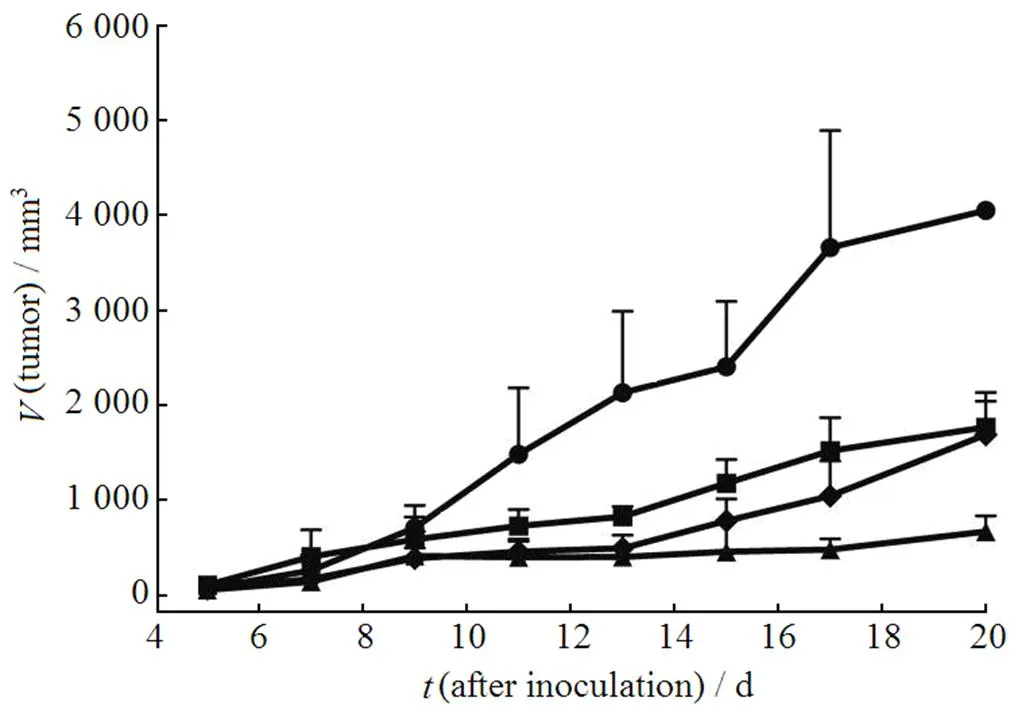
—Control; ¾—SA-DMP-L(l); p—SA-DMP-L(m); ¿—SA-DMP-L(h)
由图1可见,相比对照组,NT-DMP-E、NT-DMP-L和SA-DMP-L(m)治疗组能不同程度地抑制S180荷瘤小鼠的肿瘤生长。其肿瘤抑制作用强弱顺序为:SA-DMP-L(m) > NT-DMP-L > NT-DMP-E,说明DMP脂质体的抗肿瘤效应要优于DMP乳剂,且SA的修饰能显著提高该脂质体的肿瘤抑制活性(< 0.05)。图2则进一步反映了SA-DMP-L抗肿瘤作用的量效关系。3个给药剂量中,给药剂量为5.0 mg·kg-1的SA-DMP-L(m)组肿瘤疗效最佳。后两者抗肿瘤作用强弱顺序为:SA-DMP-L(h) > SA-DMP-L(l),但这种优势随着时间延长逐渐减弱。第15天后SA-DMP-L(h)组平均肿瘤体积开始较快速地增长,至第20天时,与SA-DMP-L(l)组平均肿瘤体积相当。具体的肿瘤抑制率数据见表2。
Table 2 Tumor inhibition rates of S180-bearing mice treated with DMP formulations. (Data were presented as (±s, n=1-6)
表2 地塞米松棕榈酸酯脂质体治疗的S180荷瘤小鼠肿瘤抑制率(±s, n=1~6)
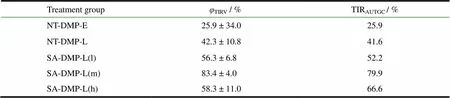
Table 2 Tumor inhibition rates of S180-bearing mice treated with DMP formulations. (Data were presented as (±s, n=1-6)
Treatment groupφTIRV / %TIRAUTGC / % NT-DMP-E25.9 ± 34.025.9 NT-DMP-L42.3 ± 10.841.6 SA-DMP-L(l)56.3 ± 6.852.2 SA-DMP-L(m)83.4 ± 4.079.9 SA-DMP-L(h)58.3 ± 11.066.6
由表2可知,无论是以体积抑瘤率计还是以肿瘤生长曲线下面积抑瘤率计,各给药组的肿瘤抑制率大小顺序均为:SA-DMP-L(m) > SADMP-L(h) > SA-DMP-L(l) > NT-DMP-L > NT-DMP-E。然而,以体积抑瘤率评价时,SA-DMP-L(h)组相比SA-DMP-L(l)组的优势并不明显;而以肿瘤生长曲线下面积抑瘤率评价时,SA-DMP-L(h) 优于SA-DMP-L(l)。
2.5.2 生存分析
将各治疗组所记录的小鼠生存率对接种后天数作图,结果见图3。
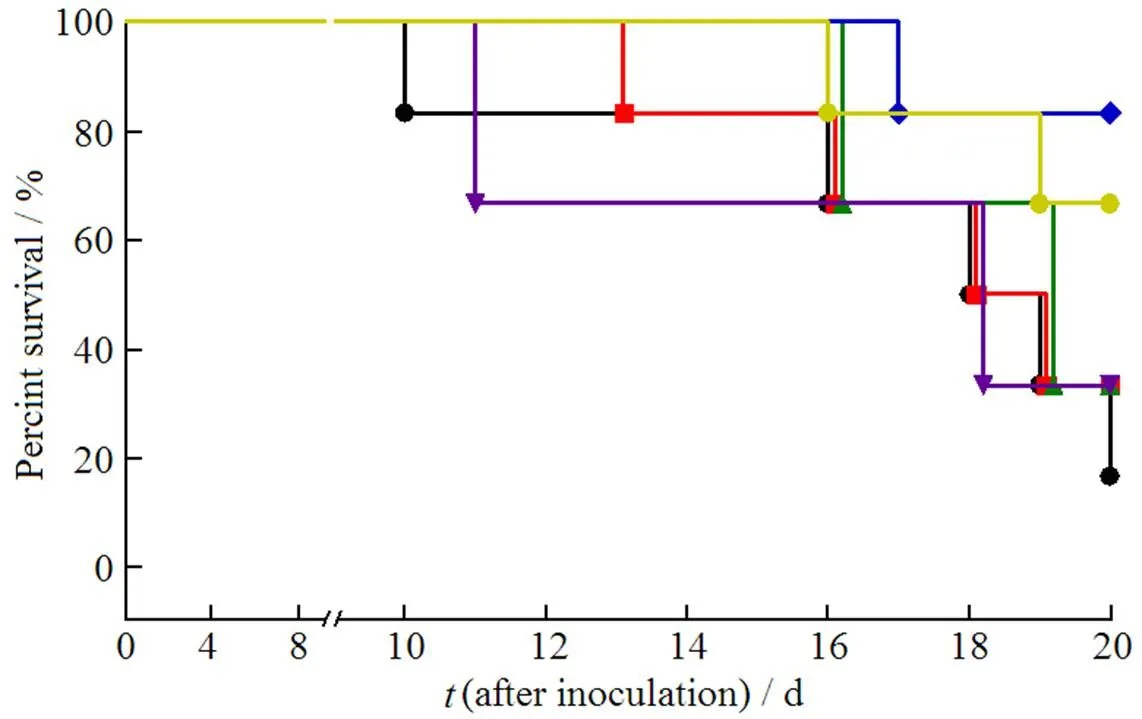
—Control; ¾—NT-DMP-E; p—NT-DMP-L; —SA-DMP-L(l); ¿—SA-DMP-L(m); —SA-DMP-L(h)
采用Kaplan-Meier方法进行生存分析,结果显示对照组、NT-DMP-E组、NT-DMP-L组和SA-DMP-L(l)组的中位生存时间分别为18.5、18.5、19和18 d,这4组间并无显著性差异(> 0.05)。而SA-DMP-L(m)组和SA-DMP-L(h)组20 d的生存率分别为83.3%和66.7%,与对照组比较,显著延长了荷瘤小鼠的生存时间(< 0.05)。
2.5.3 体质量试验
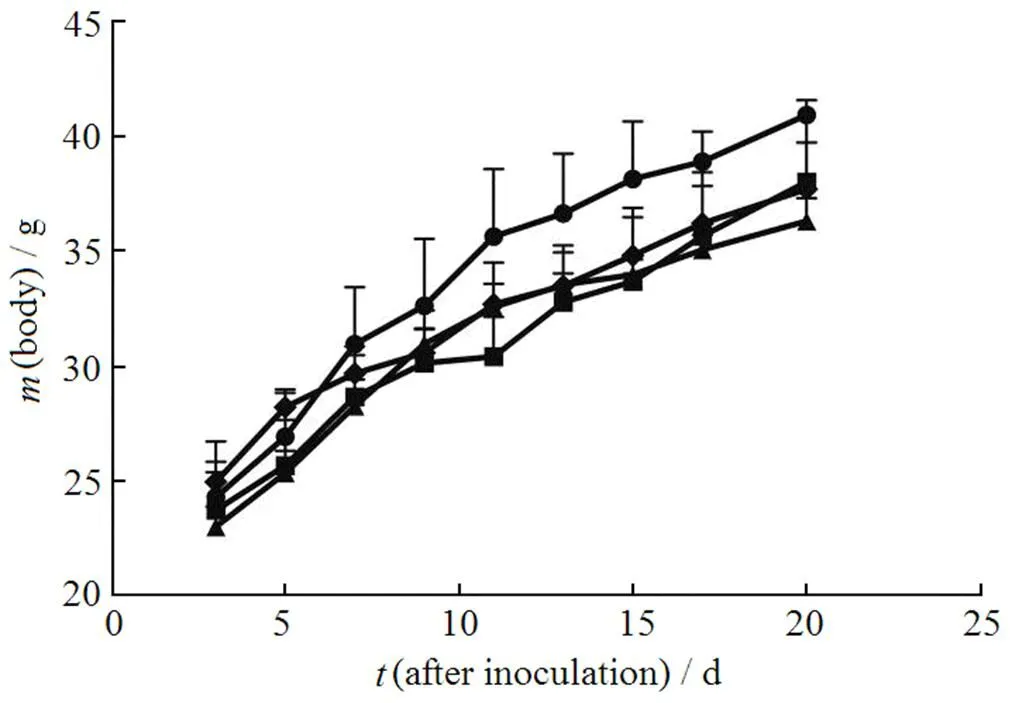
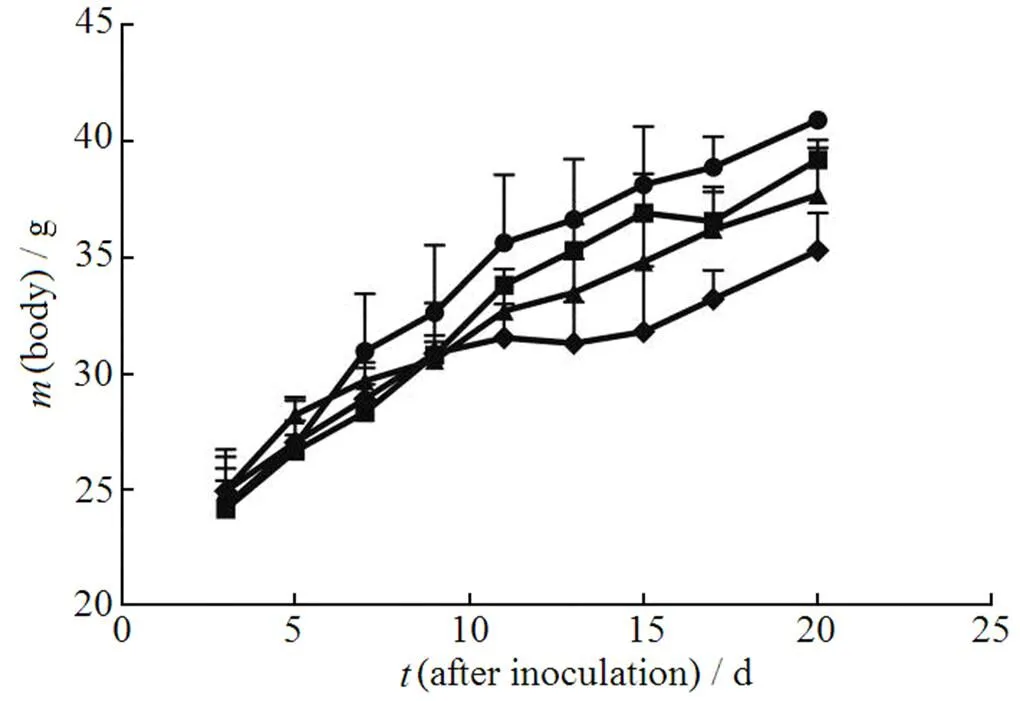
将所记录的各治疗组荷瘤小鼠体质量对接种后天数作图,结果见图4、5。
—Control; ¾—NT-DMP-E; p—NT-DMP-L; ¿—SA-DMP-L(m)
—Control; ¾—SA-DMP-L(l); p—SA-DMP-L(m); ¿—SA-DMP-L(h)
由图4可见,相比对照组,NT-DMP-E、NT-DMP-L和SA-DMP-L(m)治疗组均抑制了荷瘤小鼠体质量的增长,且此三组间,DMP对小鼠体质量增长的抑制作用无显著性差异(> 0.05)。图5则反映了不同剂量SA-DMP-L对小鼠体质量的影响。结果显示,SA-DMP-L对荷瘤小鼠体质量的影响具有明显的剂量依赖性,即随着DMP剂量的增长,SA-DMP-L对小鼠体质量的抑制作用也将增强。这种对小鼠体质量增长的抑制作用在高剂量(10 mg·kg-1DMP)时表现得非常显著(< 0.01 v.s. Control)。
3 讨论
3.1 肿瘤模型的选择
异种移植性肿瘤模型是目前抗肿瘤药物或制剂评价中应用广泛的肿瘤模型,它通过将肿瘤移植于免疫缺陷动物而建立,如严重联合免疫缺陷(severe combined immunodeficiency,SCID)小鼠和无胸腺裸鼠(nude mouse)。这种建立于免疫缺陷动物的肿瘤模型,弱化甚至忽视了机体免疫系统对肿瘤治疗的影响。由于免疫系统在肿瘤治疗中扮演着关键角色,并且临床上肿瘤患者的免疫功能健全,因此在选择评价抗肿瘤药物及制剂的模型时,需要充分考虑药物或制剂、肿瘤及机体免疫系统三者的关系及相互作用。本研究探讨具有免疫抑制作用的GC在肿瘤治疗中的作用,并期待能为临床应用提供参考,故而选择免疫功能正常的小鼠S180肿瘤模型进行试验。作者认为,使用免疫健全动物建立肿瘤模型对于抗肿瘤药物或制剂的筛选及评价至关重要。
3.2 SA修饰DMP脂质体抗肿瘤效应的分析
在肿瘤微环境中,肿瘤细胞除了被脉管系统缠绕外,还被成纤维细胞、免疫细胞、髓源抑制性细胞、肿瘤相关中性粒细胞以及TAMs等基质细胞所包围[12]。大量试验和临床数据显示,TAMs是微环境炎性反应最主要的缔造者[13-15],它们甚至可作为肿瘤不良预后的独立指标[15]。作者认为,针对TAMs的炎性细胞本质,抗炎药物(如GC)在肿瘤治疗方面的应用值得期待。据文献报道,GC类药物泼尼松龙可以抑制肿瘤部位巨噬细胞(即TAMs)一系列促瘤活性,如分泌生长因子和促细胞分裂素以及血管生成促进作用等[8],甚至能够直接对肿瘤细胞产生凋亡诱导及增殖抑制的作用[9]。本研究中,作者使用SA修饰的DMP脂质体包载GC类药物DMP,并对比考察了其抗肿瘤效应。试验结果(图1和表2)表明,非靶向的NT-DMP-E和NT-DMP-L组20 d体积抑瘤率仅分别为(25.9±34.0)%和(42.3±10.8)%,而SA-DMP-L(m)的体积抑瘤率高达(83.4±4.0)%。SA-DMP-L(m)的优秀抑瘤率效果,一方面归功于SA修饰脂质体对TAMs的靶向作用,另一方面是GC类药物DMP对TAMs以及肿瘤细胞的双向抑制作用也有较大贡献。作者从本试验结果得到启示,结合靶向药物递送系统,GC类抗炎药物可以发挥很可观的肿瘤治疗效应。
3.3 机体免疫系统在肿瘤治疗中的作用
TAMs不仅能发挥多种促肿瘤作用,它们还具有强烈的免疫抑制活性,这种免疫“屏障”作用使得肿瘤能够逃逸正常的机体免疫监视[5, 16]。试验结果表明,不同剂量SA-DMP-L组间抗肿瘤作用的差异揭示了正常的机体免疫功能在肿瘤治疗中发挥着重要作用[16]。由图2可见,SA-DMP-L(l)组小鼠肿瘤在整个试验过程中一直缓慢、持续地增长,该组20 d的体积抑瘤率为(56.3±6.8)%。SA-DMP-L(h)组则先经历了一个从第9至13天的平台期,其平均肿瘤体积维持在450 mm3左右(同期对照组从700 mm3增长至2 100 mm3,SA-DMP-L(l)组也从550 mm3增长至850 mm3)。该平台期后,SA-DMP-L(h)组肿瘤自第13天起开始快速增长,20 d时平均肿瘤体积达到与SA-DMP-L(l)组相当,两组间无显著性差异(> 0.05)。SA-DMP-L(m)组小鼠的肿瘤体积也在第9天达到与SA-DMP-L(h)组相当的平台,直至末次给药的3 d后(第18天)方有所增长。令人鼓舞的是,该组体积抑瘤率高达(83.4 ± 4.0)%。作者分析,DMP的介入使得肿瘤及其微环境与机体免疫系统的相互作用发生了改变,而不同剂量组DMP对三者的影响各异。低剂量的SA-DMP-L(2.5 mg·kg-1)能对微环境中TAMs起到一定抑制作用,但不能达到为机体免疫系统彻底打开这个“屏障”的程度。因此,该组肿瘤保持缓慢增长的趋势。高剂量的SA-DMP-L(10.0 mg·kg-1)则足以打破肿瘤微环境的“屏障”,但其对机体免疫系统的抑制作用也更为强烈,致使后者在面对失去了“屏障”的肿瘤细胞时仍然“无能为力”。虽然SA-DMP-L(h)组平均肿瘤体积自第7天起就低于SA-DMP-L(l)组,但在试验末期却快速增长至与低剂量组相当,甚至有超过后者的趋势。高、低2个剂量组的肿瘤体积变化过程说明,GC类药物DMP对肿瘤微环境炎性反应抑制程度不够或对机体免疫系统的抑制程度过高都将影响抗肿瘤疗效。更值得注意的是,中剂量的SA-DMP-L(5.0 mg·kg-1)则恰如其分地抑制了TAMs的促肿瘤活性,同时对机体免疫系统的抑制作用较为缓和。机体免疫系统能对失去微环境“屏障”的肿瘤细胞发挥正常的免疫杀伤和清除作用。因此,该组小鼠的肿瘤在较长一段时间中均处于生长抑制状态,20 d的体积抑瘤率也是高达80%以上,达到与一些细胞毒性抗肿瘤药物的临床前体内试验水平相当。另外,体质量的抑制也能从侧面显示SA-DMP-L对小鼠机体的毒性及不良反应,DMP的体质量增长抑制作用与剂量成正相关(图5)。非靶向DMP制剂组较差的肿瘤治疗效应表明,非靶向DMP制剂组更多地表现出了GC对试验动物机体免疫系统的抑制作用。以上结果启示研究者,GC在治疗肿瘤方面扮演着“双刃剑”角色。它们既能抑制肿瘤微环境中的免疫细胞,发挥可观的治疗作用;又能干预机体免疫系统的正常功能,反而不利于肿瘤的治疗。
3.4 体内抗肿瘤作用的综合评价
目前,在进行体内抑瘤活性试验时,通常采用体积抑瘤率评价药物(或制剂)的抗肿瘤活性。该指标能一定程度地反映试验终点的情况,但由于肿瘤生长本身便不是匀速的过程,加之药物(或制剂)的介入将影响肿瘤的发展,简单地以某一个时间点评价抗肿瘤药物(或制剂)的优劣必然存在缺陷,肿瘤全过程的变化更需要受到关注。基于以上考虑,本课题组提出“肿瘤生长曲线下面积抑瘤率(即AUTGC抑瘤率)”的评价指标[17]。它将整条肿瘤生长曲线量化,表征的是整个试验区间而非单一时间点的情况。在本研究中,试验终点(第20天)SA-DMP-L(l)组和SA-DMP-L(h)组的平均肿瘤体积相当。但从整条曲线来看,第15天后SA-DMP-L(h)组平均肿瘤体积方开始较快速地增长,而在第11~15天,SA-DMP-L(h)组都显著优于SA-DMP-L(l)组(< 0.05)。因此,需要采用AUTGC抑瘤率才能客观反映出SA-DMP-L(h)组的优势。当然,AUTGC抑瘤率也有其缺陷。由于试验动物生存时间的差异性,在计算时AUTGC只有均值能较好地反映问题,而标准偏差的统计学意义不大。综上,体内抗肿瘤效应的优劣需要更多的指标来全方面地评价。
[1] DeVITA Jr V T, ROSENBERG S A. Two hundred years of cancer research[J]. New England Journal of Medicine, 2012, 366(23): 2207-2214.
[2] UDAGAWA T, WOOD M. Tumor–stromal cell interactions and opportunities for therapeutic intervention[J]. Current Opinion in Pharmacology, 2010,10(4): 369-374.
[3] MANTOVANI A, ALLAVENA P, SICA A, et al. Cancer-related inflammation[J]. Nature, 2008,454(7203): 436-444.
[4] de VISSER KE, EICHTEN A, COUSSENS LM. Paradoxical roles of the immune system during cancer development[J]. Nature Reviews Cancer, 2006,6(1): 24-37.
[5] SOLINAS G, GERMANO G, MANTOVANI A, et al. Tumor-associated macrophages (TAM) as major players of the cancer-related inflammation[J]. Journal of Leukocyte Biology, 2009,86(5): 1065-1073.
[6] ELINAV E, NOWARSKI R, THAISS CA, et al. Inflammation-induced cancer: crosstalk between tumours, immune cells and microorganisms[J]. Nature Reviews Cancer, 2013,13(11): 759-771.
[7] OZBAKIR B, CRIELAARD BJ, METSELAAR JM, et al. Liposomal corticosteroids for the treatment of inflammatory disorders and cancer[J]. Journal of Controlled Release, 2014,190: 624-636.
[8] SCHIFFELERS RM, METSELAAR JM, FENS MH, et al. Liposome-encapsulated prednisolone phosphate inhibits growth of established tumors in mice[J]. Neoplasia, 2005,7(2): 118-127.
[9] BANCIU M, SCHIFFELERS RM, FENS M, et al. Anti-angiogenic effects of liposomal prednisolone phosphate on B16 melanoma in mice[J]. Journal of Controlled Release, 2006,113(1): 1-8.
[10] KLUZA E, YEO SY, SCHMID S, et al. Anti-tumor activity of liposomal glucocorticoids: The relevance of liposome-mediated drug delivery, intratumoral localization and systemic activity[J]. Journal of Controlled Release, 2011,151(1): 10-17.
[11] SHE ZN, ZHANG T, WANG XL, et al. The anticancer efficacy of pixantrone-loaded liposomes decorated with sialic acid-octadecylamine conjugate[J]. Biomaterials, 2014,35(19): 5216-5225.
[12] 王盛典, 贾明明. 肿瘤免疫微环境在肿瘤常规治疗效应中的作用[J]. 中国肿瘤生物治疗杂志, 2012,19(3): 229-238.
[13] POLLARD JW. Tumour-educated macrophages promote tumour progression and metastasis[J]. Nature Reviews Cancer, 2004,4(1): 71-78.
[14] GALDIERO MR. Tumor-Associated Macrophages in Tumor Progression: From Bench to Bedside[M]. MANTOVANI A: Springer International Publishing, 2015: 99-111.
[15] ALLAVENA P, SICA A, SOLINAS G, et al. The inflammatory micro-environment in tumor progression: the role of tumor-associated macrophages[J]. Critical Reviews in Oncology/Hematology, 2008,66(1): 1-9.
[16] ALLAVENA P, SICA A, GARLANDA C, et al. The Yin‐Yang of tumor‐associated macrophages in neoplastic progression and immune surveillance[J]. Immunological Reviews, 2008,222(1): 155-161.
[17] 程晓波. 耐冻融葫芦素口服乳剂的研发[D]: 沈阳: 沈阳药科大学, 2014: 56-57.
(本篇责任编辑:赵桂芝)
Study ofanti-tumor effects for S180-bearing mice of sialic acid-modified dexamethasone palmitate liposomes
HUANG Zhen-jun, LI Xuan, SONG Yan-zhi, LI Jing, SUN Jing, DENG Yi-hui*
(,,110016,)
Objective This article aimed at targeting glucocorticoids(GC) to the tumor microenvironment to achieve good anticancer efficacy by the means of anti-inflammatory. Method Dexamethasone palmitate(DMP) was loaded into the liposomes modified with sialic acid(SA). And mice S180 sarcoma model were established to investigate theantitumor effects of SA-modified liposomal DMP at varied doses, as well as the control groups including the non-targeted groups of commercial emulsions and liposomes. Result Both the non-targeted emulsions group and liposome groups have certain advantage over the control group in tumor inhibition. And the targeted SA-modified liposomal groups possessed a better anti-tumor efficacy than the non-targeted emulsions and liposomes groups. Within the sialic acid-modified liposomal DMP groups, the group administrated at the dose of 5.0 mg·kg-1DMP achieved the best antitumor efficacy with a tumor volume inhibition rate of (83.4 ± 4.0)%, area under the tumor curve inhibition rate of 79.9%, and survival rate of 83.3% in S180-bearing mice during 20-days’ test. Conclusion With the aid of the anti-inflammation effects of GC, excellent anticancer efficacies can be achieved. And the tumor microenvironment and host immune systems are vital factors of the cancer treatments, in which more attraction should be drawn before the launch of a new cancer therapeutic strategy, including the design of drug delivery systems.
pharmaceutics; targeting liposome; host immune system; glucocorticoids; anti-inflammation; tumor microenvironment
(2016)03–0089–10
10.14146/j.cnki.cjp.2016.03.003
R94
A
2015-04-24
国家自然科学基金资助项目(81373334)
黄振君(1990-), 男(汉族), 江西赣州人, 硕士研究生, E-mail huangzjdds@163.com; *邓意辉(1964-),男(汉族), 湖南花垣人, 教授, 主要从事药物靶向新剂型的研究, Tel. 024-23986316, E-mail dds-666@163.com。
