传统馒头老面中醋酸菌的鉴定及产酸条件优化
2017-01-13孙伟哲曲玲玉安向宇师雨梦李良军
孙伟哲,曲玲玉,滕 超,2,*,安向宇,师雨梦,2,李良军,2
(1.食品质量与安全北京实验室(北京工商大学),北京 100048;2.北京市食品添加剂工程技术研究中心(北京工商大学),北京 100048)
传统馒头老面中醋酸菌的鉴定及产酸条件优化
孙伟哲1,曲玲玉1,滕 超1,2,*,安向宇1,师雨梦1,2,李良军1,2
(1.食品质量与安全北京实验室(北京工商大学),北京 100048;2.北京市食品添加剂工程技术研究中心(北京工商大学),北京 100048)
自晋南地区传统馒头发酵剂(老面)中筛选出一株产酸量较高的醋酸菌(Q2534),对其进行了菌种鉴定及产酸量优化研究。通过16S rDNA测序分析初步鉴定为热带醋酸杆菌(Acetobactertropicalis)。在单因素实验的基础上通过响应面分析法继续对发酵产酸条件进行优化,确定该菌株的最优发酵条件为:温度32 ℃,转速140 r·min-1,pH6.0,乙醇体积分数3.4%(v/v),在此条件下产总酸量可达26.74 g/L。其结果对传统主食馒头发酵剂中醋酸菌资源的发掘及应用具有一定的意义。
醋酸菌,菌种鉴定,老面,响应面优化
传统主食馒头[1-2]在中国有着悠久的历史和广泛的分布,是中国古代劳动人民发明的一种具有中国文化特色的主食。传统的馒头是将面粉、水以及发酵剂混合在一起加工蒸制而成[3]。在我国北方,尤其是以山东、山西、河南等主要以面食为主的地区,馒头几乎是人们每日必吃的主食,南方也有其特色的馒头。南北方馒头的差异主要体现在口感以及风味上,究其原因主要是馒头发酵剂中不同的酵母菌、醋酸菌[4]、乳酸菌等菌种的糖化、酯化等作用,从而产生多种多样的有机物质,进而造成了南北方馒头质构及风味的差异[5]。目前,国内已有学者对传统馒头发酵剂中的酵母菌Succhuromycescerevisiae、Sacchuromycesexiguus、Candidamilleri、Pichianorvegensis、Hansenulanomala和Candidakrusei等进行了研究[6];另一方面多种产酸菌株也被证实在老面发酵剂中存在,且多为乳酸杆菌,经研究发现Lactobacillussanfranciscensis、Lactobacillusplantarum、Lactobacilluspontis、Lactobacillusrossiae等乳杆菌都是酸面团中的关键微生物[7]。但目前关于传统馒头发酵剂中醋酸菌的研究相对较少[8-9]。因此,对于传统发酵剂中主要菌种尤其是对于醋酸菌在传统馒头发酵剂混合体系中所起到的作用展开研究具有非常重要的意义。
本实验以晋南地区传统发酵剂为研究对象,筛选、鉴定其中的优势醋酸菌,并考察确定菌株发酵条件,充分了解该醋酸菌生长特性,为后续在实际中应用提供参考。
1 材料与方法
1.1 材料与仪器
传统面食发酵剂 晋南地区采集馒头发酵剂;葡萄糖、酵母膏、无水乙醇、盐酸、氢氧化钠等 均为国产分析纯。
PHS-3C型pH计 Thermo公司;TE1502S型电子天平 上海天平厂;VS-1300L-U型洁净工作台 北京赛伯乐实验仪器有限公司;YXQ-LS-100A型立式压力蒸汽灭菌器 上海博讯实业有限公司医疗设备厂;722E型可见光分光光度计 棱光技术;培英2-2型台式恒温振荡器 苏州培英实验设备有限公司。
1.2 培养基
PDA培养基:20%土豆汁,2%葡萄糖,2%琼脂,115 ℃灭菌20 min。
基础培养基:1.0%酵母膏,1.0%葡萄糖,pH为4.5~5.5,115 ℃灭菌20 min,使用前加入3.0%(v/v)乙醇。
分离培养基:1.0%酵母膏,1.0%葡萄糖,琼脂2%,pH为5.5,115 ℃灭菌20 min,灭菌后,加入1.5%无菌CaCO3和3.0%(v/v)乙醇,制成平板[10]。
1.3 醋酸菌分离、纯化
钙平板分离方法:称取1.00 g(精确到0.01 g)传统面食发酵剂,用无菌生理盐水以10倍递增作梯度稀释,取10-5~10-6稀释度的菌液涂布到PDA培养基上,30 ℃的温箱内培养2 d,挑取培养基上细菌单菌落至分离培养基上,30 ℃的恒温箱培养2 d。挑选有钙溶解圈的菌株转接纯培养2 d,对纯化的菌株进行镜检。将纯化的菌株接入斜面培养基中,4 ℃保藏,并进行分子生物学实验[11]。
1.4 16S rDNA序列分析
1.4.1 基因组DNA的提取 具体方法参考朱扬玲等[12]描述方法。取单菌落接种于5 mL醋酸菌基础培养基中,在32 ℃下培养。取此培养条件下1.0 mL菌液于1.5 mL离心管中,13000 r/min离心2 min,弃上清。沉淀重悬于1.0 mL 0.85% NaCl中。室温13000 r/min离心2 min,弃上清。沉淀重悬于550 μL 1×TE中。加17 μL溶菌酶(35 mg/mL),37 ℃温育30 min。加3 μL蛋白酶K(20 mg/mL),37 ℃温育30 min。加30 μL 10% SDS,37 ℃温育30 min。加100 μL 5 mol/L NaCl充分混匀。加80 μL CTAB/NaCl溶液,混匀,65 ℃水浴10 min。加等体积(0.7~0.8 mL)氯仿/异戊醇(24∶1),轻轻振荡混匀。室温,13000 r/min离心10 min。将上清液转移到一新1.5 mL离心管中,加入等体积酚/氯仿/异戊醇(25∶24∶1)轻轻振荡混匀。
1.4.2 PCR基因扩增 适当稀释的模板DNA 1.0 μL,2.5 mmol/L的dNTP 2.5μL,10 mmol/L的PCR Buffer 2.5 μL,10 μmol/L的引物各1 μL,Taq DNA聚合酶1 μL(1.0 U),补水至25 μL。
PCR条件:94 ℃预热4 min,每个循环包括94 ℃变性30 s,52 ℃退火30 s,72 ℃延伸1 min,30个循环,最后72 ℃ 10 min,降温至16 ℃取出。最后用1.5%的琼脂糖电泳检测PCR产物。
1.4.3 系统发育分析 根据测序结果,先利用BLAST程序将16S rDNA的PCR扩增产物测序结果在NCBI上比对,然后从GenBank数据库中搜索有关种的基因序列数据,用MEGA 4.1中的Neighbor-Joining法构建系统发育树[12]。
1.5 单因素实验
1.5.1 温度对产酸量的影响 设定转速为120 r·min-1,pH为5.5,乙醇体积分数为3%(v/v),装液100 mL,醋酸菌接种量为2%,考察温度分别为24、28、32、36、40 ℃时摇床培养发酵对醋酸菌产酸量的影响,间隔2 d测其总酸度。
1.5.2 转速对产酸量的影响 设定温度为32 ℃,pH为5.5,乙醇体积分数为3%(v/v),装液100 mL,醋酸菌接种量为2%,考察转速分别为110、120、130、140、150 r·min-1时摇床培养发酵对醋酸菌产酸量的影响,间隔2 d测其总酸度。
1.5.3 pH对产酸量的影响 设定温度为32 ℃,转速为140 r·min-1,乙醇体积分数为3%(v/v),装液100 mL,醋酸菌接种量为2%,考察pH分别为3.5、4.5、5.5、6.5、7.5、8.5时摇床培养发酵对醋酸菌产酸量的影响,间隔2 d测其总酸度。
1.5.4 乙醇体积分数对产生酸量的影响 设定温度为32 ℃,转速为140 r·min-1,pH为5.5,装液100 mL,醋酸菌接种量为2%,考察乙醇体积分数分别为0%、1%、2%、3%、4%、5%、6%、7%(v/v)时摇床培养发酵对醋酸菌产酸量的影响,间隔2 d测其总酸度。
1.6 产酸响应面优化
根据单因素实验结果,确定乙醇体积分数(A)、温度(B)、摇床转速(C)3因素为自变量,醋酸菌Q2534产酸量为响应值,对该醋酸菌发酵条件做进一步优化。利用Design-Expert 8.0.6.1分析软件,采用Box-Behnken[13-14]设计,进行三因素三水平的响应面分析实验,各因子的水平设置及编码值见表1[15]。

表1 响应面分析因素及水平表
1.7 菌株生长曲线及产酸曲线
根据产酸响应面结果,设定温度为32 ℃,pH6.0,转速为140 r·min-1,乙醇体积分数为3.4%(v/v),装液100 mL,醋酸菌接种量为2%,用吸光度法测量时间间隔为2 h时该醋酸菌菌体密度和总酸度。
1.8 产酸测定方法
总酸测定:GB/T 15038-1994,酸碱中和法。具体操作参考董叔阁等[14]描述方法。
1.9 数据处理
采用Design-Expert 8.0.6.1软件进行方差分析。
2 结果与分析
2.1 醋酸菌分离、纯化及鉴定
通过初筛及鉴定平板复筛,选取在钙平板上透明圈最大的一株醋酸菌进行后期分析研究。菌株Q2534的形态特征见图1。

图1 醋酸菌Q2534显微镜照片Fig.1 The microscope photograph of strain Q2534
该菌株在基础培养基上呈乳白色,单菌落直径约1.5~2 mm,革兰氏阴性菌。单纯的形态、鉴定平板及生理生化实验还不能够准确的将菌株鉴定到种,需要结合分子生物学方法。通过基因比对并采用Neighbor-Joining法构建系统发育树,结果如图2所示。序列分析表明,菌株Q2534与菌株AcetobactertropicalisDQ887340.1达到99%以上的序列同源性,且在基因进化树中位于同一分枝上,可以初步确定目的菌株Q2534属于Acetobactertropicalis,即热带醋酸杆菌。
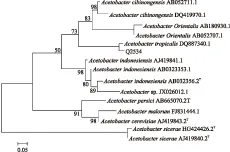
图2 菌株Q2534 16S rDNA基因序列系统发育树Fig.2 Phylogenetic tree inferred from Neighbour-joining analysis of partial 16S rDNA gene sequence of selected species
2.2 温度对产酸量的影响
由图3可看出,目的菌株在24~40 ℃时,随着温度的升高,产酸量呈现出先上升再下降的趋势,温度过高或过低对菌株产酸量都有影响。从上图分析来看,目的菌株对温度敏感,耐高温性能较差,过高的温度可能抑制其生长,如40 ℃时,该醋酸菌几乎不产酸;温度过低则缓慢生长,产酸量较低,如24 ℃时,前6 d几乎不产酸;在32 ℃时,温度适宜,菌株产酸量最高。

图3 温度对产酸量的影响Fig.3 Effect of temperature on acid yield
2.3 转速对产酸量的影响
酒精醋化为需氧发酵,醋酸菌的生长增殖需要耗氧,乙醇在脱氢酶的作用下氧化成醋酸也需要耗氧,因此,醋酸菌发酵供氧水平与醋酸的生产效率密切相关[16]。由图4可看出,醋酸菌Q2534在110~150 r·min-1时产酸量呈现先上升再下降的趋势,在110~140 r·min-1的转速变化范围内,总产酸量基本维持在25 g/L左右,说明其转速对其产酸量的影响较小。
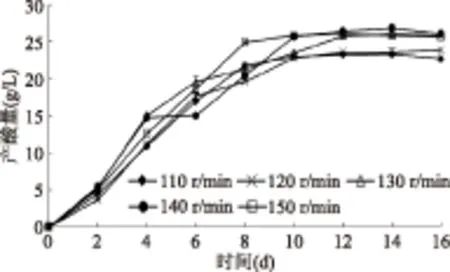
图4 转速对产酸量的影响Fig.4 Effect of shaking speed on acid yield
2.4 pH对产酸量的影响

图5 pH对产酸量的影响Fig.5 Effect of pH on acid yield
由图5可看出,目的菌株在pH为3.5~8.5时,呈现出随着pH的升高产酸量先上升后下降的趋势。pH过高时会导致醋酸菌的迟滞期变得非常长,如当pH为8.5时,该菌到前6 d几乎都不产酸。pH过低会影响其最终的产酸量,如pH为3.5时该菌在后期生长缓慢并且最终的总产酸量也较低。分析其原因可能为:偏碱性的环境,抑制该醋酸菌产酸或者可能是醋酸菌的产酸量少且被环境中的碱性环境中和,从而导致其迟滞期变得非常长;当pH过低时,随着产酸量的累积,导致整个体系pH更低,从而导致后期生长更加缓慢。综合来看,pH4.5~6.5的范围内,醋酸菌都能较好的生长,产酸量较高。
2.5 乙醇浓度对产酸量的影响
由图6可看出,目的菌株的乙醇耐受性较好,在乙醇体积分数为3%(v/v)时,随着乙醇体积分数的升高,产酸量呈现先上升后略微下降的趋势。过高或过低的乙醇体积分数都会对醋酸菌总产酸量产生一定的影响。分析其原因可能为:在发酵后期,发酵液中氧气供应充足,而乙醇含量不足的情况下,会发生过氧化反应,醋酸菌将醋酸进一步氧化成水和二氧化碳,使酸度迅速下降[17];当乙醇体积分数过低时,醋酸菌的直接碳源乙醇含量较少,不足以维持醋酸菌产酸对碳源的需要;当乙醇体积分数增高时,产酸量逐渐增加;当乙醇体积分数过高时,则可能由于菌株直接利用的底物乙醇浓度过大,而对菌株的产酸量稍有抑制,例如乙醇体积分数为6%(v/v)的样本,其最高产酸量仅为25 g/L左右。综合上图来看,醋酸菌Q2534在乙醇体积分数为3%(v/v)时总产酸量最高。

图6 乙醇体积分数对产酸量的影响Fig.6 Effect of ethanol volume on acid yield
2.6 响应面法优化醋酸菌发酵条件
Box-Behnken实验的设计表及实验结果见表2,二次回归分析的结果见表3。

表2 Box-Benhnken设计及其结果
利用Design-Expert 8.0.6.1软件对表二结果进行拟合,得到二阶回归方程为:Y=24.70+3.59A-1.12B+2.68C-0.34AB+1.27AC-7.5×10-3BC-9.39A2-6.48B2-4.36C2
对回归模型的显著性进行检验和分析,其结果见表3。由回归模型显著性检验结果及方差分析可知,模型的p值为<0.0001小于0.05,表明模型显著;模型的拟合度R2=0.9761,模型失拟项的p>F值为0.3215远大于0.05,表明失拟项不显著。所以回归方程对实验的拟合度较好,可以对实验区域的菌株产酸情况进行有效地评估,即可以用于对菌株Q2534产酸条件优化的模拟。
从表3还可以看出,在实验区域内培养乙醇体积分数(A)、pH(C)以及乙醇体积分数、温度、pH的二次项(A2、B2、C2)均对菌株Q2534发酵产酸情况影响极显著。各因素间交互作用的响应面及等高线图由图7所示。
由图7中等高线可知,AB、AC和BC交互作用不显著,即乙醇体积分数、温度和pH两两之间相互交互作用不显著,与表3结果相同。通过进一步分析得知,响应面优化最佳产酸条件为温度31.63 ℃,转速140 r·min-1,pH5.84,乙醇体积分数3.43%(v/v),在此条件下该菌产醋酸水平可以达到25.59 g/L。对模型进行验证,考虑实验的可操作性,将最佳产酸条件调整为:温度32 ℃,转速140 r·min-1,pH6.0,乙醇体积分数3.4%(v/v),三次平行实验结果均值为26.74 g/L,与预测值相差较小,说明此模型的预测可靠。
2.7 醋酸菌菌体数量与产酸量之间的关系
由图8可看出,醋酸菌菌体密度随着时间的变化在0~18 h内增长迅速,由规律判断此阶段属于对数生长期。至20 h左右,菌体密度达到最大值并在此发酵条件下基本稳定维持至200 h左右,随后菌体密度逐渐下降,菌群开始衰亡。产酸规律方面,在0~240 h内该菌产酸量逐渐上升,最高值达到26.25 g/L,240 h后总产酸量略微下降,但总体下降幅度不大。并且在该菌到达稳定期后,产酸量基本维持一定的速率增加并逐渐积累,在第10 d左右,产酸达到最大值。
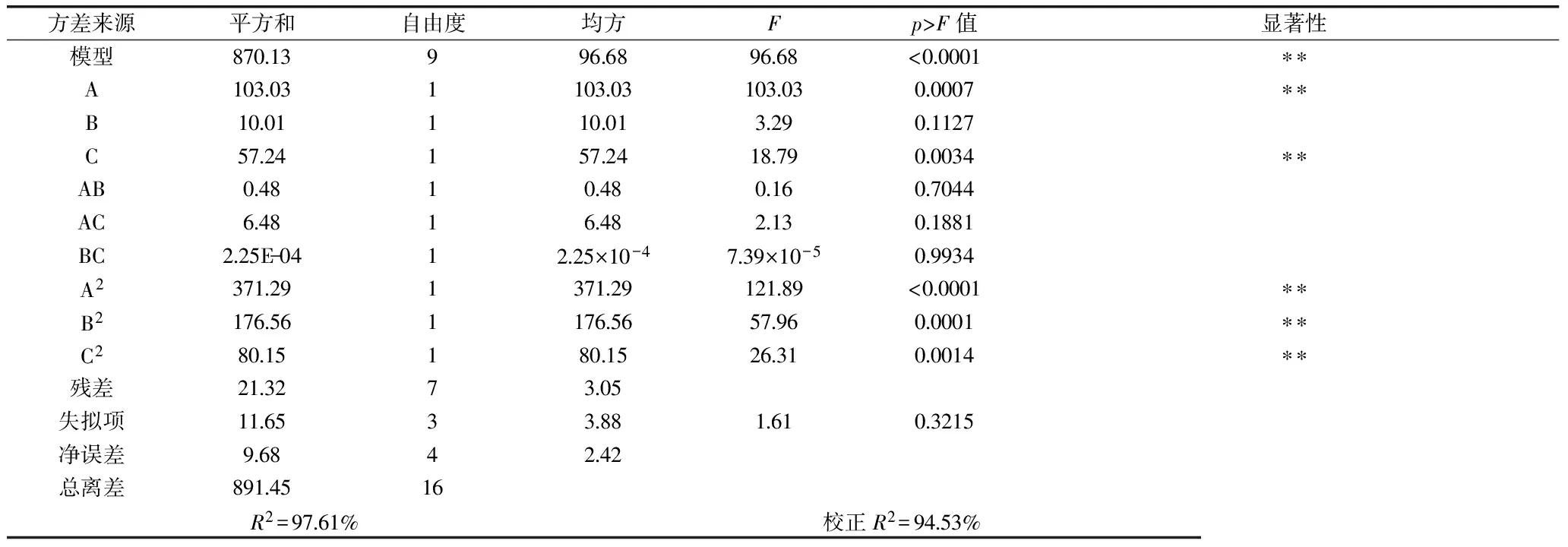
表3 Box-Benhnken设计回归分析结果

图7 各因素间交互作用的响应面Fig.7 Response surface of the combined effects on acetic acid production by Q2534
注:*:表示显著,p<0.05;**:表示极显著,p<0.01。

图8 醋酸菌Q2534菌体密度及产酸量变化 Fig.8 The relationship between cell density and the acid yield of strain Q2534
3 结论
对实验室自晋南地区筛选保藏的醋酸菌Q2534进行了鉴定,根据16S rDNA序列分析初步判定为Acetobactertropicalis,实验继续研究了醋酸菌培养条件并对其进行优化,确定最佳发酵产酸条件为:乙醇体积分数3.4%(v/v),温度32 ℃,转速140 r·min-1,pH6.0,在此最佳发酵条件下该醋酸菌产酸量为26.74 g/L。由于传统馒头老面中关于醋酸菌的研究较少,根据已进行实验初步判断其可能对传统馒头风味的形成产生作用,拟后续进一步完善相关工作。
[1]张国华,何国庆. 我国传统馒头发酵剂的研究现状[J]. 中国食品学报,2012,12(11):115-120.
[2]苏东民. 中国馒头分类及主食馒头品质评价研究[D].北京:中国农业大学,2005.
[3]Maria G,Paolo G. Acetic acid bacteria in traditional balsamic vinegar:Phenotypic traits relevant for starter cultures selection[J]. International Journal of Food Microbiology,2007,125(1):46-53.
[4]冯静,施庆珊,欧阳友生,等. 醋酸菌多相分类研究进展[J]. 微生物学通报,2009,26(5):10-13.
[5]滕超,曲玲玉,孙伟哲,等. 传统馒头发酵剂的研究进展[J]. 食品研究与开发,2015,36(11):1-5.
[6]王宁,关二旗,卞科. 传统馒头发酵剂中的微生物及风味研究现状[J]. 粮食与饲料工业,2015(7):25-28.
[7]赵晋府. 食品工艺学[M].北京:北京中国轻上业出版社,2008.
[8]Truphin S,Levin S,Forchiassin F,et al. Optimization of a culture medium for lig-ninolytic enzyme production and synthetic dye decolorization using response surface methodology[J]. J IndMicrobiol Biotechnol,2003,30(12):682-690.
[9]张卫华,汪超,罗军杰,等. 响应面优化醋酸菌发酵条件研究[J]. 中国酿造,2012,31(4):48-51.
[10]Matthias K,Wolfgang W,Stamml,et al. Isolation and classification of acetic acid bacteria from high percentage vinegar fermentations[J]. Applied Microbiol Biotechnol,1989(30):47-52.
[11]朱运平,李大为,张雪,等. 巴氏醋酸杆菌B103培养条件和培养基成分的优化研究[J]. 中国食品添加剂,2015(6):60-65.
[12]朱杨玲. 采用PCR-DGGE方法研究浙江玫瑰醋酿造过程中的微生物多样性[D].杭州:浙江工商大学,2009.
[13]Apisit S,Somboon T,Suwimon K. Identification of acetic acid bacteria isolated from fruits collected in Thailand[J]. Applied Microbiol Biotechnol,2004,50:47-53.
[14]董书阁,管斌,熊三玉,等. 利用响应面分析法优化醋酸菌AD_1的发酵条件[J]. 食品与发酵工业,2007,33(3):78-81.
[15]邓涛,单杨,李高阳,等. 响应面优化柑橘皮色素超声波辅助提取工艺[J]. 食品科学技术学报,2014,32(2):56-61.
[16]何志刚,李维新,林晓姿,等. 枇杷酒醋化过程醋酸菌的生长、产酸及耗氧的关系[J]. 食品与发酵工业,2008,34(12):22-25.
[17]陈英才. 固定化醋酸菌酿造食醋的过氧化反应[J].中国调味品,2001(9):7-8,12.
Identification of acetic acid bacteria in fermenting agent of Chinese steamed bread and optimization of fermentation conditions
SUN Wei-zhe1,QU Ling-yu1,TENG Chao1,2,*,AN Xiang-yu1,SHI Yu-meng1,2,LI Liang-jun1,2
(1.Beijing Laboratory for Food Quality and Safety,Beijing Technology & Business University(BTBU),Beijing 100048,China; 2.Beijing Engineering and Technology Research Center of Food Additives, Beijing Technology & Business University(BTBU),Beijing 100048,China)
A high acid producing acetic acid bacteria(Q2534)was screened from traditional steamed bread fermentation agent in the south of Shanxi. The identification and acid production optimization have been done to it. It has been identified asAcetobactertropicalisbased on 16S rDNA method. On the basis of single factor experiments,the best fermentation conditions and medium composition were optimized by response surface analysis method. The best fermentation conditions were as follows:temperature 32 ℃,rotation rate 140 r·min-1,pH6.0 and alcohol content 3.4%(v/v). Under these conditions,the yield of acetic acid of this bacteria can reach 26.74 g/L. The results have some effects on exploitation and application of the resource of acetic acid bacteria that got from traditional fermenting agent of Chinese steamed bread.
acetic acid bacteria;identification;traditional starter;response surface analysis
2016-05-27
孙伟哲(1994-),男,大学本科,研究方向:微生物发酵,E-mail:sun.wz@foxmail.com。
*通讯作者:滕超(1981-),男,副教授,研究方向:食品生物技术,E-mail:tc2076paper@163.com。
国家自然科学基金(31201449,31371723)。
TS210.1
A
1002-0306(2016)22-0190-06
10.13386/j.issn1002-0306.2016.22.029
