32%精甲霜灵·噁霉灵种子处理液剂的高效液相色谱分析
2017-01-12高敬雨刘润峰
高敬雨,潘 静,徐 妍,东 琴,刘润峰
(北京明德立达农业科技有限公司,北京 100085)
32%精甲霜灵·噁霉灵种子处理液剂的高效液相色谱分析
高敬雨,潘 静,徐 妍,东 琴,刘润峰
(北京明德立达农业科技有限公司,北京 100085)
采用高效液相色谱法测定32%精甲霜灵·噁霉灵种子处理液剂中精甲霜灵和噁霉灵的质量分数。以乙腈+水为流动相,使用ZORBAX SB-C18为填充物,对噁霉灵和甲霜灵进行定量分析,以正己烷+异丙醇为流动相,CHIRALCEL OD-H为填充物,对甲霜灵R-对映体(精甲霜灵)比例进行测定。结果表明,精甲霜灵和噁霉灵的标准偏差分别为0.11、0.24;变异系数分别为2.63%、0.85%;平均回收率分别为98.89%、99.68%。该法具有较高的准确性和精密度,简便、快速,分离效果好。
精甲霜灵;噁霉灵;高效液相色谱;分析
精甲霜灵(metalaxyl-m)是先正达公司开发的酰胺类杀菌剂,也叫高效甲霜灵,具有预防和治疗功效,对霜霉病菌、疫霉病菌、腐霉病菌等所致的蔬菜、果树、烟草、棉花等作物病害具有良好的防治效果。此物质在土壤中的降解速度快,持效期长施药次数少,对使用者安全性,与环境相容性好[1-2]。噁霉灵(hymexazol)是1930年由三井公司开发的一种内吸杀菌剂,对土壤病原真菌等有强烈的杀灭作用,能通过植物根部吸收,在植物体内代谢产生糖苷,促进作物根的生长和吸收,提高种苗的存活率。噁霉灵对由土传病菌引起的各种作物立枯病、猝倒病、枯黄萎病、根腐病、茎枯病、茎腐病等防治效果显著[3]。目前用于防治土传病害的药剂较少。对现有杀菌剂进行复配,可以延缓病菌抗药性的产生,提高防效,扩大杀菌谱及降低用药成本[4]。
有关精甲霜灵、噁霉灵单剂的检测已有很多报道,梁有[5]等采用反相液相色谱法测定烟叶中精甲霜灵残留。谭智勇[6]采用气相色谱法对稻谷中噁霉灵的残留进行检测。关于两者复配剂,崔林燕[7]等研究了甲霜·噁霉灵水剂的气相液谱分析法,但液相色谱同条件分析方法目前尚未见报道。本文建立了同一液相色谱条件下测定精甲霜灵和噁霉灵质量分数的方法。试验结果表明,该方法操作简便,分离效果好,精密度、准确度较高。
1 材料与方法
1.1 甲霜灵、噁霉灵质量分数的测定
1.1.1 仪器和试剂
高效液相色谱仪:Agilent 1260,具可变波长紫外检测器;色谱数据处理工作站。
乙腈:色谱纯;水:新蒸2次蒸馏水;甲霜灵标样(≥98.0%),噁霉灵标样(≥99.0%)(两者均由北京明德立达农业科技有限公司提供);32%精甲霜灵·噁霉灵种子处理液剂(4%精甲霜灵+28%噁霉灵,北京明德立达农业科技有限公司研制)。
1.1.2 色谱操作条件
色谱柱:150 mm×4.6 mm(i.d.)不锈钢柱,内装ZORBAX SB-C18填充物,粒径5 µm;检测波长:210 nm;流动相:乙腈︰水=45︰55(体积比);流速:1.0 mL/min;进样量:5 µL;柱温:25 ℃。
上述操作条件,系典型操作参数,可根据不同仪器特点,对给定的操作参数作适当调整,以期获得最佳效果。保留时间:噁霉灵约1.8 min,甲霜灵约5.9 min。典型的甲霜灵、噁霉灵液相色谱图见图1、图2。
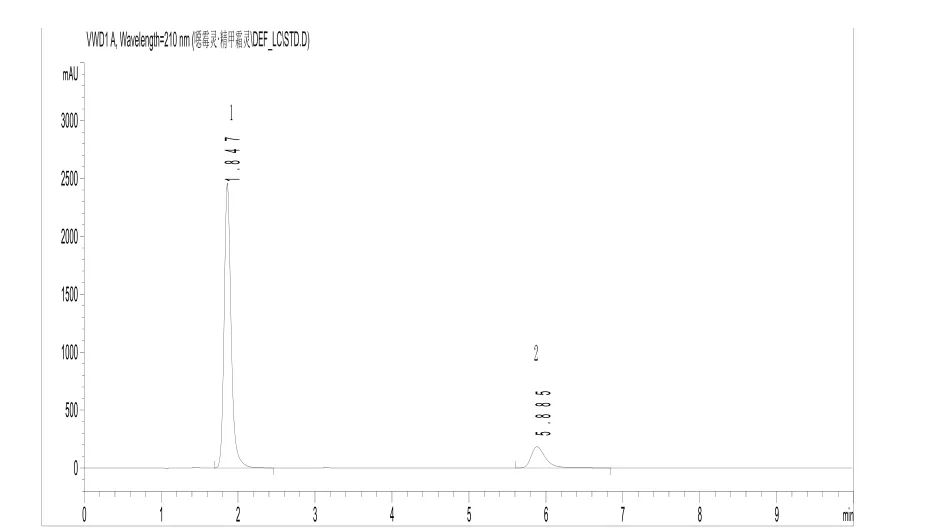
图1 标样液相色谱图(1-噁霉灵、2-甲霜灵)
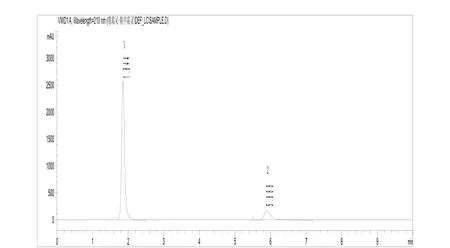
图2 试样液相色谱图(1-噁霉灵、2-甲霜灵)
1.1.3 溶液配制
1.1.3.1 标样溶液的配制
称取甲霜灵标样约30 mg、噁霉灵标样约210 mg (精确至0.000 2 g)于50 mL容量瓶中,用乙腈溶解、定容,摇匀后吸取2 mL至10 mL容量瓶中,再用乙腈定容,摇匀后备用。
1.1.3.2 试样溶液的配制
称取试样约148 mg(精确至0.000 2 g)于50 mL容量瓶中,用乙腈溶解、定容,摇匀、过滤后备用。
1.1.4 测定
在上述操作条件下,待仪器稳定后,连续注入数针标样溶液,直至相邻2针甲霜灵(噁霉灵)响应值相对变化小于1.5%时,按照标样溶液、试样溶液、试样溶液、标样溶液的顺序进行测定。
1.1.5 计算
将测得的2针试样溶液以及试样前后2针标样溶液中的甲霜灵(噁霉灵)峰面积分别进行平均。试样中甲霜灵(噁霉灵)的质量分数X1(%)按式(1)计算:

式中:A1——标样溶液中,甲霜灵(噁霉灵)峰面积的平均值;A2——试样溶液中,甲霜灵(噁霉灵)峰面积的平均值;m1——甲霜灵(噁霉灵)标样的质量,g;m2——试样的质量,g;P——标样中甲霜灵(噁霉灵)的质量分数,%;5——稀释因子。
1.2 甲霜灵R-对映体(精甲霜灵)比例的测定
1.2.1 仪器和试剂
高效液相色谱仪:Agilent 1260,具可变波长紫外检测器;色谱数据处理工作站。
正己烷:色谱纯;异丙醇:色谱纯;水:新蒸2次蒸馏水;精甲霜灵标样(≥98.0%)(北京明德立达农业科技有限公司提供);32%精甲霜灵·噁霉灵种子处理液剂(4%精甲霜灵+28%噁霉灵,北京明德立达农业科技有限公司研制)。
1.2.2 色谱操作条件
色谱柱:250 mm×4.6 mm(i.d.)不锈钢手性柱,内装CHIRALCEL OD-H填充物,粒径5 µm;检测波长:225 nm;流动相:正己烷︰异丙醇=70︰30(体积比);流速:1.0 mL/min;进样量:5 µL;柱温:25 ℃。
上述操作条件,系典型操作参数,可根据不同仪器特点,对给定的操作参数作适当调整,以期获得最佳效果。保留时间:S-对映体约7.2 min,R-对映体(精甲霜灵)约16.3 min。典型的精甲霜灵液相色谱图见图3、图4。
1.2.3 溶液配制
1.2.3.1 标样溶液的配制
称取精甲霜灵标样约10 mg(精确至0.000 2 g)于50 mL容量瓶中,用流动相溶解、定容,摇匀后备用。
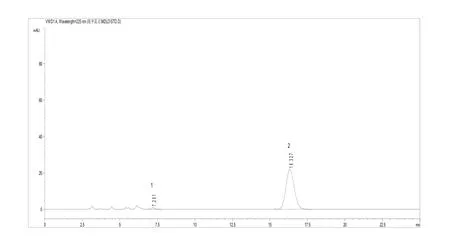
图3 精甲霜灵标样液相色谱图(1-S-对映体、2-R-对映体)
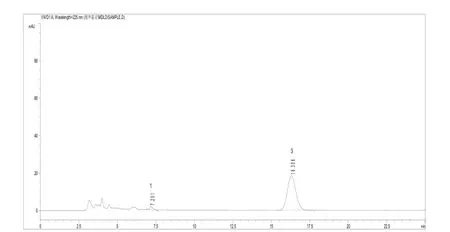
图4 精甲霜灵样品液相色谱图(1-S-对映体、2-R-对映体)
1.2.3.2 试样溶液的配制
称取试样约含精甲霜灵10 mg(精确至0.000 2 g)于50 mL容量瓶中,用流动相溶解、定容,摇匀后备用。
1.2.4 测定
在上述操作条件下,待仪器稳定后,连续注入数针标样溶液,直至相邻2针甲霜灵S-对映体、R-对映体响应值相对变化小于1.5%时,按照标样溶液、试样溶液、试样溶液、标样溶液的顺序进行测定。
1.2.5 计算
试样中甲霜灵R-对映体的比例K,按式(2)计算:

式中:AR——试样溶液中甲霜灵R-对映体峰面积的平均值;AS——试样溶液中甲霜灵S-对映体峰面积的平均值。
试样中精甲霜灵质量分数X2(%)按式(3)计算:
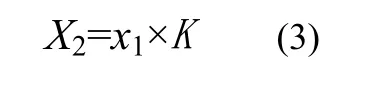
2 结果与讨论
2.1 检测波长的选择
波长直接影响吸收峰面积的大小。对精甲霜灵、噁霉灵和甲霜灵标样溶液分别进行紫外扫描(如图5、图6、图7),从图中可以看出精甲霜灵、噁霉灵和甲霜灵的最大吸收波长分别在195 nm、205 nm和195 nm处。通过对比影响值,发现在甲霜灵、噁霉灵质量分数的测定中选择210 nm作为检测波长比较适宜。在此波长噁霉灵和甲霜灵均具有较强吸收峰,同时杂质影响值小,流动相无吸收。综合考虑多种因素,最终选定210 nm作为同时检测噁霉灵和甲霜灵的波长。同时发现甲霜灵S-对映体、R-对映体在225 nm处均具有较强吸收峰,同时杂质影响值小,流动相无吸收;综合考虑多种因素,最终选定225 nm作为S-对映体和R-对映体的检测波长。

图5 精甲霜灵的紫外吸收图
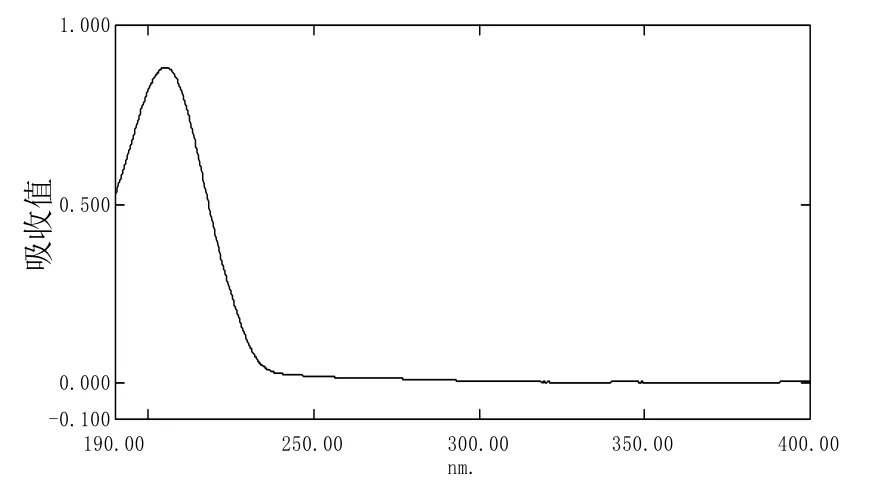
图6 噁霉灵的紫外吸收图

图7 甲霜灵的紫外吸收图
2.2 流动相的选择
在甲霜灵、噁霉灵的检测中,分别采用不同比例的乙腈+水作为流动相对试样进行分离检测,结果发现,乙腈和水的体积比为45︰55时分离效果好,出峰时间短,且色谱峰尖锐,工作效率高。综合以上因素,最终选定乙腈+水(体积比为45︰55)作为流动相。
在精甲霜灵的检测中,分别采用不同比例的正己烷+异丙醇作为流动相对试样进行分离检测,结果发现,正己烷和异丙醇的体积比为70︰30时分离效果好,出峰时间短,且色谱峰尖锐,工作效率高。综合以上因素,最终选定正己烷+异丙醇(体积比为70︰30)作为流动相。
2.3 分析方法的线性曲线
配制5份不同浓度的精甲霜灵(噁霉灵)标样溶液,在上述色谱操作条件下进行分析。以精甲霜灵(噁霉灵)质量浓度为横坐标,峰面积为纵坐标绘制标准曲线,得精甲霜灵线性方程y=19.212 5x+31.050 5,其线性关系系数R2=0.999 3,表明线性关系良好(表1、图8);得噁霉灵线性方程y=18.383 1x+10.651 7,其线性关系系数R2=0.999 5,表明线性关系良好(表1、图9)。
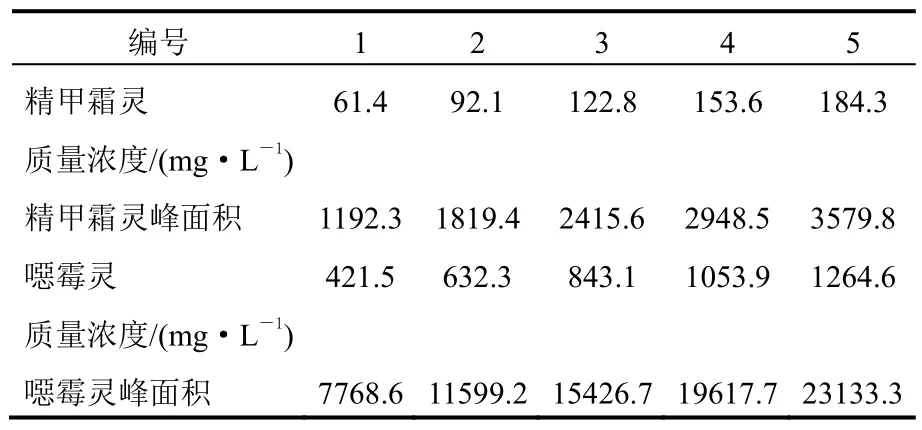
表1 分析方法的线性试验数据

图8 精甲霜灵线性关系图
2.4 分析方法的精密度
在上述色谱条件下对同一个样品进行5次平行测定,计算精甲霜灵、噁霉灵的标准偏差、变异系数(表2)。
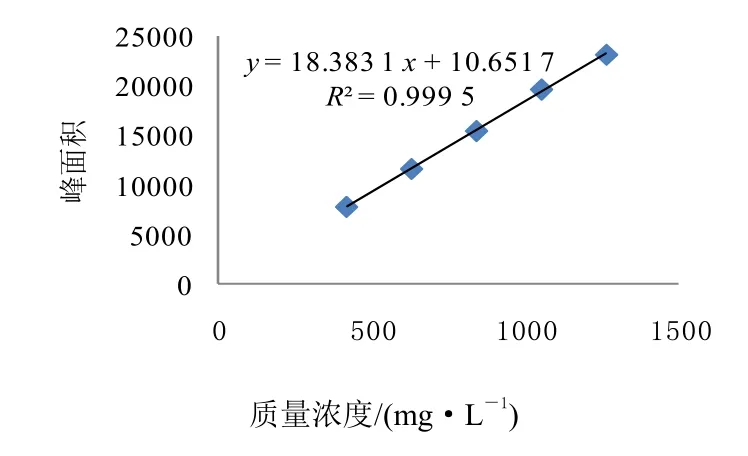
图9 噁霉灵线性关系图
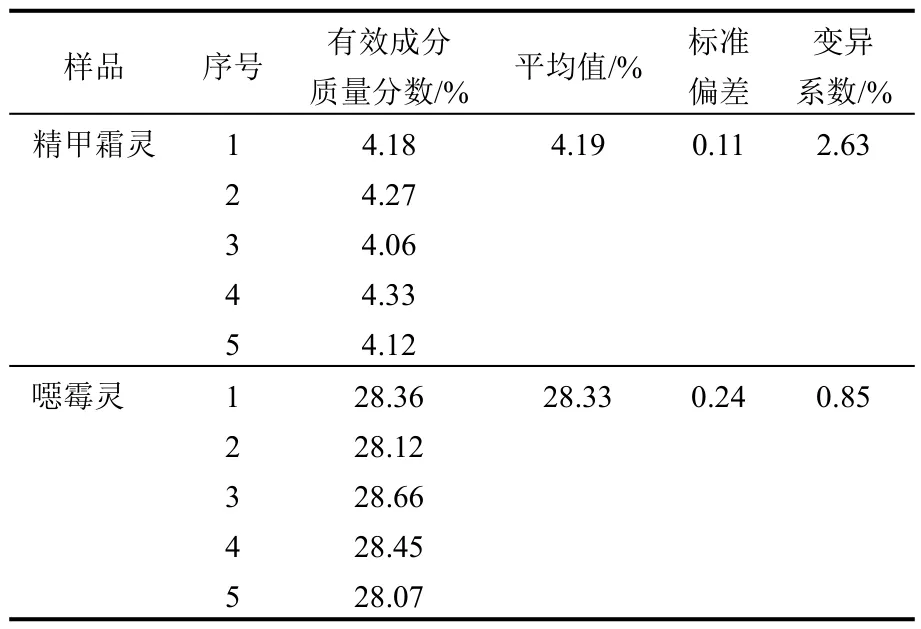
表2 32%精甲霜灵·噁霉灵种子处理液剂精密度测定
由表2看出,此方法的标准偏差和变异系数都较小,精密度较高。
2.5 分析方法的回收率
为检测分析方法的准确度,测定产品的回收率。在已知含量的32%精甲霜灵·噁霉灵种子处理液剂中分别加入一定量的精甲霜灵、噁霉灵标样,在上述色谱条件下,对各试样中精甲霜灵、噁霉灵进行分析,重复5次,计算回收率(表3)。

表3 32%精甲霜灵·噁霉灵种子处理液剂高效液相色谱测定法准确度
由表3看出,此方法平均回收率在99.5%以上,准确度较高,方法可行。
3 结 论
本文中提出的32%精甲霜灵•噁霉灵种子处理液剂中有效成分质量分数的分析方法具有可行性,准确度和精密度较高,且简便、快速。
[1] 刘长令. 世界农药大全:杀菌剂卷[M]. 北京: 化学工业出版社, 2006:84-86.
[2] 刘西莉, 马安捷, 林吉柏, 等. 精甲霜灵与外消旋体甲霜灵对掘氏新烟碱类杀虫剂残留[J]. 烟草化学, 2011, 12: 52—55.
[7] 吕岱竹, 罗金辉, 王明月, 等. 超高压液相色谱-串联质谱法测定含硫蔬菜中烟碱类农药残留[J]. 农药, 2011, 50(5): 359—361.
[8] 庄乾坤, 郑和辉, 卞战强, 等. 我国常用三类化学农药的色谱检测方法研究进展[J]. 环境健康杂志, 2015, 32(3): 272—275.
[9] 黄庆, 欧晓明, 欧阳承虎, 等. 新烟碱类农药在环境介质中的残留检测方法研究概况[J]. 世界农药, 2013, 35(2): 37—42.
[10] NY/T 761-2008. 蔬菜和水果中有机磷、有机氯、拟除虫菊酯和氨基甲酸酯类农药多残留的测定[S]. 北京: 中国农业出版社,2008.疫霉菌的抑菌活性比较[J]. 农药学学报, 2003, (3): 45-49.
[3] 孙娟, 吕承德. 杀菌剂噁霉灵现状和发展前景[J]. 中国农药, 2009, (9): 22-25.
[4] 朱卫刚, 胡伟群, 陈杰. 精甲霜灵和噁霉灵复配对辣椒猝倒病的联合毒力[J]. 农药, 2010, (12): 920-921.
[5] 梁有, 赵金尧, 周恩荣, 等. 反相液相色谱法测定烟叶中精甲霜灵残留[J]. 现代农药, 2013, (1): 40-43.
[6] 谭智勇, 郭正元. 稻谷中噁霉灵残留气相色谱检测方法研究[J]. 农药科学与管理, 2011, (4): 29-31.
[7] 崔林燕. 3%甲霜•噁霉灵水剂的气相色谱分析[J]. 现代农药, 2012, (4): 37-39.
Analysis of Metalaxyl-m and Hymexazol 32% LS by HPLC
GAO Jing-yu,Pan Jing,XU Yan,MA Chao,DONG Qin,LIU Run-feng
(Beijing MindleaderAgroscience Co., Ltd., Beijing 100085, China)
A method was developed for the determination of metalaxyl-m·hymexazol 32% LS by HPLC in this paper. Quantitative analysis of hymexazol and metalaxyl was carried out using acetonitrile and water as mobile phases using ZORBAX SB-C18as filler. The ratio of metalaxyl R-enantiomer (mefenoxam) was performed using n-hexane and isopropanol as mobile phase and CHIRALCEL OD-H as filler. The results showed that the standard deviations, coefficients of variationand average recovery ratesofmetalaxyl-m and hymexazol were 0.11, 2.63%, 98.89% and 0.24, 0.85%, 99.68%, respectively. This method has the advantages of high precision and accuracy, simple, fast, good separation.
metalaxyl-m; hymexazol; HPLC; analysis
10.16201/j.cnki.cn31-1827/tq.2016.06.11
TQ450.7
:A
1009-6485(2016)06-0047-04
高敬雨(1993—),男,河北省邯郸市人,工程师,主要从事农药制剂加工研究工作。Tel: 010-62975002,E-mail: gaojingyu@mdldagro.com。
2016-11-17。
