新一代杀虫剂
——在叶部能稳定应用的dsRNA
2017-01-12李本杰徐汉虹编译
李本杰,徐汉虹 编译
(天然农药与化学生物学教育部重点实验室 华南农业大学,广州 510642)
新一代杀虫剂
——在叶部能稳定应用的dsRNA
李本杰,徐汉虹 编译
(天然农药与化学生物学教育部重点实验室 华南农业大学,广州 510642)
在过去10年间,人类对RNA分子生物学的认识有了显著的提高。其中一个重大的进步是RNA干扰(RNAi)的发现,RNA干扰是利用约18~30个核苷酸的非编码RNA来调控基因和基因组的表达,调控可以发生在染色体合成、染色体分离、转录、RNA修饰和RNA 翻译等过程中。小RNA一般抑制基因的表达和调控,此被称为RNA沉默。
RNA干扰主要被用来研究细胞功能,即将目的基因沉默,然后研究基因沉默的影响。虽然目前对于RNA干扰技术来说,并不是每一种方法都能把dsRNA导入每种昆虫、每个发育阶段的虫体或基因,但该技术仍然拥有非常广阔的应用前景。
起初,进行昆虫RNA干扰研究是直接将dsRNA注射到虫体,故试验需要较多的人力。在过去的6年间,通过其他方法获得了许多RNA干扰试验的成功。特别需要注意的是,其与作物保护具有相关性,研究发现数种昆虫摄入体外合成的dsRNA能有效防治这些昆虫。由此有人提出dsRNA可以被用于防治病害,应用于转基因作物防治害虫。研究发现在转基因植物体内表达的dsRNA能够使玉米根叶甲幼虫发育不良和死亡,这启发人们认为dsRNA可能会成为重要的害虫防治方法。dsRNA具有高度特异性,以及表达dsRNA的转基因作物不会产生引起过敏性反应的蛋白,这些都有力地支持了此观点。
dsRNA的长度会影响RNA干扰的效果。饲喂研究中使用的dsRNA长度为134~1 842 bp,dsRNA的最佳长度由多种因素决定。到目前为止,很少对饲喂试验所需dsRNA的最佳长度进行过系统评估研究。Bolognesi等人研究了不同长度dsRNA对南方玉米根虫的影响,结果表明240 bp的dsRNA防治效果最好。
马铃薯甲虫[Leptinotarsa decemlineata (Say)]隶属于鞘翅目叶甲科,是马铃薯(Solanum tuberosum L.)的主要害虫,同时还可危害番茄(S. lycopersicum L.)、茄子(S. melongena L.)等茄科植物。马铃薯是马铃薯甲虫的主要寄主,马铃薯在世界范围内的广泛种植,使马铃薯甲虫短时间内就从美国西南部和墨西哥传播到了欧洲、中东、中亚、和中国西部,并且有进一步扩散到亚洲其余地区、南美、非洲和大洋洲的趋势。
马铃薯甲虫取食量大,繁殖率高,传播途径广,对马铃薯造成巨大危害。马铃薯甲虫的防治主要依赖杀虫剂,最初使用滴滴涕防治,但抗药性问题很快凸显。农药对马铃薯甲虫的高选择压力使马铃薯甲虫对多种杀虫剂产生了抗性和交互抗性,现在马铃薯甲虫已经对大多数类型的杀虫剂产生了抗药性。仅在北美地区,马铃薯甲虫每年造成的经济损失和防治费用就在1亿美元以上。
尽管dsRNA具有作物保护潜力,但这类分子(不是转基因作物表达的dsRNA)在环境中不能长时间稳定存在,已有研究报道在土壤中dsRNA的半衰期很短。本文研究表明在温室条件下,dsRNA叶部施用可以稳定存在28 d以上,并且随着叶片干燥dsRNA并不会随水分流失而消失。试验结果证明了叶部施用dsRNA防治害虫可行,拓宽了RNA干扰技术在植物保护领域的应用。
1 材料与方法
1.1 马铃薯甲虫
试验所用马铃薯品种为Yukon gold,温室生长,种植于直径10 cm的花盆内,种植土壤为郎伯土。马铃薯甲虫饲养于养虫笼内,用4周大小的马铃薯叶片饲喂,光周期12︰12(L︰D),温度恒定25 ℃。成虫产卵后,将卵及时移于同样的饲养条件下,观察并记录卵的孵化。小心的用干净挑虫笔将1龄幼虫转移到马铃薯叶片,挑选大小相同的2龄幼虫称重后继续用于后续试验。
1.2 马铃薯甲虫肌动蛋白基因cDNA全序列的克隆
用TRIzolTM(Invitrogen, Carlsbad, CA)分离马铃薯甲虫2龄幼虫的总RNA。为了确保样品中不含有DNA,加入2 U/μL的DNase1(Ambion, Grand Island,NY),在37 ℃反应1 h,然后用苯酚︰氯仿(24︰1)提取,再用氯仿提取。剩余的RNA用异丙醇沉淀,用70%乙醇冲洗,用不含核酸酶的水(Promega,Madison,WI)重新悬浮,浓度为0.2 μg/μL。参照文献报道,用FirstChoice®RLM-RACE试剂盒(Invitrogen)和马铃薯甲虫肌动蛋白基因的特异性引物进行5′和3′RACE反应(5′反应用CPB 肌动蛋白R,3′反应用CPB 3′RACE internal F)(表1)。用Wizard® SV凝胶及PCR纯化系统(Promega)纯化PCR电泳阳性条带物质(含0.5 μg/mL嗅化乙锭的1%琼脂糖凝胶电泳),在康奈尔大学基因组测序中心用相同的基因特异性引物测序。
以分离纯化的RNA为模板,用GoScript™逆转录酶系统(Promega)合成cDNA第一链。进行PCR反应,其(50 μL)包含10 μM CPB 肌动蛋白F和CPB肌动蛋白R引物(表1),1 μL cDNA第一链,25 μL2× GoTaq® Green Master Mix(Promega),22 μL不含核酸酶的水(Promega)。PCR反应条件为:95 ℃预变性2 min;然后是95 ℃变性30 s,50 ℃退火30 s,72 ℃延伸1 min,共进行35个循环;最后72 ℃终延伸10 min。对适当大小的PCR产物切胶,纯化,连接到pGEM®-T Easy 载体(Promega),利用热休克蛋白法转化到JM109感受态细胞。菌落PCR验证正确的阳性单克隆在含100 μg/mL氨苄青霉素的LB液体培养基中培养过夜。使用Pure Yield™ Plasmid Mini prep System (Promega)提取质粒,然后用载体引物SP6和T7测序验证,得到马铃薯甲虫激动蛋白基因的cDNA全序列,用DNASTAR Lasergene 11软件对8个马铃薯甲虫个体(2龄幼虫、4龄幼虫、蛹和成虫各2个,不区分性别)的激动蛋白基因的cDNA全序列进行分析,比较序列之间的差异性,并组装测序片段。
1.3 EGFP和家蝇肌动蛋白
选择EGFP基因(U76561)作为阴性对照,以购买的质粒(Clontech, Madison, WI)为模板,PCR扩增EGFP片段(引物为EGFP F/EGFP R)(表1),随后连接到T-easy载体,并测序验证。以T载体为模板,利用T7和EGFP T7R引物扩增EGFP基因5′端303 bp的片段(碱基对-3~300,从起始密码子算起),该片段被用于后续dsRNA的合成。
试验所用家蝇为aabys品系。为了得到家蝇(Musca domestica)肌动蛋白的部分cDNA序列,首先提取家蝇成虫的总RNA,反转录得到cDNA,过程同马铃薯甲虫一致。根据一段未确定的序列(JN969088)设计引物Md Actin F和Md Actin R,扩增肌动蛋白基因片段(该片段在家蝇基因组位置为LOC101901018),测序验证后的片段作为合成353 bp dsRNA的模板(引物为T7和Actin T7 R353)。
1.4 dsRNA合成
用于dsRNA合成的PCR产物(马铃薯甲虫、家蝇和EGFP)均以质粒为模板扩增的。PCR反应体系为GoTaq® Green Master Mix(Promega)、载体特异性的T7启动子和基因特异性的反向引物T7启动子。PCR反应条件为:95 ℃预变性2 min;然后是95 ℃变性30 s,50 ℃退火30 s,72 ℃延伸1 min,共进行35个循环;72 ℃终延伸10 min。PCR终产物回收纯化后用作dsRNA合成的模板,用AmpliScribeTMT7-flashTMtranscription kit (Epicentre,Madison,WI)进行合成。反应孵育时间增加至7 h,反应和纯化均参照说明书进行。用添加0.5 μg/mL溴化乙锭的1%琼脂糖凝胶电泳对纯化的dsRNA定性,用分光光度计(NanoDrop 2000;NanoDrop Technologies,Wilmington,DE)定量。在合成所有dsRNA的过程中用到的引物列于表1。载体特异性的T7引物是引物对中的一个。因此,所有dsRNA(除了266 bp替代dsRNA)除了含有基因特异性的序列外还含有60 bp的载体序列。把含有该60 bp片段的从350 bp载体合成的dsRNA,单独饲喂给2龄马铃薯甲虫,对马铃薯甲虫的生长和存活没有影响(文中未列出数据)。用于和T7引物协同合成了以下区域的马铃薯甲虫dsRNA的反向引物有:297 bp=CPB Actin T7 R297,208 bp=CPB Actin T7 R208,102 bp=CPB Actin T7 R102,50 bp= CPB Actin T7 R50,266 bp替代dsRNA=CPB Actin T7 R266A(CPB Actub T7 F2A为正向引物)。
1.5 室内饲喂试验
用马铃薯叶片进行饲喂试验:在一次性纸杯的底部钻一个直径12 mm的圆孔,放上一个装满水的8 mL的小瓶(Thermo Scientific,Rockwood,TN),用封口膜封口。用镊子在封口膜上扎一个小孔,然后将一片重约为1.3 g的马铃薯叶片(所有的叶片大小相近)的叶柄浸入水中。用吸管分别吸取200 μL液体(含5 μg actin-dsRNA、5μg EGFP-dsRNA 或蒸馏水)均匀涂抹在叶表面。干燥30 min后,每片叶接种2头2龄马铃薯甲虫。在纸杯口用穿孔塑料覆盖后,用橡皮筋固定;置于光周期12︰12(L︰D),恒温25 ℃室内培养7 d,及时向样品瓶内补充水分。4 d后,向每个处理添加未经处理的新鲜叶片。7 d后,记录马铃薯甲虫的重量、龄期和死亡率。

表1 试验所用的引物序列
1.6 温室试验
分别用5 μg的马铃薯甲虫actin-dsRNA、EGFP-dsRNA或自来水处理大小均一的马铃植株(生长4周的马铃薯),然后用挑虫笔小心的将预先称重的马铃薯甲虫接种到植株上,马铃薯甲虫可以在植株上自由活动和取食。7 d后,从植株上移取马铃薯甲虫,称重,记录重量、龄期和死亡情况。再选取2龄幼虫接种到原植株上,饲养7 d。actin-dsRNA处理的植株上虫口数为12~92头,平均每株48头,EGFP或自来水处理的对照组每株植物虫口数4~24头,平均每株15头。当EGFP或水处理的对照组植株上幼虫过多时,改用新的植株经相同处理后继续作对照处理,马铃薯甲虫actin-dsRNA处理的植株在整个试验期间不更换(仅有2龄和3龄幼虫取食)。试验开始4周后,因为actin-dsRNA处理组植株受到温室内的蓟马侵染而终止。每个处理含有5~22棵植株(总计3个重复),整个试验过程共重复6次。试验分别在2月(冬季条件,重复3次)和8月(夏季条件,重复3次)进行,不同季节的试验结果没有明显差异。晴天时,温室外紫外线辐射量为(6.9±0.2) mW/cm2,室内为(2.8±0.1) mW/cm2。
1.7 叶片对dsRNA的吸收
在1.7 mL的样品管内加入含有5 μg的马铃薯甲虫actin-dsRNA(297 bp)或5 μg EGFP-dsRNA 200 μL的水溶液,将叶柄浸入液体中,设置清水为对照。约1 h后,叶片将样品瓶内液体全部吸收后,继续向瓶内添加200 μL原溶液,共重复添加5次,即叶片总计吸收1.2 mL溶液。然后将叶片用于饲喂试验,验证叶片是否可以通过这种方式吸收dsRNA。
1.8 叶片冲洗试验
为了确定dsRNA是否可以在降雨条件下稳定存在,将叶柄按上述方法浸入含dsRNA的溶液中吸收1 h。1 h后,将叶片浸入250 mL清水中,并不断振荡,随后干燥0.5 h,进行饲喂试验。
1.9 紫外照射试验
为了确定dsRNA在紫外照射下的稳定性,将含5 μg CPB actin-dsRNA(297 bp)或5 μg EGFP-dsRNA或自来水的200 μL水溶液加入玻璃滴试板(85 mm ×100 mm; Corning GlassWorks, Corning, NY)上,利用紫外交联仪(Spectronics, Corp., Westbury, NY)分别照射0 h、0.5 h、1 h或2 h(254 nm, 1 500 μW/cm2),用双蒸水将各处理体积补足至200 μL。取10 μL处理液,通过琼脂糖凝胶电泳检测dsRNA完整性,剩余190 μL处理液均匀涂抹到马铃薯叶片上,然后进行室内饲喂试验。
1.10 内吸性检测
试验选用生长在温室中的4周的马铃薯植株,分别用5 μg的CPB actin-dsRNA(297 bp)或EGFP-dsRNA,以及自来水处理植株,每处理仅用药液处理1个马铃薯植株的1片叶。试验共分2组,第1组处理后立刻接种马铃薯甲虫,第2组处理24 h后再接种。第1组EGFP-dsRNA或水处理(对照)的叶片上接种1头2龄幼虫,然后用穿孔的塑料膜将叶片密封,防止马铃薯甲虫移动到其他未处理的叶片上;1头2龄幼虫接种于同一植株上未处理的叶片上。
2 结果与分析
2.1 CPB actin cDNA全长序列的克隆
以马铃薯甲虫2龄幼虫的cDNA为模板,5′和3′RACE扩增得到了马铃薯甲虫肌动蛋白基因的全长cDNA,5′RACE产物大小约为300 bp,3′RACE产物大小约为1 100 bp。利用引物CPB Actin F和CPB FLR进行PCR扩增,得到了actin基因的全长序列(GenBank accession number KJ577616)。通过与其他种类甲虫的actin基因进行BLAST比对,确认克隆的cDNA是CPB actin基因序列。该肌动蛋白序列与先前确定的部分肌动蛋白基因序列完全相符,比较8个不同个体的全长cDNA序列,共发现4处碱基替换,分别是C99T(5个个体是C,3个个体是T);A420G(4个A,3个G,1个异质结合);C663T(7个C,1个是T);C825T(7个是C,1个是T)。这些都是非同义突变,目前尚不清楚这些替换发生的原因。
2.2 浓度-反应生测
试验结果表明,CPB actin-dsRNA有明显的浓度-反应关系(表2)。每叶5 μg和10 μg的actin-dsRNA对马铃薯甲虫幼虫毒性很高,幼虫取食10、5 μg CPB actin-dsRNA处理的叶片3 d内停止取食,4 d后,开始死亡,取食5 μg actin-dsRNA处理叶片的所有幼虫都不能发育到4龄,体重轻,只有对照的8%,死亡率达到98%。2.5 μg actin-dsRNA处理组的幼虫体重增长明显受到抑制(分别是EGFP-dsRNA和水对照处理的39%和41%),生长缓慢,有75%的幼虫不能发育到4龄,死亡率达到77%。1.0 μg actindsRNA处理组的幼虫体重增长也明显小于2个对照组,并且叶片的消耗量明显减少,但是没有滞育和死亡现象发生。0.5 μg actin-dsRNA处理组与对照组没有明显差异。
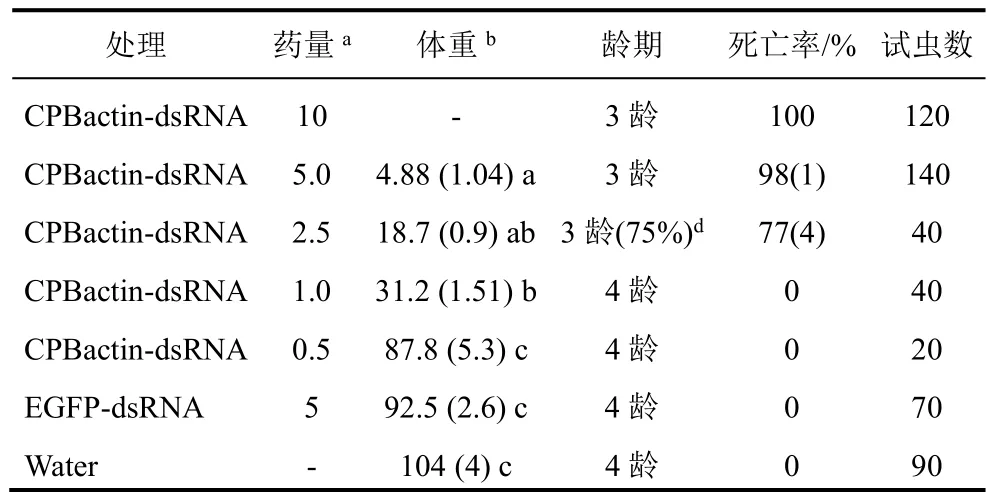
表2 actin-dsRNA叶面施用后7 d对马铃薯甲虫2龄幼虫的影响
CPB actin-dsRNA的生物活性(体重、发育和死亡)与肌动蛋白RNA双链的长度呈负相关性(表3)。297 bp dsRNA处理组的死亡率高于208 bp dsRNA处理组,其余更短的dsRNA处理组在7 d后没有虫死亡。297、208 bp dsRNA处理组的幼虫均不能发育到4龄,102 bp dsRNA处理组仅有45%的幼虫能够发育到4龄,50 bp dsRNA处理组同对照组一样,所有幼虫均能生长到4龄。297、208、102 bp dsRNA处理组明显抑制了幼虫的体重增长,其次是50 bp dsRNA处理组,这些处理组的幼虫体重增长量均明显低于对照组。dsRNA 266-A(改变dsRNA合成的模板区域)(图2)处理组对马铃薯甲虫的生物活性效果与297 bp dsRNA处理组基本相同。家蝇353 bp actindsRNA(与马铃薯甲虫actin dsRNA序列相似度80%)处理组对马铃薯甲虫的体重和死亡有重要的影响(表2和表3)。
2.3 温室饲喂试验
CPB actin-dsRNA处理马铃薯植株叶片后,对其保护作用至少能持续4周(表4)。actin-dsRNA处理4周后,同处理后1、2、3周一样,明显抑制了马铃薯甲虫体重增长,造成马铃薯甲虫滞育和死亡(表4)。用5 μg actin-dsRNA处理叶片后,将2龄幼虫置于叶片上后,在2~3 d内停止取食。actin-dsRNA处理后3 d内幼虫停止取食,与对照处理相比,植株受损非常小。图4展示了actin-dsRNA对马铃薯植株保护作用,actin-dsRNA处理组的叶片受损很小,并且可以继续生长,但对照组的叶片已经几乎全部脱落。
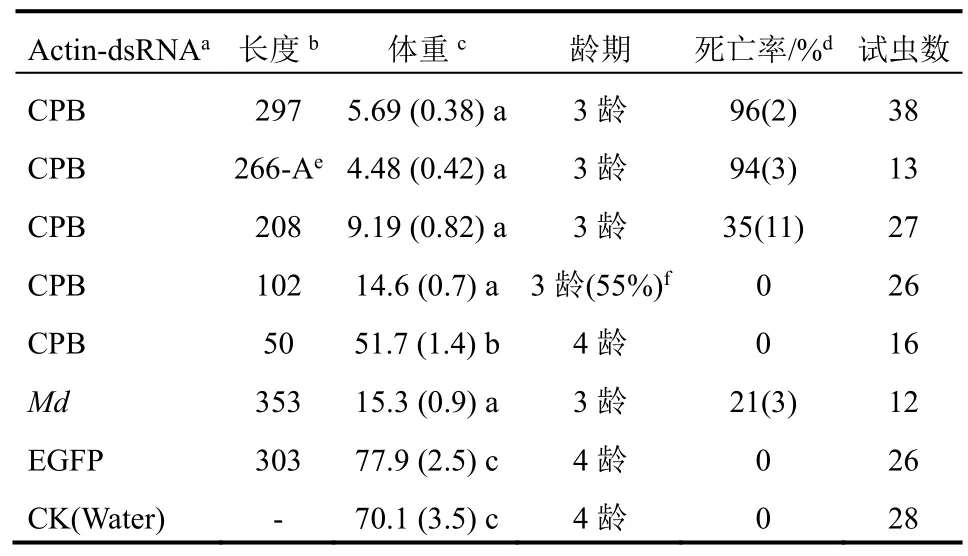
表3 不同长度actin-dsRNA叶面施用后7 d对马铃薯甲虫2龄幼虫的影响(剂量5 μg/叶)
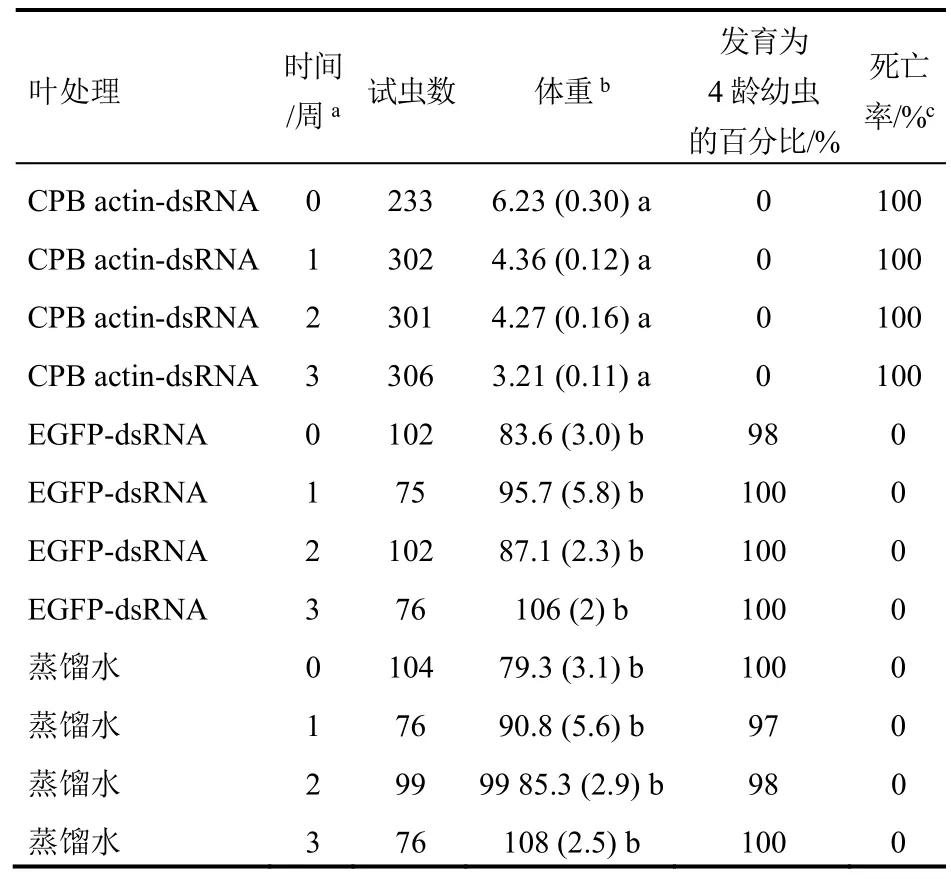
表4 温室条件下dsRNA的稳定性
2.4 叶片对dsRNA的吸收
将马铃薯叶柄浸入含actin-dsRNA的溶液,通过饲喂试验分析叶片能否通过叶柄吸收dsRNA。试验结果列于表5。由试验可知,与EGFP-dsRNA和清水对照相比,actin-dsRNA处理组的马铃薯甲虫幼虫体重增长明显受到了抑制,分别为EGFP-dsRNA和清水对照的25%和24%,有49%的幼虫不能正常发育到4龄,23%的幼虫死亡。这说明水中的dsRNA能被叶柄吸收运输到叶片。但是通过叶柄吸收对马铃薯甲虫的防治效果不如叶面施用高。
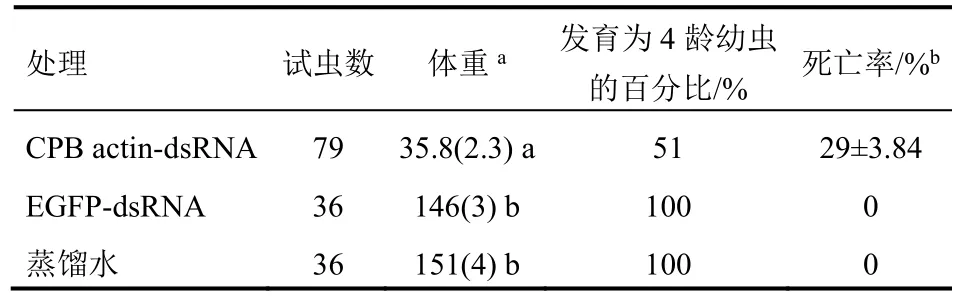
表5 叶柄吸收dsRNA
2.5 叶片冲洗试验
由试验结果(表6)可知冲洗组和未冲洗组在抑制幼虫体重增长、滞育和致死效果没有明显差异,这表明dsRNA并没有被水显著地冲洗掉,actindsRNA处理组对马铃薯甲虫的防治效果明显优于对照组。
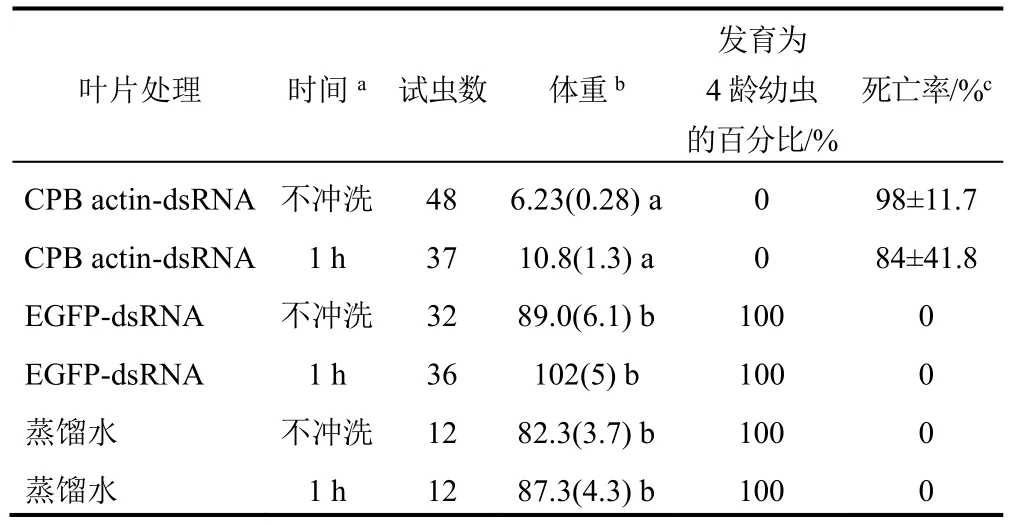
表6 dsRNA被叶片吸收后被水冲淋的稳定性
2.6 紫外照射下dsRNA的稳定性
室内饲喂试验和琼脂糖凝胶电泳的结果均表明:将CPB actin-dsRNA置于玻璃皿表面,用254 nm紫外线(光强1 500 μW/cm2)照射数小时后,dsRNA就会失去活性(表7)。紫外照射30 min后,虽然电泳结果显示dsRNA已经有部分降解,但饲喂试验结果表明actin-dsRNA的活性并没有受到影响。紫外照射1 h的actin-dsRNA处理的叶片饲喂试验中,马铃薯甲虫幼虫体重增长明显受到了抑制,分别为EGFP-dsRNA和清水对照的27%和26%,有44%的幼虫不能发育到4龄,31%的幼虫死亡。试验所用的紫外交联仪发出的紫外强度是地球表面紫外线强度的1.5倍。
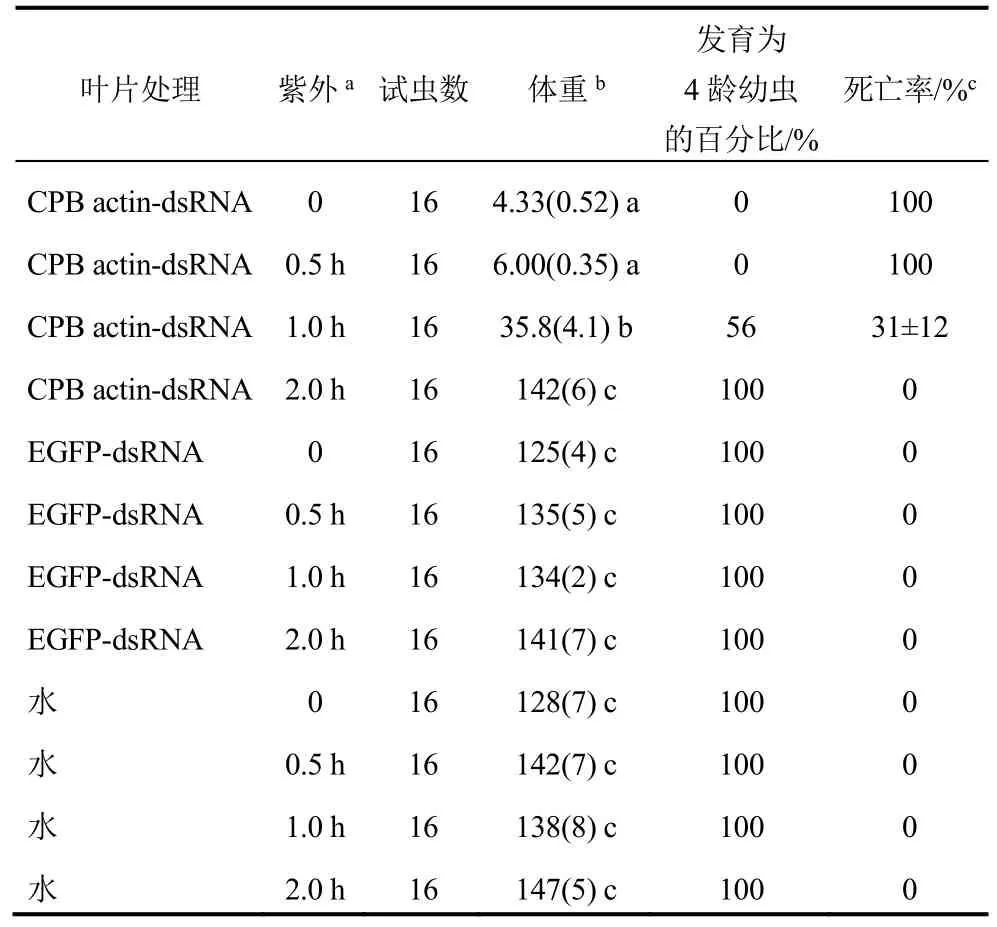
表7 紫外处理后dsRNA的稳定性
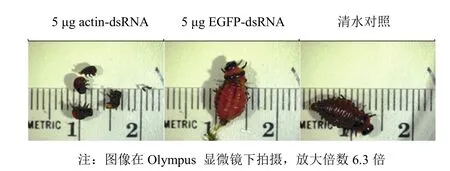
图1 2龄马铃薯甲虫取食经actin-dsRNA处理叶片7 d后,出现滞育和死亡现象

图2 马铃薯甲虫肌动蛋白基因序列缩略图

图3 用作dsRNA合成模板的马铃薯甲虫和家蝇肌动蛋白基因序列比对(二者的相似度80%)
2.7 内吸性
将2龄幼虫分别接种到同一植株不同叶片(用actin-dsRNA处理和未用actin-dsRNA处理)后,只有actin-dsRNA处理叶片上的幼虫受到了影响,其余幼虫(actin-dsRNA处理后立刻接种到未处理叶片和处理24 h后接种到未处理叶片)均没有受到影响(表8)。

图4 不同处理的叶片受损对比(actin-dsRNA处理叶片受损程度明显小于对照组)
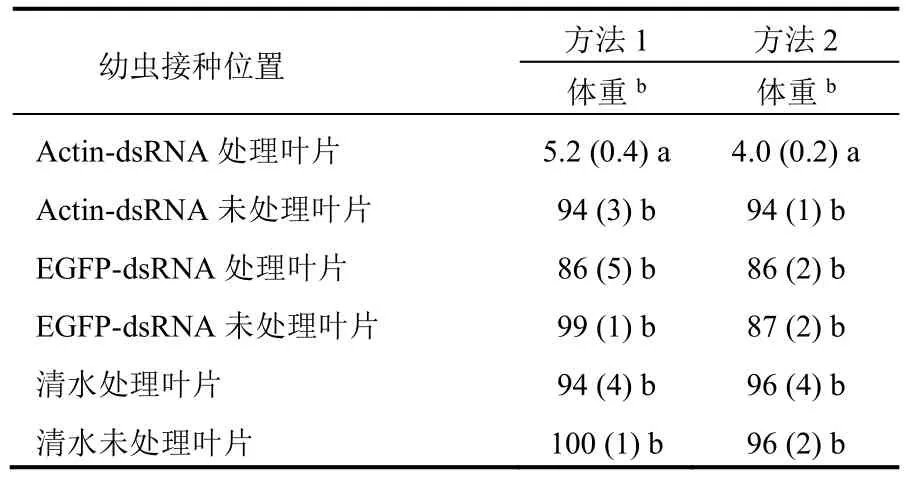
表8 dsRNA处理叶片后,不能对同一植株上的非处理叶片提供保护a
3 讨 论
试验结果证明了dsRNA叶部施用足够稳定,温室条件下持效期在28 d以上。在施药后28 d植株的高度增加了1倍,但dsRNA仍然保持着非常高的活性。温室试验的结果表明dsRNA在田间条件下同样有效,因为dsRNA一旦在叶片上干燥后不易被水冲淋掉。dsRNA不被水冲淋掉的原因尚不清楚,可能是因为马铃薯叶片上大量存在的毛状体吸附了dsRNA,或者是因为dsRNA进入了植株内部,这些都需要进一步的研究还需要进一步研究在田间条件下dsRNA施用于不同种类植物表面的半衰期。在dsRNA商品化之前,需要开发dsRNA经济有效的批量生产方法。dsRNA在叶片施用后没有内吸性,需要开发合理的施药方式,使dsRNA能完全覆盖叶片,从而使防治效果最大化。actin-dsRNA的叶用量多于5 μg时,其防治效果与5 μg/叶的处理没有明显差异,害虫的取食时间也没有减少。这说明5 μg/叶为actin-dsRNA的最佳使用量。本文中没有测定actin基因的表达量,但先前的研究表明马铃薯甲虫食用CPB actin-dsRNA后,actin基因的表达会受到抑制,这可能就是dsRNA的作用机制。
马铃薯叶片能够通过叶柄有效地吸收dsRNA,但对马铃薯甲虫的防治效果明显低于叶片直接施药的。Hunter等证明了dsRNA能够被根吸收,但尚不明确这种转运方式的效率,以及这种施药方式防治害虫所需的dsRNA的量,需要进行大量的工作进行研究。
紫外光照能破坏核酸,故常用紫外线来杀菌。假设dsRNA在环境中不能稳定存在,Keri San Miguel等人研究了破坏dsRNA所需要的紫外光量。结果表明紫外照射1~2 h,在饲喂试验中dsRNA就对2龄马铃薯甲虫无活性。温室条件下actin-dsRNA的活性至少可保持4周,说明在叶表面的dsRNA要比用于紫外照射稳定性研究的玻璃表面上的dsRNA稳定。
dsRNA能够被植株的根吸收,然后运输到叶,但不清楚dsRNA被叶片吸收后,能否运输到未处理的叶片。温室条件下的内吸性试验结果显示,dsRNA处理一部分叶的植株上的非处理叶片对马铃薯甲虫没有影响。这说明dsRNA不能从一个植株的处理叶转移到非处理叶,或从处理叶转移到非处理叶的dsRNA的量很少,不足以产生生物活性。
本试验用肌动蛋白证明了dsRNA用于害虫防治的稳定性,但由于不同物种间肌动蛋白基因具有高度相似性,所以试验所用的肌动蛋白可能在实际应用中并不是最佳选择。例如,家蝇的肌动蛋白与马铃薯甲虫的相似度为80%,而家蝇的actin-dsRNA对马铃薯甲虫仍然有很高的生物活性。尽管可以通过精心选择dsRNA靶标基因区域,来提高dsRNA的物种特异性,但如果要实现种特异性害虫防治的目标,就需要选择在不同种间序列保守性低的基因做模板,合成专用于防治某一种生物的dsRNA。
5 结 论
马铃薯叶面施用针对马铃薯甲虫肌动蛋白基因的dsRNA能够有效的防治该害虫,温室条件下,dsRNA对作物的保护作用可以持续28 d以上,dsRNA在叶面干燥后不易被水冲淋掉。以上结果表明叶部施用dsRNA能够成为一种有效的害虫防治策略。
10.16201/j.cnki.cn31-1827/tq.2016.06.01
TQ450
:A
1009-6485(2016)06-0001-07
李本杰(1989—),男,博士研究生,山东菏泽人。E-mail:18320728261@163.com。
徐汉虹(1961—),男,教授,博士生导师。E-mail: hhxu@scau.edu.cn。
2016-10-11。
