微生物作用下金的生物地球化学循环及其应用1
2017-01-12李雪珍许心雅孟丹杰程扬健
黄 振,李雪珍,许心雅,孟丹杰,程扬健*
(福州大学 环境与资源学院,福建 福州 350108)
微生物作用下金的生物地球化学循环及其应用1
黄 振,李雪珍,许心雅,孟丹杰,程扬健*
(福州大学 环境与资源学院,福建 福州 350108)
微生物对金的转化和循环有着重要作用,推动了金的生物地球化学循环过程。自然界中微生物先把矿石中的金溶解沥滤出来,再通过微生物的吸附,累积,最后被矿化成二次金,使金在环境中不断循环。文章从能够富集金的微生物种类,及其作用机理和过程进行概述,阐述了微生物在金的生物地球化学循环中所起的作用,有助于理解和推动利用微生物回收金尾矿和含金废弃物中的金元素研究的不断发展进步。
微生物;金;生物地球化学循环;二次成矿
微生物在地球表面分布广泛,种类繁多,在自然界C、N、S、P、O、H、Fe、Mn等多种生命元素的转化和循环中发挥着不可忽略的作用,维持了自然界的生态平衡,推动了地球生物化学循环[1-2]。大部分金属在自然界中的循环依赖于微生物,一些金属如Fe、Mn是微生物的必要营养成分,另一些金属离子特别是重金属离子Ag+、Hg2+、Zn2+、Pb2+、CrO42-、Cu2+等被微生物氧化或还原以获取新陈代谢能量[3]。
金在自然界主要以Au0、Au+和Au3+三种价态存在,在空气中非常稳定,不会与氧形成氧化物,在高温熔融状态下也不与氧反应[4-5]。金是种惰性贵重金属,在地表水中不会形成游离的金离子,但是金的配合物很稳定。在原生矿床中,自然金通常与银,铜,铝,铁,铅,锌等金属以合金的形式同时存在,金的含量通常在50%~80%(wt)[6]。在富含金属的水热流体中,金与硫复合形成硫化物和二硫化物从而具有化学流动性。在这些溶液中形成的沉积物形成了含金硫化物,并产生了黄铁矿和砷黄铁矿。在表生矿床,金的化学流动性与这些硫化矿物的风化作用,氧化作用及络合作用均有关联[7]。在地表环境下,金在水溶液中以胶体金,一价金和三价金复合物存在。由于Au(Ⅰ)(1.68 V)和Au(Ⅲ)(1.50 V)的标准氧化还原电位都超过了水(1.23 V),这使水中游离的金离子在热力学上是不稳定的,基于热力学推算和自然界中丰富配体的存在,水中Au(Ⅰ/Ⅲ)与硫代硫酸盐和氯形成的复合物成为水中极少含有机质的金的重要复合物[8]。硫代硫酸盐可溶解金,形成一价金与硫代硫酸盐的复合物[Au(S2O3)23-],并能在适度氧化和还原环境中保持稳定。在干旱和半干旱地区,含有高浓度氯的氧化性地表水也能溶解金,使Au(Ⅰ/Ⅲ)的氯化物([AuCl2-],[AuCl4-])形成,而与Au(Ⅲ)-氯化物不同的是,Au(Ⅰ)-氯化物在低温(<100℃)氧化条件下不稳定[9]。金也可与有机配体形成复合物,Vlassopoulose等[10]认为在还原条件下,金优先与有机硫结合,而在氧化条件下,则主要与有机氮和碳结合。有机金复合物在水溶液中主要以Au(Ⅰ)-氰化物存在,Au(Ⅰ)与氰形成稳定的复合物[Au(CN,可在不同pH条件下保持稳定[5,11]。在原生矿床附近,金复合物和胶体金被吸附至有机物,黏土,铁矿和锰矿,同时生物累积和生物矿化作用可使二次金颗粒产生[12]。
中国金矿资源丰富,黄金开采历史悠久,是世界上最早认识和开发利用黄金的国家之一。改革开放以来,金矿勘查与黄金生产取得了飞速发展。目前,中国黄金行业供需已稳居世界前列,在需求方面已成为仅次于印度的第二大黄金需求市场;黄金产量也逐年提高,2007年黄金产量为2701491 t,仅次于南非[13]。近年来,由于大面积的开采浪费,金矿石的等级不断呈现下降趋势,而对于黄金的需求却从未减少,对于矿区废水和工业废水中的低浓度金离子的回收利用就拥有很大潜力。与传统物理,化学方法相比,微生物对低浓度的金离子回收更为经济有效,对低品级金矿石可以达到提纯效果[14]。微生物作用下金的生物地球化学循环的研究成果可优化微生物对金的回收条件,提高金的回收效率。文章综述了能够富集金的微生物种类,过程及其机理,阐明了微生物在金的生物地球化学循环中所起的作用,旨在推动微生物作用下金的生物地球化学循环研究的不断发展进步。
1 微生物种类
金的生物地球化学循环与微生物息息相关,不只有细菌对金在自然金中的循环转化发挥作用,真菌和藻类的作用也不可忽视。
1.1 细菌
氧化亚铁硫杆菌分布在金矿酸水中,可将黄铁矿和砷黄铁矿中的金溶解沥滤出来。芽孢杆菌属是细菌中能富集金的主要类型,包括蜡状芽孢杆菌,枯草芽孢杆菌,巨大芽孢杆菌和地衣芽孢杆菌,其中主要以蜡状芽孢杆菌为主。蜡状芽孢杆菌的化学沉积能引起块金的形成,说明该菌有一定的富集金并能将其矿化的能力[15]。从毛单胞菌中,戴尔福特食酸菌能在细胞外将金离子与自身分泌的金属蛋白结合而积累金,使可溶金矿化沉淀下来[16]。硫酸盐还原菌可利用Au(Ⅰ)-硫代硫酸盐中的硫代硫酸盐,该菌在还原硫代硫酸盐的同时也使金析出[17]。
1.2 真菌
霉菌中青霉和曲霉吸附金离子较为明显,黄淑惠(1991)[18]的研究表明,金离子在真菌细胞壁上被矿化沉淀为金单质,随后沉积在细胞壁和菌丝上。链霉菌大量存在于各种金矿中,是一种金矿中的优势菌群,具有一定的富集矿化金能力[19]。米根霉菌在细胞质和细胞壁上均可吸附金离子,并通过释放金属蛋白将其矿化,形成金单质[20]。
1.3 藻类
Lengke等(2006)[17]通过丝状蓝藻与Au(Ⅰ)-硫代硫酸盐及Au(Ⅲ)-氯化物相互作用形成了金颗粒。蓝藻可在海水中富集金,死亡后与沉积物下沉,其中蓝藻的部分有机体被微生物分解,其中富集的金被释放出来与有机酸和腐殖酸形成配合物和螯合物,进而进入沉积物中,经过成岩和后生作用形成含金矿层[21]。
2 微生物作用下金的生物地球化学循环过程及机理
2.1 金的生物氧化与溶解沥滤
天然淋滤含金硫化矿石的酸性废水中存在着硫杆菌,这类微生物以含金硫化物为能源进行新陈代谢,通过氧化作用使金从硫化矿石中沥滤分离出来[19]。某些放线菌,氧化亚铁硫杆菌可产生硫代硫酸盐,硫代硫酸盐在一些配体(如氨)以及氧化物(铜离子)的存在下可沥滤出金[22]。很多土壤细菌(如荧光假单胞菌,铜绿假单胞菌),以及一些真菌能产生和分泌氰化物,在氧气存在的条件下,金与氰化物络合成金的氰化物,使金溶解于土壤溶液中[23]。
2.2 金的生物吸附和生物积累
很多细菌(嗜麦芽单胞菌,枯草芽孢杆菌,大肠杆菌),还有放线菌(白色链霉菌,弗氏链霉菌,糖多孢红霉菌),以及一些藻类(球形褐藻,Chl.vulgaris,马尾藻),酵母菌(产元假丝酵母,酿酒酵母)和真菌(黑曲霉菌,芽枝霉菌,尖孢镰刀菌,无根根霉菌)都能引起溶液中金离子的被动吸附[23-24]。有一部分细菌拥有不寻常的收集金离子的能力,并能将其生物浓缩到非常高的浓度。其中一株菌是生丝单胞菌MHS-3(Hyphomonas a dhaerens MHS-3),它能在胞外多糖形成的囊中积累金离子。金能被形成囊结构的菌体捕集而未形成囊结构的突变菌体则无法富集金[25]。与自由的浮游细胞相比,在含有0.1mM AuCl4-的溶液中铜绿假单胞菌形成了一层生物膜并引起金在囊结构中的富集,同时该菌的生存能力也有提高[26]。Kenny等(2012)[27]使用无代谢活性的枯草芽孢杆菌和恶臭假单胞菌在pH<5,初始浓度为5 ppm条件下,在2 h之内从溶液中吸附了85%的金离子。
在早期研究中,Beveridge(1976)[28]发现枯草芽孢杆菌能选择性地将金从AuCl4-溶液中吸附到细胞壁,在含有AuCl4-、Cu2+、Fe2+、Zn2+的溶液中,金被枯草芽孢杆菌选择性地吸附富集。Ulberg等(1992)[29]的研究表明,一株蜡状芽孢杆菌依靠其生物膜,相关蛋白质和糖类的特殊化学结构在细胞表面吸附金离子。另外,他们还发现这种生物富集金颗粒过程直接依赖于细胞的新陈代谢活动尤其是细胞质膜的代谢反应,特别是ATP酶引起的ATP水解过程[28]。蜡状芽孢杆菌通过物理化学作用将金吸附到细胞表面,随后将金转运进入细胞内,通过络合作用和螯合作用将金离子富集下来[30]。
2.3 金的生物还原和生物矿化
从Au(Ⅰ)-硫代硫酸盐溶液中还原金已在硫代硫酸盐氧化细菌中被发现[31]。由嗜酸氧化硫硫杆菌(Acidithiobacillus thiooxidans)引起的金的沉淀以微粒胶体(粒径5~10 nm)的形式存在于细菌体内,或以微米级结晶的形式存在于溶液中。已有报道称硫酸盐还原菌可从Au(Ⅰ)-硫代硫酸盐复合物中还原硫代硫酸盐,在还原硫代硫酸盐的同时沉淀金[17],Lengke and Southam(2007)[32]利用土柱实验研究了硫酸盐还原菌在金的沉淀中所起的作用。
在Au(Ⅰ)-硫代硫酸盐复合物中,由细菌引起的金的沉淀效率(98.2%~99.6%)明显比对照的无生物条件下的金沉淀效率(0~74.3%)更高[17]。硫酸盐还原菌把硫代硫酸盐和其他硫化物还原成硫化氢,产生的硫化氢能沉淀诸如Fe2+之类的金属离子,促使金属硫化物的产生。因此,硫酸盐还原菌可能是通过产生硫化氢,使Au+转化为Au0,从而间接对金的沉淀起作用[12,33],这些不稳定的金单质可能重新形成新的硫化矿物。与硫代硫酸盐配体的利用相似,微生物还能利用金-羧酸的(如氨基酸)络合物或氰化物,它们可以使金复合物变得不稳定并使其沉淀。一些细菌和古菌可以通过将Au3+还原为Au0从而使金沉淀[34]。有些物种包括冰岛热棒菌(Pyrobaculum isl andicum),强烈炽热球菌(Pyrococcus f uriosus),海藻希瓦氏菌(Shewanella algae)和D. Vulgaris在细胞外沉淀金,其他如Geobacter ferrireducens在细胞周质间隙内形成Au0。
根据Kashefi等(2001)[35]的报道,异养Fe3+还原微生物是在把金离子吸附到细胞表面之前还原金,或者是在吸附的同时将金矿化沉淀。这种机制与好氧微生物的还原机制有明显区别,好养微生物首先将金离子吸附到细胞表面,随后再将被吸附的金离子生物矿化为颗粒金[35-36]。耐金属贪铜菌(Cupriavidus metallidurans)能将金离子还原为纳米金颗粒,Fairbrother等(2013)[36]曾利用石英砂填料塔来测定耐金属贪铜菌的生物矿化效果。当不接种细菌时,只有30%(wt)的金转变为Au(Ⅰ)-硫代硫酸盐,接种了耐金属贪铜菌后,超过99%(wt)的金被移除。
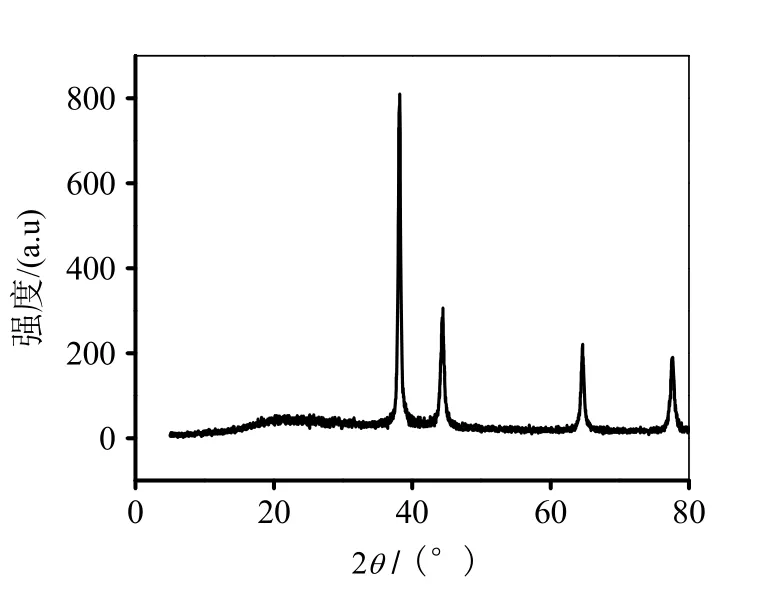
图1 微生物矿化金产物XRD谱图
2.4 几种细菌矿化金的机理对比
在各种环境中,金的生物矿化的形成普遍认为是由金的酶促反应引起的[36]。Johnston等(2013)[16]对戴尔福特食酸菌(Delftia acidovorans)的研究发现,与耐金属贪铜菌在细胞内部富集还原金离子不同,该菌在环境中含有较高浓度金离子情况下会产生一种二次代谢产物——戴尔福肌动蛋白(delftibactin),并将其排出细胞外,通过该二次代谢物对环境中的金离子吸附、还原,并形成胶体金和正八面体金纳米颗粒,从而降低环境中金离子浓度,防止了金离子对菌体的伤害。尽管戴尔伏肌动蛋白(delftibactin)在生长中并不必要,但和其他次生代谢物一样,它在保护金颗粒的产生者不被有毒可溶金毒害过程中起重要作用。戴尔夫肌动蛋白(Delftibactin)可能是我们所知的第一例可以在有毒可溶金中保护其产生者并提供一种细菌生物矿化金机制的金属结合蛋白[16]。
Reith等(2009)[37]发现,耐金属贪铜菌(Cupriavidus metallidurans)与次生金矿的产生有关,耐金属贪铜菌能沉淀金,表明它可能是通过对流动的金的复合物的主动沉淀形成自然界中的次生金矿。戴尔福特食酸菌和耐金属贪铜菌都能引起金的生物矿化,但两者机理不同,耐金属贪铜菌通过在细胞质内生物积累惰性纳米金颗粒,从而使它能在含可溶金环境中存活。而戴尔福特食酸菌则是在细胞外分泌出戴尔夫肌动蛋白,通过戴尔夫肌动蛋白与金的络合作用将溶液中的金离子矿化沉淀下来[16]。
耐金属贪铜菌和其他细菌对Au(Ⅰ/Ⅲ)复合物的主动沉淀,可能是由于这些复合物对于微生物的毒性作用。即使在低浓度Au(Ⅰ/Ⅲ)复合物溶液中,Au(Ⅰ/Ⅲ)复合物仍能断开肽和蛋白质中的双硫键,破坏细胞壁和细胞膜而引起细胞死亡。因此,耐金属贪铜菌还原有毒的金复合物并富集金单质,形成一种避免金的毒性使细菌在其生存环境中解毒的机制[3]。
与其他已知微生物相比,耐金属贪铜菌更能耐受高浓度重金属,如Cu、Cd、Pb、Zn、Cd、Ag以及Au[22]。耐金属贪铜菌是革兰氏阴性菌,是自养兼性β-变形杆菌,最初在1976年被鉴定,分离自被各种高浓度重金属污染的工业堆积物,土壤和垃圾中。耐金属贪铜菌对重金属的极度耐受性和在其表面富集这些金属的能力来源于它的多重外排泵。在它的蛋白质组中已被认定有932种属于转运蛋白(13%)[22]。在已知的全序列微生物中,能转运金属离子和有机分子通过细胞膜的蛋白质的比例,耐金属贪铜菌是最高的。这使耐金属贪铜菌成为一种了解微生物对金的抗性和富集过程的理想模型,同时它也是金的生物处理工艺中一种潜在生物试剂[22]。耐金属贪铜菌在含金溶液中会形成生物膜,从溶液中迅速富集Au(Ⅲ)复合物,随后被转移至细胞内并被转化为Au(Ⅰ)-S复合物,使金的毒性增加,该菌通过产生氧化压力和金属抗性基因簇来提高细胞抵抗力。所以这个解毒过程是泵出作用,还原作用以及金复合物的甲基化作用的综合,最终导致了Au(Ⅰ)-C复合物和纳米金的形成[3]。
不只是原核生物有富集和矿化金作用,Sujoy K. Das等(2012)[20]的研究表明,米根霉菌(Rhizopous oryzae)通过吸附从溶液中富集Au(Ⅲ),首先将其还原为Au(Ⅰ),再形成Au(Ⅰ)的络合物并最终被还原为金单质,该过程在细胞壁和细胞质内均有发现。Au(Ⅲ)最初附着于细菌表面,然后被还原成中间产物Au(Ⅰ)-蛋白复合物并最终形成AuNPs(Au0)。Au(Ⅲ)的大部分则被转移进入细胞质区域,在那里被细胞质蛋白还原为AuNPs,该蛋白很可能是金属还原酶[20]。米根霉菌在Au(Ⅲ)的亚毒性浓度(130 μM)下生长时,产生了压力应激蛋白。在更高的Au(Ⅲ)浓度(250 μM)下,金毒性对细胞亚显微结构产生了损害,同时AuNPs的生物合成大幅度减少。在亚毒性浓度(130 μM)下的提取物的蛋白分析显示两种细胞质蛋白,分子量分别约为45和42 kDa,很有可能就是促使AuNPs的生物合成的原因。蛋白的产生与抑制与Au(Ⅲ)的亚毒性浓度对应,并对应AuNPs生物合成的增加。从AuNPs的生物合成物中分离出一种蛋白表明,该80 kDa蛋白充当一种AuNPs封端剂,是通过静电排斥使生物合成物稳定,阻止AuNPs聚合的。这种特定的金合成基因的表达的发现可能会促使廉价的AuNPs生物合成工艺的发展[20]。
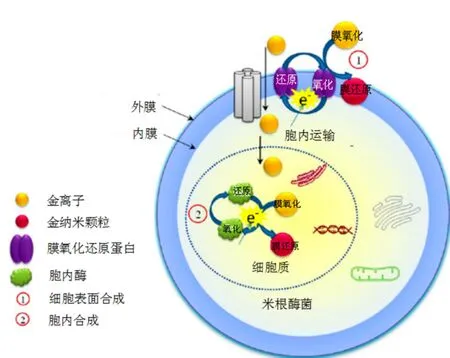
图2 米根霉菌生物矿化还原金机理(Das S K et al.,2012)
3 工业应用
3.1 金的生物沥滤和氧化浸出
由于金在自然界中分布不均和过度开采等原因,造成了很多贫矿,废矿,表生矿等浓度较低的矿石难以处理,微生物氧化浸出技术因其投资成本低,回收率高,无环境污染受到国内外广泛关注[14]。南非最早利用细菌氧化难浸出金矿,对金矿进行预处理后再使用氰化浸出,加拿大东部的黄铁矿一砷黄铁矿混合精矿经过实验室和中试以及工业规模连续细菌槽浸试验研究,效果显著,并于1989年投产建成了日均处理100t精矿的微生物浸出厂[38]。我国利用微生物氧化浸出技术起步较晚,中科院曾对广西平南县六岭金矿进行金的浸出研究,发现金的浸出率可达87%,但只是处于实验室研究阶段,而国内还有许多低品位矿石,难溶金矿石等待开发,尾矿和矿山废弃物需要处理,因此对于微生物氧化浸出和生物沥滤技术的改进和利用显得迫在眉睫[39]。
3.2 电子垃圾中金的回收
随着电子产业和信息产业的迅猛发展,贵金属的消耗也随之不断增加[40],电子产品的生命周期却在不断缩短,废旧电子电器设备淘汰日趋频繁。研究从电子垃圾回收贵金属的方法具有重大意义,不仅可以节约资源能源,还能达到保护环境的目的。电子垃圾种类繁多,成分复杂,处理难度大,利用传统的机械处理法、火法冶金、湿法冶金等技术难以充分回收其中的贵金属;利用生物处理、微波热解法和螫合树脂吸附等新兴技术,可使电子垃圾中的贵金属得到高效的资源化利用。用于回收电子垃圾中贵金属的生物吸附技术具有成本低、回收率高和环保等优点,符合当今经济和环境协调发展的时代要求,具有巨大的潜力和广阔的前景[40]。
3.3 电镀废水中金的回收
电镀废水水质较复杂,电镀废水中含有铬、锌、铜、镍、镉等重金属离子以及酸、碱、氰化物等具有很大毒性的杂物。电镀废水成分复杂,污染物可分为无机污染物和有机污染物两大类,水质变化幅度大,且电镀废水毒性大,含有大量的重金属离子,若不经处理直接排放会对周边水体造成极大的污染[41]。国内外对高浓度电镀废水处理方法研究甚多,工艺各异,主要有沉淀法、离子树脂交换法、电解法、活性炭吸附法、反渗透法、电渗析法等[42-44]。但传统方法处理电镀废水存在成本过高,资源浪费,环境污染等问题,生物技术是具有较大发展潜力的技术,具有成本低、效益高、不造成二次污染等优点。随着基因工程、分子生物学等技术的发展和应用,具有高效、耐毒性的菌种不断培育成功,为生物技术的广泛应用提供了有利条件[41,45]。
4 结论与展望
在微生物作用下,金在自然界中由不溶金经过氧化浸出作用溶解于沥滤液,再经过微生物的吸附和积累,从沥滤液中富集最后被矿化为金颗粒,形成金的生物地球化学循环。根据金的生物地球化学循环过程和机理,可利用微生物对尾矿中的低品级矿石进行溶解沥滤,再通过其吸附和富集作用对金进行提纯。
电镀废水和电子垃圾中金含量较低,同时还含有铜、锌、铅、铬、镍等多种金属离子,戴尔福特食酸菌能在细胞外选择性地吸附金离子并将其矿化沉淀为金颗粒。该菌受其他金属离子对该菌矿化沉淀金的干扰很小,其中铬对细胞有一定损伤,使金离子的矿化速度稍有减慢,食酸菌也能矿化一部分铅,但对金的矿化作用影响很小,其他如铜,锌,铂对金食酸菌矿化金几乎没有影响,因此戴尔福特食酸菌可有效回收电镀废水和电子垃圾中的金。但同时电镀废水和电子垃圾成分复杂,需要对其进行预处理,所以需要简化对废水和电子垃圾的前处理过程。
[1] 张胜, 孙振华, 肖宇. 地球表层微生物地球化学作用[J]. 自然杂志, 2002, 24(2): 78-81.
[2] 张胜, 张翠云, 张云, 等. 地质微生物地球化学作用的意义与展望[J]. 地质通报, 2005, 24(1): 1027-1031.
[3] Reith F, Etschmann B, Grosse C, et al. Mechanisms of gold biomineralization in the bacterium Cupriavidus metallidurans[J]. Proceedings of the National Academy of Sciences, 2009, 106(42): 17757-17762.
[4] 吴锁平. 黄金: 金属之王[J]. 中国金属通报, 2010(41): 14-17.
[5] Aitio A, Kiilunen M, Santonen T, et al. Handbook on the toxicology of metals[J]. Gold and Gold Mining, 2015, 38: 817-843.
[6] Boyle R W. The geochemistry of gold and its deposits[J]. Geological Survey of Canada, 1979(280): 583.
[7] Southam G. The geomicrobiology of Ore deposits[J]. Economic Geology, 2005, 100(6): 1067-1084.
[8] Vlassopoulos D, Wood S A. Gold speciation in natural waters: Ⅰ. Solubility and hydrolysis reactions of gold in aqueous solution[J]. Geochimica Et Cosmochimica Acta, 1990, 54(1): 3-12.
[9] Gammons C H, Yu Y, Williams-Jones A E, et al. The disproportionation of gold(Ⅰ) chloride complexes at 25 to 200℃[J]. Geochimica Et Cosmochimica Acta, 1997, 61(10): 1971-1983.
[10] Vlassopoulos D, Wood S A, Mucci A. Gold speciation in natural waters: Ⅱ. The importance of organic complexing―Experiments with some simple model ligands[J]. Geochimica Et Cosmochimica Acta, 1990, 54(6): 1575-1586.
[11] Lawrance L M, Griffin B J. Crystal features of supergene gold at Hannan South, Western Australia[J]. Mineralium Deposita, 1994, 29(5): 391-398.
[12] Reith F, Lengke M F, Falconer D, et al. The geomicrobiology of gold[J]. Isme Journal, 2007, 1(7): 567-584.
[13] 孙兆学. 中国金矿资源现状及可持续发展对策[J]. 黄金, 2009, 30(1): 12-13.
[14] 肖华花, 孙水裕, 顾泽平. 选矿过程的清洁生产技术——生物技术[J]. 矿业安全与环保, 2006, 33(2): 72-75.
[15] 邵苗苗, 高昂, 姚默, 等. 嗜金微生物研究概况[J]. 宁夏农林科技, 2012, 53(1): 88-90.
[16] Johnston C W, Wyatt M A, Li X. Gold biomineralization by a metallophore from a gold-associated microbe[J]. Nature Chemical Biology, 2013, 9(4): 241-243.
[17] Lengke M, Southam G. Bioaccumulation of gold by sulfate-reducing bacteria cultured in the presence of gold(I)-thiosulfate complex[J]. Geochimica Et Cosmochimica Acta, 2006, 70(14): 3646-3661.
[18] 黄淑惠. 吸附金(Au3+)的真菌筛选[J]. 微生物学通报, 1991(1): 11-14.
[19] 薛堂荣, 陆元法. 含金地质体表生带中主要微生物类群的研究[J]. 微生物学报, 1994(4): 319-325.
[20] Das S K, Liang J, Schmidt M, et al. Biomineralization mechanism of gold by zygomycete fungi rhizopous oryzae[J]. ACS Nano, 2012, 6(7): 6165-6173.
[21] 张景荣, 朱法华. 蓝藻富集金的模拟实验及其地质意义[J]. 地球化学, 1993(1): 61-67.
[22] Reith F, Zammit C M, Rogers S L, et al. Potential for the utilisation of micro-organisms in gold processing: A review[J]. Mineral Processing & Extractive Metallurgy Imm Transactions, 2012, 121(4): 251-260.
[23] Kaksonen A H, Mudunuru B M, Hackl R. The role of microorganisms in gold processing and recovery―A review[J]. Hydrometallurgy, 2014, 142(2): 70-83.
[24] Cui J, Zhang L. Metallurgical recovery of metals from electronic waste: A review[J]. Journal of Hazardous Materials, 2008, 158(158): 228-256.
[25] Quintero E J, Langille S E, Weiner R M. The polar polysaccharide capsule of Hyphomonas adhaerens, MHS-3 has a strong affinity for gold[J]. Journal of Industrial Microbiology & Biotechnology, 2001, 27(1): 1-4.
[26] Karthikeyan S, Beveridge T J. Pseudomonas aeruginosa, biofilms react with and precipitate toxic soluble gold[J]. Environmental Microbiology, 2002, 4(11): 667-675.
[27] Kenney J P L, Song Z, Bunker B A, et al. An experimental study of Au removal from solution by non-metabolizing bacterial cells and their exudates[J]. Geochimica Et Cosmochimica Acta, 2012, 87(87): 51-60.
[28] Beveridge T J, Murray R G. Uptake and retention of metals by cell walls of Bacillus subtilis.[J]. Journal of Bacteriology, 1976, 127(3): 1502-1518.
[29] Ulberg Z R, Karamushka V I, Vidybida A K, et al. Interaction of energized bacteria cells with particles of colloidal gold: Peculiarities and kinetic model of the process.[J]. Biochimica Et Biophysica Acta, 1992, 1134(2): 89-95.
[30] 汤显春, 谢树成. 生物矿化一蜡状芽孢杆菌聚金作用的研究[J]. 微生物学杂志, 2001, 21(1): 31-32.
[31] Lengke M F, Southam G. The effect of thiosulfate-oxidizing bacteria on the stability of the gold-thiosulfate complex[J]. Geochimica Et Cosmochimica Acta, 2005, 69(15): 3759-3772.
[32] Lengke M F, Southam G. The deposition of elemental gold from gold(Ⅰ)thiosulfate complexes mediated by sulfate-reducing bacterial conditions[J]. Economic Geology, 2007, 102(1): 109-126.
[33] Reith F, Mcphail D C. Mobility and microbially mediated mobilization of gold and arsenic in soils from two gold mines in semi-arid and tropical Australia[J]. Geochimica Et Cosmochimica Acta, 2007, 71(5): 1183-1196.
[34] He S, Guo Z, Zhang Y, et al. Biosynthesis of gold nanoparticles using the bacteria Rhodopseudomonas capsulata[J]. Materials Letters, 2007, 61(18): 3984-3987.
[35] Kashefi K, Tor J M, Nevin K P, et al. Reductive precipitation of gold by dissimilatory, Fe(Ⅲ)-reducing bacteria and archaea[J]. Applied & Environmental Microbiology, 2001, 67(7): 3275-3279.
[36] Savvaidis I, Karamushka V I, Lee H, et al. Micro-organism-gold interactions[J]. Biometals, 1998, 11(1): 69-78.
[37] Fairbrother L, Etschmann B, Brugger J, et a l. Biomineralization of gold in biofilms of Cupriavidus metallidurans[J]. Environmental Science & Technology, 2013, 47(6): 2628-2635.
[38] 张汉泉. 微生物技术在处理难选金矿工业中的应用现状[C]. 全国选矿专业学术年会, 2008.
[39] 刘国仁, 袁宗仪. 应用生物浸矿工艺回收利用难选矿产资源[J]. 中国地质, 1994(7): 18-19.
[40] 李丹, 黄树辉, 祝甜甜. 电子垃圾中贵金属的资源化回收研究[J]. 广东微量元素科学, 2013, 20(9): 39-44.
[41] 徐涛. 浅谈电镀重金属废水治理技术的现状及展望[J]. 城市建设理论研究(电子版), 2014(3): 204-204.
[42] 白滢, 常青. 高分子重金属絮凝剂PEX处理电镀废水研究[J]. 中国给水排水, 2006, 22(19): 53-55.
[43] Gode F, Pehlivan E. Removal of Cr(Ⅵ) from aqueous solution by two Lewatit-anion exchange resins[J]. Journal of Hazardous Materials, 2005, 119(1-3): 175-182.
[44] Hu J, Chen G, Lo I M C. Removal and recovery of Cr(Ⅵ) from wastewater by maghemite nanoparticles[J]. Water Research, 2005, 39(18): 4528-4536.
[45] Quintero E J, Langille S E, Weiner R M. The polar polysaccharide capsule of Hyphomonas adhaerens, MHS-3 has a strong affinity for gold[J]. Journal of Industrial Microbiology & Biotechnology, 2001, 27(1): 1-4.
Biogeochemical Cycle of Gold by Microorganisms
HUANG Zhen, LI Xue-zhen, XU Xin-ya, MENG Dan-jie, CHENG Yang-jian*
(College of Environment & Resources, Fujian Chuanzheng Communications College, Fuzhou 350108, China)
Microorganisms are responsible for the transformation and circulation of gold, and they promote the biogeochemical cycle process of gold. Gold is cycled through dissolution and leaching in gold ores, biosorption, bioaccumulation, and finally soluble gold is minerlized into second gold. To better understand and promote the gold recovery in gold tailings and garbage with microorganisms, this review summrized the role of microorganism in biogeochemical cycle of gold, with focuses on species , mechanism of microorganism in the processes of gold concentration.
microorganism; gold; biogeochemical cycle; second mineralization
X142
A
1009-220X(2016)06-0062-08
10.16560/j.cnki.gzhx.20160615
2016-09-19
国家重点基础研究发展计划资助(973)项目(2014CB846003);国家自然科学基金项目(41372346)。
黄 振(1991~),男,硕士研究生;主要从事土壤修复技术的研究。
* 通讯作者:程扬健(1975~),男,副教授;主要从事环境生物地球化学的研究。yjcheng@fzu.edu.cn
