内镜黏膜下剥离术治疗胃肠道神经内分泌肿瘤的临床观察
2017-01-12庄惠军沈许德陈进忠姚礼庆苏虹雷天霞杨炜琳吴建海郑永胜李秀梅潘丽云李世群
庄惠军,沈许德,陈进忠,姚礼庆,苏虹,雷天霞,杨炜琳,吴建海,郑永胜,李秀梅,潘丽云,李世群
(厦门大学附属第一医院 内镜中心,福建 厦门 361003)
内镜黏膜下剥离术治疗胃肠道神经内分泌肿瘤的临床观察
庄惠军,沈许德,陈进忠,姚礼庆,苏虹,雷天霞,杨炜琳,吴建海,郑永胜,李秀梅,潘丽云,李世群
(厦门大学附属第一医院 内镜中心,福建 厦门 361003)
目的 探讨内镜黏膜下剥离术(ESD)在胃肠道神经内分泌肿瘤(GI-NENs)治疗中的安全性和有效性。方法回顾性分析该院2011年1月-2015年12月52例经ESD治疗的GI-NENs患者临床资料,总结其内镜下形态,记录完整切除率,并发症发生率,病理特征以及随访结果。结果52例患者中胃16例,结肠9例,直肠27例;大部分病灶为黏膜下隆起,少数为不典型的息肉样改变;所有病灶均一次性整块切除病变,其中G144例,G28例;完整切除率94.23%(49/52);2例直肠病灶侵犯固有肌层,追加外科手术;1例直肠穿孔,内镜下处理及保守治疗好转。全组病例未出现大出血,术后平均随访22.6个月,1例胃病灶发生局部复发,行第二次ESD治疗,未发现淋巴结和远处转移病例。结论严格把握内镜治疗适应证,ESD治疗GI-NENs是可行、安全、有效的。
内镜黏膜下剥离术;神经内分泌肿瘤;胃肠
神经内分泌肿瘤(neuroendocrine neoplasms,NENs)是一组异质性肿瘤的统称。它起源于肽能神经元和神经内分泌细胞,显示了从惰性的缓慢生长、低度恶性直至高转移性等一系列生物学行为,预后差异较大[1-2]。NENs可发生于全身诸多器官,其中胃肠道神经内分泌肿瘤(gastrointestinal neuroendocrine neoplasms,GI-NENs)最多见,且其发病率逐年上升,有研究显示其发病率是30年前的5倍,已成为消化道恶性肿瘤中第二常见的肿瘤类型[3-4]。随着内镜技术的不断发展、成熟,可以早期发现GI-NENs,并进行内镜下治疗,预后良好。本研究回顾性分析本院内镜中心自2011年1月-2015年12月收治的GI-NENs病例资料,观察内镜对GI-NENs的早期诊断及治疗的安全性及有效性。
1 资料与方法
1.1 一般资料
收集本院内镜中心2011年1月-2015年12月收治的52例GI-NENs患者的病例资料。所有病例术前完善内镜、超声内镜(endoscopic ultrasonography,EUS)和腹部增强CT等检查,详细记录其临床病理特征、完整切除率、增殖活性分级、并发症发生率以及有无局部复发或远处转移等资料。所有病灶均行内镜黏膜下剥离术(endoscopic submucosal dissection,ESD),于术前签署知情同意书,告知可能获得的益处和风险。术后随访包括内镜、腹部增强CT等检查。
共52例GI-NENs患者。其中,男24例(46.15%),女28例(53.85%),男女比例为1∶1.17,年龄24~78岁,平均(48.5±8.6)岁。本组约50.00%患者无症状,体检发现病灶。余患者表现为不同程度腹部不适、腹痛、腹胀和大便习惯改变等非特异性症状。所有患者均未发现类癌综合征现象。
1.2 方法
1.2.11 器械 器械采用Olympus GIF-H260单钳道电子胃镜,Olympus CF-Q260AI型电子结肠镜,EU-M3内镜超声系统,超声探头采用Olympus UM-2R,频率为12 MHz。KD-611L IT刀,KD-620LR Hook刀,NM 200V-0423注射针,FD-M-1热活检钳,HX-610-90 HX-600-135 止血夹,爱尔博ICC-200D高频电切装置和使用氩离子束凝固术(argon plasma coagulation APC)的氩离子凝固器,D-201-11802透明帽。
1.2.2 手术方法 所有病例均在全麻下行ESD治疗①标记:应用Hook刀于病灶外缘约0.5 cm进行电凝标记;②黏膜下注射:在标记点外侧多点黏膜下注射100 ml生理盐水+5 ml靛腚紫+1 ml肾上腺素混合溶液,直至病灶明显抬起;③切开标记点外侧黏膜:应用Hook刀沿病灶边缘标记点外侧切开黏膜;④剥离病变:应用Hook刀或IT刀切开黏膜下层,显露病变后于病变边缘及基底对病变进行完整剥离;在剥离的过程中根据情况可重复进行黏膜下注射;⑤创面处理切除病变后对于创面可见的小血管,应用热活检钳夹闭止血或APC凝固治疗;必要时应用金属止血夹夹闭血管或闭合创面。直肠NENs典型病例ESD术情况见图1和2。
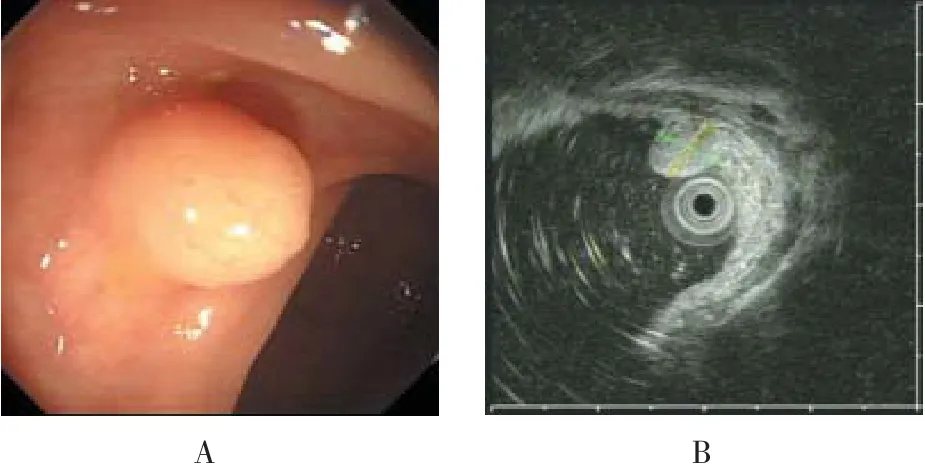
图1 直肠NENs典型病例术前检查所见
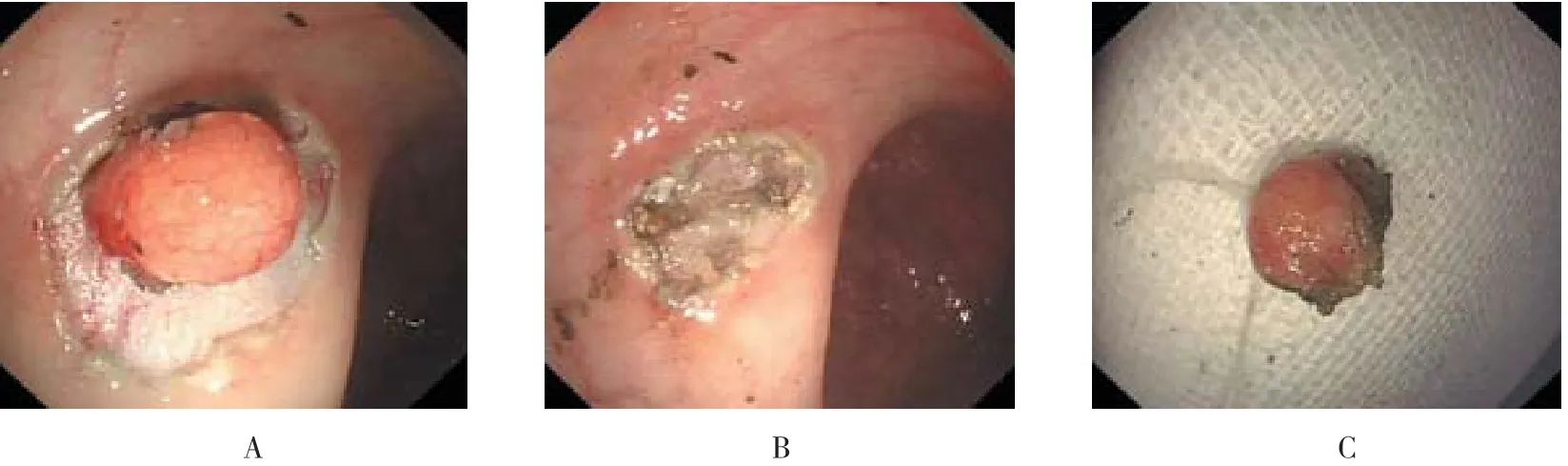
图2 直肠NENs典型病例ESD术
1.3 病理学检查及评价
标本用10%甲醛固定送病理检查,免疫组化法检测Syn、CgA和Ki67等指标。采用2010年WHO神经内分泌肿瘤病理学分类标准,分为:①神经内分泌瘤(neuroendocrine tumor,NET);②神经内分泌癌(neuroendocrine cancer,NEC);③混合性腺神经内分泌癌(mixed adenoneuroendocrine carcinoma,MAN⁃EC)。按照每10个高倍视野核分裂像数或每400~2 000个细胞的Ki67指数进行肿瘤分级,G1级核分裂像数为1,Ki67阳性指数≤2.00%;G2级核分裂像数为2~20,Ki67阳性指数>2.00%~20.00%;G3级核分裂像数为>20,Ki67阳性指数>20.00%。基于肿瘤的增殖活性,GI-NENs可分级为G1、G2或G3。G1和G2定义为NET,而G3命名为NEC。组织病理学诊断切除标本侧切缘和基底切缘均阴性,定义为完整切除;如阳性,则定义为不完整切除。
1.4 补救性手术指征
如果病变切缘阳性,直径>20.0 mm,组织学分级为G2~G3,侵犯至固有肌层或存在脉管侵犯,建议行补救性外科手术。
1.5 随访
所有病例均接受随访。术后第3、6和12个月分别行内镜检查,观察创面愈合情况,局部有无病变残留或复发。若无上述情况以后每年随访1次。同时术后每年随访腹部增强CT等,检查有无远处转移。
2 结果
2.1 病灶分布及内镜下表现
52例患者中胃16例,结肠9例,直肠27例。病灶大小4.0~17.3 mm(平均7.5 mm),内镜下主要表现为半球状隆起或息肉样隆起,色泽同周围黏膜或呈淡黄色、灰黄色,表面光滑、凹陷或糜烂,部分病灶质地偏硬等。全组病例术前均行超声内镜及腹部CT检查,结果显示所有病灶深度均限于黏膜层或黏膜下层内,未侵犯固有肌层,无淋巴结或远处转移征象。
2.2 治疗情况
全组病例中有3例胃体病灶及3例直肠病灶,内镜下表现为丘状息肉,直径均小于5.0 mm,初次内镜检查误诊为腺瘤性或增生性息肉并予行钳除术,术后病理诊断NET,分级G1,遂行超声内镜及腹部CT检查,随后追加行ESD术治疗。全组病例均一次性完整剥离,整块切除率为100.00%。全组病例术中未出现内镜难以控制的大出血。其中1例直肠病灶患者发生术中穿孔,用数枚金属夹夹闭创面,放置肛管,保守治疗后顺利出院。
2.3 病理结果
根据2010年WHO分类标准,5例直肠病灶及3例胃病灶分级为G2,其余44例病灶分级均为G1。1例直肠病灶病理分级G2,侧切缘阳性,基底切缘阴性,无脉管侵犯,该患者因年龄大及生理状况较差,拒绝补救性外科手术治疗,接受第二次ESD治疗,术后病理显示侧切缘及基底切缘均阴性,予密切随访。另2例直肠病理分级G2,病理结果显示肿瘤侵犯固有肌层,基底切缘阳性,且伴有脉管侵犯,2例患者均进行了补救性外科手术治疗。余49例病灶均完整切除(94.23%,49/52),病变深度局限于黏膜层或黏膜下层,均无脉管侵犯。NET病理结果见图3。
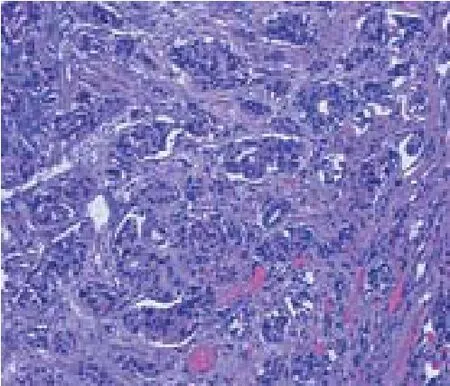
图3 NET病理 (G1,HE×40)
2.4 随访结果
全组病例均获得随访,平均随访时间为22.6个月(4~54个月)。1例胃病灶于初次ESD术后8个月后出现局部复发,无淋巴结或远处转移征象,再次行ESD治疗。随访中未发现淋巴结或远处转移表现。
3 讨论
GI-NENs在临床中越来越常见,既往人们认为其生物学特征良性,同时形态类似癌,故称之为“类癌”,但长期随访结果证实该肿瘤有不同的恶性生物学行为,预后差异较大。GI-NENs在临床中表现多样化,无特异性症状,很容易造成误诊与漏诊。临床中多数的患者在确诊时已经发现肿瘤转移,严重影响患者身体健康、治疗效果及预后[5]。因此,肿瘤的早期诊断及早期治疗尤为重要。
临床中如何有效地提高GI-NENs的临床诊断效果是医生关注的重点。内镜检查可以最大限度及最大范围的直视窥查胃肠道腔内病变并进行活组织病理检查,能够及时早期发现病灶。EUS结合了内镜与超声的优势,高频超声探头可尽可能贴近病灶,获得空间分辨力良好的声像图,清楚显示消化管壁的层次结构和病变起源部位、大小、浸润深度和范围、腔外血管和淋巴结的情况,GI-NENs常表现为黏膜层或黏膜下层隆起,内部呈均匀、不均匀的低回声病变。同时可行EUS引导下穿刺活检,有助于GI-NENs的定性诊断、术前分期及疗效评价。大部分病灶内镜下表现为黏膜下隆起,为提高GI-NENs诊断准确率,内镜检查发现黏膜下隆起性病灶应想到GI-NENs的可能,注意观察其色泽、质地、活动度等,并注意与脂肪瘤、平滑肌瘤、间质瘤等鉴别。但也有些病灶表现不典型,本组有6例病灶表现为丘状息肉,在检查中极易误诊或漏诊。
根据2012年欧洲NENs协会治疗共识,直径<1.0 cm的肿瘤很少发生转移(<3.00%),1.0~2.0 cm的肿瘤发生转移的概率为10.00%~15.00%,>2.0 cm的肿瘤发生转移的概率升至60.00%~80.00%。共识指出直径<1.0 cm的肿瘤,如果分化良好且无固有肌层浸润应行内镜下切除,如果分化不良或出现固有肌层浸润应行手术切除;直径1.0~2.0 cm的肿瘤,如果分化良好且无固有肌层浸润可行内镜下切除,如果分化不良或出现固有肌层浸润应行根治性手术切除;直径>2.0 cm的肿瘤应行根治性手术切除[6]。完善本组病例术前检查,评估全组病例均有行内镜下治疗的指征。
随着内镜治疗技术的发展与成熟,ESD可实现较大病灶的整块切除并提供准确的病理诊断分期,已广泛应用于消化道早癌、黏膜下肿瘤等疾病的治疗。本研究采用ESD技术对52例GI-NENs进行切除治疗。所有病变均一次性整块剥离,术后病理显示,绝大部分肿瘤侵犯至黏膜层或黏膜下层(96.15%,50/52),其中49例病变完整切除,完整切除率高达94.23%。与传统外科手术相比,ESD不影响胃肠道正常解剖结构,并发症较少,创伤小,术后恢复快,生活质量较高;与传统内镜切除技术相比,ESD可对病变深部黏膜下组织进行精确剥离,具有更高的完整切除率,可对切缘、脉管侵犯及病理学分级进行准确评估,从而指导进一步治疗决策。
出血和穿孔是ESD治疗的主要并发症,关系到手术的安全性及成败,术前评估尤为重要。术前了解基础病、凝血功能、瘤体大小及深度等,术中须操作轻柔、多次充分黏膜下注射、视野暴露清晰、配合默契,较小血管可用电刀直接电凝,较大血管使用热活检钳钳夹血管后电凝,必要时可用止血夹夹闭出血点。当病变完整切除后,应对创面进行全面彻底检查、止血处理。穿孔一般较小,术中都能及时发现,应用止血夹多能完整夹闭穿孔。充分的黏膜下注射、多角度调整切割平面、避免长时间的高频电凝、术后充分抽吸胃肠道内残留气体等都是有效防止穿孔的方法。本组病例,无难控制的大出血。1例发生术中穿孔,保守治疗成功。充分显示了ESD治疗GI-NENs的安全性。
中国胃肠胰神经内分泌肿瘤病理学诊断共识意见认为,所有的GI-NENs均具有一定的恶性潜能,早期发现和早期治疗是改善预后的关键,并且应该进行长期随访[7]。本研究随访仅发现1例术后局部复发,行第二次ESD治疗,所有病例未发现淋巴结及远处转移。再次表明ESD治疗<2.0 cm且未累及固有肌层的GINENs是安全、有效的,值得临床进一步大样本研究证实,以建立GI-NENs规范化内镜诊治方案。
[1] SALYERS W J, VEGA K J, MUNOZ J C, et al. Neuroendocrine tumors of the gastrointestinal tract case reports and literature review[J]. World Journal of Gastrointestinal Oncology, 2014, 6(8): 301-310.
[2] ZHANG X, MA L, BAO H, et al. Clinical pathological and prognostic characteristics of gastroenteropancreaticneuroendocr ine neoplasms in China aretrospective study[J]. BMC Endocrine Disorders, 2014, 14: 54.
[3] OBERG K. Neuroendocrine tumors (NETs): historical overview and epidemiology[J]. Tumori, 2010, 96(5): 797-801.
[4] SCHIMMACK S, SVEJDA B, LAWRENCE B, et al. The diversity and commonalities of gastroenteropancreatic neuroendocrine tumors[J]. Langenbeck’s Archives of Surgery, 2011, 396(3): 273-298.
[5] 杨晓鸥, 钱家鸣, 李景南. 血浆嗜铬粒蛋白A对胃肠胰腺内分泌肿瘤的诊断价值[J]. 胃肠病学, 2008, 13(4): 205-208.
[6] CAPLIN M, SUNDIN A, NILLSON O, et al. ENETS Consensus Guidelines for the management of patients with digestive neuroendocrine neoplasms: colorectal neuroendocrine neoplasms[J]. Neuroendocrinology, 2012, 95(2): 88-97.
[7] 中国胃肠胰神经内分泌肿瘤病理专家组. 中国胃肠胰神经内分泌肿瘤病理学诊断共识意见[J]. 中华病理学杂志, 2011, 40(4): 257-262.
(吴静 编辑)
Endoscopic submucosal dissection in treatment of gastrointestinal neuroendocrine neoplasms
Hui-jun Zhuang, Xu-de Shen, Jin-zhong Chen, Li-qing Yao, Hong Su, Tian-xia Lei, Wei-lin Yang, Jian-hai Wu, Yong-sheng Zheng, Xiu-mei Li, Li-yun Pan, Shi-qun Li
(Department of Endoscopy Center, the First Affi liated Hospital of Xiamen University, Xiamen, Fujian 361003, China)
ObjectiveTo investigate the feasibility and effi cacy of endoscopic submucosal dissection (ESD) for gastrointestinal neuroendocrine neoplasms (GI-NENs).Methods52 patients with confi rmed histological diagnosis of GI-NENs performed ESD from January 2011 to December 2015 were included. The endoscopic morphology of tumor was summarized. Complete resection rate, complications, clinicopathological characteristics, and follow-up results were evaluated.ResultsThere were 16 cases of stomach, 9 cases of colon and rectum 27 cases. Most of the lesions were submucosal uplift. A few of lesions looked like polyps. All the lesions were one-time whole diseased. 44 lesions were NET-G1, 8 lesions were NET-G2. Complete resection rate was 94.23%. 2 cases of rectal lesions infringemented intrinsic muscle layer, and got additional surgery. 1 case of rectal perforation, which was managed by endoscopic treatment and conservative treatment. All cases did not appear haemorrhage. During a mean followup period of 22.6 months, local recurrences occurred in 1 case of stomach, and treated with second line ESD. No cases lymph node and distant metastasis were found. Conclusion ESD appears to be a feasible, safe and effective treatment for GI-NENs with strict endoscopic treatment indications.
endoscopic submucosal dissection (ESD); neuroendocrine neoplasms (NENs); gastrointestinal
R735.2;R735.3
B
10.3969/j.issn.1007-1989.2016.12.019
1007-1989(2016)12-0090-04
2016-07-08
陈进忠,E-mail:endocjz99@126.com
