腹腔镜肾部分切除术与腹腔镜冷冻消融术治疗小肾肿瘤的安全性和疗效的Meta分析
2017-01-12郭强任瑞民王靖宇李建文张建东张雁钢
郭强,任瑞民,王靖宇,李建文,张建东,张雁钢
(1.山西医科大学 研究生学院,山西 太原 030001;2.山西医学科学院 山西大医院泌尿外科,山西 太原 030032)
腹腔镜肾部分切除术与腹腔镜冷冻消融术治疗小肾肿瘤的安全性和疗效的Meta分析
郭强1,任瑞民2,王靖宇2,李建文2,张建东2,张雁钢2
(1.山西医科大学 研究生学院,山西 太原 030001;2.山西医学科学院 山西大医院泌尿外科,山西 太原 030032)
目的 系统评价腹腔镜肾部分切除术(LPN)与腹腔镜冷冻消融术(LCA)治疗小肾肿瘤(SRMs)的安全性及疗效。方法计算机检索PubMed、SCI、Ovid、The Cochrane Library、CNKI、CBM、VIP及万方数据库,全面收集有关LPN与LCA比较治疗SRMs的临床对照试验,检索时限截至2016年4月。由2名评价者按照纳入与排除标准选择试验、提取资料和评价质量后,采用RevMan 5.3软件进行Meta分析。结果纳入9篇研究,共748例患者。Meta分析结果显示:LCA较LPN手术时间短[均数差(MD)=42.75,95%CI(12.19,73.31),P=0.006],术中出血量少[MD=190.73,95%CI(126.67,254.78),P=0.000],住院时间短[MD=2.23,95% CI(0.17,4.28),P=0.030],术式转换率低[比值比(O)=3.54,95%CI(1.18,10.59),P=0.020],并发症少[O=3.90,95%CI(1.84,8.24),P=0.000],术后肾小球滤过率(GFR)下降量低[MD=10.30,95%CI(5.38,15.24),P=0.000],局部复发风险高[O=0.13,95%CI(0.04,0.44),P=0.000],远处转移风险高[O=0.16,95%CI(0.03,0.78),P=0.020],而在术后血肌酐(Scr)上升量、输血率比较差异均无统计学意义(P>0.05)。结论LCA在围手术期结果、保护肾功能方面更有优势,但其有较高的肿瘤局部复发和远处转移风险,近期、中期疗效相当,远期疗效尚不明确,故在手术病例的选择上仍需谨慎。
腹腔镜肾部分切除术;腹腔镜冷冻消融术;小肾肿瘤;Meta分析
随着影像学检查技术的广泛应用以及人们健康意识的不断提高,无症状隐匿性小 肾肿瘤(small ren al tumors,SRMs)的检出率明显增加(约占50%)[1-2]。对于SRMs人们越来越趋于选择保留肾单位手术(nep hron sparing surgery,NSS),开放性肾部分切除术(open partial nephrectomy,OPN)是NSS的标准治疗技术[3],因其有较好的肾功能保护作用和5年生存率大于>95%的优势[4]。然而,随着微创技术的发展,腹腔镜肾部分切除术(laparoscopic partial nephrectomy,LPN)目前已成为开展最广泛、疗效最肯定的NSS,且LPN 与OPN的治疗效果无明显差别[5],但其对术者腹腔镜操作技术要求更高,且对患者仍有一定创伤。因此,临床学者一直在探索治疗SRMs更为微创、并发症少、操作简单的方法[6],其中腹腔镜冷冻消融术(1aparosc opic cryoablation,LCA)获得了较为理想的结果,LCA无需切开肾实质和阻断血管,一定程度 上能更好的保护肾单位和避免肾缺血再灌注损伤,但其安全性和疗效一直是人们关注的焦点。本研究综合现有的相关文献进行Meta分析,比较LPN和LCA的临床疗效及安全性方面的差异,以期为临床应用提供最佳证据。
1 资料与方法
1.1 一般资料
依据Cochrane协作组检索手册,检索2000年1月-2016年4月关于LPN与LCA治疗SRMs的相关文献。 选 用PubMed、SCI、Ovid、The Cochrane Library、CNKI、CBM、VIP及万方数据库。中文检索词为“小肾肿瘤、腹腔镜肾部分切除术、腹腔镜冷冻消融术”,英文检索词为“small renal tumors、Laparoscopic Partial Nephrectomy、Laparoscopic Cryoablation”。此外,对纳入文献及相关综述进行二次检索,以免遗漏相关文献。
1.2 纳入标准和排除标准
纳入标准:①研究类型为临床对照试验,限中、英文;②研究对象为SRMs的患者;③干预措施为LPN与LCA;④至少报告一个结局指标[手术时间、术中出血量、住院时间、术式转换率、输血率、术后血清肌酐(serum creatinine,Scr)上升量,术后肾小球滤过率(glomerular filtration rate,GFR)下降量、并发症、局部复发、远处转移]。排除标准:①没有对照组;②没有全文;③文献中未提及相关结局指标;④机器人辅助腹腔镜。
1.3 资料提取和质量评价
由2名评价员根据纳入和排除标准独立筛选文献,而后交叉核对,对难以判断的文献在获取全文后进一步筛查,如遇分歧,通过讨论或咨询第三方裁决。由2名评价者参照Cochrane 手册的质量评价标准对纳入研究进行质量评价。质量评分使用纽卡斯尔-渥太华量表(Newcastle-Ottawa Scale,NOS),有“选择”、“暴露”、“可比性”3个类别8个条目,其总评分为9分。
1.4 统计学方法
采用Revman 5.3完成Meta分析过程。计量资料采用均数差(mean difference,MD)及其95%CI,计数资料采用比值比(odds ratio,O)及95%CI,以P<0.05为差异有统计学意义。采用χ2检验分析各研究间的统计学异质性,同质性好的研究(P>0.10,I2<50%)采用固定效应模型;如存在异质性(P≤0.10,I2>50%),分析异质性来源,若无明显临床异质性,采用随机效应模型分析,若有临床异质性可根据来源作亚组分析,若异质性过大,则采用描述性分析。
2 结果
2.1 纳入文献的基本情况和方法学质量评价
经初筛后15篇文献纳入研究,进一步查找和 阅读全文,严格按照纳入与排除标准筛选最终纳入9篇文献[7-15],均为临床对照试验,其中英文8篇,中文1篇。共涉及患者748例患者,其中LPN组450例,LCA组298例。文献质量评分(NOS)结果可见纳入的文献整体质量较高,但仍存在一定偏倚风险。见表1。
2.2 纳入研究对象术前基线情况比较
对纳入研究的患者术前基线资料行Meta分析汇总见表2。与LPN相比,接受LCA术的患者年龄偏大[MD=-2.35,95%CI(-4.43,-0.28),P=0.030],孤立肾率高[OR^=0.23,95%CI(0.12,0.44),P=0.000],ASA评分高[OR^=0.43,95%CI(0.27,0.69),P=0.000],相对于BMI、肿瘤大小和性别差异均无统计学意义(均P>0.05)。
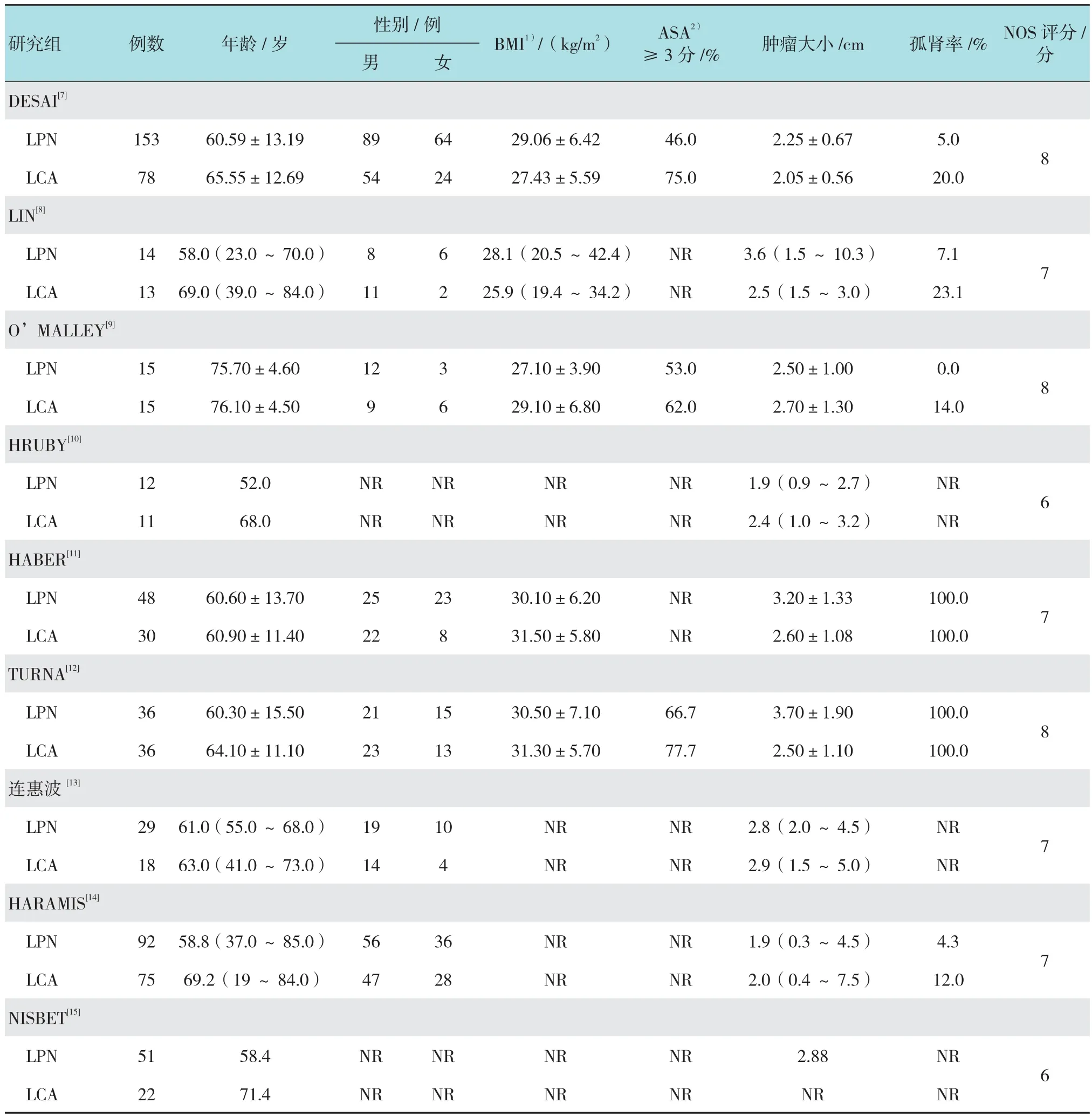
表1 纳入研究的基线特征和质量评分
2.3 围手术期结果
围手术期的相关结果指标Meta分析汇总见表3。各结果间存在异质性(除输血率、术式转换率),逐个剔除研究后仍无法消除异质性,经分析为临床一致性,故采用随机效应模型分析合并效应量,结果与LPN组相比,LCA组手术时间短[MD=42.75,95%CI (12.19,73.31),P=0.006],术中出血量少[MD=190.73,95%CI(126.67,254.78),P=0.000],住院时间短[MD=2.23,95%CI(0.17,4.28),P=0.030]。输血率和术式转换率具有同质性故采用固定效应模型分析。术式转换率低,差异有统计学意义[O=3.54,95%CI (1.18,10.59),P=0.020],而输血率差异无统计学意义[O=1.43,95%CI(0.54,3.76),P=0.470]。
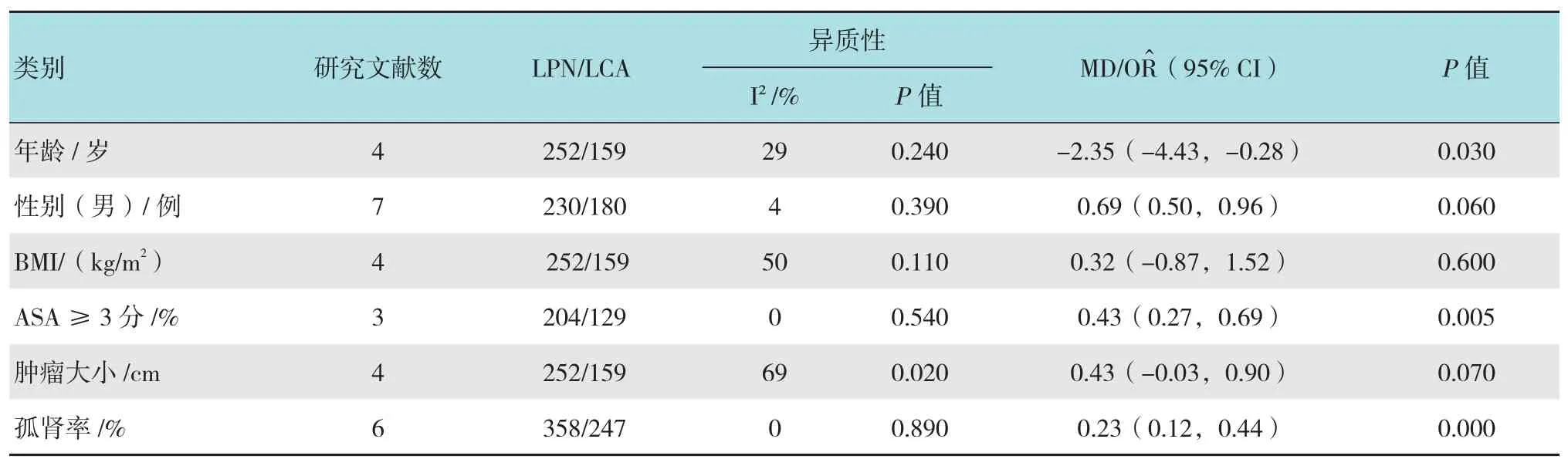
表2 LPN组和LCA组术前临床特征Meta分析汇总

表3 LPN组与LCA组围手术期结果比较汇总
2.4 并发症
有9篇文献[7-15]研究报告了并发症,各研究结果间具有异质性(P=0.010,I²=60%),故应用随机效应模型分析,结果显示两组在总并 发症方面差异有统计学意义[O=3.90,95%CI(1.84,8.24),P=0.000],LPN组发生并发症的可能性是LCA组的4倍左右。分析异质性来源,以泌尿系并发症与非泌尿系并发症来分获得两个亚组(图1),其中P分别为0.020 和0.660,I2分别为55%和0%,但将两亚组合并则P=0.130,I2=28%,亚组分析后,有效降低了总体异质性,提示泌尿系并发症可能是异质性来源之一。泌尿系并发症存在异质性,进行类型亚组分析,结果显示见表4,LPN较LCA有较高的漏尿风险(P<0.05),其他并发症类型差异无统计学意义(P>0.05)。

图1 LPN与LCA并发症比较的Meta分析
2.5 肾功能
与LPN组相比,LCA组术前GFR较低[MD=9.88,95%CI(3.35,16.40),P=0.003],术前SCr较高[MD=-0.16,95%CI(-0.29,-0.02),P=0.030]。术后肾功能,LCA组GFR下降量低于LPN[MD=10.30,95%CI(5.38,15.24),P=0.000],而术后SCr、SCr上升量、术后GFR两组差异无统计学意义(P>0.05),见表5。

表4 泌尿系并发症

表5 肾功能Meta分析汇总
2.6 肿瘤预后
肿瘤局部复发和远处转移进展风险的统计仅限于经组织学病理证实为恶性肿瘤的患者。有5篇文献[7,11-12,14-15]研究报告肿瘤局部复发,各研究结果间具有同质性(P>0.10,I2=0%),故应用固定效应模型分析,结果显示LCA有较高的肿瘤局部复发风险,差异有统计学意义[O=0.13,95%CI(0.04,0.44),P=0.000],见图2。有3篇文献[8,11-12]研究报告远处转移,各研究结果间具有同质性(P>0.10,I2=0%),故应用固定效应模型分析,结果显示LCA组有较高的肿瘤远处转移风险,差异有统计学意义[O=0.16,95%CI(0.03,0.78),P=0.020]。见图3。

图2 LPN与LCA局部复发比较的Meta分析

图3 LPN与LCA远处转移比较的Meta分析
3 讨论
LCA是指在腹腔镜下精确定位肿瘤,应用冷冻消融技术对肾脏肿瘤组织进行消融,使肿瘤组织细胞发生变性坏死,并可在直视和使用可控超声探针的情况下监测冰球的形成,能使冰球精确地超出肿瘤边缘1 cm以保证病灶的完全坏死,对减少肿瘤残留具有极其重要的意义[16]。此外,冷冻坏死的组织细胞释放的自身抗原可诱发自身免疫反应,从而发挥免疫调节的作用[17]。目前,越来越多的学者致力于LCA临床研究,但其手术安全性及疗效仍存在争议,因而有必要进行Meta分析。
Meta分析结果表明,LCA的优势主要体现在手术时间短、出血量少、住院时间短、术式转换率低、可以较好地保护肾功能和并发症少方面,输血率无差异。以Scr、GFR作为评价肾功能变化的主要指标,结果可见LCA不但对患肾功能影响很小,而且在保护肾功能方面的表现优于LPN,这可从LCA无需阻断肾血流、避免了缺血再灌注损伤、且操作精准、无需切开肾实质和手术时间短等方面解释。另外,LPN有较高的并发症,尽管接受LCA的患者临床基线特征相对较差。在泌尿系并发症方面,LPN有较高的漏尿风险,这可以由手术技术解释(肿瘤切除及创面缝合);在非泌尿系并发症方面,各系统并发症无明显差异。另外,并发症的分析是很复杂的,各研究间并不严格按Clavien分级(除HARAMIS等[14]),且各研究间对并发症的定义标准不一,存在选择性报告可能。
LCA有较高的肿瘤进展风险,局部复发率和远处转移率高于LPN。HABER等[11]对LPN组和LCA组第3、5和7年生存率进行比较:肿瘤特异生存率为(100% vs 93%)、(100% vs 88%)和(100% vs 82%);肿瘤控制率为(100% vs 92%)、(100% vs 86%)和(100% vs 86%),以上差异均无统计学意义。TURNA等[12]对LPN组与LCA组2年生存率进行比较:总体生存率为(91% vs 88%,P=0.250),肿瘤特异生存率为(100% vs 88%,P=0.780)。DESAI等[7]对LPN组和LCA组的临床疗效进行比较,在相同随访期内,两组的肿瘤复发率、肿瘤相关生存率差异无统计学意义。魏世平[18]等报道12例LCA术后患者平均随访65个月,研究证实LCA治疗局部小肾癌是安全、有效的。GILL等[19]报道56例LCA术后患者随访3年肿瘤特异生存率为98%。HEGARTY等[20]报道66例患者随访5年以上,5年总体生存率为81%、肿瘤特异性生存率为98%。 ARON等[21]对80例LCA治疗的结果进行总结,5年和10年总生存率、肿瘤特异生存率、无病生存率分别为84%、92%、81%和51%、83%、78%,提示LCA治疗SRMs有出色的肿瘤控制率和远期生存率。GUAZZONI等[22]对123例行LCA术后随访5年,肿瘤特异生存率和总生存率为100%和93%,证实LCA治疗SRMs是安全、有效的。总体来看,LCA与LPN相比,对治疗SRMs的近期、中期疗效相当,单独对LCA研究随访研究表明远期疗效可,但缺乏与LPN的临床对照试验长期随访比较。本研究结果表明LCA肿瘤预后较LPN差,这可能与临床决策有关,对于年龄大、孤立肾、肾功能不全和基础疾病多的患者更倾向于接受或推荐LCA,相反选择LPN,这可能会产生选择偏倚。
由于Meta分析属于观察性研究,其结果可能会受到偏倚、混杂等因素的影响。有几点值得讨论:①本研究没有随机对照试验比较LCA与LPN,均为临床对照试验;②纳入研究的患者LCA临床基线特征相对较差,且随访时间不一,肿瘤预后分析说服力不足;③纳入文献的研究指标和统计结果表示方法不完全一致,导致每个指标所使用的数据仅来源于部分文章,降低了数据的可信度,同时增加了偏倚的来源。此外,由于缺乏大宗病例的长期随访对照研究,尚不能进行肿瘤远期预后的评估。
综上所述,LCA在围手术期结果、保护肾功能方面更有优势,但LCA有较高的肿瘤进展风险,局部复发率和远处转移率高于LPN,这可能与LCA组患者临床基线特征较差有关,由于纳入研究所固有的局限,仍有研究偏倚存在。LPN组和LCA组近期、中期疗效相当,鉴于目前缺乏较为远期疗效的比较报道,远期疗效尚不确切,故在手术病例的选择上仍需要非常谨慎。由于纳入研究数量和质量存在局限性,尚需要大样本、多中心、前瞻性和高质量的随机对照研究进一步验证。
[1] SUN M, THURET R, ABDOLLAH F, et al. Age-adjusted incidence, mortality, and survival rates of stage-specifi c renalcell carcinoma in North America: A trend analysis[J]. Eur Urol, 2011, 59(1): 135-141.
[2] 郭应禄, 周利群 主译. 坎贝尔-沃尔什泌尿外科学[M]. 第9版.北京: 北京大学出版社, 2009: 1651-1733.
[3] 那彦群, 叶章群, 孙颖浩, 等. 中国泌尿外科疾病诊断治疗指南[M]. 北京: 人民卫生出版社, 2014: 6-7.
[4] CAMPBELL S C, NOVICK A C, BELLDEGRUN A, et al. Guideline for management of the clinical T1 renal mass[J]. J Urol, 2009, 182(4): 1271-1279.
[5] 罗照, 王德林, 盛夏, 等. 腹腔镜与开放性肾部分切除术临床疗效比较的Meta分析[J]. 中华泌尿外科杂志, 2013, 34(6): 444-447.
[6] CHEN D Y, UZZO R G. Optimal management of localized renal cell carcinoma: surgery, ablation, or active surveillance[J]. J Natl Compr Canc Netw, 2009, 7(6): 635-642.
[7] DESAI M M, ARON M, GILL I S. Laparoscopic partial nephrectomy versus laparoscopic cryoablation for the small renal tumor[J]. Urology, 2005, 66(5 Suppl): 23-28.
[8] LIN Y C, TURNA B, FROTA R, et al. Laparoscopic partial nephrectomy versus laparoscopic cryoablation for multiple ipsilateral renal tumors[J]. Eur Urol, 2008, 53(6): 1210-1216.
[9] O’MALLEY R L, BERGER A D, KANOFSKY J A, et al. A matched-cohort comparison of laparoscopic cryoablation and laparoscopic partial nephrectomy for treating renal masses[J]. BJU Int, 2006, 99(2): 395-398.
[10] HRUBY G, REISIGER K, VENKATESH R, et al. Comparison of laparoscopic partial nephrectomy and laparoscopic cryoablation for renal hilar tumors[J]. Urology, 2006, 67(1): 50-54.
[11] HABER G P, LEE M C, CROUZET S, et al. Tumour in solitary kidney: Laparoscopic partial nephrectomy vs laparoscopic cryoablation[J]. BJU Int, 2012, 109(1): 118-124.
[12] TURNA B, KAOUK J H, FROTA R, et al. Minimally invasive nephron sparing management for renal tumors in solitary kidneys[J]. J Urol, 2009, 182(5): 2150-2157.
[13] 连惠波, 郭宏骞, 甘卫东, 等. 腹腔镜下冷冻消融与肾部分切除术治疗肾细胞癌的临床效果比较[J]. 中华外科杂志, 2010, 48(11): 834-837.
[14] HARAMIS G, GRAVERSEN J A, MUES A C, et al. Retros pective comparison of laparoscopic partial nephrectomy versus laparoscopic renal cryoablation for small (<3.5 cm) cortical renal masses[J]. J Laparoendosc Adv Surg Tech A, 2012, 22(2): 152-157.
[15] NISBET A A, RIEDER J M, TRAN V Q, et al. Decision tree for laparoscopic partial nephrectomy versus laparoscopic renal cryoablation for small renal masses[J]. J Endourol, 2009, 23(3): 431-437.
[16] STEIN R J, KAOUK J H. Renal cryotherapy: A detailed review including a 5-year follow-up[J]. BJU Int, 2007, 99(5 Pt B): 1265-1270.
[17] MOURAVIEV V, JONIAU S, VAN POPPEL H, et al. Current status of minimally invasive ablative techniques in the treatment of small renal tumors[J]. Eur Urol, 2007, 51(2): 328-336.
[18] 魏世平, 李辉明, 陶维雄, 等. 腹腔镜下冷冻消融治疗肾癌的长期随访报告[J]. 中国微创外科杂志, 2015, 15(4): 344-346.
[19] GILL I S, REMER E M, HASAN W A, et al. Renal cryoablation: Outcomes at 3 years[J]. J Urol, 2005, 173(6): 1903-1907.
[20] HEGARTY N J, GILL I S, DESAI M M, et al. Probe-ablative nephron-sparing surgery: cryoablation versus radiofrequency ablation[J]. Urology, 2006, 68(1 Suppl): 7-13.
[21] ARON M, KAMOI K, REMER E, et al. Laparoscopic renal cryoablation: 8-year, single surgeon outcomes[J]. J Urol, 2010, 183(3): 889-895.
[22] GUAZZONI G, GESTARI A, BUFFI N, et al. Oncologic results of laparoscopic renal cryoablation for clinical T1a tumors: 8 years of experience in a single institution[J]. Urology, 2010, 76(3): 624-629.
(吴静 编辑)
Laparoscopic partial nephrectomy versus 1aparoscopic cryoablation for the small renal tumors: a meta-analysis of safety and effi cacy
Qiang Guo1, Rui-min Ren2, Jing-yu Wang2, Jian-wen Li2, Jian-dong Zhang2, Yan-gang Zhang2
(1.Shanxi Medical University, Taiyuan, Shanxi 030001, China; 2.Shanxi Academy of Medical Sciences, Shanxi Dayi Hospital, Taiyuan, Shanxi 030032, China)
ObjectiveTo evaluate the safety and effi cacy of Laparoscopic partial nephrectomy (LPN) versus 1aparoscopic cryoablation (LCA) for the small renal tumors (SRMs).MethodsThe databases of PubMed, SCI, Ovid, the Cochrane Library, CNKI, CBM, VIP and Wangfang Data were searched to controlled clinical trial about LPN versus LCA for the treatment of small renal tumor. The retrieval time span was from inception to Apr 2016. The studies were screened according to the inclusion and exclusion criteria, the date were extracted and the quality was evaluated by 2 reviewers independently. And then the Meta-analysis was conducted using RevMan 5.3 software.Results9 studies were included, and 748 cases were involved. The meta-analysis showed that comparing with LPN, the operation time of LCA was shorter [MD = 42.75, 95 % CI (12.19 ~ 73.31),P= 0.006], less intraoperative blood loss [MD = 190.73, 95 % CI (126.67 ~ 254.78),P= 0.000], shortening hospital stay [MD = 2.23, 95 % CI (0.17 ~ 4.28),P= 0.030], lower transfusion rate [O= 3.54, 95 % CI (1.18 ~ 10.59),P= 0.020], lower rate of postoperative glomerular fi ltration levels [MD = 10.30, 95 % CI (5.38 ~ 15.24),P= 0.000], less complications[O= 3.90, 95 % CI (1.84 ~ 8.24),P= 0.000], higher risk of local recurrence [O= 0.13, 95 % CI (0.04 ~ 0.44),P= 0.000], higher risk of distant metastases [O= 0.16, 95 % CI (0.03 ~ 0.78),P= 0.020], but there were no signifi cant differences in postoperative creatinine rise and transfusion rate (P> 0.05).ConclusionsLCA has advantage in perioperative period results and protect renal function. But LCA has a higher local recurrence and distant metastasis risk, short-term and medium-term efficacy considerably, long-term effect is not clear, therefore, in the choice of surgical cases still need to be careful.
laparoscopic partial nephrectomy; 1aparoscopic cryoablation; small renal tumors; Meta-analysis
R737.11
A
10.3969/j.issn.1007-1989.2016.12.011
1007-1989(2016)12-0055-07
2016-06-02
张雁钢,E-mail:urozyg@163.com
