姜黄素对类风湿关节炎患者破骨细胞生成数量和活性的影响
2017-01-10徐子涵商玮赵凌杰董晓蕾郭郡浩刘春丽常文静张蓓蓓蔡辉
徐子涵,商玮,赵凌杰,董晓蕾,郭郡浩,刘春丽,常文静,张蓓蓓,蔡辉,
(1.南京中医药大学,江苏 南京 210023;2.南京军区南京总医院中西医结合科,江苏 南京 210002)
姜黄素对类风湿关节炎患者破骨细胞生成数量和活性的影响
徐子涵1,商玮2,赵凌杰2,董晓蕾2,郭郡浩2,刘春丽2,常文静2,张蓓蓓2,蔡辉1,2
(1.南京中医药大学,江苏 南京 210023;2.南京军区南京总医院中西医结合科,江苏 南京 210002)
目的 研究姜黄素对类风湿关节炎(RA)患者破骨细胞生成数量和活性的影响。方法 采集RA患者外周血,密度梯度离心法分离外周血单个核细胞(PBMCs),经核因子κB受体活化因子配体(RANKL)和巨噬细胞集落刺激因子(M-CSF)诱导分化,分别采用不同浓度(2.5、5、10 μmol·L-1)姜黄素进行干预;根据姜黄素浓度将实验分为4组,即空白对照组、姜黄素低浓度组、姜黄素中浓度组和姜黄素高浓度组;14 d后行抗酒石酸酸性磷酸酶(TRAP)染色检测破骨细胞并计数;检测细胞TRAP活性。结果 细胞培养14 d后,姜黄素低、中、高浓度组的TRAP阳性细胞计数(个/10个视野)分别为96.89±3.51、76.44±1.88和62.56±2.70,均低于空白对照组131.00±4.03(P<0.05);各浓度组的TRAP活性(U·L-1)分别为5.74±0.36、4.21±0.12和3.06±0.07,均低于空白对照组7.48±0.22(P<0.05)。结论 姜黄素抑制RA患者PBMCs生成破骨细胞的数量和活性,且随着姜黄素浓度的增加,抑制作用呈增强趋势。
姜黄素;类风湿关节炎;外周血单个核细胞;破骨细胞
类风湿关节炎(rheumatoid arthritis,RA)是以慢性进展性滑膜炎症为特征的自身免疫性疾病。除四肢小关节炎症外,以骨量丢失为表现的骨代谢异常贯穿于RA的整个病程中,是造成RA患者关节变形,功能减退,高骨折发生率和残疾的主要原因。破骨细胞主要行使骨吸收功能,主要来源于造血干细胞的单核/巨噬细胞前体。在巨噬细胞集落刺激因子(macrophage colony-stimulating factor,M-CSF)和核因子κB受体活化因子配体(receptor activator of nuclear factor-κB ligand,RANKL)等细胞因子的作用下,单核细胞前体细胞分化、融合,形成多核破骨细胞,表达抗酒石酸酸性磷酸酶(tartrate resistant acid phosphatase,TRAP)和降钙素受体(calcitonin receptor,CTR)等特异性基因,分泌基质金属蛋白酶(matrix Metalloproteinases,MMPs)和CatK等蛋白水解酶,从而降解有机骨基质[1]。
姜黄素(curcumin)是从中药姜黄中提取的一种低分子量的酚类物质。Cho等[2]研究表明,姜黄素具有降低骨吸收强度、改善骨质疏松的作用。这可能与它能降低骨髓基质细胞RANKL的表达,抑制破骨细胞的形成有关[3]。本课题组前期研究发现,姜黄素能增加实验大鼠骨密度,抑制其骨丢失[4]。为进一步探讨姜黄素防治RA骨量丢失的潜在机制,本研究通过体外诱导RA患者外周血单个核细胞(peripheral blood mononuclear cells,PBMCs)生成破骨细胞,并观察姜黄素对破骨细胞生成数量和活性的影响,探讨姜黄素对破骨细胞生成的调节机制和作用。
1 材料和方法
1.1 临床资料 收集2014年7月至2014年12月,南京军区南京总医院中西医结合科门诊及住院RA患者15例,其中男性3例,女性12例,平均年龄(46±15)岁,均符合2010年RA的ACR/EULAR分类标准[5]。
1.2 主要试剂 α-MEM培养基(美国Gibco公司),胎牛血清(FBS)(杭州四季青生物工程材料有限公司),RANKL、M-CSF(美国Pepro Tech公司),磷酸盐缓冲液(PBS),TRAP染色试剂盒(南京建成生物工程研究所),TRAP检测试剂盒(碧云天生物技术)。
1.3 PBMCs的分离与培养 取RA患者外周血8 mL,用Ficoll密度梯度离心方法分离PBMCs,用PBS清洗2次,用α-MEM培养液配制成浓度为2×106·L-1细胞悬液,接种于24 孔培养板中,每孔800 μL。在37℃、5%CO2、饱和湿度的细胞培养箱内培养。
1.4 分组 共设4组:空白对照组、姜黄素低浓度组、姜黄素中浓度组和姜黄素高浓度组,每组设3个平行样本。培养2 h后,空白对照组每孔加入800 μL 诱导培养液[RANKL(100 μg·L-1)和M-CSF(50 μg·L-1)],姜黄素低、中、高浓度组每孔分别加入800 μL含不同浓度(2.5、5、10 μmol·L-1)姜黄素的诱导培养液。放入细胞培养箱培养,隔天换液1次。
1.5 细胞形态学观察 用倒置显微镜观察培养细胞的形态、细胞融合以及多核细胞形成的情况,并拍照。
1.6 TARP染色并计数 用细胞固定液固定30 s,去离子水冲洗,加入配制好的TRAP 反应液37 ℃恒温孵育60 min,去离子水冲洗 3 次,干燥,用苏木精复染3~5 min,碱性液冲洗,晾干。光学显微镜(200×)下,随机选取10个视野,计数TRAP阳性细胞(细胞核≥3 个,胞质呈酒红色),取均值,结果用“个/10个视野”表示,每孔重复计数3次。
1.7 TRAP活性测定 用PBS洗3次,用TRIzol液裂解细胞,匀浆,离心取上清。参照按说明书配置相关试剂,设置空白对照孔、标准品孔和样品孔,加入试剂及细胞裂解液,混匀后37 ℃孵育10 min,每孔加入160 μL反应终止液,在405 nm测定吸光度。以在pH4.8,37 ℃条件下,每分钟对硝基苯磷酸二钠显色底物产生1 nmol对硝基酚所需的酸性磷酸酶的量定义为一个TRAP活力单位。根据酶活性定义,计算出样品中的TRAP活性。
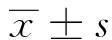
2 结果
2.1 细胞形态学观察 刚接种后观察细胞数量较多,体积小,都呈圆形,折光性强,悬浮于培养基中。细胞培养第7天,观察见培养的细胞中有个别细胞体积增大,轮廓清晰,呈椭圆形或不规则形,并有细长的伪足,细胞核体积增大,呈圆形或椭圆形。第14天,可见多个多核细胞,胞体明显增大,折光性强,形态有油煎蛋形、漏斗形或不规则形,有裙状或丝状伪足,胞内有3~5个以上的细胞核,胞浆中有较多空泡,符合破骨细胞的形态特征(图1)。
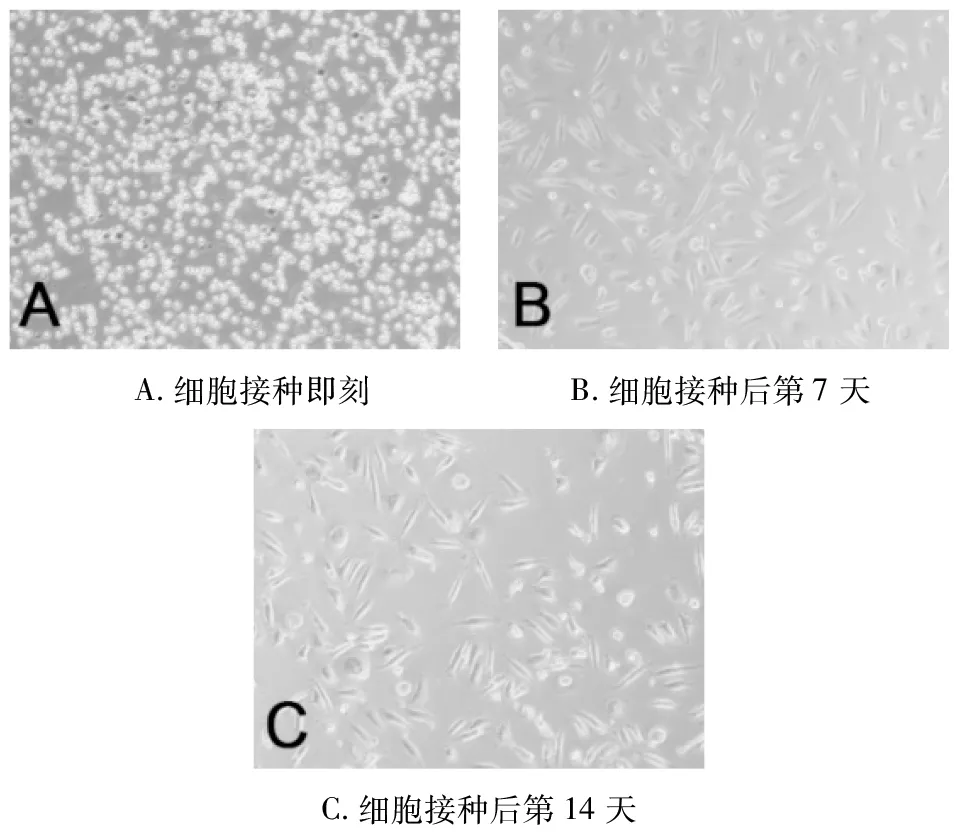
图1 倒置显微镜下细胞形态(200×)
2.2 TRAP染色阳性细胞计数结果 如图2所示,结果显示,空白对照组TRAP阳性细胞数较多,体积较大,染色较深。相比而言,姜黄素低、中、高各浓度组中形成的TRAP阳性细胞数较少,体积较小,染色较淡。细胞计数结果显示:姜黄素低、中、高浓度组破骨细胞数量均较空白对照组少,且差异有统计学意义(P<0.05),见表1。
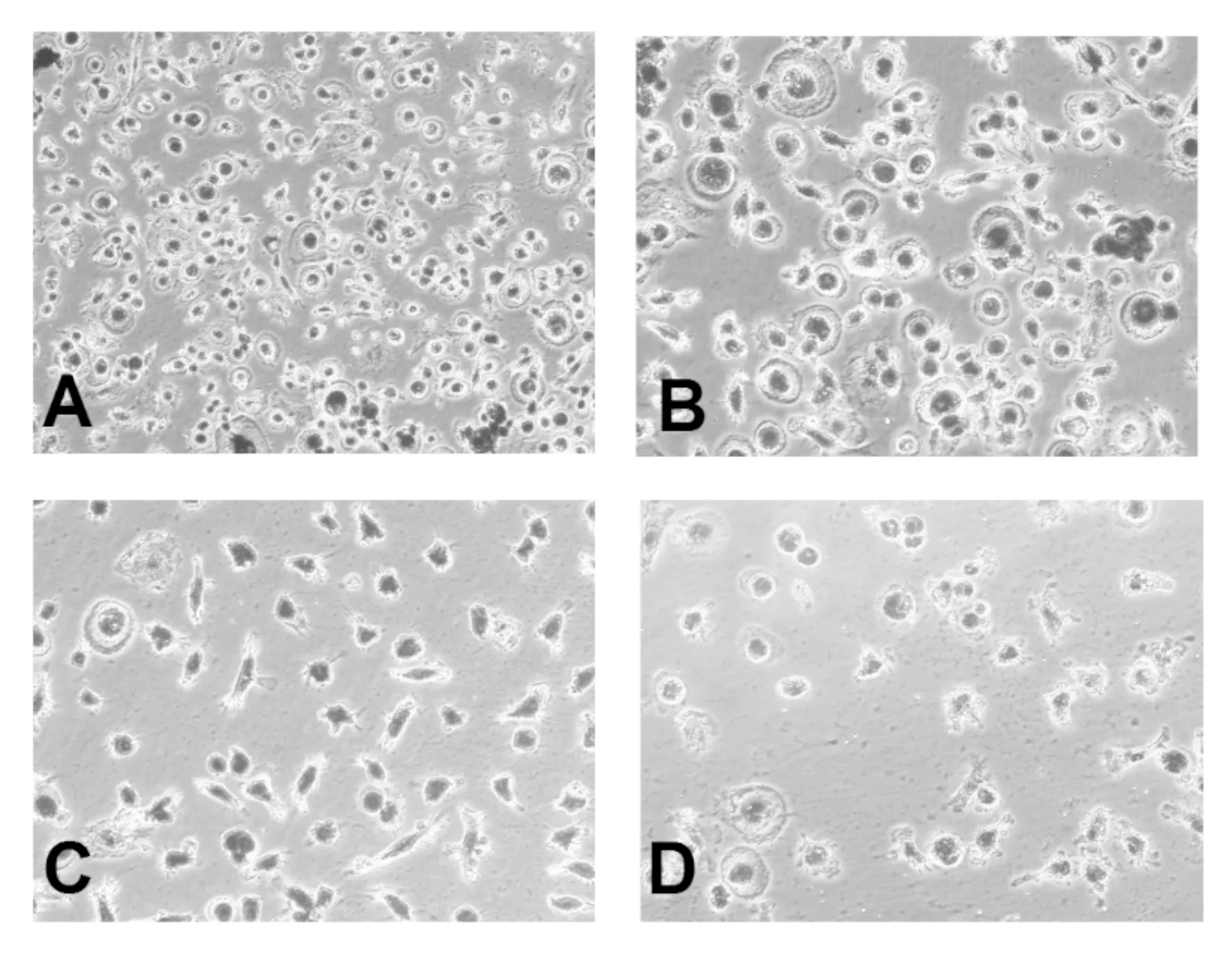
注:A.空白对照组;B.姜黄素低浓度组;C.姜黄素中浓度组;D.姜黄素高浓度组
图2 TRAP染色(200×)
2.3 TRAP活性测定结果 如表1所示,姜黄素低、中、高浓度组的TRAP活性均低于与空白对照组,且差异有统计学意义(P<0.05)。
表1 各组TRAP阳性细胞计数、TRAP活性比较
注:与空白对照组比较,aP<0.05。
3 讨论
RA是临床上常见的结缔组织病,以滑膜炎、滑膜增生及血管翳形成为基本特征[6],此外,骨量丢失也是RA常见的病理改变,包括关节周围骨量减少、骨侵蚀和广泛性骨质疏松。在人体内,骨骼不间断地重复着清除陈旧骨及形成新骨的骨重建过程,在正常生理条件下,破骨细胞和成骨细胞相互偶联与调节,以维持骨代谢平衡[7]。目前研究认为破骨细胞数量增加,活性增强,以骨吸收增加为主的骨代谢失衡是RA骨量丢失的主要原因[8]。
破骨细胞是人体内唯一具有骨破坏能力的细胞,它来源于单核巨噬细胞系的多核终末分化细胞。这些细胞具有向骨吸收区移动的特性,可黏附于骨表面分化为单核的破骨细胞前体细胞,并进一步互相融合成为多核巨细胞,分泌CatK、MMP-9 和TRAP5等蛋白水解酶进入骨吸收陷窝,并通过质子泵分泌H+,降解骨基质。
破骨细胞具有不能传代、存活时间短等特点,且破骨细胞在体内数量极少,难以分离获得[9]。破骨细胞的培养方法主要有分离法和诱导法。Fujikawa等[10]首次应用人外周血分离的单核细胞诱导培养出破骨细胞,该培养法具有来源丰富、取材方便等优点。进一步研究发现,在培养过程中为促进前体细胞向破骨细胞分化,必须使用两种诱导剂,分别是RANKL和M-CSF,两者缺一不可,共同发挥诱导作用[11]。本实验为体外培养RA患者的破骨细胞,选用PBMC诱导法,通过加用RANKL和M-CSF两种诱导剂,诱导前体细胞向破骨细胞分化。
破骨细胞的鉴定主要从细胞形态、TRAP 染色、TRAP活性检测等方面进行。诱导成熟的破骨细胞呈圆形或不规则形,胞体较大,胞核为3~15 个,边界不整见伪足。TRAP是酸性磷酸酶(acid phosphatase,ACP)同工酶的第5型,为破骨细胞所特有,直接参与破骨细胞的骨吸收过程。TRAP染色是鉴定破骨细胞的常用方法,通常将TRAP染色阳性、胞核≥3个的细胞认定为破骨细胞,通过TRAP染色阳性细胞计数,可以评估诱导生成的破骨细胞的数量。TRAP活性水平被认为是反映破骨细胞功能以及临床判断骨吸收的敏感而特异性指标。因此,可以通过这几个方面来观察破骨细胞的数量和分泌活性。
姜黄(curcumalongaL)为姜科草本植物姜黄的干燥根茎,其味辛、苦,性温,入肝脾二经,具有行气、散风活血、通经止痛之功效。姜黄素是从姜黄中提取的一种低分子量的酚类物质,现有研究证实它具有抗炎、抗肿瘤、抗氧化、抑制血管新生、抗动脉粥样硬化和神经保护等药理作用,与其能影响NF-κB等转录因子,TNF-α、IL-1等细胞因子的表达有关[12]。Hussan等[13]研究发现,姜黄素能减少破骨细胞数量,同时增加成骨细胞数量,从而对卵巢切除后大鼠骨丢失有一定治疗作用。
本研究采用RA患者PBMCs诱导培养破骨细胞,并在培养过程中用低、中、高浓度的姜黄素进行干预,通过观察细胞形态学特征、TRAP染色和计数观察姜黄素对破骨细胞生成数量的影响,检测细胞TRAP活性观察姜黄素对破骨细胞分泌活性的影响。结果显示,与空白对照组相比,姜黄素各浓度组均能减少RA患者PBMCs生成破骨细胞的数量,抑制破骨细胞分泌的TRAP活性,且随着姜黄素浓度的增加,抑制作用更明显。因此,我们认为姜黄素具有抑制RA患者破骨细胞生成数量和活性的作用,为临床应用姜黄素防治RA骨破坏提供了实验依据。
[1] Schett G,Gravallese E.Bone erosion in rheumatoid arthritis:mechanisms,diagnosis and treatment[J].Nat Rev Rheumatol,2012,8(11):656-664.
[2] Cho DC,Jung HS,Kim KT,et al.Therapeutic advantages of treatment of high-dose curcumin in the ovariectomized rat[J].J Korean Neurosurg Soc,2013,54(6):461-466.
[3] Oh S,Kyung TW,Choi HS.Curcumin inhibits osteoclastogenesis by decreasing receptor activator of nuclear factor-kappaB ligand(RANKL)in bone marrow stromal cells[J].Mol Cells,2008,26(5):486-489.
[4] 邱艳,商玮,赵智明,等.姜黄素对佐剂性关节炎大鼠滑膜OPG和RANKL蛋白表达的影响[J].中国免疫学杂志,2014,(11):1490-1493,1498.
[5] Aletaha D,Neogi T,Silman AJ,et al.2010 rheumatoid arthritis classification criteria:an American College of Rheumatology/European League Against Rheumatism collaborative initiative[J].Arthritis Rheum,2010,62(9):2569-2581.
[6] McInnes IB,Schett G.The pathogenesis of rheumatoid arthritis[J].N Engl J Med,2011,365(23):2205-2219.
[7] Abdelgawad ME,Delaisse JM,Hinge M,et al.Early reversal cells in adult human bone remodeling:osteoblastic nature,catabolic functions and interactions with osteoclasts[J].Histochem Cell Biol,2016,145(6):603-615.
[8] Rodan GA,Martin TJ.Therapeutic approaches to bone diseases[J].Science,2000,289(5484):1508-1514.
[9] 吕明波,陈克明,刘兴炎.破骨细胞体外培养研究进展[J].国际骨科学杂志,2006(5):308-310.
[10] Fujikawa Y,Quinn JM,Sabokbar A,et al.The human osteoclast precursor circulates in the monocyte fraction[J].Endocrinology,1996,137(9):4058-4060.
[11] 曹新生,张舒,王瀚.破骨细胞培养技术及应用//第十五届国际骨质疏松研讨会暨第十三届国际骨矿研究学术会议会议文集[C].北京:中国骨质疏松杂志社,2015:150-151.
[12] Esatbeyoglu T,Huebbe P,Ernst IM,et al.Curcumin from molecule to biological function[J].Angew Chem Int Ed Engl,2012,51(22):5308-5332.
[13] Hussan F,Ibraheem NG,Kamarudin TA,et al.Curcumin protects against ovariectomy-induced bone changes in rat model[J].Evid Based Complement Alternat Med,2012,2012:174916.
Effects of curcumin on the number and activity of osteoclasts in patients with rheumatoid arthritis
XU Zihan1,SHANG Wei2,ZHAO Lingjie2,et al
(1.NanjingUniversityofChineseMedicine,Nanjing,Jiangsu210023,China;2.DepartmentofIntegratedTraditionalChineseandWesternMedicine,NanjingGeneralHospitalofNanjingMilitaryCommand,PLA,Nanjing,Jiangsu210002,China)
Objective To investigate the effects of curcumin on the osteoclastogenesis from rheumatoid arthritis(RA)patients in vitro.Methods Peripheral blood mononuclear cells(PBMCs)from patients with RA separated by density centrifugation were cultured in the medium containing M-CSF and RANKL,added with different concentrations of curcumin in the process.There were 4 groups named blank control group,curcumin 2.5 μmol·L-1group,curcumin 5 μmol·L-1group and curcumin 10 μmol·L-1group.After cultured for 14 days,TRAP staining was used for the detection and calculation of osteoclasts and the activity of TRAP was evaluated.Results After cultured for 14 days,the number of TRAP-positive osteoclasts were decreased significantly in curcumin 2.5 μmol·L-1group(96.89±3.51),curcumin 5 μmol·L-1group(76.44±1.88),curcumin 10 μmol·L-1group(62.56±2.70),which were significantly lower than that in the blank control group(131.00±4.03,P<0.05).The activities of TRAP in 2.5 μmol·L-1group,5 μmol·L-1group and 10 μmol·L-1group were 5.74±0.36 U·L-1,4.21±0.12 U·L-1and 3.06±0.07 U·L-1,which were lower than that in the blank control group(7.48±0.22 U·L-1,P<0.05).Conclusions Curcumin can inhibit the osteoclastogenesis of the PBMCs from RA patients,and the inhibition effect is enhanced with the increase in the concentration of curcumin.
Curcumin;Rheumatoid arthritis;Peripheral blood mononuclear cell;Osteoclast
南京军区南京总医院科研基金(2015039)
蔡辉,男,教授,博士生导师,研究方向:中西医结合临床与基础研究,E-mail:njzy_caihui@163.com
10.3969/j.issn.1009-6469.2016.11.043
2016-04-14,
2016-07-20)
