锌镍电池及其α-Ni(OH)2正极材料的研究
2017-01-10赵宇翔吴清真
李 媛,赵宇翔,吴清真,朱 伟
(重庆大学化学化工学院,重庆400044)
锌镍电池及其α-Ni(OH)2正极材料的研究
李 媛,赵宇翔,吴清真,朱 伟*
(重庆大学化学化工学院,重庆400044)
综述了化学均相沉淀法合成α-Ni(OH)2的方法,在适宜的温度、pH值、镍盐浓度及添加相关的活性剂下能够得到容量高、电压大、循环性能好的α-Ni(OH)2材料。另外,通过掺杂不同的金属盐来改变其性能,并添加Zn盐、Al盐、Mn盐、铁盐、稀土金属盐等化合物,改良α-Ni(OH)2结构。其中掺杂Al盐得到的α-Ni(OH)2性能最好。综述了化学沉淀法以外的一些其它合成α-Ni(OH)2的方法。
化学均相沉淀法;α-Ni(OH)2;稀土金属盐
锌镍电池是一种绿色环保的理想化学电源。相比传统的铅酸电池和镉镍电池,锌镍电池更环保、更经济,因此锌镍电池可很好地代替传统的化学电源[1-2]。目前,锌镍电池的容量还有待改善,正极材料β-Ni(OH)2的电化学比容量已经临近理论值289 mAh/g,其开发研究的价值不大,而α-Ni(OH)2具有特殊的层状螺旋结构,这种结构是由等距离的层状NiO2构成的,每个NiO2层与相邻的NiO2之间插入了一些的OH-和一些金属离子,α-Ni(OH)2发生氧化还原反应时平均每个镍原子转移的电子数目是β-Ni(OH)2的1.7倍左右,其理论比容量能够达到490 mAh/g,具有很大的开发研究价值。下面综述了化学沉淀法制备α-Ni(OH)2时的适宜条件、α-Ni(OH)2材料的金属掺杂及常见的一些合成方法。
1 锌镍电池简介
1.1 锌镍电池的历史
1887年,Dun在德国就开始申请了锌镍体系电池的相关专利;锌镍电池的提出实际上是俄国学者Michalowshi于1901年首次提出的;20世纪30年代,Drumm试图发展锌镍电池;随后的研究开始有了一点起色,由于同时期出现的镍镉电池具有很强的毒性,而且当时爆发了石油危机,从40年代到60年代英国、前苏联、美国、德国、法国以及日本等国都试图开发研究锌镍电源来作为机车和汽车的电动电源。
经过了100多年的研究,许多国家都加入了锌镍电池的研究工作中,通用公司通过在电极上添加氢氧化钙、在电解液里添加氢氧化锂和碳酸钾解决了锌电极的溶解问题;美国在90年代研制了密封性很好的锌镍电池,这种电池加入了少量的氧化铅,解决了锌枝晶和形变等问题,而且循环寿命能够达到1 000次;韩国的三星研究院在密封型锌镍电池的研究上也做了很多工作,其研究的锌镍电池在90年代就开始了小规模的生产;同时,日本的三洋、松下和汤浅公司研究锌镍电池的进展也很可观,其循环寿命能够达到500次以上,充放电时,其实际容量最高能够达到额定容量的1.3倍。
我国的锌镍电池研究也在不断地发展,如中南大学、天津大学、浙江大学以及桂林理工大学等高校对该电池的研究做了不少工作,也有许多专门生产锌镍电池的公司和机构,如深圳的贝特力公司生产的锌镍电池在国内一直很畅销,河南科隆集团生产的球形氢氧化镍正极材料占据了亚洲氢氧化镍份额的主导地位。早在2000年,国内生产的氢氧化镍正极材料的利用率就超过了100%,振实密度>2.0 g/cm3,其容量已接近国外先进水平,并实现了产业化[3]。
1.2 正极氢氧化镍
在锌镍电池体系中,用到的正极材料主要是氢氧化镍,氢氧化镍是一种绿色的粉末固体,其晶型呈层状的六方晶型结构,在不同结构的氢氧化镍中,都是由层状的NiO2堆积而成的,在充放电时,正极中质子通过在NiO2中嵌入和脱出来发生正极反应,正极材料β-Ni(OH)2的电化学比容量几乎可以达到理论值289 mAh/g,其开发研究的价值不大,α-Ni(OH)2发生氧化还原反应时平均每个镍原子转移的电子数目是β-Ni(OH)2的1.7倍左右,其理论比容量能够达到490 mAh/g,具有很大的开发研究价值。
氢氧化镍的结构包括两种,一种是α-Ni(OH)2,另一种是β-Ni(OH)2,这两种化合物组成元素虽然相同,但是化学性质、物理性质及其结构都存在差别,β-Ni(OH)2是六方水镁石晶型结构,OH-离子呈六方密排结构,镍原子处在两层间八面体的空隙位置。这是一种层状的结构,层与层之间是氧原子和镍原子形成的六方平面,每个镍平面上方有3个氧原子,下方也有3个氧原子。α-Ni(OH)2在XRD中的衍射峰较宽,具有螺旋结构,含有靠氢键连接的水分子,α-Ni(OH)2这种独特的结构使得能够嵌入部分金属离子及阴离子,这样就使得每个镍原子可以得失更多的电子,进而提高电池的理论容量。
β-Ni(OH)2/β-NiOOH与α-Ni(OH)2/-NiOOH是镍电极可逆的两个氧化还原电对[4],一般情况下镍电极上进行的转化是β-Ni(OH)2与β-NiOOH之间的充放电转化,但是在过充电时β-NiOOH能够生成-NiOOH,-NiOOH放电后能够形成α-Ni(OH)2。然而 α-Ni(OH)2在碱性条件下又会转化为β-Ni(OH)2。图1为镍电极活性物质之间的转化关系。
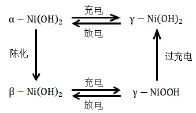
图1 镍电极活性物质之间的转化关系
1.3 电池的结构
正极为球形的氢氧化镍/羟基氧化镍,负极是氧化锌/锌,电解液为不同浓度KOH饱和ZnO的水溶液。如图2为5号成品电池的简单结构形式。

图2 5号电池简单的结构形式
1.4 电化学原理
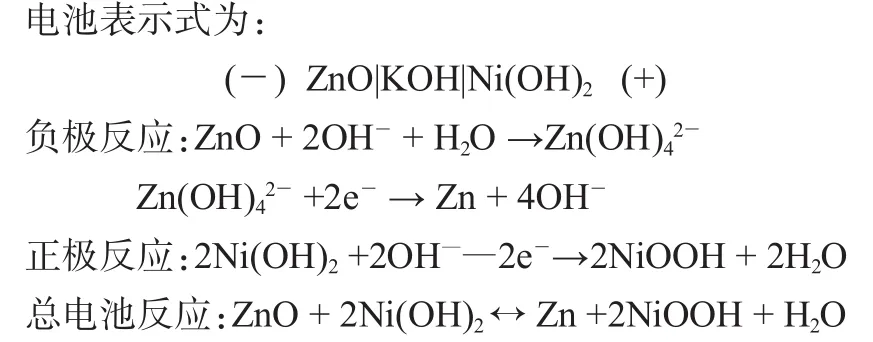
2 氢氧化镍的制备方法
制备Ni(OH)2的方法很多,包括:化学沉淀法、金属粉末法及电化学沉积法等。电化学沉积法采用镍板为阳极,多孔的导电基体为阴极,以含有M金属盐的镍盐溶液为电解液,通入直流电,在阴极基体上能够得到含有金属M的氢氧化镍;金属粉末法包括高压水解法和硝酸氧化法,高压水解法是在高压反应釜中进行的,在反应釜中加入水、纯镍粉和催化剂,通入氧气后将外界温度控制在200℃左右就能够得到 Ni(OH)2。硝酸氧化法与前者类似,只不过是在含有硝酸根的水溶液中进行;化学沉淀法包括化学络合沉淀法、缓冲溶液法、直接生成法和均相沉淀法,络合法是将镍盐溶液先与氨水(或其他络合剂如柠檬酸等)络合形成镍氨配合物,最后慢慢加入碱使得形成的配合物中的镍离子慢慢释放出来,进而得到Ni(OH)2,缓冲溶液法的原理是:在一定的pH值下往镍盐中加入NH3-NH4+的缓冲溶液后与碱作用,从而得到Ni(OH)2沉淀,直接生成法与前面方法不同的就是不加络合剂,也不加缓冲溶液,镍盐和碱直接作用生成Ni(OH)2沉淀,均相沉淀法是结合络合沉淀法、缓冲溶液法和直接生成法的特殊化学沉淀法。图3为氢氧化镍的一些常见制备方法。
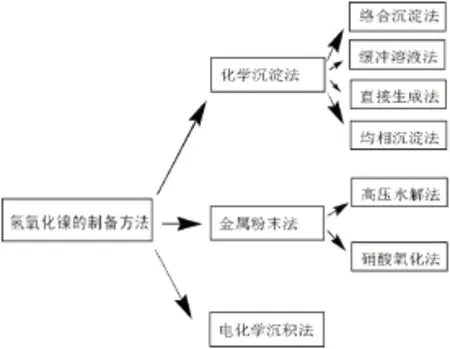
图3 氢氧化镍常见的一些制备方法
3 化学均相沉淀法制备α-Ni(OH)2
均相化学沉淀法指的是控制好参加反应溶液的浓度,将阳离子和阴离子均匀的从溶液中释放出来,溶液中得到的沉淀能够保持一种良好的平衡状态,这种方法就叫均相沉淀法。该法操作简单,温度、浓度和pH值易于控制,得到的材料颗粒较细,适合制备高性能的球形α-Ni(OH)2,因此化学共沉淀法是国内外制备合成稳定α-Ni(OH)2材料的首选方法。
镍源一般有两种,分别是硫酸镍和硝酸镍;对应的碱液沉淀剂有氢氧化钾、氢氧化钠、氨水及尿素溶液等。假如采用尿素为沉淀剂,其原理如下:
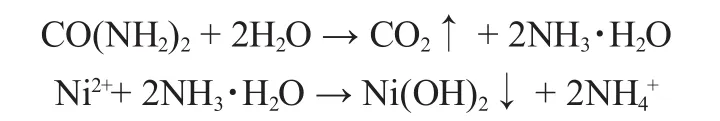
刘元刚等[5]以尿素为沉淀剂通过掺铝合成了稳定的亚微米级颗粒α-Ni(OH)2,化学式可表示为Ni0.78Al0.18(OH)1.6(CO3)0.1-(SO4)0.07·(H2O)0.6,通过几十次的充放电后发现,材料主要的成分仍然是α-Ni(OH)2。
赵为民等[6]通过均相沉淀法,将0.1 mol/L的NiSO4·6 H2O (其中含18.3%摩尔比的Zn2+)与含36.024 g尿素的100mL水溶液(加入了30%的乙醇溶液),控制温度为90℃,溶液pH值为11,在400 r/min的搅拌速率下反应3 h后,将母液在60℃水浴中陈化24 h,水洗抽滤后60℃干燥得到α-Ni(OH)2,在0.1C小电流放电下,其比容量能够达到384 mAh/g。
日本学者Alexis Bienvenu Béléké[7-8]通过均相沉淀法合成了包碳的Ni-Al LDH,碳是通过高锰酸钾和盐酸处理后在110℃烘干的,镍源用的是溶解在800mL蒸馏水中的120 g Ni(OH)·26 H2O,沉淀剂是50mL含量33%的氨水溶液,另外还添加了750mL的0.66 mol/L的NH4F,温度为室温,pH控制在7.5,将得到的混合溶胶中加入40mL0.5 mol/L H3BO3溶液和4.8mL0.05 mol/L的Al(NO3)3的溶液,抽滤、水洗、干燥后得到的α-Ni(OH)2电化学性能很稳定,2C倍率下循环充放电869次后放电比容量仍然高达 380 mAh/g,最高能达到410 mAh/g。
4 金属元素的掺杂
α-Ni(OH)2的制备工艺条件有很多,主要有镍盐和沉淀剂的种类和浓度、反应时间、温度、溶液pH值、添加剂、抽滤条件、干燥的温度、碾磨粉碎条件等,尽管控制好以上工艺条件,还是很难制备出稳定高效的α-Ni(OH)2材料,许多文献报道掺杂某些金属离子能够改良α-Ni(OH)2的稳定性,提高循环寿命以及放电比容量。
谢德梅[9]等将Co2+和Al3+离子掺杂在α-Ni(OH)2中,粒径主要分布在 2.5~50 μm之间,其放电比容量能够达到424.53 mAh/g,600次循环后放电比容量也有395.24 mAh/g。
陈慧[10-11]等通过化学均相沉淀法将不同摩尔含量的Al3+离子掺杂在硫酸镍中合成了性能稳定的α-Ni(OH)2,当Al3+离子摩尔量为18.3%时,得到的α-Ni(OH)2在1C下第一次循环放电比容量高达 477 mAh/g,600次循环后能稳定在310 mAh/g左右。
刘长久[12]等采用尿素作为沉淀剂通过掺杂Zn和稀土La制备出了稳定的α-Ni(OH)2样品,该材料在0.1C下放电比容量有 372.85 mAh/g,在 1C高倍率下比容量也有344.07 mAh/g,30次循环后比容量保持率能高达首次比容量的93%,由此可知通过掺杂Zn和稀土La制备出的α-Ni(OH)2结构和性能比较稳定。
周勤俭[13]等通过改变铝盐与镍盐的比值制备出了单一而稳定的α-Ni(OH)2样品材料,这种材料晶格参数较小,结晶程度很好,在0.2C下放电比容量高达350 mAh/g,且循环性能较稳定。
Y.W.Li[14]等将NiSO4·6 H2O与Al2(SO4)3按照Ni2+∶Al3+=4∶1配成0.4 mol/L溶液,将该溶液与等体积的 1.0 mol/L NaOH并滴共沉淀反应,温度控制在60℃,滴完后在50℃下继续搅拌反应10 h。得到的α-Ni(OH)2稳定性很好,1C下放电能达到315 mAh/g。
综合目前国内外对正极材料氢氧化镍的研究,学者通常采用的制备方法是化学共沉淀法。掺杂合成的双羟基水滑石结构(LDH)型[15]α-Ni(OH)2材料比β-Ni(OH)2材料稳定,放电比容量也比β-Ni(OH)2大。在LDH型的α-Ni(OH)2材料中,可以取代镍离子的金属阳离子有Al3+、Zn2+、Co3+、Mg2+、Fe3+、Mn2+及稀土金属离子等,其中Al3+的掺杂得到的LDH型的α-Ni(OH)2材料具有稳定性好、放电比容量高等显著优点。研究表明,掺杂两种金属阳离子可使得LDH结构的电荷不平衡,这样就能够得到稳定性更好的α-Ni(OH)2正极材料。阴离子的掺杂也能够提高这种α型材料的稳定性,C.Delmas在研究α-Ni(OH)2时发现,在掺杂阴离子时,α型正极材料稳定性依次为:掺杂CH3COO-的α-Ni(OH)2<掺杂NO3-的α-Ni(OH)2<掺杂Cl-的α-Ni(OH)2<掺杂SO42-的α-Ni(OH)2<掺杂CO32-的α-Ni(OH)2。
5 展望
在锌镍电池、氢镍电池等体系中,目前正极材料用的最多的还是β-Ni(OH)2,这主要因为β-Ni(OH)2在碱性环境中较α-Ni(OH)2稳定,但是β-Ni(OH)2的容量已经趋近理论值,然而α-Ni(OH)2在充放电时转移的电子是β-Ni(OH)2的1.7倍,因此α-Ni(OH)2的应用价值更高。结合国内外的研究,为了制备出高能量、稳定性强的α-Ni(OH)2材料,可通过掺杂不同的金属离子来制备出在碱性环境中稳定存在的双羟基水滑石结构的锌镍电池正极材料。还可以通过水热合成法提高α-Ni(OH)2正极材料的比能量。相信在不久的将来,以氢氧化镍为正极材料的碱性电池会应用在诸如电动汽车的领域中。
[1]曲格平.关注生态安全之一:生态问题已经成为国家安全的热门话题[J].环境保护,2002,5:3-5.
[2]吴锋.绿色二次电池材料的研究进展[J].中国材料进展,2009,28:41-49.
[3]谢德明.中国MH/Ni电池产业化发展[J].电池,2000,30(5):225-227.
[4]ZHANG Z J,ZHU Y J,BAO J,et al.Effect of ultrasonic on structure and electrochemical performance of α-Ni(OH)2electrodes[J].Transactions of Nonferrous Metals Society of China,2011,21:2654-2659.
[5]刘元刚.Al代α-Ni(OH)2的高温电化学性能[J].无机材料学报,2008,23(2):291-294.
[6]赵为民.尿素均相沉淀法制备La掺杂Zn/Al取代α-Ni(OH)2电极材料的性能研究[D].桂林:桂林理工大学,2008:15-21.
[7]BIENVENU BÉLÉKÉ A.Durability of nickelemetal hydride(Nie-MH)battery cathode using nickelealuminum layered double hydroxide/carbon(NieAl LDH/C)composite[J].Journal of Power Sources,2014,1:572-578.
[8]BIENVENU BÉLÉKÉ A.Electrochemical properties of nickel-aluminum layered double hydroxide/carbon composite fabricated by liquid phase deposition[J].Journal of Power Sources,2010,22:7669-7676.
[10]陈慧.稳态α型氢氧化镍的制备、结构和电化学性能[D].杭州:浙江大学,2004:33-50.
[11]CHEN H,WANG J M,PAN T,et al.Physicochemjcal properties and electrochemical performance of Al-substituted α-Ni(OH)2with several additives for Ni-metal hydride batteries[J].Journal of the Electrochemical Society,2003,150(11):A1399-A1400.
[12]刘长久.La和Zn复合掺杂α-Ni(OH)2电极材料的电化学性能[J].化工学报,2010,10:2743-2744.
[13]周勤俭.nAl∶nNi值对掺Al α-Ni(OH)2结构及性能的影响[J].电源技术,2005,4:208-210.
[14]LI Y W,YAO J H,LIU C J,et al.Effect of interlayer anions on the electrochemical performance of Al-substituteda-type nickel hydroxide electrodes[J].Journal of Hydrogen Energy,2010,35:2539-2545.
[15]KOVANDA F,ROJKA T.Effect of hydrothermal treatment on properties of Ni-Al layered double hydroxides and related mixed oxides[J].Journal of Solid State Chemistry,2009,182:27-36.
Study on Zinc-Nickel battery and α-Ni(OH)2as cathode material

Abstrat:The method of the chemical homogeneous precipitation type synthesis of alpha Ni(OH)2was reviewed.The large capacity,high voltage alpha Ni(OH)2materials could be got under the good cycle performance of appropriate temperature,PH,concentration of nickel salt and add related surfactant.Its performance could be changed by many scholars doped with different metal salt.Its structure could be changed by adding zinc salt,Al salt,Mn salt,iron salt, rare earth metal salts and other compounds.The Al salt of alpha Ni(OH)2performance was best in all metal salts.Except for the chemical precipitation method,also the synthesis of some other type of alpha Ni(OH)2was summarized.
method of chemical homogeneous precipitation;α-Ni(OH)2;rare earth metal salts
TM912
A
1002-087X(2016)12-2489-03
2016-05-12
李媛(1991—),女,湖北省人,硕士,主要研究方向为电化学。
