固相萃取法纯化制备水飞蓟宾和异水飞蓟宾
2017-01-09赵晓舒张娜珍邓付美吴明火大连理工大学食品与环境学院辽宁盘锦大连理工大学文法学院辽宁盘锦
赵晓舒, 张娜珍, 刘 敏, 邓付美, 吴明火*(. 大连理工大学食品与环境学院, 辽宁 盘锦 4; . 大连理工大学文法学院, 辽宁 盘锦 4)
邹汉法研究员纪念专辑(下)·研究论文
固相萃取法纯化制备水飞蓟宾和异水飞蓟宾
赵晓舒1, 张娜珍2, 刘 敏1, 邓付美1, 吴明火1*
(1. 大连理工大学食品与环境学院, 辽宁 盘锦 124221; 2. 大连理工大学文法学院, 辽宁 盘锦 124221)
水飞蓟宾和异水飞蓟宾是水飞蓟素中的主要有效成分,其纯化制备主要借助柱色谱法,制备量大,纯化效果好,但过程非常费时。该研究的主要目的是利用更为快速高效的固相萃取(SPE)法从水飞蓟粗提物中分离纯化水飞蓟宾和异水飞蓟宾。建立了用于分析水飞蓟宾和异水飞蓟宾的高相液相色谱法,通过优化洗脱梯度,实现了水飞蓟宾、异水飞蓟宾与其他组分的分离。试用了3种保留机理不同的SPE填料,包括亲水亲脂(HLB)填料、亲水色谱(HILIC)填料及反相C18硅胶填料。通过对比发现C18硅胶对目标化合物的选择性最佳。进一步控制SPE的淋洗及洗脱条件,收集相应的洗脱液,经氮吹干燥后得到纯化的样品。提纯后的水飞蓟宾和异水飞蓟宾混合物的纯度可达94%以上。水飞蓟宾和异水飞蓟宾的平均回收率分别为70.5%~81.7%和66.7%~81.8%,相对标准偏差分别为2.7%~9.4%和1.5%~6.1%。该方法简单、高效,免去传统分离纯化过程中长时间的柱色谱分离过程,适合制备纯度较高的水飞蓟宾和异水飞蓟宾的二元混合标准样品。
固相萃取;液相色谱;分离纯化;水飞蓟宾;异水飞蓟宾
水飞蓟素是从菊科草本植物水飞蓟的种子中提取的黄酮类混合物[1,2],具有保肝、抗氧化和抗肿瘤等多种作用[3-5],主要包括水飞蓟宾、异水飞蓟宾、水飞蓟宁和水飞蓟亭等[6],其中水飞蓟宾是水飞蓟素中最主要的活性成分[6,7]。在使用过程中,为提高使用效果并减少未知成分引起的干扰,通过将水飞蓟素的粗提物进行纯化,提高其有效活性成分的含量。
关于水飞蓟宾分离纯化的方法较多,主要是一些传统的方法,如有机溶剂重结晶法[8]、柱色谱法[9]等,但这类方法用时较长,如柱色谱法通常需要24 h以上的过柱时间。Celik等[10]利用超临界二氧化碳直接从水飞蓟种子中提取了水飞蓟宾,该方法提取效率高,但超临界萃取的方法选择性较低,纯度不及其他方法。近年来制备色谱法因其高效的分离能力被引入样品的分离纯化中。Liu等[11]采用高速逆流色谱在精制水飞蓟宾的同时,也分离纯化了水飞蓟宁和水飞蓟亭等。因水飞蓟宾存在两种手性异构体(水飞蓟宾A和B),为分别研究其活性,也发展了一些分离能力更强的方法。Li等[12]用一种制备色谱法对水飞蓟宾的两种手性异构体进行了分离纯化,且重现性良好。Zhao等[13]发展了一种二元柱循环制备高效液相色谱,成功分离了水飞蓟宾和异水飞蓟宾的两对同分异构体,纯度达98%以上。虽然色谱法分离效率高,但该方法对设备要求普遍较高。还有一些其他方法,如酶法是在酶作用的基础上,对水飞蓟宾进行适当衍生化,使其衍生物更易借助柱色谱等色谱手段分离,最后脱去衍生基团完成水飞蓟宾的纯化。Kren等[14]借助可扩展的化学酶法在一星期内制备了g级的纯水飞蓟宾的两种手性异构体。Gazak等[15]利用固定化南极假丝酵母酶B制备生产了水飞蓟宾的两种异构体。酶法制备虽有很高的选择性,但是需要多步反应,反应条件不易控制;且酶易失活,成本较高,难以放大制备。这些用于纯化拆分水飞蓟宾手性异构体A和B的方法均不能直接用水飞蓟粗提物进行上样,都需先将水飞蓟宾进行纯化。
相比上述纯化水飞蓟宾的方法,固相萃取(SPE)具有操作简单、设备要求低、选择性好等特点,本文发展了基于SPE的方法对水飞蓟粗提物中的水飞蓟宾和异水飞蓟宾进行纯化,为水飞蓟素有效成分的高效、快速纯化提供了一种新的方法。
1 实验部分
1.1 仪器与试剂
Q-Exactive液相色谱-高分辨质谱(liquid chromatography-high-resolution mass spectrometry, LC-HRMS)购于美国Thermo Fisher公司; 2030C型液相色谱(LC-UV)、AUY120电子分析天平购于日本岛津公司; Ultimate XB-C18色谱柱(150 mm×4.6 mm, 3 μm)、固相萃取装置购于月旭科技(上海)有限公司;高速台式离心机购于上海安亭科学仪器厂;可视氮吹仪购于南京稼竣生物科技有限公司;带筛板的SPE柱管(30 mL)购于美国安捷伦科技有限公司;超声波清洗机购于洁盟清洗设备有限公司;超纯水机购于上海普力菲尔。
水飞蓟宾标准样品(纯度98%)、异水飞蓟宾标准样品(纯度98%)、甲酸(色谱纯)、甲醇(色谱纯)购于阿拉丁试剂公司;水飞蓟粗提物(西安一禾生物技术有限公司);乙腈(色谱纯,美国斯百全公司); C18硅胶填料及HILIC(亲水色谱)PSA(N-丙基乙二胺)键合填料(上海博势生物科技有限公司);商品化HLB填料(美国Waters公司);其他试剂均为国产分析纯。实验室用水均为超纯水。
标准样品水飞蓟宾和异水飞蓟宾溶于甲醇中,保存在4 ℃冰箱里备用。
1.2 SPE柱的填充及样品分离
比较了3种不同分离模式的色谱填料:亲水亲脂型HLB、亲水PSA键合填料和反相C18硅胶填料。制备SPE柱时,分别称取1 g填料,将其分散于乙腈中,然后全部转移到带筛板的SPE空柱管中,并在填料上方再放置一个筛板以防在上样时柱床被冲得不均匀。上样前先将各种SPE柱用乙腈进行活化。用10 mL 20%(体积分数,下同)甲醇对HLB柱和C18柱进行平衡,用10 mL甲醇对PSA柱进行平衡。
在制备上样液时,先称取50 mg的水飞蓟粗提物,用30 mL 20%甲醇溶解。将溶解的样品以8 000 r/min的速度离心15 min,取上清液,经0.22 μm有机滤膜过滤后用于HLB柱及C18柱的上样。对于PSA柱,则用纯的甲醇溶解水飞蓟粗提物,经相同的处理步骤后上样。
对SPE的洗脱条件进行系统优化,分别收集相应条件下的洗脱液,在45 ℃下用氮气吹干。最后用50%甲醇进行复溶,用LC-UV分析样品中水飞蓟宾和异水飞蓟宾的含量。
1.3 液相色谱分离及定量分析
在优化液相色谱的洗脱梯度时,选用了水飞蓟粗提物作为样品。用LC-HRMS对该粗提物进行分离检测。色谱柱为Ultimate XB-C18柱;柱温为室温;进样体积为20 μL。流动相A为水(含0.05%甲酸),流动相B为乙腈(含0.05%甲酸)。洗脱梯度:0~5 min, 35%B~50%B; 5~6 min, 50%B~70%B; 6~7 min, 70%B~95%B; 7~9 min, 95%B。紫外检测器检测波长为288 nm。
质谱的离子源为ESI,负离子扫描模式;喷雾电压为4 kV;离子源温度为320 ℃;选择响应最高的[M-H]-为母离子,用全扫描方式进行检测。分离结束后,通过提取水飞蓟素的理论质荷比(m/z481.114 02)可在色谱图中找出相应的离子峰(质量误差≤5 ppm(5×10-6))。因该LC-HRMS系统同时配有紫外检测器,可对两种检测器下的色谱图进行对比,从而确定目标化合物的紫外色谱峰及相应的保留时间。完成色谱条件的优化之后,则仅用LC-UV作为后续的样品分析方法。选用外标法定量,配制系列不同质量浓度(1、2.5、5、10、20和50 mg/L)的水飞蓟宾和异水飞蓟宾的标准溶液,依次进样,进行液相分析,制作标准曲线。为避免紫外检测器在不同批次(不同日期)间信号响应的差异,在分析样品前都将在当天重新制作标准曲线。
2 结果与讨论
2.1 LC-UV方法的建立
经LC-HRMS分析后,对图谱进行处理,质量误差设置为5 ppm(5×10-6),选定水飞蓟宾的理论m/z481.114 02提取色谱图。结果如图1所示,因水飞蓟素家族中存在多种同分异构体,在其粗提物中也发现了除水飞蓟宾和异水飞蓟宾之外的其他同分异构体色谱峰(暂未用标准样品验证其各自对应的物质),同时也验证了在该粗提物中确实存在水飞蓟宾和异水飞蓟宾,但纯度不高,需要进一步纯化。优化洗脱梯度后,目标化合物可在5 min内实现分离,紫外检测与质谱检测所对应的峰相匹配,确定UV色谱图中所对应的峰为水飞蓟宾和异水飞蓟宾。
在LC-HRMS上完成梯度优化之后,使用该色谱洗脱条件在岛津2030C型色谱仪上对样品进行分析,结果见图2。因液相色谱系统的差异,对应的保留时间有所后移。水飞蓟宾和异水飞蓟宾在6 min内实现了基线分离,标准样品所对应的保留时间与水飞蓟粗提物中的峰一致。用LC对水飞蓟宾和异水飞蓟宾标准样品(10 mg/L)进行检测,在5~6 min间有两个峰,分别为水飞蓟宾和异水飞蓟宾。这说明所建的LC-UV方法成功分开了水飞蓟宾和异水飞蓟宾,同时这两种成分与其他组分或杂质也得到了分离,为后续的外标法定量排除了干扰。并且在1~50 mg/L的质量浓度范围内,两种目标化合物的峰面积与质量浓度均呈现良好的线性关系(r2>0.99),用外标法可对目标化合物进行准确定量。

图1 水飞蓟粗提物在LC-HRMS及LC-UV上的色谱图(Thermo Fisher)Fig. 1 Chromatograms of silymarin crude extract byLC-HRMS (LC-high-resolution mass spectrometry) and LC-UV (Thermo Fisher) 1. silybin; 2. isosilybin.
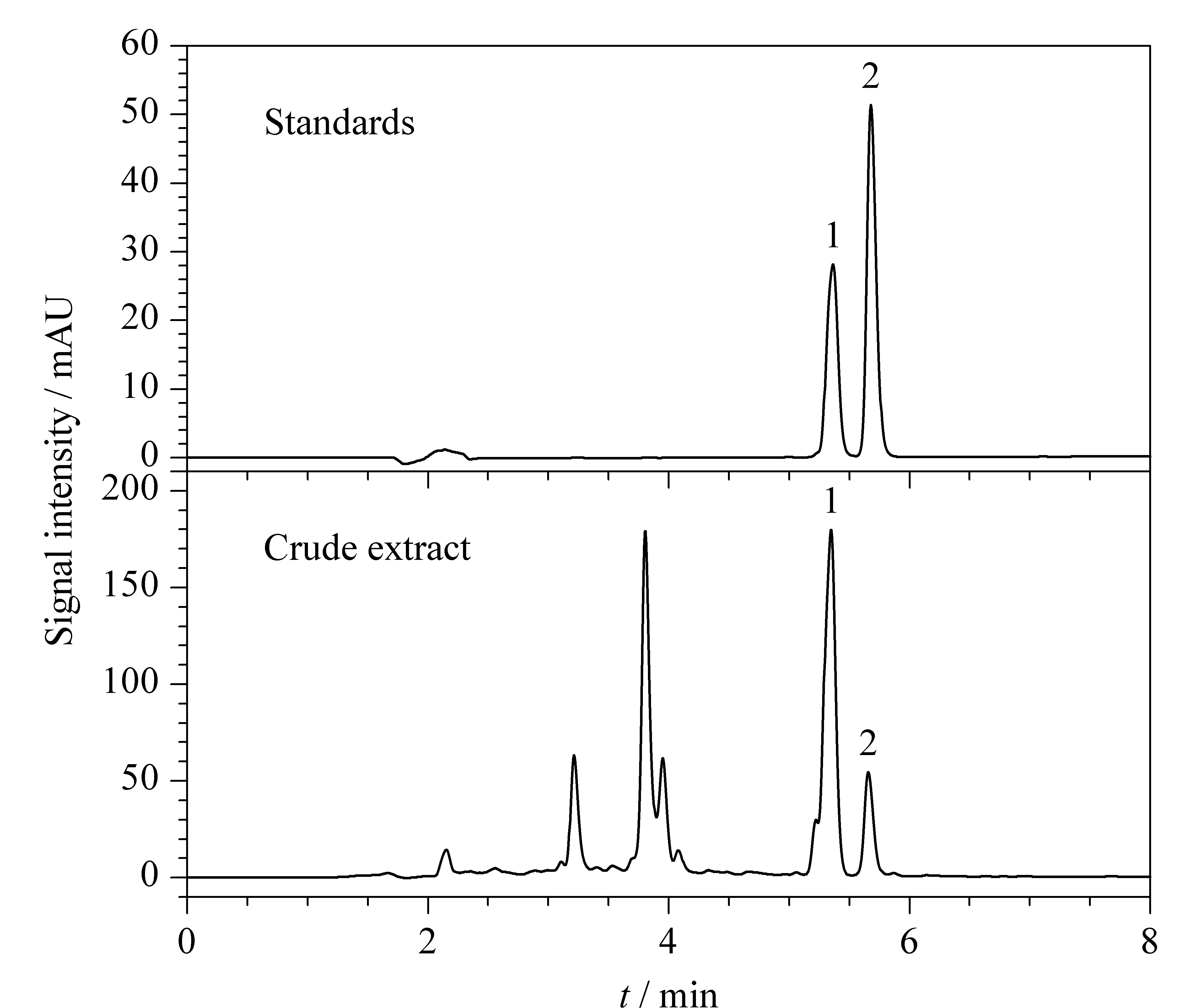
图2 水飞蓟粗提物及水飞蓟宾和异水飞蓟宾标准样品的LC-UV色谱图(岛津)Fig. 2 LC-UV chromatograms of the silymarin crudeextract and the standards of silybin and isosilybin (SHIMADZU) 1. silybin; 2. isosilybin.
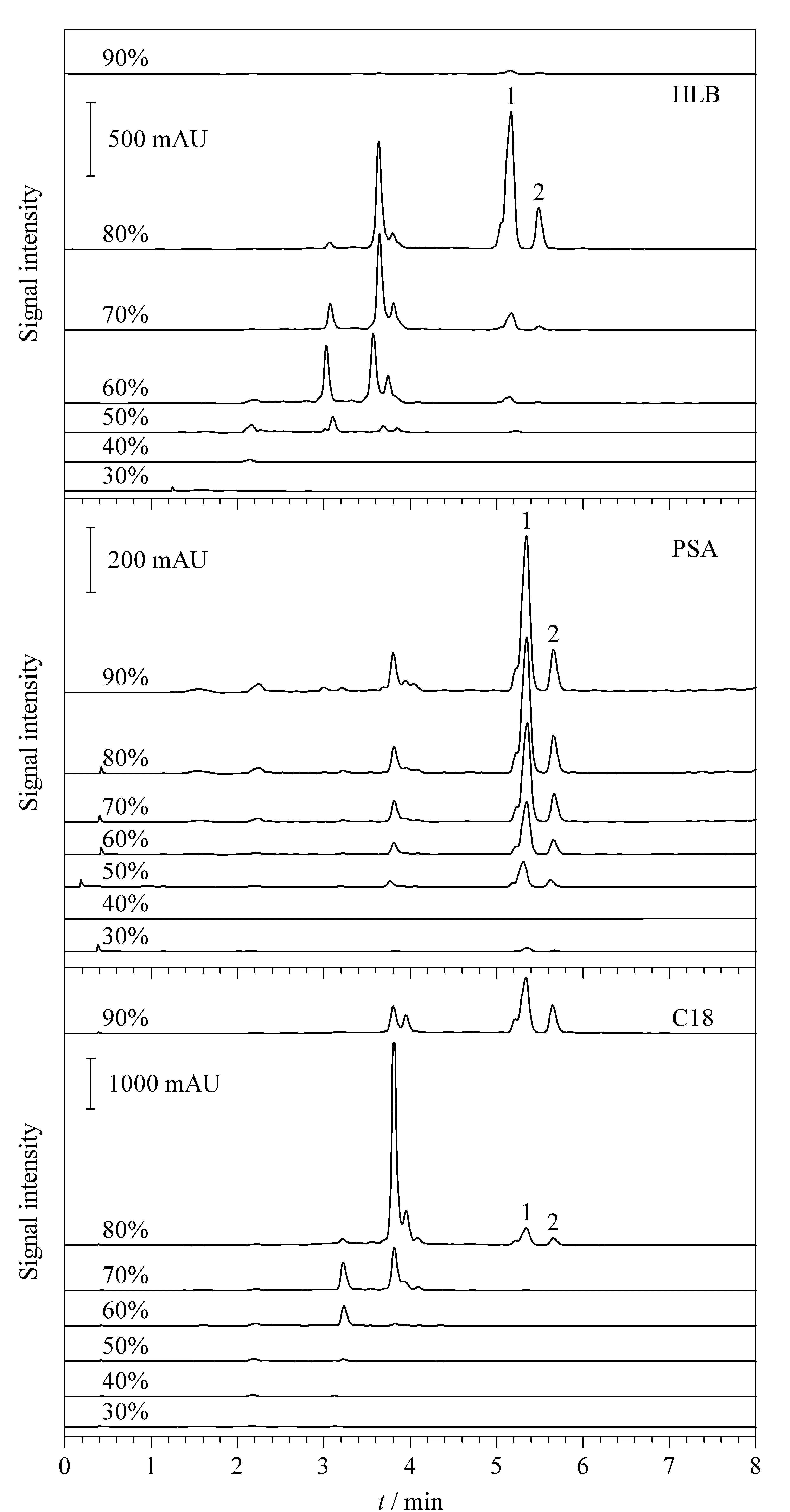
图3 3种SPE填料在不同体积分数甲醇洗脱下的LC-UV色谱图Fig. 3 LC-UV chromatograms of the eluents withdifferent volume percentages of methanol for three different SPE (solid phase extraction) cartridges 1. silybin; 2. isosilybin. PSA: primary secondary amine.
2.2 SPE填料的选择
对比了HLB填料、PSA键合填料和C18硅胶填料填充的SPE柱。上样后,依次用30%~90%的甲醇(每次5 mL)对HLB柱和C18柱洗脱,洗脱液中水飞蓟宾和异水飞蓟宾的含量用上述LC-UV测定。对于PSA柱,则用甲醇体积分数由高到低(90%~30%)的洗脱液进行洗脱。不同洗脱条件下的结果如图3所示。对比HLB填料的7个梯度洗脱图可以发现,5~6 min出峰的水飞蓟宾和异水飞蓟宾从50%甲醇洗脱液中开始出现,直到80%甲醇洗脱液中目标组分的体积分数达到了最大,但仍与样品中的其他物质共存,纯度不高。在90%甲醇洗脱液的组分中,目标组分的纯度较为理想,但其浓度过低,导致回收率过低,难以通过优化洗脱梯度对目标化合物实现高效制备。PSA填料则缺乏选择性,在90%~30%甲醇洗脱液中,色谱图无显著差别,说明目标化合物始终不能与样品中的其他杂质分离,该填料不适合本试验。在C18中,30%~70%甲醇洗脱液中没有水飞蓟宾和异水飞蓟宾,在80%甲醇洗脱液中才出现,并且30%~80%甲醇洗脱液可以把其他绝大多数杂质洗去,说明选用C18硅胶填料对目标化合物具有较好的选择性,有望通过对洗脱梯度的进一步优化实现将水飞蓟宾和异水飞蓟宾同样品中的其他物质分开,因此选用C18键合硅胶作为后续分离的SPE填料。
2.3 C18填料的SPE洗脱梯度优化
确定选用C18键合硅胶作为SPE填料后,对其洗脱条件进一步优化,最终确定洗脱过程为:用5 mL 50%甲醇洗3次,用5 mL 60%甲醇洗5次,用5 mL 70%、5 mL 80%和5 mL 90%甲醇依次洗脱1次。结果如图4所示,60%甲醇洗脱液中几乎只有保留较弱的杂质,目标化合物的含量非常少;70%甲醇洗脱液中,目标化合物开始流失,同时杂质也被进一步去除。而在80%和90%甲醇洗脱液中就几乎只有水飞蓟宾和异水飞蓟宾的峰,并且杂质极少,目标化合物的含量显著提高,因此仅收集80%和90%甲醇的洗脱液进行浓缩。
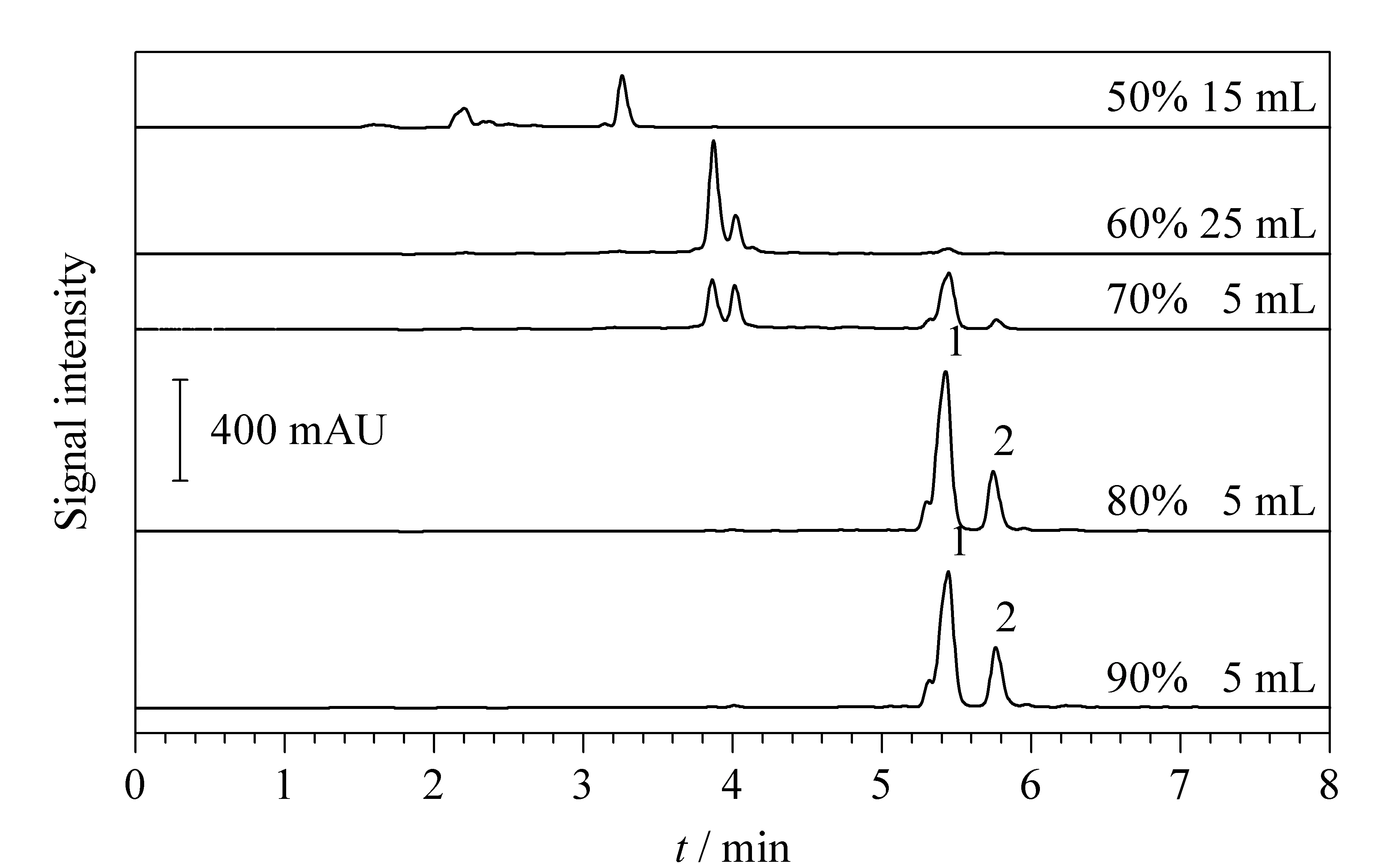
图4 经优化洗脱条件后C18填料上不同馏分的LC-UV色谱图Fig. 4 LC-UV chromatograms of different eluentfractions by methanol on C18 SPE cartridge after the optimization of elution conditions 1. silybin; 2. isosilybin.
2.4 目标化合物的纯度、回收率及方法的重现性
收集80%~90%甲醇洗脱液,氮气吹干后,称量复溶,然后用LC-UV分析水飞蓟宾和异水飞蓟宾的含量(见图5)。
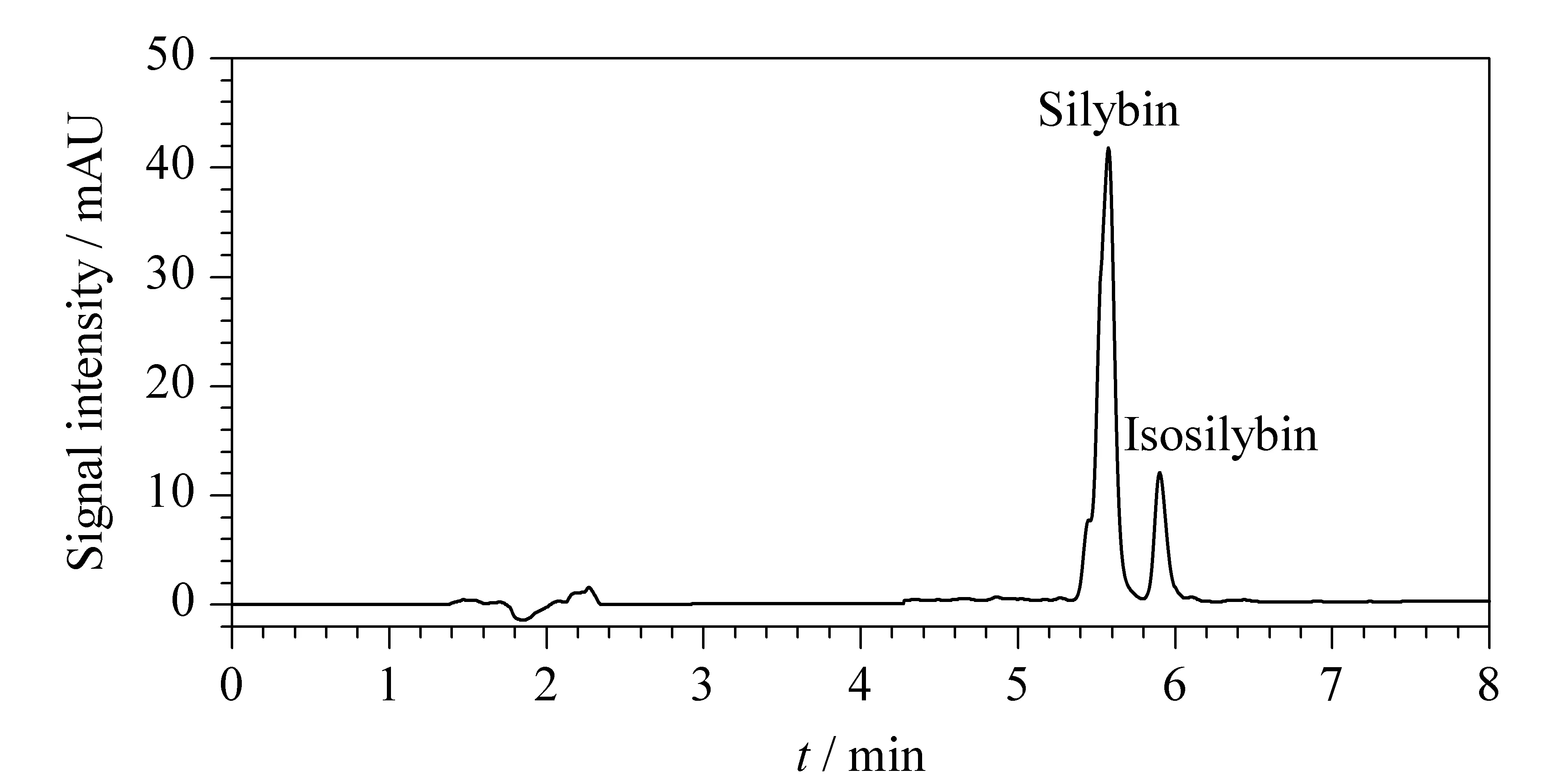
图5 经纯化后复溶样品的LC-UV色谱图Fig. 5 LC-UV chromatogram of the reconstituted sample after the purification
为考察方法的准确度和精密度,对水飞蓟宾和异水飞蓟宾的回收率和重现性进行了评定。连续做5批次的SPE纯化过程,每批次有3组平行样品。根据未经SPE纯化的样品计算出粗提物中水飞蓟宾和异水飞蓟宾的平均含量分别为6.8%和1.3%。50.0 mg水飞蓟粗提物经分离纯化后可得到3.0~3.4 mg产品。复溶后进LC-UV测定,提纯后的水飞蓟宾和异水飞蓟宾的质量分别为2.4~2.8 mg和0.4~0.5 mg,可得提纯样品中水飞蓟宾和异水飞蓟宾的含量分别为79.7%~86.5%和14.7%~15.9%,两者含量相加,可知提纯的二元混合样品的纯度均可达94%以上(对应表1中5个批次的质量纯度分别为94.4%、97.4%、101.4%、99.7%和94.4%)。通过回收率=(提纯物的质量/该物质在水飞蓟粗提物中的质量)×100%计算水飞蓟宾和异水飞蓟宾的回收率分别为70.5%~81.7%和66.7%~81.8%,相对标准偏差(RSD)分别为2.7%~9.4%和1.5%~6.1%(见表1)。
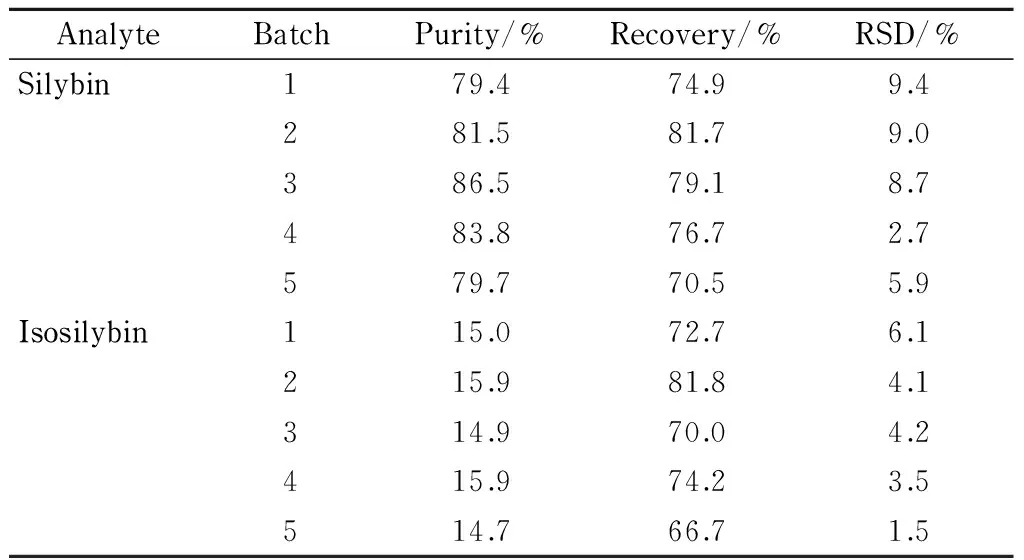
表1 不同纯化批次间水飞蓟宾和异水飞蓟宾的纯度、回收率和重现性(n=3)Table 1 Purities, recoveries and reproducibilities of thepurified silybin and isosilybin in different purified batches (n=3)
Recovery=(mass in the purification/mass in the silymarin extract)×100%.
3 小结
为纯化制备水飞蓟宾和异水飞蓟宾的二元混合样品,首先建立了用于分析水飞蓟宾和异水飞蓟宾的LC-UV分析方法。系统比较了3种不同色谱保留机理的SPE填料对分离水飞蓟宾和异水飞蓟宾的选择性,结果表明C18硅胶填料的SPE柱对水飞蓟粗提物中的水飞蓟宾和异水飞蓟宾具有更好的选择性。通过对该C18-SPE柱洗脱条件的进一步优化,从水飞蓟粗提物中成功分离纯化了水飞蓟宾和异水飞蓟宾,一步SPE操作后二者的纯度达94%以上。多批次的结果显示,该SPE方法中水飞蓟宾和异水飞蓟宾的回收率普遍在70%以上,且重现性良好(RSD<10%)。但由于水飞蓟宾和异水飞蓟宾在SPE柱上的保留行为非常接近,仅用SPE柱目前仍难以将其有效分开收集,所以本实验只收集到了这两种物质的混合物样品。该SPE法虽然不能将水飞蓟宾和异水飞蓟宾分开,但具有纯化过程简单、用时较短、不需要复杂设备等优点,适合制备水飞蓟宾和异水飞蓟宾的二元混合标准样品。此外,该SPE方法也可用于水飞蓟素其他同分异构体(如水飞蓟亭、水飞蓟宁)的分离纯化,因本论文的主要目的是提纯水飞蓟宾及异水飞蓟宾,暂未对此作进一步研究。
[1] AbouZid S F, Chen S-N, Pauli G F. Ind Crops Prod, 2016, 83: 729
[2] Keshavarz Afshar R, Chaichi M R, Ansari Jovini M, et al. Planta, 2015, 242(3): 539
[3] Kidd P, Head K. Altern Med Rev, 2005, 10(3): 193
[4] Kren V, Walterova D. Biomedical Papers, 2005, 149(1): 29
[5] Gazak R, Svobodova A, Psotova J, et al. Bioorg Med Chem, 2004, 12(21): 5677
[6] Lee D Y W, Liu Y. J Nat Prod, 2003, 66(9): 1171
[7] Rajnochová Svobodová A, Zálešák B, Biedermann D, et al. J Photochem Photobiol B, 2016, 156: 61
[8] Shi J S, Sun D F, Gu G P, et al. Chinese Wild Plant Resources, 2006, 25(6): 52
史劲松, 孙达峰, 顾龚平, 等.中国野生植物资源, 2006, 25(6): 52
[9] Li Y S, Wang J A. Chemical Engineer, 2009(2): 58
李玉山, 王经安. 化学工程师, 2009(2): 58
[10] Celik H T, Gürü M. J Supercritl Fluids, 2015, 100: 105
[11] Liu H, Yuan Q, Li C F, et al. Process Biochem, 2010, 45(5): 799
[12] Li W, Han J, Li Z, et al. J chromatogr B, 2008, 862(1/2): 51
[13] Zhao W, Yang G, Zhong F, et al. J Sep Sci, 2014, 37(17): 2300
[14] Kren V, Gazak R, Purchartova K, et al. J Mol Catal B: Enzym, 2009, 61(3/4): 247
[15] Gazak R, Marhol P, PurchartovaK, et al. Process Biochem, 2010, 45(10): 1657
Purification and preparation of silybin and isosilybinby solid phase extraction
ZHAO Xiaoshu1, ZHANG Nazhen2, LIU Min1, DENG Fumei1, WU Minghuo1*
(1.SchoolofFoodandEnvironmental,DalianUniversityofTechnology,Panjin124221,China; 2.SchoolofHumanitiesandLaw,DalianUniversityofTechnology,Panjin124221,China)
Silybin and isosilybin are mainly effective elements of silymarin. To improve the performance of treatment and decrease the side effects from the unknown components, purified silybin and isosilybin are in request. The main purpose of this research was to develop a solid phase extraction (SPE) method for the purification of silybin and isosilybin from silymarin extract. For the analysis of the samples, a liquid chromatography method with ultraviolet detector (LC-UV) was developed to separate the silybin and isosilybin from their impurities. The separation was achieved in 8 min and a total analytical time of 11 min with column washing and equilibration. In the SPE, three different SPE packings were tested, including hydrophilic-lipophilic balance (HLB), hydrophilic interaction chromatography (HILIC) and reverse phase C18 silica microspheres. Based on the selectivity against silybin and isosilybin, the C18 packings were chosen. After the optimization of the elution of SPE, the purity over 94% could be achieved for the silybin and isosilybin mixture with the recoveries of 70.5%-81.7% and 66.7%-81.8%, and the relative standard deviations (RSDs) of 2.7%-9.4% and 1.5%-6.1%, respectively. Though silybin and isosilybin could not be separated from each other by using SPE, this is a useful method for the purification of silybin and isosilybin mixture from the crude extract of their plant seeds due to its simplicity and efficiency.
solid phase extraction (SPE); liquid chromatography (LC); separation and purification; silybin; isosilybin
10.3724/SP.J.1123.2016.08046
2016-08-31
国家自然科学基金项目(21205058);中央高校基本科研业务费专项资金资助项目(DUT15RC(3)048);大连理工大学大学科技园专项项目.
Foundation item: National Natural Science Foundation of China (No. 21205058); Fundamental Research Funds for the Central Universities (No. DUT15RC(3)048); Special Project for University Science Park of Dalian University of Technology.
O658
:A
:1000-8713(2017)01-0070-05
*通讯联系人.Tel:(0427)2631788,E-mail:wumh@dlut.edu.cn.
猜你喜欢
杂志排行
色谱的其它文章
- 基于高通量解析算法的复杂样品重叠气相色谱-质谱信号的快速分析
- 移液枪头式固相微萃取-高效液相色谱法测定细胞培养液中的4种生物碱
- 整体柱在线固相微萃取-高效液相色谱法分析爽肤水中痕量雌激素
- 化学衍生辅助液相色谱-串联质谱测定枇杷膏中的齐墩果酸和熊果酸
- Holistic analysis of Liuwei Dihuang pills using ultrasoniccell grinder extraction and ultra-performanceliquid chromatography
- Investigation of aromatic impurities in liquefied petroleumgas by solid-phase extraction sampling coupled withgas chromatography-mass spectrometry
