甜瓜PI390452霜霉病抗性基因的QTL定位
2017-01-09张学军宁雪飞杨永李寐华王贤磊伊鸿平
张学军,宁雪飞,杨永,李寐华,王贤磊,伊鸿平
(1.新疆农业科学院哈密瓜研究中心,乌鲁木齐 830091;2.新疆大学生命科学与技术学院,乌鲁木齐 830046)
甜瓜PI390452霜霉病抗性基因的QTL定位
张学军1,宁雪飞2,杨永1,李寐华1,王贤磊2,伊鸿平1
(1.新疆农业科学院哈密瓜研究中心,乌鲁木齐 830091;2.新疆大学生命科学与技术学院,乌鲁木齐 830046)
【目的】研究甜瓜抗霜霉病资源PI390452,分析PI390452抗性遗传规律,并对抗病基因进行QTL定位分析,为甜瓜抗霜霉病分子辅助育种奠定基础。【方法】用甜瓜霜霉病病原菌[Pseudoperonosporacubensis(Berk.etCurt.)Rostov.]对PI390452×卡拉克赛(高感霜霉病)杂交后代F2分离群体及F2∶3家系人工接种鉴定,以F2分离群体为研究对象,基于ICuGI已构建对应分子标记连锁图谱,应用BSA法和1 090对甜瓜SSR引物进行连锁遗传分析,采用QTL IciMapping软件定位霜霉病QTL位点。【结果】资源PI390452霜霉病抗性符合数量性状遗传的特点。共检测到3个霜霉病抗性基因的QTL位点qR1-1-1、qR1-3-1、qR2-2-1,分别位于chr-5、chr-10、chr-9上,qR2-2-1表型变异率最大为80.84%。【结论】位于chr-9上的qR2-2-1是控制甜瓜霜霉病主效QTL位点,为甜瓜抗霜霉病分子标记辅助育种、抗病基因精细定位、克隆提供了技术支持。
甜瓜;霜霉病;数量性状基因(QTL);SSR分子标记
0 引 言
【研究意义】甜瓜(CucumismeloL.)为葫芦科(Cucurbitaceae)甜瓜属(CucumisLinn)一年生草本植物,是国内外重要的园艺作物和经济作物[1,2]。在世界大宗水果排名中居第9位,中国甜瓜栽培已有三千多年的历史,是甜瓜生产及消费第一大国,年产量已超过100×104吨[3-5]。瓜类霜霉病是由鞭毛菌亚门,古巴霜霉菌[Pseudoperonosporacubensis(Berk.etCurt.)Rostov.]引起的真菌性病害,威胁着世界上80多个国家的黄瓜生产和50多个国家的甜瓜生产,并且有不断增多的趋势[6-8]。瓜类霜霉病主要危害叶片,发病初期在叶片上形成水浸状小斑点,病斑扩大后,受叶脉限制呈黄褐色角斑,并伴有灰黑色霉层产生,最后叶片成片发黄甚至枯焦,俗称“跑马干”[9]。严重影响光合作用,流行年份可减产30%~50%,严重的70%~80% ,甚至绝产[10]。由于该病危害严重,流行性强,难于防治,因此,开展甜瓜霜霉病抗性遗传研究,定位抗病基因,培育抗霜霉病甜瓜品种具有重要意义。【前人研究进展】国内外学者对甜瓜抗霜霉病遗传规律研究较多,甜瓜霜霉病的抗性主要存在以下几个观点:由1个单显性基因控制;由不完全显性基因控制;由寡基因控制,并认为这些基因具有不完全显性;由部分显性基因控制;由一对隐性基因控制;而近年来的研究认为霜霉病抗性是一个数量性状,由多基因控制。国内外对甜瓜霜霉病抗性资源分子标记研究相对较少。杨柳燕等[11]以DM3为研究材料,找到了与抗霜霉病基因连锁的SRAP标记me8em11,遗传距离为9.8 cM;贺玉花等[12]以PI414723为研究材料,发现DE1887、DE1320和DE085SSR标记与抗霜霉病基因存在连锁关系,遗传距离分别为26 cM、26 cM、13.69 cM,但是都没有对标记进行定位。国外一直未见甜瓜抗霜霉病抗性资源分子标记报道,2005年Perchepied[13]利用抗原PI124112,以重组自交系为研究材料,将甜瓜霜霉病抗病基因定位第V连锁群上。【本研究切入点】迄今为止,国内外对资源PI390452控制甜瓜霜霉病抗性的QTL研究至今未见报道。研究利用抗霜霉病甜瓜资源PI390452和高感霜霉病主栽农家品种卡拉克赛为亲本构建遗传群体,对甜瓜抗霜霉病基因进行遗传规律分析。【拟解决的关键问题】研究以F2群体为作图材料,利用分离群体分组分析(BSA)法和简单序列重复(SSR)技术,实现抗霜霉病基因的QTL定位研究,并获得与其连锁的分子标记,为该基因精细定位及克隆奠定基础,为甜瓜 MAS育种提供实用技术,加速选育符合市场需求的抗病甜瓜新品种。
1 材料与方法
1.1 材 料
研究于2015~2016年在新疆农业科学院哈密瓜研究中心海南三亚育苗温室进行。抗源PI390452(P1),引自美国农业部国家植物种质资源体系,于新疆农业科学院哈密瓜中心保存,高抗霜霉病,绿皮,椭圆形,有深沟,软肉,网纹全,品质差;卡拉克赛(P2)由新疆农业科学院哈密瓜研究中心提供,高感霜霉病,墨绿皮,脆肉,网纹粗而稀,风味好,口感佳,新疆主栽农家品种。P1×P2杂交获得F1,F1自交获得139个F2个体,F2再自交获得F3,形成含139个株系的 F2∶3家系。接种所用的霜霉病[Pseudoperonosporacubensis(Berk.etCurt.)Rostov.]采自海南三亚早期自然发病的甜瓜叶片。SSR引物来自两部分,国内外相关发表文献已经发表的[14-17]和国际葫芦科网站中甜瓜信息(http://www.icugi.org/cgi-bin/ICuGI/in-dex.cgi)。
1.2 方 法
1.2.1 甜瓜霜霉病抗性的苗期人工接种鉴定
于2015年2和11月在新疆农业科学院哈密瓜研究中心海南三亚育苗温室内进行鉴定,鉴定试材包括亲本、F1、F2和 F2∶3家系(139 份),F2群体于2015年2月鉴定,F2:3家系于2015年11月鉴定。抗病鉴定前将种子72℃高温杀菌48 h后再播入装有基质的营养钵中,基质是由椰糠、黄沙按体8∶1比例混合均匀而成,基质和营养钵都经20%福尔马林灭菌杀毒。F2∶3家系鉴定采用随机区组设计,3次重复,每个重复20株,以卡拉克赛为感病对照,苗期正常管理。
采用喷雾法[18]进行霜霉病接种,接种浓度为5×103/mL个孢子。待80%以上甜瓜幼苗第2片真叶完全展平时,喷雾接种,用小型手持喷雾器将配制好的孢子悬浮液均匀喷于植株叶片正反面上,直到流水为止,接种后架小拱覆膜保湿,PE膜上加黑色遮阴网保持黑暗和控制温度,夜间24℃,白天30℃,相对湿度95%以上。接种后15 d调查发病情况。参照Criswell(2008)和Epinat C(1994a,1994b)[19-21]的抗性分级标准,并适当修正,将病情分为6个级别:0级:无任何症状;1级:病斑面积占整个叶片面积的1/4以下;2级:病斑面积占整个叶片面积的1/4~1/2;3级:病斑面积占整个叶片面积的1/2~2/3;4级:病斑面积占整个叶片面积的2/3~3/4;5级:病斑面积占整个叶片面积的3/4以上。计算病情指数(DI),DI=∑(每个病级的植株数×级别数)/(总植株数×最高级别数)×100。抗性分级标准:高抗(HR):0<病情指数≤10; 抗病(R):10<病情指数≤20;中抗(MR):20<病情指数≤40;感病(S):40<病情指数≤60;中感(MS):60<病情指数≤80;高感(HS):病情指数>80。
1.2.2 DNA提取和SSR分析
取0.5~1.0 g甜瓜幼嫩叶片,于液氮中研磨成粉末状,装入2.0 mL的离心管中,用天根生化科技(北京)有限公司的植物基因组DNA提取试剂盒提取基因组DNA,用Quawell Q3000测量DNA浓度最终调整至100 mg/L备用。F2代抗感基因池的构建取抗病(0级)和感病(5级)的F2代单株各5株等量的DNA,分别混合构建抗感基因池。SSR反应体系(20 μL)中含有:模板DNA50ng,TaqDNA聚合酶1.2U,dNTPs 2.25 mmol/L,Mg2+1.75 mmol/L,正反引物各0.6 μmol/L,2 μL 10×PCR buffer,扩增反应在TC-512(TECHNC)PCR仪上进行。扩增程序为94℃预变性5 min;94℃变性1 min,52℃退火45s,72℃延伸1 min,40个循环;72 ℃延伸7 min;4℃保存。6%聚丙烯酰胺胶进行电泳,恒压100V,电泳2~3 h。电泳结束后,采用银染方法进行染色来检测条带。
1.2.3 SSR标记筛选、数据统计
用1 090对SSR引物PI390452、卡拉克赛进行筛选,获得具有多态性的引物。参照分离组群分析法(BSA法),在F2代群体的139个单株中,根据苗期霜霉病接种鉴定结果,选取高抗(0级)和高感(5级)的单株各5株,分别提取DNA,用Quawell Q3000测量浓度,然后将高抗和高感植株的DNA分别等量混合,建立抗感基因池继续筛选多态性引物。将最终获得的多态性引物用于F2群体分析。条带统计方法:同抗病亲本的带型一致的标记命名为“a”,同感病亲本的带型一致的标记命名为“b”,杂合的带型则记为“h”,缺失或者模糊不清楚的带型记作“-”。
1.2.4 霜霉病抗性基因的 QTL 定位
结合甜瓜已发表构建的遗传图谱,采用QTL IciMapping软件进行复合区间作图法进行QTL分析,在研究中使用的阈值为LOD≥2.5。
2 结果与分析
2.1 甜瓜霜霉病的抗性鉴定及遗传分析
2015年分别对亲本、F1、F2群体和F2∶3家系进行苗期人工接种鉴定,经Excel表格统计、分析,2015年2月,抗源PI390452病情指数为6.67,高抗;卡拉克赛表现为高感,病情指数为90.00;F1病情指数为76.67,介于两个亲本之间,趋于感病。2015年11月鉴定结果与2月结果基本一致,PI390452病情指数为7.50(高抗);卡拉克赛的病情指数87.50(高感);F1的病情指数为 78.67,也介于两个亲本之间,也趋于感病。研究证明,PI390452霜霉病抗性是由隐性基因控制的。对 F2和 F2∶3株系群体病情指数绘制频数分布,F2和 F2:3群体的病情频数分布符合正态分布,PI390452霜霉病抗性是数量遗传性状,可以用于QTL分析。表1,图1,图2

表1 亲本、F1的病情指数及F2/F2∶3群体的遗传参数
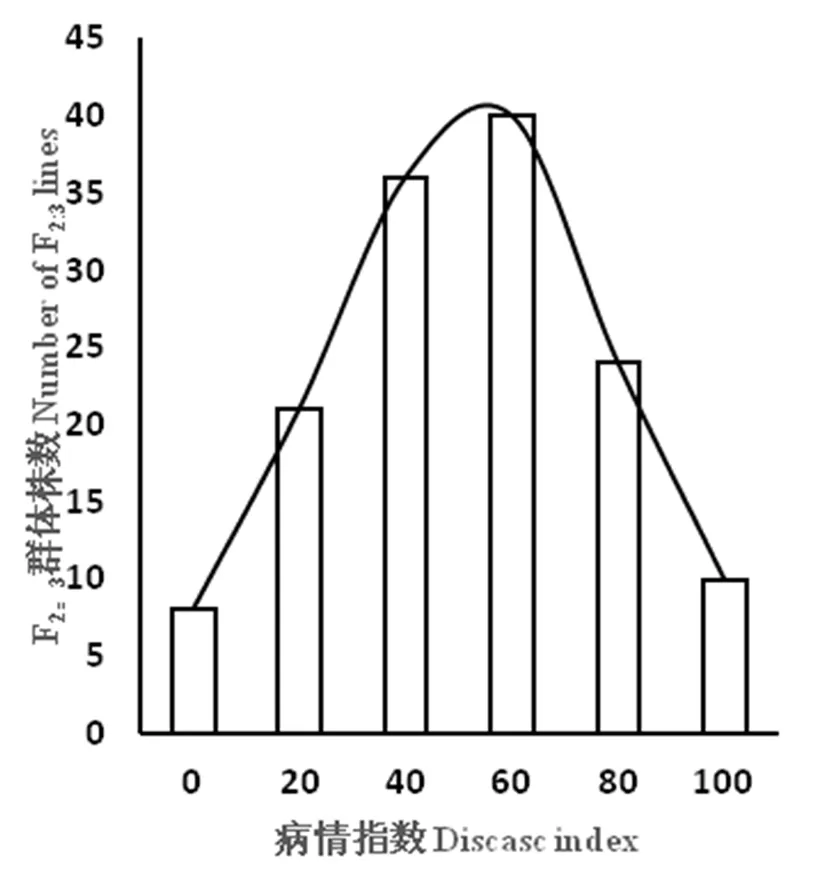
图1 2015年F2∶3群体霜霉病病情指数的频数分布
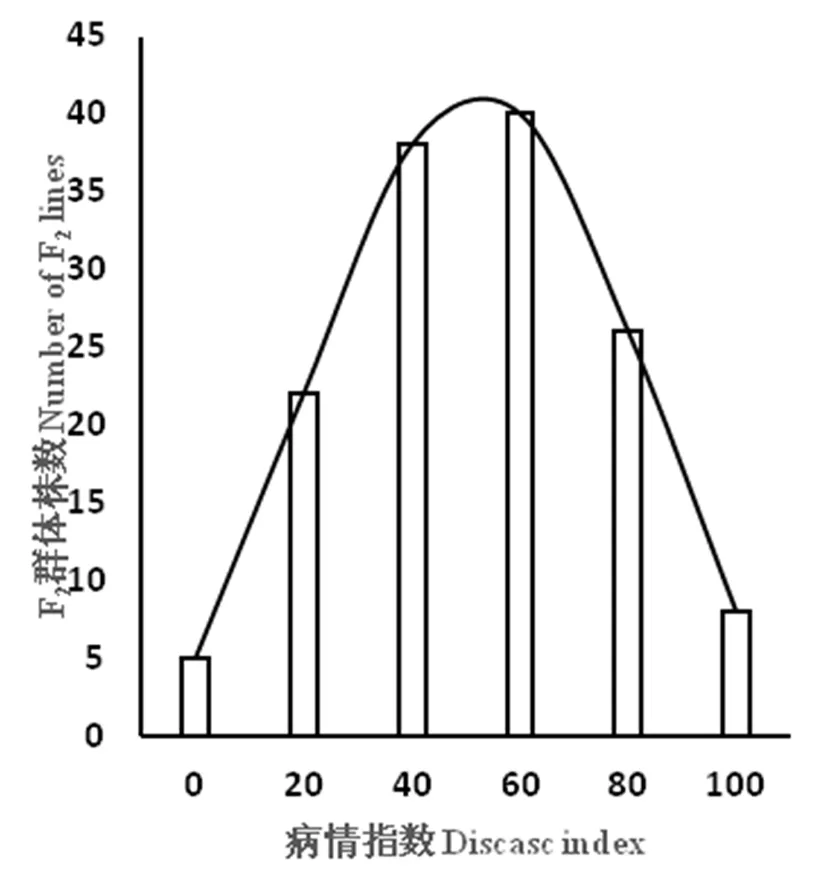
图2 2015年F2群体霜霉病病情指数的频数分布
2.2 多态性和特异性SSR引物的筛选
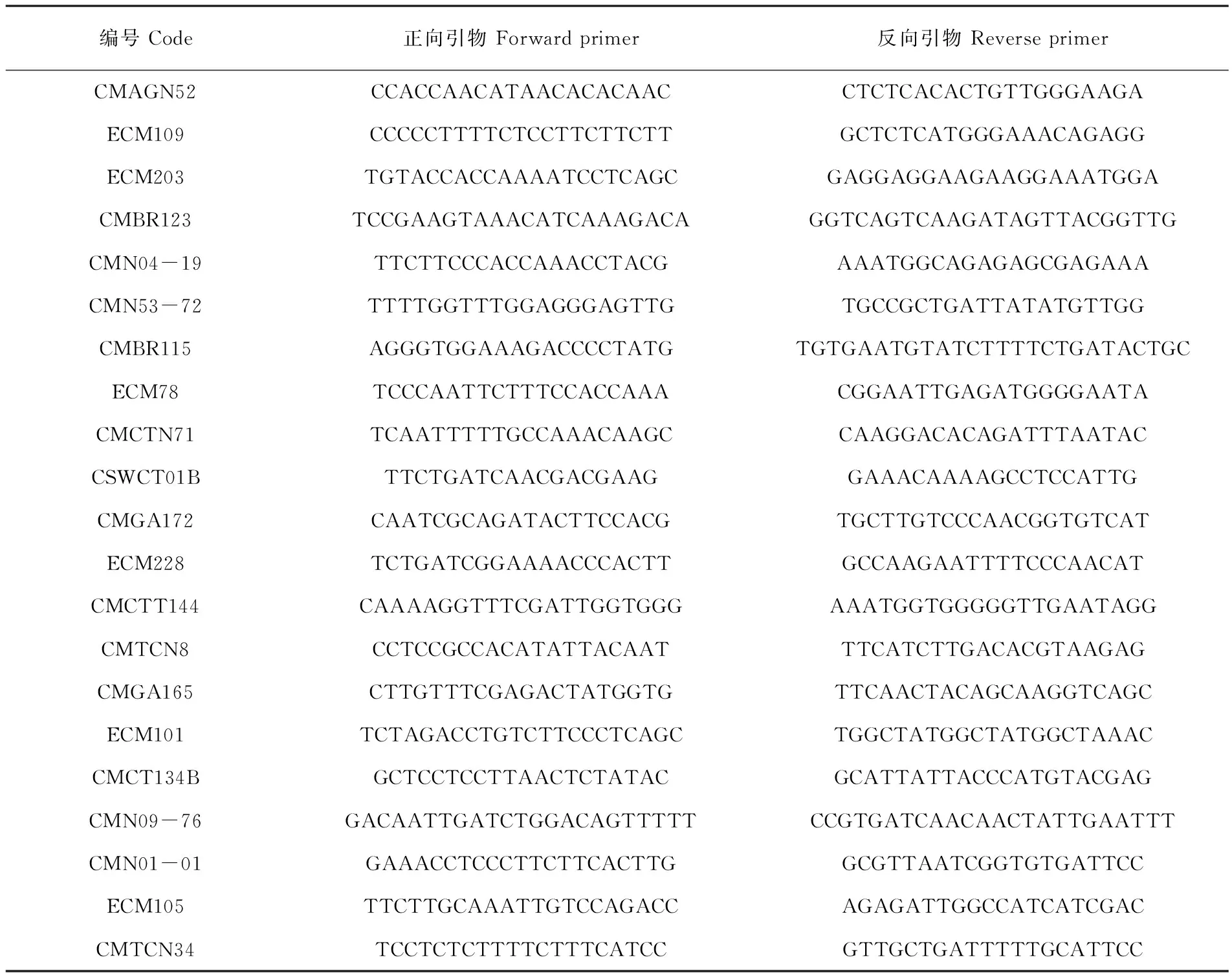
根据国际葫芦科基因组(ICuGI)网站上及相关文献上公开发表的SSR引物,选取其中1 090对引物,分别以双亲为模版进行PCR扩增,经过6%聚丙烯酰胺凝胶电泳检测,除掉无扩增产物及扩增产物不清晰的引物以外,886对引物能够扩增出明亮的条带。进一步以抗感基因池为模板进行筛选,在抗、感基因池间存在多态性的SSR引物21对,多态性比率为1.93%,列出引物编号及其碱基序列。表2
表2 抗感基因池间表现多态性的SSR引物
Table 2 SSR Primers showed polymorphisms between two bulks
编号Code正向引物Forwardprimer反向引物ReverseprimerCMAGN52CCACCAACATAACACACAACCTCTCACACTGTTGGGAAGAECM109CCCCCTTTTCTCCTTCTTCTTGCTCTCATGGGAAACAGAGGECM203TGTACCACCAAAATCCTCAGCGAGGAGGAAGAAGGAAATGGACMBR123TCCGAAGTAAACATCAAAGACAGGTCAGTCAAGATAGTTACGGTTGCMN04-19TTCTTCCCACCAAACCTACGAAATGGCAGAGAGCGAGAAACMN53-72TTTTGGTTTGGAGGGAGTTGTGCCGCTGATTATATGTTGGCMBR115AGGGTGGAAAGACCCCTATGTGTGAATGTATCTTTTCTGATACTGCECM78TCCCAATTCTTTCCACCAAACGGAATTGAGATGGGGAATACMCTN71TCAATTTTTGCCAAACAAGCCAAGGACACAGATTTAATACCSWCT01BTTCTGATCAACGACGAAGGAAACAAAAGCCTCCATTGCMGA172CAATCGCAGATACTTCCACGTGCTTGTCCCAACGGTGTCATECM228TCTGATCGGAAAACCCACTTGCCAAGAATTTTCCCAACATCMCTT144CAAAAGGTTTCGATTGGTGGGAAATGGTGGGGGTTGAATAGGCMTCN8CCTCCGCCACATATTACAATTTCATCTTGACACGTAAGAGCMGA165CTTGTTTCGAGACTATGGTGTTCAACTACAGCAAGGTCAGCECM101TCTAGACCTGTCTTCCCTCAGCTGGCTATGGCTATGGCTAAACCMCT134BGCTCCTCCTTAACTCTATACGCATTATTACCCATGTACGAGCMN09-76GACAATTGATCTGGACAGTTTTTCCGTGATCAACAACTATTGAATTTCMN01-01GAAACCTCCCTTCTTCACTTGGCGTTAATCGGTGTGATTCCECM105TTCTTGCAAATTGTCCAGACCAGAGATTGGCCATCATCGACCMTCN34TCCTCTCTTTTCTTTCATCCGTTGCTGATTTTTGCATTCC
2.3 甜瓜霜霉病抗性基因的QTL定位
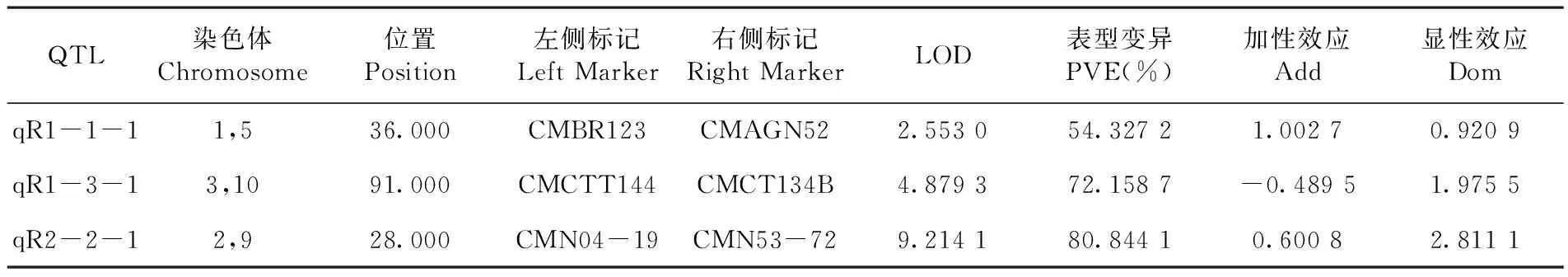
根据2015年2月F2群体霜霉病抗性鉴定结果,利用QTL IciMapping软件进行连锁分析,在 LOD≥2.5 的状态下进行连锁群分组,用 Linkage Map命令构建框架图,并进行图距的计算。最后进行优化,得到准确的图谱框架。通过软件分析最后将21个标记定位在构建的图谱上。获得了一张甜瓜SSR分子标记遗传连锁图谱,总长度为424.27 cM,平均图距为20.20 cM。遗传连锁图谱包含了4个连锁群(LG),其中最长的连锁群长为227.5 cM,最短的为37.88 cM,每个连锁群的标记数为2~12个标记,共定位3个QTL(qR1-1-1、qR1-3-1、qR2-2-1)。结合Aurora Diaz等[22]在2015年发表的遗传图谱将研究甜瓜抗霜霉病基因QTL(qR1-1-1、qR1-3-1、qR2-2-1)初步定位于5、10、9染色体上,其中qR1-1-1表型变异率为54.327 2%,LOD值2.55,位于CMBR123~CMAGN52,距离两侧标记的遗传距离分别为36.00 cM、37.93 cM;qR1-3-1表型变异率为72.158 7%,LOD值为4.87,位于CMCTT144~CMCT134B,距离两侧标记的遗传距离分别为39.37 cM、41.42 cM;qR2-2-1表型变异率为80.844 1%,LOD值为9.21,位于CMN04-19~CMN53-72,距离两侧标记的遗传距离分别为28.00和19.93 cM。表3,图3
表3 2015年2月甜瓜霜霉病抗性基因的QTL
Table 3 QTL analysis of downy mildew resistance gene in melon in 2015
QTL染色体Chromosome位置Position左侧标记LeftMarker右侧标记RightMarkerLOD表型变异PVE(%)加性效应Add显性效应DomqR1-1-11,536.000CMBR123CMAGN522.553054.32721.00270.9209qR1-3-13,1091.000CMCTT144CMCT134B4.879372.1587-0.48951.9755qR2-2-12,928.000CMN04-19CMN53-729.214180.84410.60082.8111
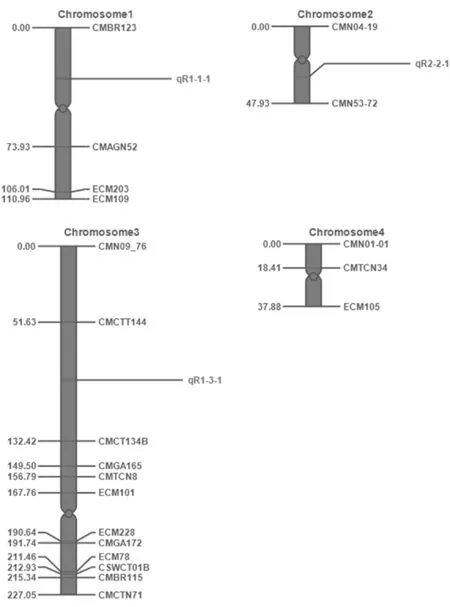
图3 F2群体SSR连锁群的构建和霜霉病抗性基因的QTL定位
Fig.3 Construction of SSR linkage group and QTL mapping for downy mildew resistance gene in F2populations
3 讨 论
3.1 关于甜瓜霜霉病的抗性遗传规律与人工接种鉴定方法
目前,虽然甜瓜抗霜霉病遗传规律研究比较早,但是相对较少,且存在分歧。Angelov等[23]以抗病自交系5-4-2-1和感病K15-6为材料,认为5-4-2-1霜霉病的抗性由显性单基因控制,而且在K15-6中存在一个上位修饰基因,影响5-4-2-1内的抗病基因表达,当5-4-2-1和其他材料杂交时,抗病基因表现为隐形遗传,而当5-4-2-1和K15-6的杂交时,抗病基因表现为显性遗传。Epinat等[24]以抗病资源PI414723、MR-1和PI124112与感病品种Vedrantais为材料,得出PI414723的霜霉病抗性是由显性单基因控制;MR-1和PI124112的霜霉病抗性是由寡基因控制,且基因表现为不完全显性。Thomas等[25]研究得出自交系MR-1的霜霉病抗性是由2个基因控制,基因表现为不完全显性且具有互补性,与Epinat等[24]认为MR-1的霜霉病抗性是由寡基因控制出入。Ivanoft[26]以高抗霜霉病的Cuban Castilian、Green Fleshed Rocky Dew、 Orange Fleshed Rocky Dew和Smith' sPerfect为材料,认为这4个印度甜瓜栽培品种抗病性是由部分显性基因控制。Cohen等[27]以PI124111为研究对象,认为PI124111的霜霉病抗性是由2个部分显性基因控制,与Epinat等[24]认为PI124112的霜霉病抗性是由寡基因控制有一定出入。Shashikumar[28]以IIHR121和IIHR122为研究对象,认为霜霉病的抗性是一个多基因控制数量性状。国内,杨柳燕等[29]认为高抗材料DM3霜霉病的抗性由一对隐性基因控制。贺玉花等[30]认为PI414723霜霉病的抗性由一对显性基因控制。产生分歧的主要原因有:(1)甜瓜霜霉病病原菌的致病型和生理小种研究尚未完全明确,存在分歧,大部分国内外学者认为甜瓜霜霉病菌存在高度的变异性,不同地区的研究者鉴定时所采用的病原菌必然就会存在差异;(2)不同研究人员所用的供试甜瓜材料不同,也会导致试验结果的不一致;(3)缺乏统一标准的甜瓜霜霉病抗病鉴定体系,不同的人采用抗病鉴定方法和标准因个人而定,必然导致研究结果缺乏可比性;(4)甜瓜霜霉病的发病受周围环境影响很大,研究人员地域不同,试验难以确保在一致的环境条件下进行;(5)甜瓜霜霉病本身抗性遗传规律比较复杂,相对其他病害研究较少。因此,很有必要对甜瓜霜霉病抗性遗传机制进行深入研究。研究用相对单一纯培养的海南甜瓜霜霉病病原菌(经过多次新鲜单病斑分离),用于温室人工喷雾接种,在模拟最接近自然情况下,同时保证植物和病原菌均匀接触,以创造甜瓜最真实的感病状态,因此能真实反映遗传群体的抗病规律,实验数据具有一定的可靠性。
3.2 甜瓜抗霜霉病的分子标记及QTL定位
鉴于甜瓜霜霉病病原菌只能活体培养,人工和田间鉴定易受环境条件影响,研究相对比较费时费力,所以利用分子辅助育种的手段开展抗霜霉病品种的选育研究较少。目前报道的与甜瓜霜霉病抗性基因连锁的分子标记较少,并且连锁距离不够紧密,致使前人研究结果对于MAS育种应用性不强。杨柳燕等[29]以高抗材料DM3为材料,找到了与抗病基因连锁的SRAP标记me8em11,遗传距离为9.8 cM;贺玉花等[30]以PI414723为材料,结果有3个SSR标记DE1887、DE1320和DE0854与抗霜霉病基因存在连锁关系,遗传距离分别为26、26、13.69 cM。国外一直未见甜瓜抗霜霉病抗性资源分子标记报道,仅仅在2005年Perchepied[10]利用PI124112×Védrantais杂交产生的重组自交系,将白粉病与霜霉病的两个抗病基因分别定位第II与第V连锁群。
使用1 090对SSR引物对甜瓜霜霉病进行研究,其中851对基于甜瓜基因组测序信息设计。同时,在试验材料上,前人对于霜霉病分子标记的研究大多利用F2群体,由于F2是临时性群体,不能进行重复试验,而在抗病性鉴定实践中,鉴定结果受环境影响很大,致使结果的可信度降低。研究以F2为研究的材料,又利用 F2∶3家系验证,研究结果更准确。研究对与霜霉病相关基因进行定位,共检测到3个QTL:qR1-1-1、qR1-3-1、qR2-2-1,初步把qR1-1-1定位到chr-5上,qR1-3-1定位到chr-10上,qR2-2-1定位到chr-9上。虽然每个QTL距离两翼标记比较远,现阶段还难以应用于大规模的MAS育种,但是为抗霜霉病相关基因确定了大概位置,下一步可以结合已经发表的甜瓜全基因组序列,同时开展全基因组重测序,重点关注这个区域,完成对抗霜霉病相关基因的精确定位,确定抗病基因序列,最终克隆甜瓜PI390452霜霉病抗性基因。
4 结 论
通过对F2及F2∶3群体抗病性鉴定结果分析,资源PI390452所含有的甜瓜霜霉病抗性基因符合数量性状遗传的特点。研究共检测到3个霜霉病抗性基因的QTL位点qR1-1-1、qR1-3-1、qR2-2-1,分别位于chr-5、chr-10、chr-9上,qR2-2-1表型变异率最大为80.84%,qR2-2-1是控制甜瓜霜霉病主效QTL位点,为甜瓜抗霜霉病分子标记辅助育种、抗病基因精细定位、克隆提供了技术支持。
References)
[1] 张学军,季娟,李寐华,等. 新疆地区厚皮甜瓜白粉病菌生理小种的鉴定[J].新疆农业学,2013,50(8):1 450-1 455.
ZHANG X J,JI J,LI M H,et al.(2013).Identification of Physiological Races of Powdery Mildew on Cucumis melo ssp.melo in Xinjiang[J].Xinjiang Agricultural Sciences, 50(8):1,450-1,455. (in Chinese)
[2] 张学军,季娟,李寐华,等.新疆厚皮甜瓜抗白粉病基因SSR分子标记[J].新疆农业科学,2014,51(1):1-7.
ZHANG X J,JI J,LI M H,et al.(2014).SSR Markers Linked to Powdery Mildew Resistance Gene inCucumismelossp.meloof Xinjiang [J].XinjiangAgriculturalSciences, 51(1):1-7. (in Chinese)
[3] 栾非时. 西瓜甜瓜育种与生物技术[M].北京:科学出版社,2013:304-307.
LUAN Fei-shi. (2013).WatermelonMelonBreedingandBiotechnology[M]. Beijing: Science Press. (in Chinese)
[4] 陶兴林,黄永红,赵长增,等.厚皮甜瓜品种离体培养再生植株能力的基因型差异研究[J].果树学报,2005,22(3):252-256.
TAO Xing-lin, HUANG Yong-hong, ZHAO Chang-zeng,et al.(2005). Study on the regeneration ability of six melon cultivars [J].JournalofFruitScience, 22(3):252-256.(in Chinese)
[5] 季娟,张学军,伊鸿平.新疆哈密瓜 SRAP 反应体系建立和优化[J].新疆农业科学 ,2012,49(5):837-821.
JI J,ZHANG X J,YI H P,et al.(2012).Optimization of SRAP-PCR Reaction System in Hami Melon[J].XinjiangAgriculturalSciences, 49(5):837-821. (in Chinese)
[6] BERKELEY M S,CURTIS A. (1868).Peronospora cubensis. Botanical Journal of the Linnean Society,10:363.
[7] HORST R K. Downy Mildews[M]//Westcott`s Plant Disease Handbook. Springer Netherlands,2013:181-186.
[8] Colucci, S. J., Wehner, T. C., & Holmes, G. J. (2006). The downy mildew epidemic of 2004 and 2005 in the eastern united states.
[9] 聂祥祥.甜瓜抗霜霉病无选择标记基因的转化和功能验证[D].乌鲁木齐:新疆大学硕士论文,2014.
NIE Xiang-xiang. (2014).TransformationandVerificationforMarker-freeTransgenicforMelonwithResistancetoDownyMildew[D]. Master Dissertation. Xinjiang University, Urumqi.(in Chinese)
[10] 贺玉花,徐永阳,徐志红,等.甜瓜霜霉病抗性研究进展[J].果树学报,2014,31(2):324-334.
HE Yu-hua, XU Yong-yang, XU Zhi-hong, et al.(2014).Research progress of resistance to downy mildew in melon [J].JournalofFruitScience, 31(2):324-334.(in Chinese)
[11] 杨柳燕.甜瓜霜霉病(Psedoperonosporacubensis)抗性遗传研究及SRAP分子标记[D].北京:中国农业科学院硕士论文,2012.
YANG Liu-yang. (2012).TheStudyofGeneticResistanceofMelontoDownyMildew(Psedoperonosporacubensis)andSRAPMarkeroftheResistanceGene[D]. Master Dissertation. Chinese Academy of Agricultural Sciences, Beijing. (in Chinese)
[12] 贺玉花.甜瓜霜霉病抗性基因的SSR标记[D].北京:中国农业科学院硕士论文,2014.
HE Yu-hua.(2014).TheSSRMarkerLinkedtoDownyMildewResistantGeneinMelon(cucumismelo) [D]. Master Dissertation. Chinese Academy of Agricultural Sciences, Beijing.(in Chinese)
[13] Perchepied, L., Bardin, M., Dogimont, C., & Pitrat, M. (2005). Relationship between loci conferring downy mildew and powdery mildew resistance in melon assessed by quantitative trait loci mapping.Phytopathology, 95(5):556-565.
[14] Daninpoleg, Y., Reis, N., Tzuri, G., & Katzir, N. (2001). Development and characterization of microsatellite markers in cucumis.Theoretical&AppliedGenetics, 102(1):61-72.
[15] Gonzalo MJ; Oliver M; Garcia-Mas J; Monfort A; Dolcet-Sanjuan R; Katzir N; Arús P; Monforte AJ. (2005). Simple-sequence repeat markers used in merging linkage maps of melon (Cucumismelo, l.).Theoretical&AppliedGenetics, 110(5):802-811.
[16] Fernandezsilva, I., Eduardo, I., Blanca, J., Esteras, C., Picó, B., & Nuez, F., et al. (2008). Bin mapping of genomic and est-derived ssrs in melon (Cucumismelol.).Tag.theoretical&AppliedGenetics.theoretischeUndAngewandteGenetik, 118(1):139-150.
[17] Fukino, N., Ohara, T., Monforte, A. J., Sugiyama, M., Sakata, Y., & Kunihisa, M., et al. (2008). Identification of qtls for resistance to powdery mildew and ssr markers diagnostic for powdery mildew resistance genes in melon (Cucumismelol.).Tag.theoretical&AppliedGenetics.theoretischeUndAngewandteGenetik, 118(1):165-175.
[18] 张学军,郭丽霞,马新力,等.甜瓜种质资源抗霜霉病和蔓枯病苗期筛选与评价[J].中国瓜菜,2014,27(增刊):38-40.
ZHANG Xue-jun, GUO Li-xia, MA Xin-li, et al.(2014). Evaluation of downy mildew and gummy stem blight resistance for melon germplasm collections at seedling stage [J].ChinaCucurbitsandVegetables, 27(S): 38-40.(in Chinese)
[19] Criswell, A. D., Wehner, T. C., Klosinska, U., Kozik, E., & Pitrat, M. (2008). Use of sporulation and other leaf and vine traits for evaluation of resistance to downy mildew in cucumber. Cucurbitaceae 2008.ProceedingsoftheIXthEUCARPIAmeetingongeneticsandbreedingofcucurbitaceae,Avignon,France, 21-24 May . (pp.433-440).
[20]Epinat C, Pitrat M. (1994a). Inheritance of resistance to downy mildew (Pseudoperonosporacubensis) in muskmelon (Cucumismelo). I. Analysis of a 8×8 diallel table.Agronomie, 8(8):239-248.
[21] Epinat C, Pitrat M. (1994b). Inheritance of resistance to downy mildew (Pseudoperonosporacubensis) in muskmelon (Cucumismelo). II. Generation means analysis of genitors.Agronomie,14(4):249-257.
[22] Aurora Diaz,Javier Forment,Jason M.,et al.(2015).Argyris Anchoring the consensus ICuGI genetic map to the melon (CucumismeloL.) genome.Mol Breeding,35:188.
[23] Angelov, D., Krasteva, L., Katzir, N., & Paris, H. S. (2000). Dominant inheritance of downy mildew resistance in melons.Cucurbitaceae2000.Proceedingsofthe,EucarpiaMeetingonCucurbitBreedingandGenetics,Ma'aleHaHamisha,Israel, 19-23 March.
[24] Epinat, C., & Pitrat, M. (1994). Inheritance of resistance to downy mildew (Pseudoperosporacubensis) in muskmelon (Cucumismelo). i : analysis of a 8 x 8 diallel table.
[25] Thomas, C. E., Cohen, Y., Mccreight, J. D., Jourdain, E. L., & Cohen, S. (1988). Inheritance of resistance to downy mildew in cucumis melo.PlantDisease, 72(1):33-35.
[26] Ivanoft S S. (1944).Resistance of cantaloupes to downy mildew and the melonaphid. The Journal of Heredity:(35):35-39.
[27] Cohen, Y.,Eya, L. H,Kenigsbueh, D. (1988). Genetics,nature and utilization of resistance to downy and powdery mildew in musknlelon[C]// Institut National de la Recherche Agronomique. Cucurbitaceae 88:Proceedings of the EUCARPIA meeting on cucurbit Genetics and breeding Avignon. France:INRA,
[28] Shashikumar, K. T., Pitchaimuthu, M., & Rawal, R. D. (2010). Generation mean analysis of resistance to downy mildew in adult muskmelon plants.Euphytica, 173(1):121-127.
[29] 杨柳燕,徐永阳,徐志红,等.甜瓜霜霉病抗性遗传及SRAP分子标记[J].江苏农业科学,2012,28(5):1 200-1 202.
YANG Liu-yan,XU Yong-yang,XU Zhi-hong,et al. (2012).Inheritance of downy mildew resistance in melon and SRAP marker linked to resistant genes [J].JiangsuAgriculturalSciences, 28(5):1,200-1,202. (in Chinese)
[30] 贺玉花,徐永阳,徐志红,等.甜瓜霜霉病抗性基因SSR分子标记[J].江苏农业科学,2014,42(7):54-55.
HE Yu-hua,XU Yong-yang,XU Zhi-hong,et al.(2014).The SSR markers linked to downy mildew resistant gene in melon [J].JiangsuAgriculturalSciences, 42(7):54-55.(in Chinese)
Fund project:High Technology Research and Development Program of Xin jiang(201411109);Youth Foundation of Xinjiang Academy of Agricultural Sciences(xjnkq-2013036);China Agriculture Research System of watermelon and melon(CARS-26-04)
QTL Mapping of Resistance Genes to Downy Mildew inCucumismelossp.meloPI390452
ZHANG Xue-jun1, NING Xue-fei2, YANG Yong1, LI Mei-hua1,WANG Xian-lei2, YI Hong-ping1
(1.TheResearchCenterofHami-melon,XinjiangAcademyofAgriculturalSciences,Urumqi830091,China; 2.CollegeLifeScienceandTechnology,XinjiangUniversity,Urumqi830046,China)
【Objective】 TheCucumismelossp.meloPI390452 with high resistance to downy mildew was used as materials for the study of the genetic law of resistance to pi390452 resistance. And the resistance gene went through QTL mapping to lay the foundation and provide a theoretical basis for the resistance mechanism and molecular assistant selection (MAS) breeding.【Method】An artificial inoculation method was adopted to test the degree of resistance toPseudoperonosporacubensis(Berk.etCurt.) for the F2∶3family lines derived from the cross of PI390452×"kalakesai "(susceptible Farmholding variety). SSR analysis, combined with bulked segregation analysis (BSA), was done on the DNA of F2population using 1,090 pairs of SSR primers. QTL IciMapping software were used to construct SSR linkages and to make sure the corresponding relations between these SSR linkages and ICuGI was constructed corresponding molecular marker linkage map. QTL analysis on downy mildew resistance genes was conducted by QTL IciMapping software.【Result】The inheritance of the resistance gene to downy mildew in PI390452 fit to the inheritance law of quantitative trait. Three QTLs named qR1-1-1,qR1-3-1 and qR2-2-1 for the resistance gene to downy mildew were detected in this study. qR1-1-1,qR1-3-1 and qR2-2-1 were located on Chr.5,Chr.9and Chr.10. The QTL of qR2-2-1 accounted for the highest phenotypic variation of 80.84%.【Conclusion】The QTL of qR2-2-1 located on Chr.9 was the major QTL. The results in this study will be of great benefit to fine mapping and gene cloning for the major QTL of downy mildew resistance gene, also the results will lay a good foundation for melon MAS resistance breeding.
Cucumismelossp.melo;downy mildew;mapping QTL;SSR marker
2016-08-24
自治区高技术研究与发展项目(201411109);新疆农业科学院青年基金项目(xjnkq-2013036);国家西甜瓜产业技术体系项目(CARS-26-04)
张学军(1980-),男,吉林四平人,副研究员,硕士,研究方向为西瓜甜瓜抗病育种,(E-mail)zxj333@126.com
伊鸿平(1962-),男,研究员,研究方向为西甜瓜遗传育种,(E-mail)xjyhp2010@sina.com
10.6048/j.issn.1001-4330.2016.12.001
S652;S188
:A
:1001-4330(2016)12-2157-09
