N′-(2-羟基-4-甲基-苯甲酰胺基)-2-亚胺基-4-噻唑烷酮的合成及生物活性
2017-01-09金龙飞亢子珍
金龙飞, 亢子珍, 范 昕, 张 健
(中南民族大学 化学与材料科学学院,武汉 430074)
N′-(2-羟基-4-甲基-苯甲酰胺基)-2-亚胺基-4-噻唑烷酮的合成及生物活性
金龙飞, 亢子珍, 范 昕, 张 健
(中南民族大学 化学与材料科学学院,武汉 430074)
为探讨4-噻唑烷酮衍生物的生物活性,用4-甲基水杨酸甲酯和水合肼作为原料反应得到4-甲基水杨酰肼,再将其与硫氰酸钾合成得4-甲基水杨酰氨基硫脲,最后与溴代乙酸乙酯反应合成终产物N′-(2-羟基-4-甲基苯甲酰胺基)-2-亚胺基-4-噻唑烷酮. 对其进行了13C NMR、IR、1H NMR和元素分析表征,并对该化合物进行了体内抗炎活性和体外抗菌活性的测试. 结果表明:该化合物具有较好的抗炎和抗菌活性.
4-噻唑烷酮衍生物;表征;抗炎活性;抗菌活性
近年来,对噻唑、吡唑、三唑、嘧啶等杂环化合物的探索呈现出快速发展的态势. 其中,噻唑类杂环化合物由于具有独特的结构和显著的生物活性而得到了众多研究者的关注. 通过在不同化合物中引入噻唑基团,目前已经得到了一些具有潜在活性的多位点结构化合物.4-噻唑烷酮化合物就是这样一类含有五元噻唑环结构的新型杂环化合物,具有许多重要的生物活性. 4-噻唑烷酮化合物是值得重视的潜在的新药研制对象,其在抗炎、抗菌[1-3]、抗病毒[4-6]、抗心脑血管疾病[7]、镇静、麻醉、抗痉挛、抗氧化性等方面具有广泛应用前景[8].
在4-噻唑烷酮化合物的结构中,对生物活性影响比较大的因素主要有3种. 其一是存在着比较特殊的强弱交替型共轭体系[9-10];其二是五元杂环主结构中含有N、S等原子,其中4-噻唑烷酮环结构上的两个杂原子分别在1-位(S原子)和3-位(N原子);其三则是4-噻唑烷酮化合物的修饰基团. 由于4-噻唑烷酮化合物的五元杂环主结构相对固定,研究尝试了不同的修饰基团,比如水杨酰肼类基团的影响[11]. 在这些修饰基团中,当苯环上含有不同类型的取代基时,其抗菌的活性差别较大[12,13]. 为了进一步研究修饰基团的影响效果,本文拟合成一种新型的以给电子基甲基为取代基的4-噻唑烷酮类化合物(见图1和图2),并进一步测试其抗炎和抗菌活性,为更深入地研究新的低毒高效类化合物提供了非常有意义的参考.
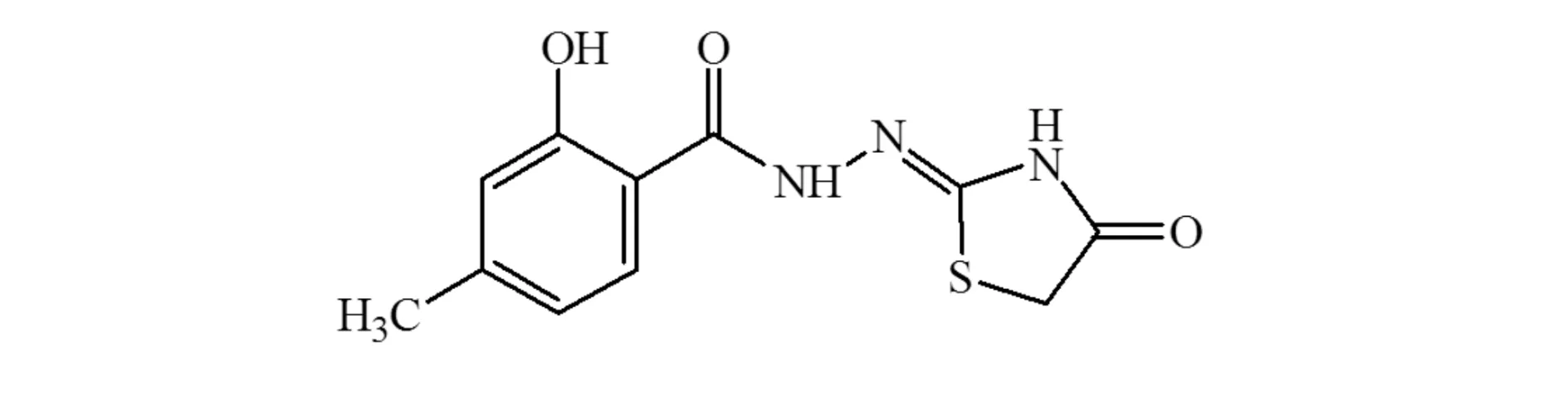
图1 终产物结构式Fig. 1 Structural formular of end product
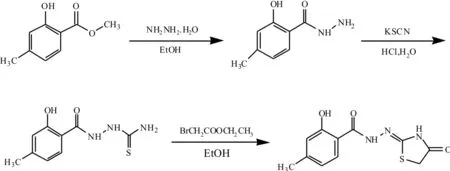
图2 4-噻唑烷酮衍生物的合成路线Fig. 2 Synthetic route of 4-thiazolidinone derivative
1 实验部分
1.1 仪器与试剂
可见紫外分光光度计(Perkin Elmer Lnc., Lambda 35 UV/Vis spectrometer, 25 ℃, 190 ~ 700 nm),傅里叶红外光谱仪(美国Nicolet公司,NEXUS 470 FT-IR , KBr压片法 ),旋转蒸发仪(上海亚荣生化仪器厂,RE52AA),数字显微熔点测试仪(予华仪器有限责任公司,XT-4型),元素分析仪( Elemental Analysensysteme GmbH, Vario EL Ш),高效薄层板(青岛海洋化工有限公司,GF254),核磁共振仪(德国布鲁克公司, Varian Mercury 400,1H NMR、13C NMR, DMSO-d6作为溶剂,以TMS为内标).
4-甲基水杨酸甲酯、水合肼(80 %)、浓HCl、无水乙酸钠、浓H2SO4、无水甲醇、BrCH2COOEt、KSCN、蒸馏水、无水乙醇、DMF,所涉及试剂都为AR,在使用前没有进一步的处理.
1.2 4-甲基水杨酰肼的合成
取16.60 g (0.1 mol) 4-甲基水杨酸甲酯于250 mL圆底烧瓶中,加入10.01 g (0.2 mol) 80 %的水合肼和15 mL甲醇, 常温搅拌40 min后,缓慢升高温度至62 ℃,回流反应7 h.将溶液转移到干燥烧杯中,0℃静置一夜,有大量白色晶体析出,抽滤,用蒸馏水、50%甲醇洗2次,抽滤,后用50%乙醇重结晶得到纯度较高的白色晶体13.60 g. Yield: 83.5 %,m.p. 168~169 ℃.
1.3 4-甲基水杨酰基氨基硫脲的合成
取9.96 g (0.06 mol) 4-甲基水杨酰肼于250 mL圆底烧瓶中,加入约100 mL水,0℃下加入约10 mL浓HCl,搅拌30 min后加入硫氰化钾9.84 g(0.12 mol),继续搅拌20 min. 混匀后,使其逐渐升温至室温并搅拌40 min. 后升温至80 ℃,回流9 h. 反应终止后将溶液转移至烧杯中,自然冷却过夜,析出的固体抽滤后用蒸馏水洗3次直至pH为7,按体积比为φ(乙醇︰DMF︰水)=5︰1︰1配制混合溶液对产物进行重结晶,得到淡黄色固体粉末产物8.81 g. Yield: 73.1%,m.p. 209 ℃.
1.4N′-(2-羟基-4-甲基-苯甲酰胺基)-2-亚胺基-4-噻唑烷酮的合成
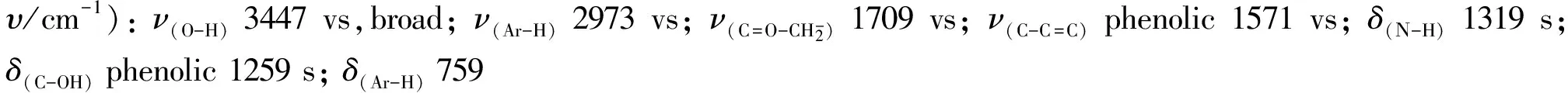
1.5 抗炎活性测试
采用爪掌肿胀法[14],对合成的目标化合物进行了抗炎活性的测试. 参照品、引发剂、空白对照分别为二氟尼柳、γ-卡拉胶及甲基纤维素.
选取20只20 ~ 25 g小白鼠,雌雄不分分成3组. 用标准颗粒饲料喂食小白鼠且自由饮水2 d使其适应实验室环境. 从测试当日起,将饲料撤掉,只提供饮水. 对小白鼠进行混合物灌胃后1 h,于各只试验鼠的右后掌分跖位置注射25 μL现配的γ-卡拉胶盐水溶液,另外将25 μL盐水溶液注射于每只小鼠左后掌分跖组织处,用作内部对照. 灌胃后4 h,用千分尺测量各只试验鼠的右、左后掌的肿胀厚度.
1.6 抗菌活性测试
采用浓度稀释法[15,16],让4种不同的菌种在一定浓度梯度的样品溶液繁殖生长,通过测溶液浑浊时的浓度[最小抑制浓度(MIC)]来分析和确定此化合物的抗菌性活性. 采用了4种菌种,包含有大肠埃希氏杆菌(Escherichiacoli)、金黄色葡萄球菌(StaphyloccocusaureusRosenbach)、普通变形杆菌(Proteusvulgaris)和枯草芽孢杆菌(Bacillussubtilis). 选取Mueller-Hinton broth作为实验培养基,用蒸馏水配制浓度分别为 1600,800,400,200,100,50,25 μg/mL目标产物的溶液.
2 结果与讨论
2.1 化合物红外光谱分析归属
在目标化合物的红外光谱中,苯上O-H的伸缩振动出现的宽强峰出现在3451 cm-1处;C-H (phenolic)的伸缩振动出现的强峰在2969 cm-1处;五元内酰胺的C=O基团的伸缩振动强峰出现在1713 cm-1;苯环骨架的伸缩振动强峰和C=N基团的伸缩振动强峰分别出现在1577 cm-1和1619 cm-1. 归属于Ν-H基团的弯曲振动,在1308 cm-1出现峰;归属于Ar-H的弯曲振动峰在766 cm-1处出现.
2.2 化合物核磁共振表征
目标化合物的核磁共振氢谱信号归属为:-Ar-CO-NH-里的1个质子对应11.94处的单峰,在11.59处出现单峰为-CH2-CO-NH-的1个质子,Ar-OH里的单质子为10.75处的单峰,PhCH的3个质子在7.79和6.70处出现多重峰,出现在4.09处的单峰为-CH2中的2个质子,-CH3-中的3个质子在2.30处为单峰.
目标化合物的核磁共振碳谱信号归属分别为:173.98处的谱峰为噻唑环上酰胺羰基C=O-CH2-中的碳原子,163.99的谱峰归属于羰基C=O-Ph的碳原子,159.10的谱峰归属于Ph-OH的碳原子,143.89的谱峰为噻唑环上C=N的碳原子,134.20的谱峰归属于Ph- CH3的碳原子,130.10的谱峰归属于6-Ph的碳原子, 119.98的谱峰归属于5-Ph的碳原子,118.01为1-Ph的碳原子谱峰,113.73为3-Ph的碳原子谱峰,34.69的谱峰归属于-CH2的碳原子,21.66为-CH3碳原子的谱峰.
2.3 抗炎活性
生物体内的炎症抑制效应,将通过测量的实验鼠右左腿肿胀差值进行计算,其计算公式为:Inhibition(%)= [(m-m′)/m]×100%,式中m代表对照组试验鼠右左腿肿胀差值,m′代表样品组或参照组试验鼠右左腿肿胀差值. 表1为终产物抗炎活性测试结果. 由表1可见,参照品的F值为66.126,其所对应的P值0.001239<0.050,在0.050水平上有显著不同. 样品F值是242.429,对应P值为2.00600×10-5< 0.050,在0.050水平上有显著不同. 与参照品比较,化合物表现出更好的抗炎效果.
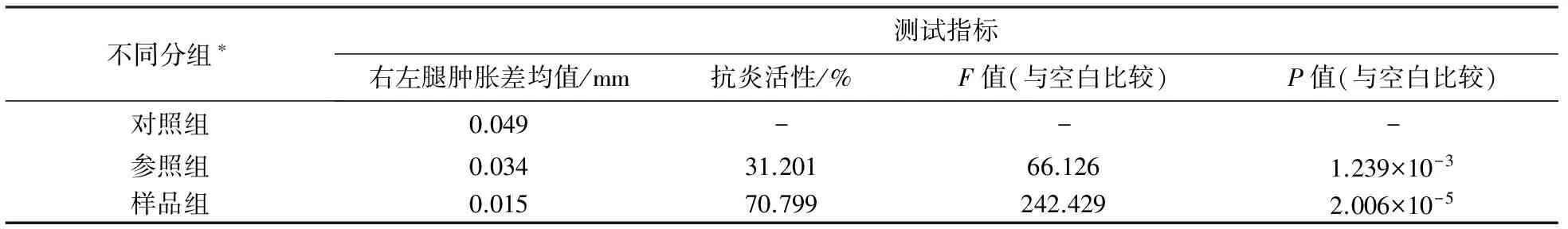
表1 终产物的抗炎测试结果
*对照组为甲基纤维素;参照组为二氟尼柳;样品组为N′-(2-羟基-4-甲基-苯甲酰胺基)-2-亚胺基-4-噻唑烷酮
2.4 抗菌活性
应用浓度稀释法测定了化合物对4种微生物的最小抑制浓度.测定的抗菌活性结果见表2. 由表2可见,在抗菌活性上,化合物对4种测试菌种均有不同程度的抑制效果,但对金黄色葡萄球菌的抑制效果最好,值得进一步探讨和研究.

表2 终产物的最小抑制浓度
3 结语
在1、3位包含S、N两个杂原子的4-噻唑烷酮类化合物具有很高的生物活性,让其与水杨酰肼类衍生物反应,能够产生更大的共轭体系,对该类化合物生物活性的提高有着显著的效果. 为了研究其抗炎活性及抗菌活性,本文以氨基硫脲分子及4-CH3水杨酰肼为原料合成了目标产物. 并对其进行了元素分析、核磁共振氢谱、IR、核磁共振碳谱等表征,用爪掌肿胀法测试得该化合物的抗炎活性值为70.8 %;采用浓度稀释法测得化合物的抗菌活性分别为:大肠埃希氏杆菌400 μg/ mL,枯草芽孢杆菌400 μg/ mL,普通变形杆菌400 μg/ mL,金黄色葡萄球菌50 μg/ mL. 说明该噻唑烷酮衍生物在抗炎及抗菌活性方面具有效果较好,为该类化合物的深层次研究提供了很有价值的参考.
[1] Paola V,Athint G,Matteo I,et al. 2-Hetero arylimino-5-b enzylidene-4-th iazolidinones analogues of 2-thiazolylimino- 5-benzylidene-4-thiazolidinones with antimicrobial activity: synthesis and structure-activity relationship[J]. Bioorg Med Chem,2008,16(7): 3714-3724.
[2] Qin Z Q,Zhang J,Xu B,et al. Structure-based discovery of inhibitors of the YycG histidine kinase: new chemical leads to combat Staphylococcus epidermidis infections[J]. BMC Microbiol,2006,6: 96-97.
[3] Bonde C G,Gaikward N J. Synthesis and preliminary evaluation of some pyrazine containing thiazolines and thiazolidinones as antimicrobial agents[J]. Bioorg Med Chem,2004,12(9): 2151-2161.
[4] Rawal R K,Prabhakar Y S,Katti S B,et al. 2-(Aryl)-3-furan-2-ylmethyl-thiazolidin-4-ones as selective HIV-RT Inhibitors[J]. Bioorg Med Chem,2005,13(24): 6771-6776.
[5] Rawal R K,Tripathi R,Katti S B,et a1. Design,synthesis,and evaluation of 2-aryl-3-heteroaryl-1,3-thiazolidin-4-ones as anti-HIV agents[J]. Bioorg Med Chem,2007,15(4):1725-1731.
[6] Rawal R K,Tripathi R,Katti S B,et a1. Design,synthesis,and evaluation of 2-(2,6-dibromophenyl)-3-heteroaryl-1,3-thiazolidin-4-ones as anti-HIV agents[J]. Eur J Med Chem,2007,15(9): 3134-3142.
[7] Kozlowskia C A,Ulewiczb M,Walkowiakc W,et a1. The effect of tautomeric rearrangementon the separation of Zn(II) and Cd(II) in ion flotation process with 4-thiazolidinone derivatives[J]. Minerals Engineering,2002,15(9): 677-682.
[8] Tenorio R P,Carvalho C S,Pessanha C S,et a1. Synthesis of thiosemicarbazone and 4-thiazolidinone derivativesand their in vitro anti-Toxoplasmagondiiactivity[J]. Bioorg Med Chem Lett,2005,15(10): 2575-2578.
[9] 张 荣,钱旭红. 2,5-二取代-1,3,4噁二唑和N,N′-二酰基肼化合物的合成与生物活性[J]. 应用化学,1996,13(5):5-9.
[10] 金龙飞,杨 明,毛 骁,等. (Z)-3-水杨酰肼羰基丙烯酸乙酯的合成[J]. 中南民族大学学报(自然科学版), 2014,33(1):11-12.
[11] 金龙飞,李培娟,亢子珍,等.N′-(2-羟基-4-甲基-苯甲酰胺基)-2-亚胺基-4-噻唑烷酮[J]. 中南民族大学学报(自然科学版), 2015,34(4):15-18.
[12] Vicini P,Geronikaki A,Anastasia K,et a1. Synthesis and antimicrobialactivityof novel 2-thiazolylimino-5-arylidene-4-thiazolidinones[J]. Bioorg Med Chem,2006,14(11): 3859-3864.
[13] 金龙飞,范 昕,金呈之,等.L-谷氨酸-5-甲酯金属铜化合物的合成、表征及生物活性[J]. 中南民族大学学报(自然科学版),2012,31(2):18-19.
[14] Kasahara Y,Hikino H,Tsurufuji S,et al. Antiinflamma- tory actions of ephedrines in acute inflammations[J]. Planta Med,1985,51 (4) 325-331.
[15] 宋晓晶,董 岩,张 虹,等. 微量稀释法检测四种药物对白念珠菌的敏感性分析[J]. 大连医科大学学报,2010,32(4): 462-464.
[16] 陈秀枢,屠 涛. 微量肉汤稀释法测定MIC的评价[J]. 中华医学检验杂志,1994,2: 95-98.
Synthesis and Bioactivity ofN′-(2-Hydroxy-4-Methyl-Benzoylamide)-2-Imino-4-Thiazolidinone
Jin Longfei, Kang Zizhen, Fan Xin, Zhang Jian
(College of Chemistry and Materials Science, South-Central University for Nationalities, Wuhan 430074, China)
To investigate the bioactivity of 4-thiazolidinone derivatives, 4-methyl salicylhydrazide was synthesized using methyl 4-methylsalicylate and hydrazine hydrate as raw material, then reacted with potassium thiocyanate to form 4-(4-methyl salicyloyl) thiosemicarbazide, which finally reacted with ethyl bromoacetate to obtain the end product. The structure of the final compound was characterized by elemental analysis, IR,1H NMR and13C NMR. The synthesized compound was tested for its anti-inflammatory activity assemblyinvivoand antibacterial activity assemblyinvitro. The results showed that the compound had good anti-inflammatory and antibacterial activity.
4-thiazolidinone derivative; synthesis; characterization; anti-inflammatory activity; antimicrobial activity
2016-03-02
金龙飞(1962-),男,教授,博士,研究方向:化学生物学与药物化学,E-mail: longfei_jin@163.com
湖北省自然科学基金重点项目(2008CDA067)
TQ217
A
1672-4321(2016)04-0005-04
