多不饱和脂肪酸对军曹鱼幼鱼生长和核酸代谢的影响
2017-01-08许友卿李伟峰郑一民丁兆坤
■ 许友卿 李伟峰,2 郑一民 丁兆坤*
(1.广西大学水产科学研究所,广西南宁530004;2.广西北部湾海洋生物多样性养护重点实验室(钦州学院),广西钦州535011)
高度不饱和脂肪酸(Highly unsaturated fatty acids,HUFAs)是海水鱼的必需脂肪酸(Essential fatty acids,EFAs),如二十二碳六烯酸(Docosahexaenoic acid,DHA,C22∶6n-3)、二十碳五烯酸(Eicosapentaenoic acid,EPA,C20∶5n-3)和二十碳四烯酸(Arachidonic acid,AA,C20∶4n-6)[1-3]。HUFAs在维持机体的正常机能、促进生长、发育、繁殖和提高成活率等方面发挥重要的生理功能[4-5]。
鱼油(FO)富含的n-3 HUFAs,不仅是海水鱼必需脂肪酸,还能增加饲料的适口性[6]。然而,随着水产养殖业的迅速发展,海洋渔业资源日益减少,鱼油(FO)供应越来越有限[7-8],务必选用替代品。植物油来源广,供应稳定,质量可靠,而且价格低廉。选用植物油作为鱼油替代品,既可减少对鱼油的依赖,又可降低养殖成本[9]。苏籽油(perilla oil,PO)含有70%亚麻酸(C18∶3n-3)[10],红花油(safflower oil,SO)含有80%亚油酸(C18∶2n-6)[11],两者均可被脂肪酸去饱和酶和延长酶转化为HUFAs,而且价廉物美,用之替代鱼油的前景广阔[12]。
然而,与淡水鱼相异,大部分海水鱼由于缺少脂肪酸去饱和酶和(或)延长酶,不能合成或合成的HUFAs不能满足其生理需要,只能从日粮摄取HUFAs[13-14]。一些广盐性海水鱼类(如大西洋鲑和黄斑蓝子鱼等)表现出“淡水鱼模式”,能够将植物油中C18∶2n-6和C18∶3n-3分别转化成AA、EPA和DHA等HUFAs[15-16]。军曹鱼生长快、肉质细嫩、营养价值高,是我国南方人工网箱养殖的优良海水鱼种之一[17-18]。目前还未发展合适的人工配合饲料,尚需研究军曹鱼的营养生理[19-21]。军曹鱼能否利用植物油,把其中C18∶2n-6和C18∶3n-3分别转化成AA、EPA和DHA等值得研究。
我们前期研究发现,军曹鱼具有Δ6和Δ5脂肪酸去饱和酶以及延长酶[22],因此假设军曹鱼具有转化多不饱和脂肪酸(PUFAs)为AA、EPA和DHA等HUFAs的能力;添加PUFAs可促进军曹鱼(Rachycentron canadum)生长、核酸代谢。本文用添加不同种类PUFAs的饲料投喂军曹鱼幼鱼,对鱼生长和核酸代谢的影响,并讨论了其机理。
1 材料和方法
1.1 饲料原料
北太平洋白鱼粉(蛋白质≥65%,脂肪≤10%)和鱼油(EPA+DHA≥20%)均购自美国seafood公司;维生素混合物和矿物质混合物购自青岛杰海饲料有限公司;苏籽油(C18∶3n-3≥70%)和红花油(C18∶2n-6≥79%)购自江西吉平天然植物油有限公司;其他饲料原料均是食品级,购自中国的不同生物公司。
1.2 试验设计与饲料组成
本试验设计和各组饲料配方主要参考了我们前期的研究[23],同时参考了Kamarudin等(2012)[24]和Zhou等(2012)[25]的报告。在基础饲料中分别添加6%的鱼油(FO组)、苏籽油(PO组)、红花油(SO组)以及添加3%的鱼油和3%的红花油(FO+SO组)。各组饲料配方和营养成分见表1。

表1 试验饲料配方及营养成分
1.3 试验鱼、驯化、养殖和采样
试验用军曹鱼,购自广东省湛江市流沙镇海水鱼育苗场,养殖试验在广西水产研究所防城企沙南美白对虾研究基地的养殖车间进行。用对照组日粮驯化23 d鱼龄的军曹鱼2周后,挑选47 d鱼龄,初始体重为(12.60±0.35)g的军曹鱼幼鱼825尾,随机分为5个组,每组3个平行,每桶55尾鱼(每桶容积400 L),用5组不同的日粮投喂:①对照日粮(CO)仅含基础饲料;②鱼油日粮(FO)为基础饲料添加6%鱼油(富含n-3 PUFAs);③苏籽油日粮(PO)为基础饲料添加6%苏籽油(富含 C18∶3n-3,LNA);④红花油日粮(SO)为基础饲料添加6%红花油(富含C18∶2n-6,LA);⑤红花油+鱼油日粮(SO+FO)为基础饲料添加3%红花油(富含n-6 PUFAs)和3%鱼油(富含n-3 PUFAs)。试验养鱼用过滤和曝气海水,水温28.0~32.0 ℃,盐度26.0~29.0,pH值7.8~8.5,溶氧≥6 mg/l。每天于8:00和17:00投喂,日投喂量为当时鱼体重的5%。
分别于0周和12周随机取全鱼和组织或器官样品。0周共取样品鱼37尾,其中9尾全鱼样品,解剖28尾取组织或器官样品。第12周末,每个养殖桶随机取全鱼3尾,另6尾解剖取组织或器官样品。取样前,鱼禁食24 h,用1/13 000的间氨基苯甲酸乙酯甲磺酸盐(MS-222,Sigma,St.Louis,MO,USA)逐尾将鱼麻醉2~3 min,用纱布吸干体表水分,称体重、量体长和全长。用注射器从心脏采血至EP管中,血液于室温静置0.5 h后,3 800×g离心12 min取血清。然后分别解剖鱼体取脑、肝脏、心脏、肾脏和背大肌(去皮),并用0.65%鱼用生理盐水清洗组织或器官样品表面附着的血液,各组织或器官称重和记录。把解剖好的各组织或器官分别妥装于样品袋中,标注固定好,于液氮中速冻,然后转至-80℃冰箱保存待测定(Ding等,2017)。
1.4 提取鱼组织或器官样品总RNA和DNA
称100 mg军曹鱼肝脏(或脑、肌肉、心脏、肾脏)样品,于液氮条件下,用研钵迅速将样品研成粉末后,将样品粉末迅速转入已预冷并于4℃的玻璃匀浆器中充分匀浆(血清样品无需研磨和匀浆),根据标准Trizol抽提法,用RNAiso plus试剂(Takara,大连宝生物工程有限公司)提取总RNA。
用UNIQ-10柱式动物基因组DNA抽提试剂盒(上海生工生物工程技术有限公司)抽提组织DNA(血清样品无需研磨和匀浆)。用Nanodrop 1200微量核酸蛋白分析仪(Thermo,USA)分别测定和计算样品总RNA和DNA浓度。
1.5 计算公式和数理统计

式中:CRNA——每毫克样品中RNA的含量(μg/mg);
CDNA——每毫克样品中DNA的含量(μg/mg);
CA和CB——分别为测定的DNA和RNA浓度;
100(μl)——样品DNA和RNA被稀释体积;
1 000——ng和μg的换算倍数;
M——样品重量(mg)。
相对增重率(RWG,%)=(Wt-Wi)/Wi×100。
式中:Wt——最终体重;
Wi——最初体重。
用SPSS 19.0数据处理软件对组间数据进行单因素统计分析,得出平均值、标准差和标准误等值,并用Duncan's法对平均数进行多重比较(P<0.05)。
2 结果
2.1 投喂不同PUFAs添加剂对军曹鱼幼鱼生长的影响
用添加不同PUFAs的饲料投喂军曹鱼幼鱼12周,其生长受到不同程度的影响,其中SO+FO组鱼体重(143.73 g)显著高于SO组鱼(127.40 g)(P<0.05)和CO组鱼(121.46 g)(P<0.05)。但SO+FO、FO组和PO组鱼体重间无显著差异(P>0.05)(图1A),用添加不同PUFAs的饲料投喂的各组军曹鱼的相对增重率(RWG)均分别显著高于CO组(P<0.05)(图1B)。
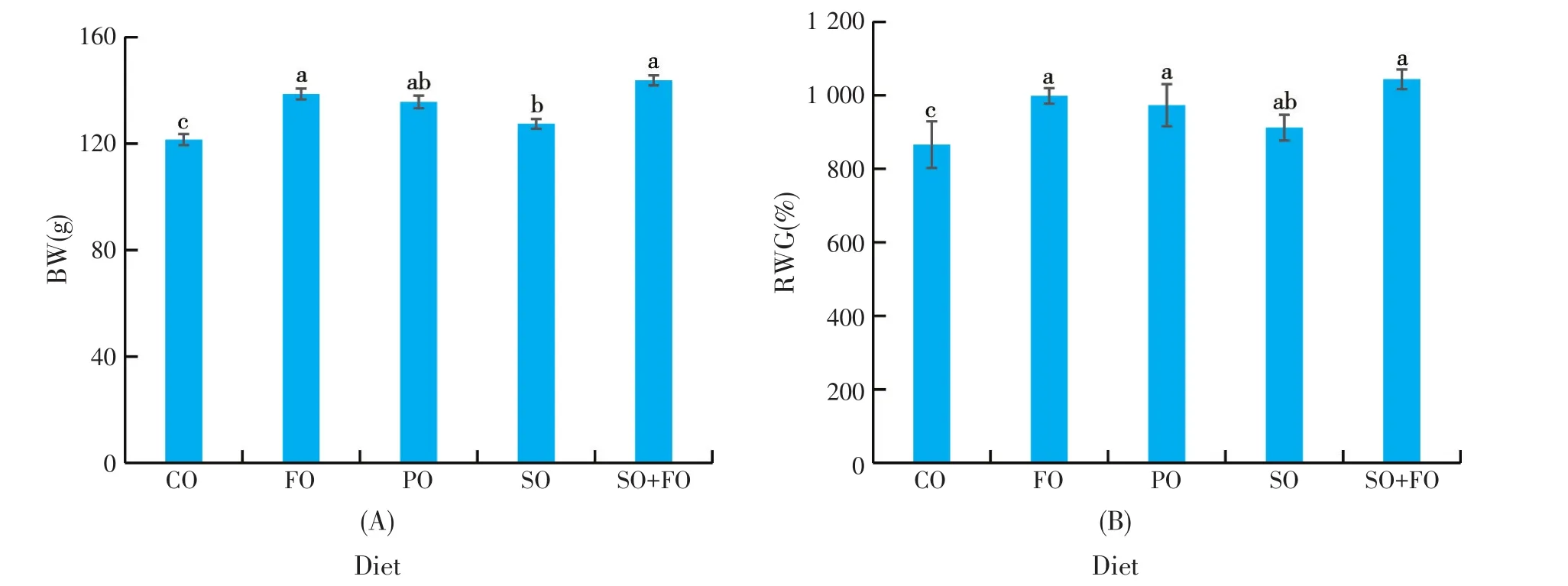
图1 不同PUFAs添加剂投喂军曹鱼幼鱼12周,对其体重(BW,图1A)和相对增重率(RWG,图1B)的影响
2.2 投喂不同PUFAs添加剂对军曹鱼幼鱼组织或器官核酸代谢的影响
用添加不同PUFAs的饲料投喂军曹鱼幼鱼12周,不同程度的影响其肌肉、肝脏、脑、心脏、肾脏和血清的核酸代谢(见表2),以肌肉为例,SO+FO组鱼合成RNA 最多,为[(239.48±0.79)μg/mg],显著高于 PO[(201.19±0.81)μg/mg]、SO[(194.86±0.93)μg/mg]组和CO[(143.44±1.25) μg/mg]组(P<0.05)。SO+FO 组鱼RNA/DNA比值也显著高于CO、PO组和SO组鱼(P<0.05)。

表2 添加不同PUFAs的饲料投喂军曹鱼幼鱼12周,对其肌肉、肝脏、脑、心脏、肾脏和血清核酸代谢的影响
线性回归分析显示(见图2),军曹鱼幼鱼组织或器官RNA/DNA比值与体重的相关性随组织或器官不同而异,肌肉的RNA/DNA比值与体重的相关性呈显著正相关(R2=0.956 9),依次是肝脏(R2=0.905 5)、脑(R2=0.775 7)、心脏(R2=0.527 4)、肾脏(R2=0.502 8)和血清(R2=0.419 3),其中血清的RNA/DNA比值与体重的相关性最低。
3 讨论
我们发现,PUFAs是影响鱼生长的重要因素之一,而且n-3和n-6 PUFAs的比例也显著影响鱼的生长。试验结果表明,用不同PUFAs添加剂投喂的各组鱼体重和相对增重率均显著高于对照组(CO)(P<0.05)(见图1),依次为:SO+FO组>FO组>PO组>SO组>CO组。除CO组外,SO+FO组鱼的生长效果最好,SO组鱼最低。这是因为SO组鱼饲料的∑n-3 PUFAs含量最低(3.44%),∑n-6 PUFAs含量最高(42.45%),∑n-3 PUFAs和∑n-6 PUFAs的比值最低,为0.08%,促进生长的能力最低;相反地,PO组鱼饲料的∑n-3 PUFAs含量最高(35.53%),∑n-6 PUFAs含量最低(12.58%),∑n-3 PUFAs和∑n-6 PUFAs的比值最高(2.82%),促进鱼生长的能力较高,但不是最高;而SO+FO组日粮含有较高的∑n-6 PUFAs(27.44%)和较高的∑n-3 PUFAs(17.42%),∑n-3 PUFAs和∑n-6 PUFAs比值适中,为0.63%(见表1),促进鱼生长的能力最高。可见,∑n-3 PUFAs和∑n-6 PUFAs对军曹鱼的生长都是必要的。其理由n-6和n-3 PUFAs都是军曹鱼所必需。n-6和n-3 PUFAs都是海水鱼的必需脂肪酸[26]。在海水稚幼鱼阶段,DHA和AA在神经细胞和视觉细胞中,特别是视杆细胞外节膜和突触膜中含量很高[27],说明DHA和AA在神经和视觉系统发育及其功能的重要性;PUFAs,尤其是AA和EPA,是类花生酸的重要前体[28]。类花生酸是一类重要的旁分泌激素,参与机体一系列的生理活动,包括发育、免疫和繁殖[29]。并在介导和调控各种细胞活动中发挥动态作用,也是细胞膜的重要组成物质[30]。AA还可显著影响鱼的生长和成活率[31]。另一方面,∑n-3 PUFAs和∑n-6 PUFAs的合理比例对军曹鱼生长也非常重要,∑n-3 PUFAs和∑n-6 PUFAs比值过高或过低都不适宜军曹鱼的生长,只有适宜的比例才适合其生长,而且合理的n-3和n-6 PUFAs比例对军曹鱼的正常生长发育至关重要。其他某些学者对其他鱼种的研究也有相似的报道。Robaina等[32]报道,使用合理的n-3和n-6 PUFAs比例饲料投喂金头鲷(Sparus aurata)可以提高其生长性能。饲料中n-3和n-6 PUFAs比例显著影响革胡子鲶(Clarias gariepinus)[33]和军曹鱼[34]的生长和体成分(P<0.05)。AA、DHA/PEA和AA/EPA是评估鱼卵和幼鱼质量的重要指标[26,35]。然而,日粮中高比例的n-6/n-3 PUFAs可能增加鱼的应激反应,导致心脏疾病[36]。

图2 用添加不同PUFAs的饲料投喂军曹鱼幼鱼12周,对各组鱼体重与肌肉、肝脏、脑、心脏、肾脏和血清RNA/DNA比值的回归关系的影响
同时,我们发现,只添加n-3 PUFAs比只添加n-6 PUFAs更能促进军曹鱼的生长。这就是PO(富含C18∶3n-3,LA)组鱼体重和相对增重率高于SO(富含C18∶2n-6,LNA)组鱼的缘故。这些事实主要说明两个问题:①军曹鱼具有把C18∶3n-3转化为EPA和DHA以及把C18∶2n-6转化为AA的能力。这与我们前期研究发现军曹鱼具有合成HUFAs关键酶——Δ6、Δ5脂肪酸去饱和酶和延长酶活性是一致的[22],证明军曹鱼可以合成HUFAs。饲料中充足的C18PUFAs(LNA和LA)可以激活军曹鱼体内合成HUFAs关键酶的脂肪酸去饱和酶和延长酶活性,或(和)促进合成HUFAs关键酶的转录,以致能将LNA和LA转化为HUFAs,此是自身因素和营养调节的结果。Seiliez等[14]发现,用菜籽油和豆油饲喂金头鲷(Sparus aurata)幼鱼,其Δ6脂肪酸去饱和酶mRNA表达量提高6倍,但是金头鲷Δ6去饱和酶的两种转录本都被富含HUFAs的日粮所抑制。植物油可提高鱼Elovl 2和Elovl 5b mRNA的表达水平,促进HUFAs生物合成过程的延长效率[37-38]。②n-3 PUFAs对军曹鱼幼鱼生长的作用大于n-6 PUFAs或说前者更能促进军曹鱼生长。这可能是因为幼鱼在快速生长时期需要更多的n-3 HUFAs来维持代谢、满足生物膜结构完整性以及神经系统的发育需要[39-41]。EPA对维持海水幼鱼细胞膜结构和功能的完整性方面发挥重要作用[14]。发育中的幼鱼会优先将DHA供给神经细胞和视网膜[42-43]。在幼鱼早期生长发育阶段,神经组织是机体的主要组成部分[44]。
本试验发现,添加PUFAs影响军曹鱼的核酸代谢。这与我们前期研究结果一致,添加EPA、DHA和AA等n-3 HUFAs,可促进军曹鱼(Rachycentron canadum)幼鱼的核酸代谢,提高鱼RNA/DNA比率,增加蛋白质合成,加速生长;而且不同剂量和比例的EPA、DHA和AA对军曹鱼幼鱼核酸代谢影响相异,剂量高的影响大,与鱼肌肉核酸代谢成正比,与幼鱼生长正相关[45-46]。RNA含量和RNA/DNA比值是体内蛋白质合成能力的生理指标之一,它可以反映机体的营养和生长状况[47-48]。研究证实,RNA/DNA比值与鱼类生长呈正相关,生长良好的鱼RNA/DNA比值较大,生长差的鱼RNA/DNA比值较小,揭示了RNA/DNA比值与鱼类生长之间的变化规律,用RNA/DNA比值可以更精确地评价鱼类近期和长期生长状况,具有实用价值[49-51]。鱼类生长过程的实质是体内蛋白质合成过程,而蛋白质合成取决于RNA量的变化[52]。因此,蛋白质的合成和鱼的生长可通过检测RNA含量来预测[53]。由于DNA含量在鱼的细胞中是固定的,DNA含量只与细胞以及核体积密切相关,DNA浓度高,说明单位组织中细胞体积小但数目多,RNA/DNA比值能排除细胞数量的影响而反映出细胞内RNA的浓度。所以,RNA/DNA比值比单独的RNA浓度能更好地反映出鱼体蛋白质合成的水平[54-55]。即使在鱼开始生长阶段,根据RNA/DNA比值的大小就能够算出鱼类的生长速度[45]。
总而言之,添加PUFAs可提高军曹鱼稚幼鱼的生长性能和促进核酸代谢,其肌肉和肝脏的RNA/DNA比值均可作为军曹鱼稚幼鱼生长的衡量指标。
