真菌免疫调节蛋白结构与功能的研究进展
2017-01-07帖卫芳贾俊忠郭文平
帖卫芳,贾俊忠,郭文平
(1.河套学院医学系,内蒙古巴彦淖尔 015000;2.巴彦淖尔市医院,内蒙古巴彦淖尔 015000;3.西北农林科技大学动物医学院,陕西杨凌 712100)
真菌免疫调节蛋白结构与功能的研究进展
帖卫芳1,贾俊忠2,郭文平3
(1.河套学院医学系,内蒙古巴彦淖尔 015000;2.巴彦淖尔市医院,内蒙古巴彦淖尔 015000;3.西北农林科技大学动物医学院,陕西杨凌 712100)
真菌免疫调节蛋白是一类具有多种生物学功能的小分子蛋白质。介绍了已发现真菌免疫调节蛋白的序列特性及结构,并对其生物学功能的最新研究进展进行了综述,最后对其今后的发展趋势进行了展望。
真菌免疫调节蛋白;结构;生物学功能
在传统中医药中,许多真菌作为药物被广泛使用;在民间,人们也通过食用真菌来增强自身的免疫力。随着现代科学技术的发展,已经从真菌中分离到许多与提高人体免疫力密切相关的生物活性物质,主要包括多糖、肽、蛋白质、糖蛋白、甾醇、萜类、维生素等。在提取的生物活性蛋白质中,凝集素与真菌免疫调节蛋白(Fungal immunomodulatory protein,Fip)是2种重要的具有免疫调节功能的蛋白。真菌免疫调节蛋白是一类从高等担子菌中分离出来的具有免疫调节活性的小分子蛋白质,最早由日本学者Kino等[1]从赤灵芝(Ganodermalucidum)中分离纯化到,并将其命名为Ling Zhi-8(LZ-8)。最初,真菌免疫调节蛋白的研究主要集中在可食用的真菌;在随后的20多年中,更多的真菌免疫调节蛋白被发现,包括一些非食用的真菌。研究发现,该类蛋白具有包括抗肿瘤活性和免疫调节功能在内的多种生物学功能。笔者介绍了已发现真菌免疫调节蛋白的序列特性及其结构,并对其生物学功能的最新研究进展进行了综述,最后对其今后的发展趋势进行了展望。
1 真菌免疫调节蛋白的来源及特征
1989年,日本学者Kino等[1]对赤灵芝菌丝体的粗提取物进行进一步纯化,经过凝胶过滤及离子交换层析,得到了一种等电点为4.4的蛋白质,Tricine-SDS-聚丙烯酰氨凝胶电泳结果表明其分子量约为13 kD。该蛋白能刺激小鼠脾淋巴母细胞的形成,命名为LZ-8,这是第1个从真菌中分离到的真菌免疫调节蛋白。Tanaka等[2]对该蛋白进行了测序,测序结果表明成熟的LZ-8是由110个氨基酸残基组成的,其氨基端为乙酰化的丝氨酸,根据其氨基酸组成,推导其分子量为12.4 kD,与试验结果相一致。1991年,Murasugi等[3]从灵芝的 cDNA 文库中筛选到LZ-8蛋白的编码基因,不包括终止密码子的碱基长度为333 bp,根据该基因核苷酸序列推导的氨基酸序列与蛋白质测序结果完全一致,只比成熟的LZ-8多1个甲硫氨酸(Met)。
除了赤灵芝中分离到的LZ-8外,学者也从小孢子灵芝(G.microsporum)[4]、金针菇(Flammulinavelutipes)[5]、草菇(Volvariellavolvacea)[6]和松杉灵芝(G.tsugae)[7]中分离到真菌免疫调节蛋白,分别被命名为Gmi、FIP-fve、FIP-vvo和FIP-gts。迄今为止,NCBI 网站上公布的免疫调节蛋白的完整序列共有15种,分别来自赤灵芝(G.lucidum,P14945)[1]、紫灵芝(G.japoncium,AAX98241)、小孢子灵芝(3KCW_A)[4]、松杉灵芝[7]、树舌灵芝(G.applanatum,AEP68179)[8]、黑灵芝(G.atrum,AJD79556)[9]、紫芝(G.sinense)[10]、草菇[6]、云芝(Trametesversicolor,XP_008038009)[11]、污叉丝孔菌(Dichomitussqualens,XP_007362866)、金针菇(P80412)[5]、色钉菇(Chroogomphusrutilus,AKU37620)[12]、褐腐菌(Postiaplacenta,AJL35148.1)[13]、台湾樟芝(Taiwanofunguscamphoratus,AAT11911)[14]和银耳(Tremellafuciformis,ABL96299)[15]。以上这些真菌免疫调节蛋白由111~136个氨基酸组成,其中最长的来自台湾樟芝,为136个氨基酸,与其他真菌来源的免疫调节蛋白的同源性低于20%。除了来自台湾樟芝的免疫调节蛋白外,银耳中发现的免疫调节蛋白与其他真菌来源的免疫调节蛋白的同源性甚至更低,约为10.0%。其他真菌来源的免疫调节蛋白的同源性为44.5%~100%,其中赤灵芝与松杉灵芝来源的免疫球蛋白的氨基酸序列完全一致。在真菌的Ganoderma属中,其他物种来源的氨基酸同源性为80.2%~86.5%。除了LZ-8外,叶波平等[16]从赤灵芝中分离到3种具有促进淋巴细胞增殖活性的蛋白质,但其分子量远大于LZ-8;这也表明灵芝中存在多种与免疫调节相关的生物活性物质。因此,据此推测来源于台湾樟芝和云芝中的真菌免疫调节蛋白可能与其他真菌中来源的免疫调节蛋白不属于同一个家族。Pushparajah等[17]报道了Lignosusrhinocerotis中的真菌免疫调节蛋白FIP-lrh,它与LZ-8的同源性最高,为64%。
2 真菌免疫调节蛋白的结构
目前已发现的大部分真菌免疫调节蛋白具有较高的同源性,因此其蛋白质的一级结构非常相似。在氨基酸组成上,除了台湾樟芝和云芝外,源自其他真菌的免疫调节蛋白不含组氨酸(His)、半胱氨酸(Cys)和甲硫氨酸(Met),但是却富含天冬氨酸(Asp)和缬氨酸(Val),并且其中的28个氨基酸完全相同,其中FDYTP 5个氨基酸残基高度保守。在已发现的真菌免疫调节蛋白中,LZ-8为糖蛋白,其他均不含糖。经过凝胶过滤与层析纯化后的LZ-8含糖量为1.3%,再经过高效液相色谱纯化后,其含糖量降至0.6%,仅检测到少量的甘露糖与氨基己糖[1]。
LZ-8是第1个被发现的真菌免疫调节蛋白,Tanaka等[2]发现LZ-8与几种免疫球蛋白重链的可变区具有一定的同源性,如鼠的AVMS67和A1MS47、人的G1HUHL,甚至还包括低等脊椎动物金鱼的G6A。在NBRF数据库中,LZ-8与AVMS67(鼠IgA重链的可变区)的同源性最高,AVMS67、 A1MS47、G1HUHL、G6A与LZ-8中28%的氨基酸完全相同,其中11%的氨基酸残基非常保守,主要包括Tyr/Phe、Ser/Thr、Lys/Arg、Asp/Glu、Ile/Leu或Val。
由于氨基酸组成的高度同源,因此真菌免疫调节蛋白也应该具有类似的二级结构与高级结构。Tanaka等[2]也对LZ-8的二级结构进行了分析,发现其富含β-折叠,对其二级结构的预测发现LZ-8可能含有7个β-折叠。Lin等[7]也对松杉灵芝中FIP-gts的二级结构进行了预测,结果表明其二级结构包括2个α-螺旋、7个β-折叠以及1个β-转角(图1)。Zhou等[10]推测紫芝中FIP-gsi的二级结构与FIP-gts相似,包括2个α-螺旋、7个β-折叠以及1个β-转角。Pushparajah等[17]推测FIP-lrh的二级结构至少包括1个α-螺旋与7个β-折叠。Ko等[5,18]发现金针菇免疫调节蛋白FIP-fve与LZ-8和FIP-gts有相似的二级结构,由3个α-螺旋、6个β-折叠以及1个β-转角组成,不同的是FIP-gts 3’端的β-折叠在FIP-fve中变成了α-螺旋。Lin等[7]利用酵母双杂交和点突变的方法研究发现,真菌免疫调节蛋白N端约10个氨基酸的α-螺旋结构对二聚体的形成以及其识别靶细胞表面受体发挥生物学功能至关重要。将真菌免疫调节蛋白与免疫球蛋白A重链可变区的二级结构进行比较,发现二者在相似的区域形成β-折叠,只是后者可形成9个β-折叠。
2003年,Seow等[19]采用悬滴法获得了金针菇真菌免疫调节蛋白FIP-fve的晶体,并用X-射线对其晶体结构进行了分析,发现其为二聚体结构。2003年,Paaventhan等[20]对金针菇真菌免疫调节蛋白的结构进行了研究,利用NaBr渗透对该蛋白进行单项不规则晶体衍射,进一步证实了FIP-fve为二聚体结构,其分子结构类似“哑铃型”。研究发现,2个单体各自N端的α-螺旋(HA和HB)通过疏水作用结合到一起,分别与之邻近的2个反向平行的β-折叠结构(SA和SB)通过氢键结合到一起形成了β片层。每个单体中的其他β-折叠依靠分子间的氢键形成β片层,图2中的E-B-A形成1个片层,G-F-C-C’形成另一个片层,与免疫球蛋白样折叠(Ig-like fold)相似,被称为FNⅢ型折叠。该折叠是一种7个β折叠-s型与8个β折叠-h型的中间过渡结构。这种结构又被称为“假-h型拓扑结构”构型,这种构型广泛存在于很多功能蛋白质中,却是首次在真菌免疫调节蛋白中被发现。真菌免疫调节蛋白的N端大部分是疏水氨基酸,还不存在半胱氨酸,而不能形成二硫键,因此疏水作用是维持2个单体N端的α螺旋形成二聚体的主要作用力。2009年,Huang等[21]分析了赤灵芝中LZ-8的晶体结构,发现其也是由2个单体形成的同源二聚体,与FIP-fve的FNIⅡ型折叠类似,β折叠A-B-E与G-F-C-D分别形成2个片层。2007年,Wu等[4]研究发现小孢子灵芝中的真菌免疫调节蛋白FIP-gmi的晶体结构为同源四聚体(图3)。

图1 FIP-gts(B)[7]的氨基酸序列与二级结构Fig.1 Amino acid sequences and the secondary structure of FIP-gts(B)
3 真菌免疫调节蛋白的生物学功能
3.1 凝集血红细胞 迄今为止,已研究的几种真菌免疫调节蛋白都可以凝集哺乳动物的血红细胞,并且凝集能力一般较强,低浓度的蛋白就可以产生明显的凝集效果。虽然每种真菌免疫调节蛋白凝集血细胞的活性不具有种属特异性,但也具有选择性,并不是每种真菌免疫调节蛋白可以凝集所有动物的红细胞。Kino等[1]研究发现从菌丝体中分离纯化的天然LZ-8可以凝集绵羊血红细胞,最小凝集浓度为6.25 μg/mL。Liang等[22]在巴斯德毕赤酵母(Pichiapastoris)中重组表达了LZ-8,发现其能凝集绵羊血红细胞,最小凝集浓度为12.5 μg/mL。Xue等[23]研究发现10.0 μg/mL的重组表达LZ-8才可以凝集小鼠血红细胞。Lin等[24]研究发现3.13 μg/mL重组表达的LZ-8就能凝集绵羊血红细胞。但是,天然的LZ-8与重组表达的LZ-8均不能凝集人的4种血细胞。低剂量的FIP-vvo就可以凝集大鼠(0.52 μg/mL)、小鼠(1.10 μg/mL)和兔(0.13 μg/mL)的血红细胞,但不能凝集人的血红细胞[6]。然而,Ko等[5,18]研究发现FIP-fve(大于2.00 μg/mL)可以凝集人的血红细胞。Pushparajah等[17]研究发现0.34 μmol/L原核表达的FIP-lrh可以凝集人和小鼠的血红细胞。Li等[13]原核重组表达了褐腐菌的真菌免疫调节蛋白FIP-ppl,发现64 μg/mL的表达产物能够凝集兔子的血红细胞,但高浓度的FIP-ppl也不能凝集人的血红细胞。一般而言,一些简单的寡糖或糖复合物可以抑制凝集素的血细胞凝集活性,但却不能抑制真菌免疫调节蛋白的[6],表明这2种蛋白凝集血红细胞的机制应该不同,据此推测真菌免疫调节蛋白可能特异的识别比多糖更为复杂的寡糖连[25]。

图2 FIP-fve(A)[19]与LZ-8[21](B)的晶体结构Fig.2 The crystal structure of FIP-fve(A)and LZ-8(B)
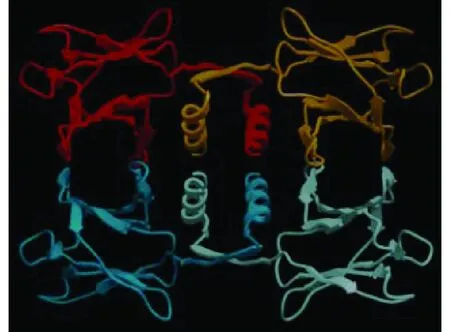
图3 FIP-gmi晶体的四聚体结构[4]Fig.3 The tetramer structure of Fip-gmi crystal
3.2 促进淋巴细胞增殖 研究发现,真菌免疫调节蛋白可以促进小鼠脾细胞和人外周血淋巴细胞的有丝分裂。Kino等[1]在培养的鼠脾细胞中加入LZ-8,然后以放射性同位素[3H]的增加来检测鼠脾细胞的增殖情况,发现[3H]随着LZ-8量的增加而增加,表明LZ-8可以促进鼠脾细胞的有丝分裂。当LZ-8的量达到3.13 μg/mL,鼠脾细胞的增殖达到最大,随着LZ-8量的进一步增加,鼠脾细胞的增殖反而下降,表明LZ-8促进脾细胞的有丝分裂呈现出剂量效应。重组表达的LZ-8也具有促进鼠脾细胞增殖的作用[23-24]。Hsu等[6]采用放射性同位素[3H]的方法证实FIP-vvo可以促进人外周血淋巴细胞的增殖,促进人外周淋巴细胞增殖的最大浓度为5.0 μg/mL。Ko等[5]研究发现FIP-fve促进人外周血淋巴细胞的增殖效果不如LZ-8和FIP-vvo,当其浓度为100.0 μg/mL时最能促进人外周淋巴细胞的增殖。Wang等[26]研究发现,高浓度的FIP-fve可以促进人外周血淋巴细胞的有丝分裂,促进细胞周期从G1/G0期向S期的转化。Li等[13]研究发现2.0 μg/mL的FIP-ppl可以最大程度促进鼠脾细胞的增殖。Haak-Frendscho等[27]和van der Hem等[28]研究LZ-8对人外周淋巴细胞增殖的促进机制,发现LZ-8先是激活巨噬细胞和T淋巴细胞诱导产生产生细胞因子和α肿瘤坏死因子,这些因子进而会促进人外周淋巴细胞的增殖。
3.3 抗过敏与Arthus反应 小鼠的活体试验表明,真菌免疫调节蛋白可以抑制其系统过敏与Arthus反应。当给小鼠经皮下或腹腔注射牛血清蛋白使其致敏,对照组小鼠均出现过敏反应,而注射了LZ-8和FIP-fve的试验组小鼠均不表现出过敏症状,表明这2种真菌免疫调节蛋白具有完全抑制过敏反应的作用[1,5]。然而,Hsu等[6]发现注射了FIP-vvo的试验组小鼠大部分出现了过敏症状,抑制过敏反应的作用不如LZ-8和FIP-fve。当用牛血清蛋白或48/80复合物注射小鼠的足垫,小鼠就会发生Arthus反应而足垫出现水肿。当再给小鼠的足垫注射以上3种真菌免疫调节蛋白后,小鼠足垫的水肿就会减弱,表明真菌免疫调节蛋白可以减弱Arthus反应[1,5-6]。Kino等[29]用乙肝病毒的表面抗原免疫小鼠,同时给小鼠腹腔注射LZ-8,发现LZ-8可以抑制小鼠产生抗体,因此认为这是LZ-8抑制系统过敏与Arthus反应的原因。Hsu等[6]研究发现,与LZ-8和FIP-fve诱导Th1产生IFN-γ与IL-2相比,FIP-vvo不仅可以诱导Th1产生IFN-γ与IL-2,而且可以诱导Th2产生IL-4,而IL-4进一步促进B淋巴细胞增殖与分化,最终释放IgE。这也解释了FIP-vvo不能有效抑制过敏与Arthus反应的原因。Hsieh等[30]发现口服FIP-fve可以抑制小鼠因食用卵清蛋白而引起的过敏反应。Liu等[31]研究发现FIP-fve可以抑制羽刺皮癣螨2型抗原引起的呼吸道炎症。
3.4 抗肿瘤作用 药用真菌具有显著的抗肿瘤作用,并且发现真菌中提取的混合蛋白可以有效抑制肿瘤,因此药用真菌越来越得到学者们的重视[32]。近年来研究表明,真菌免疫调节蛋白具有良好的抗肿瘤作用,受到越来越多的关注,而且发现其抗肿瘤的机制具有多样性。
2006年,Chang等[33]报道给患肝癌的小鼠口服FIP-fve表现出明显的抗肿瘤作用,抑制肿瘤的生长,明显延长了其寿命,其机制是通过激活机体的特异性与非特异性免疫应答,进而增强巨噬细胞和腹腔细胞对肿瘤细胞的杀伤能力。Li等[13]研究发现FIP-ppl可以诱导胃癌细胞MGC823与肝癌细胞HepG2的凋亡,进而发挥其抗肿瘤的作用。
在真菌免疫调节蛋白抗肿瘤方面,Liao等[34]研究发现原核重组表达的FIP-gts可以抑制人肺癌细胞A549的生长,其机制可能是c-myc转录因子结合在人端粒酶逆转录酶的启动子上,抑制其转录进而抑制逆转录酶的表达,从而发挥其抗肿瘤的作用。2007年,Liao等[35]研究发现FIP-gts进入细胞后定位在内质网从而诱导内质网应激,引起钙离子的释放而激活钙离子依赖的信号通路,抑制人端粒酶逆转录酶从细胞核进入细胞质进而抑制端粒酶活性。2008年,Liao等[36]发现原核重组表达的FIP-gts可以阻止A549的细胞周期,使其停滞在G1期,进而降低细胞的生长和表现出抗肿瘤活性。2014年,Li等[37]研究发现FIP-gts可以促进顺铂耐药的尿路上皮癌细胞发生自噬。此外,Wang等[38]研究发现人1型非转移性克隆23基因与FIP-gts协同作用可增强其对癌细胞迁移的抑制作用。
Lin等[24]研究发现酵母中重组表达的LZ-8对人类白血病NB4具有明显的杀伤作用,当其浓度为16.0 μg/mL时起抑制作用,抑制率为38.5%,表现出一定的抗癌活性,其机制为引起细胞发生凋亡。2011年,Wu等[39]研究发现重组的LZ-8使细胞周期在G1期停止并阻止细胞的生长;此外,重组的LZ-8还可以抑制移植Lewis肺癌细胞小鼠的癌细胞的生长。这些研究表明,重组表达的LZ-8在体内试验与体外试验中均能抑制癌细胞的生长,其机制为LZ-8引起核糖体应激促进p53的表达,p53又抑制细胞周期的进行使细胞停滞在G1期。Liang等[40]研究发现重组表达的LZ-8可以引起人胃癌细胞SGC-7901的自噬,其机制为LZ-8引起细胞内质网应激和激活ATF4-CHOP途径,进一步激活泛素/蛋白酶体内质网相关蛋白降解系统,从而引起细胞发生自噬,并且该自噬反应不依赖含半胱氨酸的天冬氨酸蛋白水解酶。Cong等[41]研究发现10.0 μg/mL 的LZ-8就能诱导人星形胶质瘤细胞U-251的凋亡,并且抑制其细胞周期从G1期到S期的转化,因此LZ-8表现出抗人星形胶质瘤细胞U-251的生物学活性。
2010年,Lin等[42]研究发现FIP-gmi可以抑制表皮生长因子介导的EGFR和AKT信号通路的磷酸化与激活、Cdc42 GTPase的激活和微丝解聚,进而抑制A549细胞的迁移和侵袭;同时,Lin等[43]也发现FIP-gmi可以下调肿瘤坏死因子α介导的基质金属蛋白酶9的表达,进而抑制A549细胞的迁移和侵袭。Hsin等[44-45]研究发现,无论在体内试验还是体外试验中,FIP-gmi均可以诱导肺癌细胞发生自噬而引起细胞死亡。Chiu等[46]研究发现,FIP-gmi通过抑制Akt-mTOR-p70S6K 细胞信号通路而诱导多重耐药肺癌细胞的自噬。然而,Hsin等[47]在肺癌细胞中研究发现FIP-gmi引起的细胞自噬可以增强顺铂诱导癌细胞的凋亡。
3.5 其他生物学功能 除了生物学活性外,Kino等[48]发现灵芝真菌免疫调节蛋白LZ-8可以抑制自主免疫性糖尿病的发生,腹腔注射LZ-8试验小鼠的胰腺没有炎症并且分泌胰岛素的细胞数量正常,然而未经LZ-8处理的对照组小鼠表现出胰腺炎和分泌胰岛素的细胞数量减少,并且表现出糖尿病临床症状。van der Hem等[28,49]研究发现LZ-8可以增加异体皮肤移植小鼠的存活时间。此外,还发现LZ-8可以延缓胰脏移植排斥反应的发生和延长该小鼠的存活期,持续地给小鼠使用LZ-8可以进一步延长其生存时间,且不会产生毒副作用。
Wang等[26]研究发现,真菌免疫调节蛋白FIP-fve能够诱导人外周血淋巴细胞黏附分子-1(ICAM-1)的表达,适量的FIP-fve对ICAM-1的产生有明显的促进作用,呈现出剂量依赖关系。Miyasaka等[50]研究发现LZ-8主要选择性地提高U937细胞系CD11b的表达,并且存在剂量依赖性;LZ-8可以诱导血管内皮细胞ICAM-1的表达,显著增强IFN-r诱导的血管内皮细胞和U937细胞的相互黏合;可以选择性地促进MOLT4细胞上CD2的表达;促进人T细胞与羊血红细胞的玫瑰花结的形成。因此,LZ-8可以通过调节黏附分子的表达而促进细胞间的相互作用。
4 展望
药用、食用真菌在我国民间的应用已有1 000多年,在其他一些亚洲国家其相关的应用也有悠久的历史,但对其研究大多停留在多糖以及一些小分子次生代谢物上,虽然也有一些应用于临床的案例,但并不广泛。随着分子生物学和生物工程技术的飞速发展,利用药用、食用真菌培养获得大量重组免疫调节蛋白的研究取得了较好的进展。此外,学者已经对真菌免疫调节蛋白的结构和功能进行了深入研究,这将为有效利用真菌资源探索能提高人体免疫力的功能食品和新型免疫调节蛋白药物奠定了基础。利用基因工程手段可以大量获得真菌免疫调节蛋白,发现其与天然分离纯化的蛋白不仅具有相似的结构而且还表现出相似的生物学功能,因此利用基因工程获得真菌免疫调节蛋白是一种重要手段和发展的必然趋势。因此,利用重组表达的真菌免疫调节蛋白,深入研究其功能及作用机制是今后真菌免疫调节蛋白的重要研究方向之一。与此同时,真菌免疫调节蛋白在临床方面的开发与利用应该得到关注,这也是研究真菌免疫调节蛋白功能的初衷。参考文献
[1] KINO K,YAMASHITA A,YAMAOKA K,et al.Isolation and characterization of a new immunomodulatory protein,ling zhi-8(LZ-8),fromGanodermalucidium[J].Journal of biological chemistry,1989,264(1):472-478.
[2] TANAKA S,KO K,KINO K,et al.Complete amino acid sequence of an immunomodulatory protein,ling zhi-8(LZ-8).An immunomodulator from a fungus,Ganodermalucidium,having similarity to immunoglobulin variable regions[J].Journal of biological chemistry,1989,264(28):16372-16377.
[3] MURASUGI A,TANAKA S,KOMIYAMA N,et al.Molecular cloning of a cDNA and a gene encoding an immunomodulatory protein,Ling Zhi-8,from a fungus,Ganodermalucidum[J].Journal of biological chemistry,1991,266(4):2486-2493.
[4] WU M Y,HSU M F,HUANG C S,et al.A 2.0 Å structure of GMI,a member of the fungal immunomodulatory protein family fromGanodermamicrosporum[J].Protein crystallogr,2007,2:132.
[5] KO J L,HSU C I,LIN R H,et al.A new fungal immunomodulatory protein,FIP-fve isolated from the edible mushroom,Flammulinavelutipesand its complete amino acid sequence[J].European journal of biochemistry,1995,228(2):244-249.
[6] HSU H C,HSU C I,LIN R H,et al.Fip-vvo,a new fungal immunomodulatory protein isolated fromVolvariellavolvacea[J].Biochemical journal,1997,323(Pt2):557-565.
[7] LIN W H,HUNG C H,HSU C I,et al.Dimerization of the N-terminal amphipathic α-helix domain of the fungal immunomodulatory protein fromGanodermatsugae(Fip-gts)defined by a yeast two-hybride system and site-directed mutagenesis[J].Journal of biological chemistry,1997,272(32):20044-20048.
[8] 林景卫,段作文,关山越,等.树舌灵芝免疫调节蛋白基因克隆,生物信息学分析及真核表达载体构建[J].沈阳农业大学学报,2016,47(1):1-7.
[9] 苏恺琪,王雪飞,周选围.黑灵芝免疫调节蛋白基因的克隆和生物信息学分析[J].上海交通大学学报(农业科学版),2012,30(1):65-71.
[10] ZHOU X W,XIE M Q,HONG F,et al.Genomic cloning and characterization of a FIP-gsi gene encoding a fungal immunomodulatory protein fromGanodermasinensisZhao et al.(Aphyllophoromycetideae)[J].International journal of medicinal mushrooms,2009,11(1):77-86.
[11] LI F,WEN H A,LIU X Z,et al.Gene cloning and recombinant expression of a novel fungal immunomodulatory protein fromTrametesversicolor[J].Protein expression and purification,2012,82(2):339-344.
[12] 林景卫,关山越,钟鸣,等.血红铆钉菇免疫调节蛋白基因克隆及其生物信息学分析和重组表达[J].沈阳农业大学学报,2015,46(5):561-567.
[13] LI S Y,SHI L J,DING Y,et al.Identification and functional characterization of a novel fungal immunomodulatory protein fromPostiaplacenta[J].Food and chemical toxicology,2015,78:64-70.
[14] SHEU F,CHIEN P J,HSIEH K Y,et al.Purification,cloning,and functional characterization of a novel immunomodulatory protein fromAntrodiacamphorata(bitter mushroom)that exhibits TLR2-dependent NF-κB activation and M1 polarization within murine macrophages[J].Journal of agricultural and food chemistry,2009,57(10):4130-4141.
[15] HUNG C L,CHANG A J,KUO X K,et al.Molecular cloning and function characterization of a new macrophage-activating protein fromTremellafuciformis[J].Journal of agricultural and food chemistry,2014,62(7):1526-1535.
[16] 叶波平,王庆华,周书进,等.灵芝蛋白质的分离及其免疫活性研究[J].药物生物技术,2002,9(3):150-152.
[17] PUSHPARAJAH V,FATIMA A,CHONG C H,et al.Characterisation of a new fungal immunomodulatory protein from tiger milk mushroom,Lignosusrhinocerotis[J].Scientific reports,2016,6:30010.DOI:10.1038/srep30010.
[18] KO J L,LIN S J,HSU C P,et al.Molecular cloning and expression of a fungal immunomodulatory protein,FIP-fve,fromFlammulinavelutipes[J].Journal of the formosan medical association,1997,96(7):517-524.
[19] SEOW S V,KUO I C,PAAVENTHAN P,et al.Crystallization and preliminary X-ray crystallographic studies on the fungal immunomodulatory protein Fve from the golden needle mushroom(Flammulinavelutipes)[J].Acta crystallographica section D,2003,59(8):1487-1489.
[20] PAAVENTHAN P,JOSEPH J S,SEOW S V,et al.A 1.7Å structure of Fve,a member of the new fungal immunomodulatory protein family[J].Journal of molecular biology,2003,332(2):461-470.
[21] HUANG L,SUN F,LIANG C Y,et al.Crystal structure of LZ-8 from the medicinal fungusGanodermalucidium[J].Proteins structure function and bioinformatics,2009,75(2):524-527.
[22] LIANG C Y,ZHANG S Q,LIU Z Y,et al.Ganodermalucidumimmunomodulatory protein(LZ-8) expressed inPichiapastorisand the identification of immunocompetence[J].Chinese journal of biotechnology,2009,25(3):441-447.
[23] XUE Q,DING Y X,SHANG C H,et al.Functional expression of LZ8,a fungal immunomodulatory protein fromGanodermalucidiuminPichiapastoris[J].Journal of general and applied microbiology,2008,54(6):393-398.
[24] LIN J W,HAO L X,XU G X,et al.Molecular cloning and recombinant expression of a gene encoding a fungal immunomodulatory protein fromGanodermaluciduminPichiapastoris[J].World journal of microbiology and biotechnology,2009,25(3):383-390.
[25] 林景卫,孙非,张韧,等.真菌免疫调节蛋白的研究进展[J].中国免疫学杂志,2005,21(6):477-480.
[26] WANG P H,HSU C I,TANG S C,et al.Fungal immunomodulatory protein fromFlammulinavelutipesinduces interferon-gamma production through p38 mitogen-activated protein kinase signaling pathway[J].Journal of agricultural and food chemistry,2004,52(9):2721-2725.
[27] HAAK-FRENDSCHO M,KINO K,SONE T,et al.Ling Zhi-8:A novel T cell mitogen induces cytokine production and upregulation of ICAM-1 expression[J].Cellular immunology,1993,150(1):101-113.
[28] VAN DER HEM L G,VAN DER VLIET J A,BOCKEN C F,et al.Ling Zhi-8:Studies of a new immunomodulating agent[J].Transplantation,1995,60(5):438-443.
[29] KINO K,SONE T,WATANABE J,et al.Immunomodulator,LZ-8,prevents antibody production in mice[J].International journal of immunopharmacology,1991,13(8):1109-1115.
[30] HSIEH K Y,HSU C I,LIN J Y,et al.Oral administration of an edible-mushroom-derived protein inhibits the development of food-allergic reactions in mice[J].Clinical and experimental allergy,2003,33(11):1595-1602.
[31] LIU Y H,KAO M C,LAI Y L,et al.Efficacy of local nasal immunotherapy for Dp2-induced airway inflammation in mice:Using Dp2 peptide and fungal immunomodulatory peptide[J].Journal of allergy and clinical immunology,2003,112(2):301-310.
[32] SULLIVAN R,SMITH J E,ROWAN N J.Medicinal mushrooms and cancer therapy:Translating a traditional practice into Western medicine[J].Perspectives in biology and medicine,2006,49(2):159-170.
[33] CHANG H H,SHEU F.Anti-tumor mechanisms of orally administered a fungal immunomodulatory protein fromFlammulinavelutipesin mice[J].FASEB Journal,2006,20(5):1057.
[34] LIAO C H,HSIAO Y M,HSU C P,et al.Transcriptionally mediated inhibition of telomerase of fungal immunomodulatory protein fromGanodermatsugaein A549 human lung adenocarcinoma cell line[J].Molecular carcinogenesis,2006,45(4):220-229.
[35] LIAO C H,HSIAO Y M,SHEU G T,et al.Nuclear translocation of telomerase reverse transcriptase and calcium signaling in repression of telomerase activity in human lung cancer cells by fungal immunomodulatory protein fromGanodermatsugae[J].Biochemical pharmacology,2007,74(10):1541-1554.
[36] LIAO C H,HSIAO Y M,LIN C H,et al.Induction of premature senescence in human lung cancer by fungal immunomodulatory protein fromGanodermatsugae[J].Food and chemical toxicology,2008,46(5):1851-1859.
[37] LI J R,CHENG C L,YANG W J,et al.FIP-gts potentiate autophagic cell death against cisplatin-resistant urothelial cancer cells[J].Anticancer research,2014,34(6):2973-2983.
[38] WANG P H,YANG S F,CHEN G D,et al.Human nonmetastatic clone 23 type 1 gene suppresses migration of cervical cancer cells and enhances the migration inhibition of fungal immunomodulatory protein fromGanodermatsugae[J].Reproductive sciences,2007,14(5):475-485.
[39] WU C T,LIN T Y,HSU H Y,et al.Ling Zhi-8 mediates p53-dependent growth arrest of lung cancer cells proliferation via the ribosomal protein S7-MDM2-p53 pathway[J].Carcinogenesis,2011,32(12):1890-1896.
[40] LIANG C Y,LI H R,ZHOU H,et al.Recombinant Lz-8 fromGanodermaluciduminduces endoplasmic reticulum stress-mediated autophagic cell death in SGC-7901 human gastric cancer cells[J].Oncology reports,2012,27(4):1079-1089.
[41] CONG W R,XU H,LIU Y,et al.Production and functional characterization of a novel fungal immunomodulatory protein FIP-SN15 shuffled from two genes ofGanodermaspecies[J].Applied microbiology and biotechnology,2014,98(13):5967-5975.
[42] LIN C H,SHEU G T,LIN Y W,et al.A new immunomodulatory protein fromGanodermamicrosporuminhibits epidermal growth factor mediated migration and invasion in A549 lung cancer cells[J].Process biochemistry,2010,45(9):1537-1542.
[43] LIN C H,HSIAO Y M,OU C C,et al.GMI,aGanodermaimmunomodulatory protein,down-regulates tumor necrosis factor α-induced expression of matrix metalloproteinase 9 via NF-κB pathway in human alveolar epithelial A549 cells[J].Journal of agricultural and food chemistry,2010,58(22):12014-12021.
[44] HSIN I L,OU C C,WU T C,et al.GMI,an immunomodulatory protein fromGanodermamicrosporum,induces autophagy in non-small cell lung cancer cells[J].Autophagy,2011,7(8):873-882.
[45] HSIN I L,SHEU G T,JAN M S,et al.Inhibition of lysosome degradation on autophagosome formation and responses to GMI,an immunomodulatory protein fromGanodermamicrosporum[J].British journal of pharmacology,2012,167(6):1287-1300.
[46] CHIU L Y,HU M E,YANG T Y,et al.Immunomodulatory protein fromGanodermamicrosporuminduces pro-death autophagy through Akt-mTOR-p70S6K pathway inhibition in multidrug resistant lung cancer cells[J].PLoS One,2015,10(5):63-64.
[47] HSIN I L,OU C C,WU M F,et al.GMI,an immunomodulatory protein fromGanodermamicrosporum,potentiates cisplatin-induced apoptosis via autophagy in lung cancer cells[J].Molecular pharmaceutics,2015,12(5):1534-1543.
[48] KINO K,MIZUMOTO T,SONE T,et al.An immunomodulating protein,Ling Zhi-8(LZ-8)prevents insulitis in non-obese diabetic mice[J].Diabetologia,1990,33(12):713-718.
[49] VAN DER HEM L G,VAN DER VLIET J A,BOCKEN C F,et al.Prolongation of allograft survival with Ling Zhi-8,a new immunosuppressive drug[J].Transplantation proceedings,1994,26(2):746.
[50] MIYASAKA N,INOUE H,TOTSUKA T,et al.An immunomodulatory protein,Ling Zhi-8,facilitates cellular interaction through modulation of adhesion molecules[J].Biochemical and biophysical research communications,1992,186(1):385-390.
Advances of Research on the Structure and Function of Fungal Immunomodulatory Proteins
TIE Wei-fang1, JIA Jun-zhong2, GUO Wen-ping3
(1. Department of Medicine, Hetao University, Bayannur, Inner Mongolia 015000; 2. Inner Mongolia Bayannur City Hospital, Bayannur, Inner Mongolia 015000; 3. College of Veterinary Medicine, Northwest A&F University, Yangling, Shaanxi 712100)
Fungal immunomodulatory proteins(FIPs)is a kind of low molecular weight proteins with many biological functions. The sequence character and structure of FIPs were introduced, and the latest research progress on its biological functions were reviewed. Finally,its development trend in the future was forecasted.
Fungal immunomodulatory protein;Structure;Biological functions
帖卫芳(1984- ),女,山西大同人,讲师,硕士,从事生物化学与分子生物学研究。
2016-11-18
Q 949.32;R 392
A
0517-6611(2016)35-0020-05
