印度梨形孢通过激活抗氧化物酶活性及诱导P5CS基因表达提高紫花苜蓿耐盐性
2017-01-07王晓阳齐树亭
李 亮,陈 希,王 奋,王晓阳,齐树亭
(河北工业大学 海洋科学与工程学院,天津 300130)
印度梨形孢通过激活抗氧化物酶活性及诱导P5CS基因表达提高紫花苜蓿耐盐性
李 亮,陈 希,王 奋,王晓阳,齐树亭
(河北工业大学 海洋科学与工程学院,天津 300130)
印度梨形孢能广泛促进植物生长,增强植物对生物及非生物胁迫的抵抗性.然而其作用机制还知之甚少.本研究通过分析不同盐浓度胁迫下紫花苜蓿的生物产量以及体内丙二醛含量、抗氧化物酶活性、电导率以及吡咯啉-5-羧基合成酶基因(P5CS基因)的表达,揭示盐害胁迫下,印度梨形孢对紫花苜蓿的生长调节机制.实验表明紫花苜蓿是印度梨形孢良好的寄主,并能显著促进紫花苜蓿的生长.与未侵染组相比,印度梨形孢定殖能缓解盐害对植物造成的损伤,提高产量.生理生化实验表明印度梨形孢定殖可显著激活植物体内抗氧化物酶活性、有效降低丙二醛含量以及降低根部电导率.分子生物学实验表明该真菌可诱导脯氨酸合成酶基因(P5CS)的表达增强紫花苜蓿的耐盐害能力.
印度梨形孢;紫花苜蓿;抗氧化物酶;耐盐性
0 引言
印度梨形孢(Piriformospora indica)是担子菌纲(Basidiomycota)腊壳耳目(Sebacinales)的一种能够定殖在多种植物根部的内生真菌[1-2].印度梨形孢具有广泛的宿主,并且能有效促进宿主植物的生长发育[3-7].另外,研究表明印度梨形孢定殖可增强植物对生物及非生物胁迫的抵御能力并诱导植物的系统抗性[8-10].然而,印度梨形孢介导的植物产量提高和抗性增强机制还有待于深入挖掘和阐明.
本研究发现紫花苜蓿是印度梨形孢良好的宿主.盐害胁迫下,印度梨形孢能显著增加紫花苜蓿的产量.紫花苜蓿作为首选优良草种,具有极强的科研价值.苜蓿草生物学的农业和生态方面表现为和土壤中各种微生物如根际细菌和菌根真菌的互作能力.然而,这种互作关系会受到土壤中盐害的影响.对与土壤中的盐胁迫,苜蓿草比根际微生物更加敏感[11].盐胁迫会影响根际微生物的定殖和早期的侵染[12];另外,盐胁迫会影响根际类细菌膜结构从而影响固氮过程[13].尽管印度梨形孢和植物的互作机制与菌根真菌[14]以及根际细菌[15]有很多相似的地方,然而目前对印度梨形孢介导的植物生长调节机制的研究成果还相对甚少.
实验中首先明确印度梨形孢可在紫花苜蓿根部定殖,通过检测抗氧化物酶活性、丙二醛含量,植物根部电导率以及P5CS基因的表达等生理生化以及分子生物学指标,探讨了印度梨形孢提高紫花苜蓿耐盐的分子机制.
1 材料与方法
1.1 材料
紫花苜蓿(Medicago sativa)种子和印度梨形孢(Piriformospora indica)分别由中国科学院上海生命科学研究院植物生理生态研究所王彦章博士和德国吉森大学植物病理研究所(Instituteof Pathology and Applied Zoology,IPAZ,Giessen)Karl-Heinz Kogel教授惠赠.
1.2 方法
1.2.1 印度梨形孢的培养和菌丝体的收集
将P.indica接种到完全培养基上[16],保持25℃黑暗培养3周.从已经大量繁殖后的完全培养基上收集P.indica.在培养基上倒入少量表面活性剂(0.05%的吐温20),用扁铲或三角棒平放在培养基上轻转培养基获取菌体悬液,在离心机上以4 000 r/m in,离心10m in,除去菌丝体和培养基碎片用吐温20冲洗培养基表面,反复3~4次,离心,获得孢子菌液;血球计数板计数使细胞密度达到4×104个/m L.
1.2.2 紫花苜蓿种子的处理
种子用温水泡30m in,75%酒精震荡60 s,消毒,用灭菌的蒸馏水冲洗几次,再置于10%次氯酸钠中浸泡致使种子破皮,将处理好的无菌紫花苜蓿种子种入配置好的富集培养基[17]中,置于培养箱内,24℃,16h光周期;18℃,8h暗周期.待种子萌发7 d后,用收集好的印度梨形孢孢子液侵染紫花苜蓿根部,将收集的P.indica接种到植物根部组织,接种方法见文献 [16].对照处理为不加菌丝体的培养基,印度梨形孢与紫花苜蓿根部共培养14 d后,发芽种子转移到蛭石珍珠岩2∶1的土壤中培养,以备用于盐胁迫实验的生理生化分析.
1.2.3 根样的染色与显微镜观察
植物和P.indica共生1周后,用台盼蓝进行根系染色,选取未侵染和已被P.indica侵染的紫花苜蓿根系,洗净后擦干水分,将植物根系置于洁净的平板内放入10%KOH适量进行软化,15m in后取出后无菌水冲洗,擦干水分,置于1mol/L溶液中进行酸化,10m in后取出置于事先配置好的0.02%台盼蓝溶液中过夜染色,要保证染色时间充足,取出后用50%乳酸酚脱色液(乳酸20 m L,苯酚20 m L,甘油40 m L,蒸馏水20 m L)脱色2 h,最后在相差显微镜下观察P.indica在根部的定殖情况及植物细胞内孢子形态,拍照并保存.
1.2.4 生物产量测定
印度梨形孢与紫花苜蓿共培养5周后,植物与P.indica共同培养5周后,对实验组和对照组植物的根长、根重和茎重分别进行测定.植物根部用蒸馏水洗净,分别进行称重统计.每个处理称取100株植物.实验重复3次.
1.2.5 盐胁迫实验
土壤中培养1个月后设置5个实验组及1个对照组,实验组分别加入不同浓度的NaCl5m L于植物根部:A组浓度为50mmol/L,B组浓度为100mmol/L,C组浓度为150mmol/L,D组浓度为175mmol/L,E组浓度为200mmol/L,对照组加同样5m L的无菌水.盐处理后的12 h、18 h、24 h收获紫花苜蓿根部组织用于分析盐胁迫下P.indica的生物学效应.
1.2.6 抗氧化物酶活性测定
粗酶液的制备:取0.2 g洗净的苜蓿草的根部,在研钵中,加入5m LPBS研磨成匀浆.将匀浆液全部转入离心管中,用PBS冲洗,并倒入离心管中至10m L,于4 000 r/m in条件下离心15m in,取上清液6m L于容器中,低温保存备用.过氧化氢酶、超氧化物歧化酶以及过氧化物酶活性测定参考文献 [19-20].
1.2.7 测定植物体内丙二醛含量测定
丙二醛含量测定方法参考试剂盒说明书(MDA assay Kit,Abcam).
1.2.8 植物根部电导率测定
取实验组和对照组的植物根部组织,先用自来水冲洗再用蒸馏水冲洗2~3次,吸干水分,分别称取待测鲜样0.1 g置于25m L比色管中加入10m L蒸馏水,盖上塞子室温下静置12 h,用电导率仪测定浸提液电导率记为R1,沸水浴30 m in,室温下冷却后震荡均匀,测定浸提液电导率记为R2,重复该过程3次.相对电导率可记为R1/R2×100%.
1.2.9 RNA提取、RT-PCR以及目的基因扩增
紫花苜蓿组织研磨后进行RNA的提取,方法参见文献 [17].RT-PCR体系及各物质含量参见鼎国RT-PCR试剂盒说明(产品编号:TER016-1).RT-PCR程序如表1.

表1 RT-PCR程序Tab.1 RT-PCR program
PCR体系及各物质含量参见鼎国PCR试剂盒说明(产品编号:TER016-2).PCR程序见表2.

表2 PCR程序Tab.2 PCR program
内参及引物序列如表3(由北京鼎国生物科技有限公司合成).

表3引物序列Tab.3 Primersequence
1.2.10 Northern分析
1.2.11 数据分析
采用EXCEL、MATLAB等软件对数据进行分析.
2 结果与分析
2.1 印度梨形孢定殖提高紫花苜蓿生物产量
印度梨形孢接种紫花苜蓿14 d后,可显著增加紫花苜蓿的生物产量(如图1a),而且经接种的紫花苜蓿根部主根和侧根含量明显多于未接种的(如图1b).发芽种子移栽到土壤后的10 d,印度梨形孢的促进效应更加明显(如图1c).菌根复合体经台盼蓝染色后,定殖于紫花苜蓿根部表面的孢子被染成蓝褐色,显微镜下发现印度梨形孢主要定殖于根的表皮细胞及细胞间隙中(如图1d).
2.2 印度梨形孢定殖增强紫花苜蓿对盐胁迫的耐受力
45 d苗龄的紫花苜蓿经持续的不同盐浓度的NaCl溶液(100mmol/L、175mmol/L、200mmol/L)处理7d后,发现接种印度梨形孢侵染的紫花苜蓿生长良好,而未经印度梨形孢侵染的植物出现不同程度的萎蔫,而经盐胁迫14 d后,未经接种的紫花苜蓿幼苗表现出生长迟滞,并伴随一定程度的早衰现象如泛黄,萎蔫,而经过印度梨形孢接种的则症状轻微,盐害效应明显减弱(图2a).通过对100株植物的生物量统计,数据表明接种印度梨形孢使根长分别提高51%、67%和65%(图2b);使茎鲜重分别提高97%、66.7%和157%(图2c);而在根鲜重上,接种印度梨形孢使茎鲜重分别提高57%,31%,24%(图2d)(P<0.01).

图1 印度梨形孢在紫花苜蓿根部的定殖Fig.1 Colonization of P.indica in the rootof Medicago sativa
2.3 盐胁迫下印度梨形孢定殖提高紫花苜蓿抗氧化物酶活性
有研究显示在印度梨形孢介导的植物对非生物胁迫的系统抗性中,过氧化氢酶扮演重要的角色[22-23].因此,我们感兴趣于盐害胁迫下,印度梨形孢是否会激活抗氧化物酶活性.实验结果显示在实施200 mmol/L的高盐胁迫后3 d,印度梨形孢的定殖在不同程度上诱导了紫花苜蓿体内的抗氧化物酶活性活性.接种印度梨形孢的植株其体内POD、SOD和CAT活性比未接种的分别提高了33%、25%和20%.这与之前在蒺藜苜蓿中的抗氧化物酶活性影响程度有所不同(如图3所示)[24].图3中,Control:空白对照;Piri:只加印度梨形孢;NaCl:200mmol/L的盐处理;Piri+NaCl:在加入印度梨形孢的蒺藜苜蓿根部实施200mmol/L的盐处理.
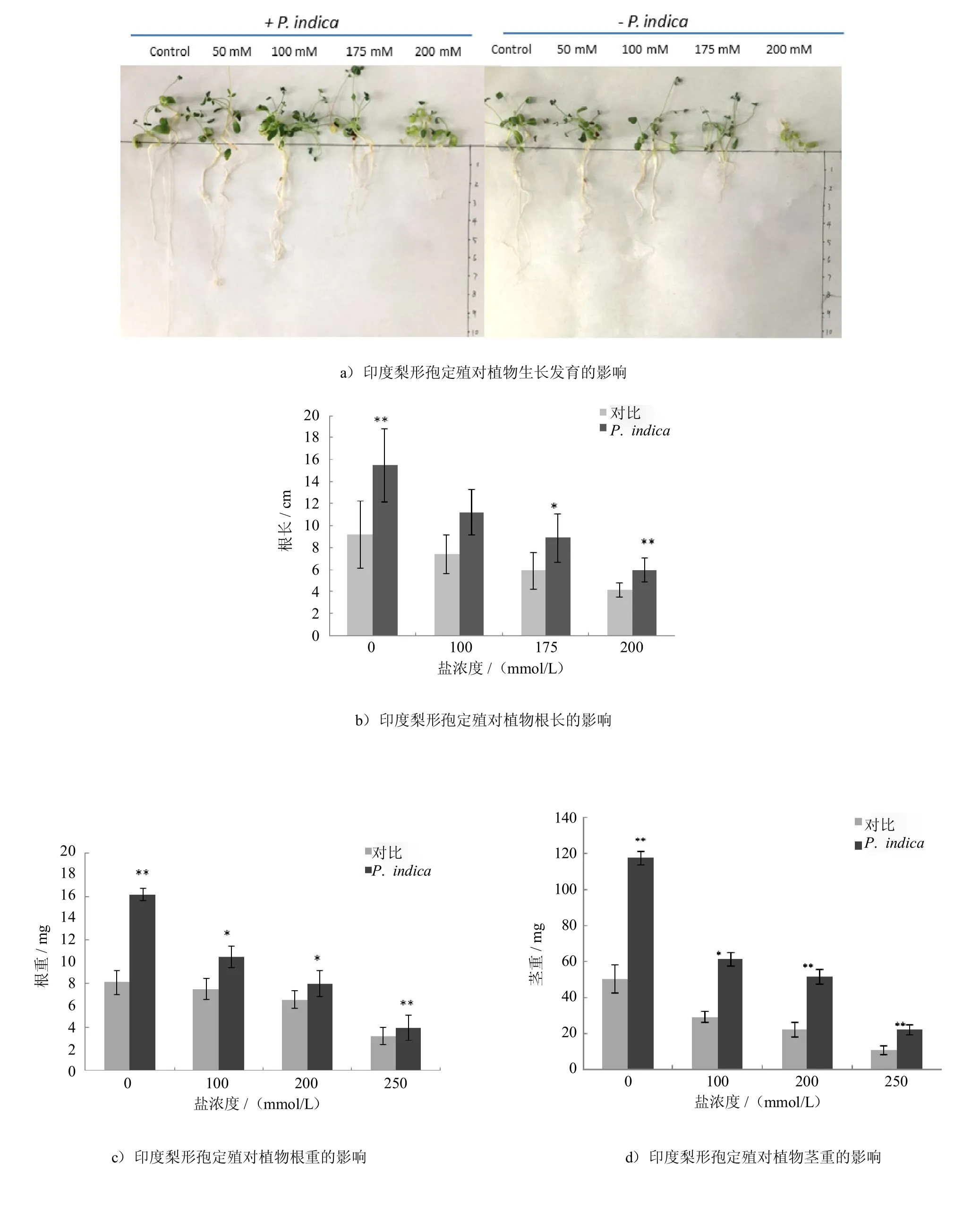
图2 盐胁迫下印度梨形孢定殖对紫花苜蓿生长的影响Fig.2 Effectof P.indica colonization on thebiomassof Medicago sativa under saltstress(**P<0.01,*P<0.05)

图3 盐胁迫下印度梨形孢定殖对紫花苜蓿抗氧化物酶活性的影响Fig.3 Effectof P.indica colonization on theantioxidantenzymeactivitiesof Medicago sativa under saltstress(**P<0.01)
2.4 盐胁迫下印度梨形孢定殖降低紫花苜蓿丙二醛含量
植物在受到逆境胁迫下,代谢产物丙二醛(malondialdehyde,MDA)含量会积累.MDA作为脂质过氧化产物,用来表征细胞膜脂过氧化作用程度和植物对逆境反应条件的强弱.实验中,比较了不同处理对紫花苜蓿根部丙二醛(MDA)含量变化的影响.结果显示,随着NaCl浓度的升高,MDA在紫花苜蓿根部的积累也逐渐加强,与对照相比,定殖有印度梨形孢的植株体内MDA含量明显低于未接种植株(如图4所示).该结果显示印度梨形孢定殖能减少盐害胁迫对细胞膜带来的伤害,表现为有效降低丙二醛的积累.

图4 盐胁迫下接种印度梨形孢对紫花苜蓿丙二醛含量的影响Fig.4 Effectof P.indica colonization on theMDA contentof Medicago sativa under saltstress
2.5 盐胁迫下印度梨形孢定殖降低紫花苜蓿根部电导率
当植物受到逆境胁迫时,细胞膜受破坏,其透性增大,胞内电解质渗出,增大了植物细胞浸提液的电导率.电导法已成为反应植物受逆境胁迫强弱程度的1个精确且实用的方法.实验中发现,在50 mmol/L、100mmol/L、175mmol/L、200mmol/L的盐胁迫条件下,与未定殖的对照组相比,印度梨形孢定殖的紫花苜蓿根部电导率分别下降了13%,25%,26%和34%(如图5所示).
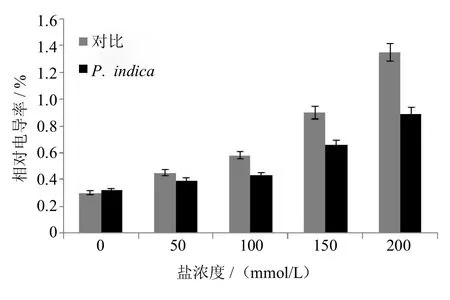
图5 盐胁迫下,印度梨形孢定殖对紫花苜蓿相对电导率的影响Fig.5 Effectof P.indica colonizationon the relativeelectricalconductivity(REC)of Medicago sativa under saltstress(**P<0.01)
2.6 盐胁迫下印度梨形孢定殖诱导吡咯啉-5-羧基合成酶基因(P5CS)表达
已完成的研究表明印度梨形孢可以提高紫花苜蓿体内脯氨酸含量[24].为了从分子水平阐明机制,检测了脯氨酸合成途径关键基因P5CS的表达.P5CS基因产物为吡咯啉-5-羧基合成酶,可催化谷氨酸最终生成脯氨酸,P5CS是脯氨酸合成过程中的重要酶.利用RT-PCR技术对P5CS基因的转录水平进行半定量分析.结果显示:正常条件下,紫花苜蓿中P5CS基因表达量很低(图6a)、图6b)、Conc、Piri泳道).当受到盐害胁迫(200mmol/L)12 h后,P5CS基因在定殖印度梨形孢的紫花苜蓿中表达量明显高于未定殖的对照组(图6a);当盐处理18 h后,半定量PCR显示P5CS基因表达量依然高于对照组(图6b).核酸杂交实验进一步验证了实验结果(图6c):Northern-blot表明随着盐害胁迫时间的增加,P5CS基因的表达量也逐步升高.这些结果表明在盐害胁迫下,印度梨形孢可诱导P5CS基因的高效表达.

图6 盐胁迫下接种印度梨形孢对紫花苜蓿P5CS基因表达的影响Fig.6 Effectof P.indica colonization on the P5CS expression of Medicagosativa under saltstress
3 结论
本实验通过设置盐害胁迫,研究了印度梨形孢在紫花苜蓿中的定殖对提高其耐盐性的分子机制.结果表明:1)印度梨形孢能定殖紫花苜蓿根部并显著提高盐害胁迫下紫花苜蓿生物产量;2)印度梨形孢通过激活紫花苜蓿体内抗氧化物酶活性,从而增加植物对盐胁迫的抵抗力;3)印度梨形孢通过降低紫花苜蓿体内丙二醛含量,增强对植物的保护;4)印度梨形孢定殖可降低紫花苜蓿根部电导率,减少盐害胁迫对植物根部细胞的伤害;5)盐胁迫下,印度梨形孢定殖可以诱导脯氨酸合成途径吡咯啉-5-羧基合成酶基因(P5CS)表达,实现分子水平调控.
总之,印度梨形孢作为一种可离体培养的根部内生真菌,可与紫花苜蓿形成互惠共生的菌根复合体,可将土壤中的营养物质和水分传递给宿主,有效提高宿主植物生物产量,减缓盐胁迫对植物的伤害,有效促进盐渍化生境下植物的生长,该真菌对于指导农业生产,实施间接土壤改良具有重要意义.
[1]VermaS,VarmaA,RexerKH,etal.Piriformospora indica,genetspnov,anew root-colonizing fungus[J].M ycologia,1998,90:896-903.
[2]HibbettD S.A phylogenetic overview of the Agaricomycotina[J].Mycologia,2006,98(6):917-925.
[3]Qiang X,WeissM,KogelKH,etal.Piriformospora indica-amutualisticbasidiomycetew ithanexceptionally largeplanthostrange[J].Molecular PlantPathology,2012,13(5):508-518.
[4]Waller F,AchatzB,BaltruschatH,etal.Theendophytic fungus Piriformospora indica reprogramsbarley to salt-stress tolerance,disease resistance,and higher yield[J].Proceedingsof the NationalAcademy of Sciencesof the United Statesof America,2005,102(38):13386-13391.
[5]Schafer P,PfiffiS,Voll LM,etal.Manipulation of plant innate immunity and gibberellin as factor of compatibility in themutualistic association of barley rootsw ith Piriformospora indica[J].The Plant Journal,2009,59(3):461-474.
[6]DasA,KamalS,ShakilNA,etal.The rootendophyte fungus Piriformospora indica leads toearly flowering,higherbiomassandaltered secondary metabolitesof themedicinalplant,Coleusforskohlii[J].PlantSignaling&Behavior,2012,7(1):103-112.
[7]PeŠkan-BerghoferT,ShahollariaB,Giong PH,etal.Associationof Piriformospora indica w ith Arabidopsis thaliana roots representsanovelsystem to study beneficialplant-m icrobe interactionsand involvesearly plant proteinmodifications in theendo plasmatic reticulum and at the plasmamembrane[J].Physiologia Plantarum,2004,122(4):465-477.
[8]Sahay NS,VarmaA.Piriformospora indica:anew biologicalhardening tool formicro propagated plants[J].FEMSM icrobiology Letters,1999,181(2):297-302.
[9]Deshmukh SD,KogelKH.Piriformospora indica protectsbarley from rootrotdiseasecausedby Fusarium gram inearum[J].JournalofPlantDiseases and Protection,2007,114(6):263-268.
[10]Stein E,Molitor A,Kogel KH,et al.System ic resistance in Arabidopsis conferred by themycorrhizal fungus Piriformospora indica requires jasmonic acid signaling and the cytoplasmic function of NPR1[J].Plant&CellPhysiology,2008,49(11):1747-1751.
[11]DelPapaMF,BalaguéLJ,Sow inskiSC.Isolation and characterization ofalfalfa-nodulating rhizobiapresentinacidic soilsof centralargentinaand uruguay[J].ApplEnviron M icrob.,1999:65,1420-1427.
[12]M ckay IA,Djordjevic M A.Production and excretion of nodmetabolitesby rhizobium leguminosarum bv.trifolliare disrupted by the same environmental Factors that reduced nodulation in the field[J].ApplEnviron M icrobiol,1993,59:385-3392.
[13]Bolanos L,El-HamdaouiA,Bonilla I.Recovery ofdevelopmentand functionality ofnodulesand plantgrow th in salt-stressed Pisum sativum-Rhizobium leguminosarum symbiosisby boron and calcium[J].PlantPhysiol,2003,60,1493-1497.
[14]Oldroyd G,Harrison M,UdvardiM.Peace talksand trade deals.Keys to long-term harmony in legume-m icrobe symbioses[J].PlantPhysiol,2005,137:1205-1210.
[15]Lugtenberg B,Kam ilova F.Plant-grow th-promoting rhizobacteria[J].AnnualReview ofM icrobiology,2009,63(63):541-56.
[16]PeŠkan-BerghoferT,ShahollariB,Giong PH,etal.Associationof Piriformospora indica w ith Arabidopsis thaliana roots representsanovelsystem to study beneficialplant-microbe interactionsand involvesearly plantproteinmodifications in theendoplasm ic reticulum and at the plasmamembrane [J].Physiologia Plantarum,2004,122(4):465-477.
[17]刘伟,曹连莆,陈爱民,等.蒺藜苜蓿小G蛋白M tROP9基因的克隆与表达分析 [J].西北农林科技大学学报,2009,37(6):210-216.
[18]Qiang X,Zechmann B,Reitz MU,etal.Themutualistic fungus Piriformospora indica colonizes Arabidopsis rootsby inducing an endoplasm ic reticulum stress-triggered caspase-dependentcelldeath[J].The PlantCell,2012,24(2):794-809.
[19]高俊凤.植物生理学实验指导 [M].北京:高等教育出版社,2006:214-215.
[20]李合生.氮蓝四唑(NBT)法测定超氧化物歧化酶(SOD)活力 [A]//植物生理生化实验原理和技术 [M].北京:高等教育出版社,2000:164-169;258-260.
[21]Sambrook J,Fritsch EF,Maniatis T.MolecularCloning:a LaboratoryManual[M].New York:Cold Spring Harbor Laboratory.Cold Spring Harbor Press,1989,672e690.
[22]BaltruschatH,Fodor J,HarrachBorbálaD,etal.A salttoleranceofbarley induced by the rootendophyte Piriformospora indica isassociatedw ith a strong increase in antioxidants[J].New Phytologist,2008,180(2):501-510.
[23]Vadassery J,TripathiS,Prasad R,etal.Monodehydroascorbate reductase2and dehydroascorbate reductase5arecrucial foramutualistic interaction between Piriformospora indica and Arabidopsis[J].PlantPhysiol,2009b,166:1263-1274.
[24]李亮,武洪庆,马朝阳,等.印度梨形孢促进蒺藜苜蓿生长及其提高耐盐性研究 [J].微生物学通报,2015,42(8):1492-1500.
[责任编辑 田 丰 夏红梅]
Piriformospora indica conferssalt tolerance in Medicago sativa by stimulating antioxidantenzymesactivitiesand the expression of P5CS genes
LILiang,CHEN Xi,WANG Fen,WANG Xiaoyang,QIShuting
(SchoolofMarine Scienceand Engineering,HebeiUniversity of Technology,Tianjin 300130,China)
Piriformospora indica promotesplantgrow th and confers toleranceagainstbiotic and abiotic stress.However, themolecularmechanism is required to be revealed.In the paper,the plantbiomass,MDA content,antioxidantenzyme activitiesand relative electrical conductivity(REC)aswellas the Pyrroline-5-Carboxylate Syn-thetase(P5CS)gene expressionwereanalyzed in theMedicago sativa colonized by P.indica undersaltstress.The data indicated thatMedicago sativa is a good host for P.indica.The fungus could effectively increase plantbiomass.Compared to the control,the injuriescaused by saltstresscould besignificantly reduced by P.indica colonization.Physiologicaland biochem icaldata suggested that the endophyte significantly promote antioxidantenzyme activities,reduced the relative electrical conductivity(REC)andmalondialdehyde(MDA)content.Molecular biology experiment show that the P5CS genewhich is the key gene for proline synthesiswasupregulated in the P.indica colon ized plantunder saltstress.
Piriformospora indica;medicago sativa;antioxidantenzymes;salt-tolerance
S541.9
A
1007-2373(2016)04-0029-08
10.14081/j.cnki.hgdxb.2016.04.006
2016-06-20
天津市自然科学基金(13JCYBJC37600);河北省自然科学基金(C2014202256)
李亮(1982-),女(满族),讲师,博士.
