沙棘油复合蛋白多肽液抗氧化性研究
2017-01-06李乐陈树俊康俊杰徐晓霞庞震鹏刘晓娟胡洁石玥
李乐,陈树俊,康俊杰,徐晓霞,庞震鹏,刘晓娟,胡洁,石玥
(山西大学生命科学学院,山西太原030006)
沙棘油复合蛋白多肽液抗氧化性研究
李乐,陈树俊,康俊杰,徐晓霞,庞震鹏,刘晓娟,胡洁,石玥
(山西大学生命科学学院,山西太原030006)
复合蛋白液是以核桃、燕麦、藜麦蛋白为原料,依据蛋白质互补作用的原理及必需氨基酸的参考模式,采用氨基酸比值系数的方法来评价各蛋白产品的营养价值,从而将3种蛋白液按照不同比例进行科学复配。利用碱性、中性、风味3种蛋白酶对复合蛋白液酶解后进行沙棘油脂的强化,通过测定溶液总还原能力、DPPH自由基清除能力、羟基自由基清除能力、超氧阴离子自由基清除能力、总抗氧化能力,研究复合蛋白多肽液经沙棘油强化前后抗氧化活性的变化情况。结果表明,3种酶经最优条件酶解后,多肽质量浓度为17.43 mg/mL,复合蛋白多肽液和沙棘油复合蛋白多肽液,其还原力的半清除率分别为3.84,1.86 mg/mL,DPPH自由基的半清除率分别为94.72,74.29 μg/mL,羟基自由基的半清除率分别为1.52,1.01 mg/mL,超氧阴离子自由基的半清除率分别为2.09,1.33 mg/mL,2种多肽液的总抗氧化能力分别为26.76,65.74 U/mL。复合蛋白多肽液和沙棘油复合蛋白多肽液均具有一定的体外抗氧化活性,而且后者的抗氧化能力明显强于前者,其总还原能力,DPPH自由基、羟自由基、超氧阴离子自由基的清除率与质量浓度呈量效关系。
沙棘油;复合蛋白多肽液;抗氧化活性
沙棘油含有脂溶性成分多达数百种,目前为止已经有大量的文献对此进行了研究[1-4]。不过确定其生物活性功效和开发利用价值的主要是人体必需脂肪酸、植物甾醇、维生素E、维生素K、类胡萝卜素、植物磷脂等[5-6]。沙棘油[7]是一种脂肪酸甘油脂,其中含有油酸、棕榈酸、亚麻酸、亚油酸等18种脂肪酸[8],而且大部分都是不饱和脂肪酸,很容易被人体吸收利用;同时,其还含有锰、磷、镁、硼、铁、钾、硅、钙、铜等24种矿质元素[9],其中,含量最多的是锌、硒、钙、钾、铁;并且还含有超氧化物歧化酶(SOD),其含量比人参还要高。机体氧化过程中会产生一种有害物质,即自由基,过量自由基会对机体产生氧化性损害,人体的许多慢性疾病和衰老主要是由于体内自由基失衡而引起的。当这种损害不能够及时修复并且积累到一定程度时,就会导致机体缺氧、老化、动脉粥样硬化甚至肿瘤等疾病[10]的发生。
本研究将复合蛋白多肽液与沙棘油进行最佳配比,以沙棘油复合蛋白多肽液为研究对象,测定了其在一定浓度范围内的总还原能力、DPPH自由基清除能力、羟基自由基清除能力、超氧阴离子自由基清除能力和总抗氧化能力,全面考察沙棘油复合蛋白多肽液的体外抗氧化活性[11-13],并同具有显著抗氧化效果的抗坏血酸(Vc)进行比较,旨在为大多数人群提供一种具有较高营养价值和抗氧化能力的辅助食品,也为今后的相关研究提供理论依据。
1 材料和方法
1.1 材料
山西大学生物工程基础实验室自制复合蛋白多肽液;沙棘油由山西省林业科学院提供。
1.2 试剂、仪器与设备
碱性蛋白酶,食品级,北京索莱宝科技有限公司;中性蛋白酶,食品级,北京索莱宝科技有限公司;风味蛋白酶,食品级,北京索莱宝科技有限公司;铁氰化钾、三氯乙酸(TCA)、无水乙醇、磷酸二氢钠、邻苯三酚、磷酸氢二钠、抗坏血酸、盐酸、三氯化铁均为分析纯;2,2-二苯代苦味酰基苯肼自由基(DPPH·),Sigma公司;抑制与产生超氧阴离子自由基(O2-)试剂盒、羟自由基试剂盒、总抗氧化能力(T-AOC)检测试剂盒均购自南京建成生物工程有限公司。
HRHS24 Haier电热恒温水浴锅,青岛海尔医用低温科技有限公司;WFZ UV-2100型紫外可见分光光度计,尤尼柯(上海)仪器有限公司;SB4200DT超声波,宁波新芝生物科技股份有限公司;SENCO旋转蒸发仪,上海申生科技有限公司;TDL-5型4台式离心机,上海安亭科学仪器厂制造;DHG-9240A型电热恒温鼓风干燥箱,上海精宏实验设备有限公司;81-2型恒温磁力搅拌器,上海司乐仪器厂;PHS-3C精密pH计,上海精密科学仪器有限公司;JA1003型精密电子天平,上海良平仪器仪表有限公司。其他为常规仪器。
1.3 试验方法
山西大学生物工程基础实验室自制复合蛋白液是以核桃、燕麦、藜麦蛋白为原料,依据必需氨基酸参考模式、蛋白质互补作用的原理,采用氨基酸比值系数法评价各蛋白产品营养价值,将3种蛋白按照不同比例进行科学复配而成。复合蛋白的化学评分(CS)、氨基酸评分(AAS)、必需氨基酸指数(EAAI)、生物价(BV)及氨基酸比值系数分(SRCAA)分别为65.5,78.9,74.8,69.8,87.25。不论是从氨基酸模式还是生物价都说明复合蛋白具有很高的营养价值,核桃蛋白、燕麦蛋白、藜麦蛋白最佳比例为3∶3∶4。
将上述配比最佳的复合蛋白所制成的蛋白液进行酶解,最优条件:碱性蛋白酶∶中性蛋白酶为2∶1,复合酶添加量1 000 U/g,最适pH值7.5~8.0,酶解温度60℃,酶解时间3 h,酶用量7 000 U/g。酶解完成后,将酶解液加热到80~85℃保持5 min使酶失活,然后经2 000 r/min离心得到复合蛋白多肽液。
在上述复合蛋白多肽液中加入质量分数为2%的沙棘油,同时添加单甘脂∶蔗糖酯为1∶1的复合乳化剂0.15%,黄原胶0.05%,羧甲基纤维素钠(CMC-Na)0.05%,并进行均质乳化,得到的即为沙棘油复合蛋白多肽液。
1.3.1 复合蛋白多肽液多肽含量的测定[14]
1.3.1.1 标准曲线的制作使用三氯乙酸(TCA,5%)先后配制成0.0,0.2,0.4,0.6,0.8,1.0,1.2,1.4,1.6,1.8 mg/mL的Gly-Gly-Tyr-Arg四肽标准溶液,分别定容于10个10 mL的容量瓶中,然后分别移取上述的标准溶液6.0 mL,与4.0 mL双缩脲试剂混合均匀后静置10 min,在2 000 r/min的条件下离心10 min,最后取上清液在540 nm下测定OD值(第1管作为空白对照)。将肽的质量浓度作为横坐标X(mg/mL),OD值作为纵坐标Y,制作标准曲线。
1.3.1.2 多肽含量的测定移取2.5 mL的样品溶液,并且向其中加入2.5 mL 10%(W/V)的三氯乙酸(TCA)水溶液,在漩涡混合仪上混合均匀并且静置10 min后,在4 000 r/min条件下离心15 min,之后要将上清液全部转到50 mL的容量瓶中,使用5%的TCA定容摇匀。移取上述溶液6.0 mL置于另外一个试管当中,并与4.0 mL的双缩脲试剂(样液∶双缩脲试剂=3∶2,V/V)在漩涡混合仪上混合均匀后静置10 min,在2 000 r/min下离心10 min,最后取上清液在540 nm下测定OD值,对照所求的标准曲线,从而求得样品溶液中的多肽质量浓度C(mg/mL),样品中的多肽含量计算公式如下。

1.3.2 还原力测定对于一种物质而言,提供电子能力越强还原能力就越强,所以,物质的还原力实际上反映的也就是它的供电子能力。本试验选择的氧化剂是铁氰化钾(K3(Fe(CN)6)),用来被检测的物质当中所具有的抗氧化成分能够提供电子使Fe3+还原成Fe2+,从而使得反应体系中的颜色发生变化,反应后在700 mn处测定反应体系中的吸光度。如果吸光度越大,则表明样品还原能力越强,也就是被检测物质的抗氧化效果越好[15]。
移取2.5 mL不同多肽浓度的样品液,并向其中加入2.5 mL磷酸钠缓冲液(PBS 0.2 mol/L)(pH=6.6)和1%的铁氰化钾溶液2.5 mL,将上述混合溶液在50℃水浴条件下反应20 min后迅速冷却,并且立刻加入2.5 mL 10%的三氯乙酸(TCA)溶液终止反应,在3 000 r/min的离心条件下离心10 min。移取2.5 mL的上清液,加入2.5 mL蒸馏水和0.1%的三氯化铁0.5 mL混匀后反应10 min,并测定700 nm处的吸光度。用抗坏血酸作为对照品,重复3次,吸光度值越大,表明多肽的还原能力越强。
1.3.3 DPPH自由基的清除能力测定本试验中的DPPH·是一种在乙醇溶液中呈现深紫色,而且最大吸收波长为517 nm人工稳定的有机氮自由基。反应体系中的抗氧化物由于能与DPPH·中的电子成对,从而使波长吸收慢慢的消失,因此溶液就会逐渐褪色,并且其褪色程度和所接受的电子数呈现出一种线性关系,而且吸光度越低,表明样品对于DPPH·的清除能力越强,所以可以用分光光度计来进行定量分析。
移取一定浓度的样品液或抗坏血酸溶液2 mL,加入DPPH·(0.2 mmol/L,用无水乙醇配制)溶液2 mL于试管中混合均匀(以无水乙醇代替DPPH·作为样品空白),在室温下避光放置30 min后,在波长为517 nm处检测吸光度值,而且每个浓度都要测定3次。

式中,Ai为2 mLDPPH·溶液与2 mL待测定样品液混合液的吸光度;Aj为2 mL无水乙醇与2 mL待测定样品液混合液的吸光度;Ac为2 mL DPPH·溶液与2 mL无水乙醇混合液的吸光度。
1.3.4 ·OH清除能力的测定首先要准确地将样品液配制成一系列浓度,其次测定的具体步骤按照羟自由基测定试剂盒中的说明书进行操作。室温下放置20 min后于550 nm波长处测定各个试管的吸光度值(以抗坏血酸作为对照,蒸馏水调零),重复3次。
抑制率=(对照管吸光度值-测定管吸光度值)/对照管吸光度值×100%。
1.3.5 O2-·清除能力的测定首先将样品液准确配成一系列浓度,其次测定的具体步骤按照超氧阴离子自由基试剂盒中的说明书进行操作(以抗坏血酸作为对照)。使用分光光度计测定波长为550 nm处的吸光度(蒸馏水调零),从而计算出对超氧阴离子自由基的清除能力,重复3次。
抑制率=(对照管吸光度值-测定管吸光度值)/对照管吸光度值×100%。
1.3.6 总抗氧化能力的测定机体中含有的许多抗氧化物质能够使Fe3+还原成Fe2+,并且Fe2+能够同菲啉类物质形成一种稳固的络合物,进而通过比色测定出物质抗氧化能力的高低。
首先将样品液准确配成一系列浓度,其次具体的步骤按照总抗氧化能力检测试剂盒中的说明书进行操作。要在漩涡混匀器上混匀后放置10 min(蒸馏水调零1 cm光径),再在520 nm波长处测定吸光度值(OD值),重复3次取平均值。以每分钟每毫升样品液在37℃下使反应体系OD值每增加0.01时为一个抗氧化能力单位。
总抗氧化能力=((测定管OD值-对照管OD值)×反应液用量(mL)×样品测试前稀释倍数)/(0.01×30×取样量(mL))。
1.3.7 半清除率的测定半清除率(IC50)也就是半数有效浓度,是指清除率为50%时所需要的抗氧化剂浓度,浓度越低,说明抑制能力越强。通过比较不同浓度抗氧化剂作用的IC50值,做出清除率制作曲线,从而求出IC50值。
2 结果与分析
2.1 复合蛋白多肽液多肽含量分析
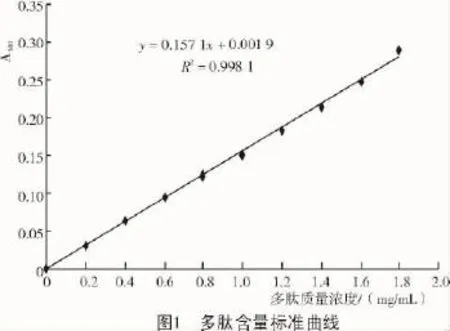
2.1.1 多肽标准曲线以吸光度值为纵坐标,以多肽质量浓度为横坐标,制作多肽含量标准曲线如图1所示。
2.1.2 复合蛋白多肽液多肽含量分析用三氯乙酸法测得复合蛋白多肽液的多肽质量浓度为17.43 mg/mL。
2.2 还原力分析[16-17]
一种物质的供电子能力或还原能力可以反映其潜在的抗氧化性能。抗氧化剂通过自身将电子提供给自由基而自身获得一个质子,从而使自由基变为稳定的分子,一般情况下,还原力越强,抗氧化性也就越强。故而可以通过测定物质的还原力来反映抗氧化活性的大小。样品中的还原性物质可将Fe3+还原成Fe2+,供电子数越多,还原出的Fe2+越多,从而形成普鲁士蓝化合物,反应体系的溶液颜色由黄色变成蓝色,在700 nm处有特征吸收峰,故通过测定吸光度的变化可知还原力的大小。700 nm处吸光度值越大,还原力越强、抗氧化活性越高[17](图2)。

从图2可以看出,在一定的范围内,吸光度随着浓度的增加而增大,还原能力逐渐增强。从线性回归分析(表1)中IC50可看出,沙棘油复合蛋白多肽液的还原能力明显强于复合蛋白多肽液。还原力强弱顺序依次是:Vc(IC50=33.93 μg/mL)>沙棘油复合蛋白多肽液(IC50=1.86 mg/mL)>复合蛋白多肽液(IC50=3.84 mg/mL)。

表1 样品还原力分析
2.3 DPPH自由基的清除能力分析[18-19]
DPPH·能够接受电子或质子,其乙醇溶液呈紫色,在517 nm处有特征吸收峰,DPPH法就是通过体系中样品对于DPPH·清除率的强弱来评价待测物质体外的抗氧化能力,具有简单、快速、灵敏等优点而被广泛应用。因其呈色反应的量效关系稳定,在反应体系中,DPPH·可被自由基清除剂将溶液的颜色由深紫色变为黄色。褪色程度越大,自由基清除能力越强(图3)。

由图3可知,随着复合蛋白多肽液多肽浓度的升高,清除效果增大。复合蛋白多肽液和沙棘油复合蛋白多肽液对DPPH自由基均有较高的清除率。从线性回归分析中IC50值可看出,沙棘油复合蛋白多肽液的清除能力明显强于复合蛋白多肽液,但略低于抗坏血酸的清除能力。清除能力强弱顺序依次是抗坏血酸(IC50=8.65 μg/mL)>沙棘油复合蛋白多肽液(IC50=74.29 μg/mL)>复合蛋白多肽液(IC50=94.72 μg/mL)(表2)。

表2 DPPH自由基的清除活性分析
2.4 ·OH清除能力分析
羟基自由基具有极强的得电子能力,它是生命代谢活动过程中所产生的毒性最大、进攻性最强的分子,可导致多糖裂解、机体组织脂质过氧化以及蛋白质聚合、解聚,核酸断裂等过程,还能够迅速引发各类疾病的发生和机体衰老的加速[20],引发组织细胞损伤病变等等。Fenton反应是一种最常见产生羟基自由基的化学反应,其产生的·OH量和H2O2量成正比,当给予电子受体后用griess试剂显色就会形成红色物质,并且在550 nm处有最大吸收峰,呈色与·OH的多少成正比。当体系中存在抗氧化物质时,有色物质得以清除。吸光度变化越大,清除活性越高。

由图4可知,复合蛋白多肽液和沙棘油复合蛋白多肽液对·OH均表现出一定的清除效果,且清除率随着复合蛋白多肽液多肽质量浓度的增加而逐渐升高。从表3可以看出,沙棘油复合蛋白多肽液的清除能力明显强于复合蛋白多肽液。对·OH清除能力强弱顺序依次是抗坏血酸(IC50=387.6 μg/mL)>沙棘油复合蛋白多肽液(IC50=1.01 mg/mL)>复合蛋白多肽液(IC50=1.52 mg/mL),其中,沙棘油复合蛋白多肽液的IC50约为抗坏血酸的2.6倍,说明沙棘油复合蛋白多肽液对羟基自由基的清除能力比较接近抗坏血酸。

表3 清除羟基自由基的活性分析

超氧阴离子自由基是通过模拟机体中黄嘌呤与黄嘌呤氧化酶反应系统而产生的,在加入griess显色剂和电子传递物质后使得反应体系呈紫红色,可以通过分光光度计测定其吸光度,用抗坏血酸作标准可以计算出样品对于超氧阴离子自由基的影响能力。超氧阴离子自由基是O2的还原形式,是由O2分子获得一个电子后产生的,不仅本身具有很大的毒性,而且可通过一系列反应产生其他自由基,对机体造成更大的破坏[22]。
由图5可知,在试验浓度范围内,沙棘油复合蛋白多肽液和复合蛋白多肽液对超氧阴离子的清除作用有着明显的量效关系,并且随着复合蛋白多肽液多肽质量浓度的增大而增强。从线性回归分析中IC50可看出,对超氧阴离子清除能力强弱顺序依次是抗坏血酸(IC50=65.3 μg/mL)>沙棘油复合蛋白多肽液(IC50=1.33 mg/mL)>复合蛋白多肽液(IC50=2.09 mg/mL)(表4)。沙棘油复合蛋白多肽液的清除能力明显强于复合蛋白多肽液。

表4 清除超氧阴离子自由基的活性分析
2.6 总抗氧化能力的测定
吸光度值变化越大,总抗氧化能力就越强。沙棘油复合蛋白多肽液、复合蛋白多肽液和抗坏血酸的质量浓度均为4 mg/mL(图6)。

从图6可以看出,相同质量浓度的3种溶液总抗氧化能力各不相同,并且它们的强弱顺序依次为:抗坏血酸(89.54 U/mL)>沙棘油复合蛋白多肽液(65.74 U/mL)>复合蛋白多肽液(26.76 U/mL)。沙棘油复合蛋白多肽液和抗坏血酸的总抗氧化能力明显高于复合蛋白多肽液。
3 结论
本研究结果表明,复合蛋白多肽液的还原能力、DPPH自由基清除能力、羟基自由基清除能力、超氧阴离子自由基清除能力和总抗氧化能力随着多肽质量浓度的增加而逐渐增大。其中,沙棘油强化前后复合蛋白多肽液抗氧化能力有显著的差别,这是由于沙棘油中本身就含有天然抗氧化成分[5-6],如维生素E、β-胡萝卜素、δ-羟色胺及黄酮类等许多生物活性物质,对抗氧化结果起到了协同增效的作用[23]。
沙棘油复合蛋白多肽液的还原能力明显强于复合蛋白多肽液,但却低于抗坏血酸的还原能力。羟基自由基清除能力强弱顺序依次是抗坏血酸(IC50=8.65μg/mL)>沙棘油复合蛋白多肽液(IC50=74.29μg/mL)>复合蛋白多肽液(IC50=94.72μg/mL),沙棘油复合蛋白多肽液清除能力明显强于复合蛋白多肽液,但略低于抗坏血酸的清除能力。·OH清除能力强弱顺序依次是抗坏血酸(IC50=387.6 μg/mL)>沙棘油复合蛋白多肽液(IC50=1.01 mg/mL)>复合蛋白多肽液(IC50=1.52 mg/mL),其中,沙棘油复合蛋白多肽液的IC50约为抗坏血酸IC50的2.6倍,说明沙棘油复合蛋白多肽液对羟基自由基的清除能力接近抗坏血酸。
O2-·清除能力从强到弱的顺序依次是抗坏血酸(IC50=65.3μg/mL)>沙棘油复合蛋白多肽液(IC50=1.33mg/mL)>复合蛋白多肽液(IC50=2.09 mg/mL),沙棘油复合蛋白多肽液的清除能力明显强于复合蛋白多肽液。相同质量浓度的3种溶液总抗氧化能力各不相同,并且总抗氧化能力的强弱顺序依次为抗坏血酸(89.54 U/mL)>沙棘油复合蛋白多肽液(65.74 U/mL)>复合蛋白多肽液(26.76 U/mL),沙棘油复合蛋白多肽液和抗坏血酸的总抗氧化能力明显高于复合蛋白多肽液。
试验证明,复合蛋白多肽液本身具有一定的抗氧化性,通过沙棘油强化制得的沙棘油复合蛋白多肽液抗氧化性得到了显著提升,具有较高的抗氧化活性。
[1]臧茜茜,邓乾春,从仁怀,等.沙棘油功效成分及药理功能研究进展[J].中国油脂,2015(5):76-81.
[2]邢伟.沙棘油产品的加工技术及市场前景[J].山西农业科学,2009,37(10):64-71.
[3]忻耀年,周伯川,李静,等.不同沙棘种和亚种籽及油的生化成分研究初报[J].沙棘,1996,9(1):32-34.
[4]张秀荣,李堃,都桂芳,等.沙棘果实化学采收的研究[J].华北农学报,1991,6(1):105-109.
[5]严丹丹.沙棘的营养成分与药用保健价值[J].中国食物与营养,2006(11):49-51.
[6]忻耀年.沙棘主要有效生物活性物质的含量、分布和提取方法[J].国际沙棘研究与开发,2007,5(1):17-24.
[7]车锡平,郭峰,关晓红,等.沙棘籽油和果油对动物皮肤烫伤、烧伤、创伤的治疗作用[J].沙棘,1999,12(4):46-48.
[8]林赫杰,陈钰.沙棘研究现状、开发利用及发展前景[J].天津农业科学,2010,16(2):128-130.
[9]刘德波.介绍一种药用价值很高的沙棘油[J].中国油脂,1986(2):36-38.
[10]Halliwell B,Gutteridge J M C,Cross C E.Free radicals,antioxidants,and human disease:where are we now[J].J Clin Lab Med,1992,119(6):598-620.
[11]朱艳华,谭军.玉米多肽抗氧化作用的研究[J].中国粮油学报,2008,23(1):36-38.
[12]Peng X Y,Xiong Y L,Kong B H.Antioxidant activity of peptide fractions from whey protein hydrolysates as measured by electron spin resonance[J].Food Chemistry,2009,113:196-201.
[13]Chang C Y,Wu K C,Chang S H.Antioxidant properties and protein compositions of porcine haemoglobin hydrolysates[J].Food Chemistry,2007,100(4):1537-1543.
[14]鲁伟,任国普,宋俊梅.蛋白水解液中多肽的含量测定方法[J].食品科学,2005,26(7):169-171.
[15]黄海霞,张亚坤,张丹丹,等.芍药花粉提取物的抗氧化能力研究[J].河南农业科学,2012,41(11):117-120.
[16]Sanaa Ragaee,EI-sayed M,Abdel-Aal.Antioxidant activity and nutrient composition of selected cereals for food use[J].Food Chemistry,2006,98(1):32-38.
[17]Oyaizu M.Antioxidant activityof browningproduets of glucosamine fractionated by organic solvent and thin-layer cllromatography[J]. Nippon Shokuhin KogyoGakkaishi,1988,35:771-775.
[18]李鹏,李萍,田向学,等.丹参提取剩余物的体外抗氧化活性研究[J].天津农业科学,2011,17(5):50-52.
[19]Sun T,HoCT.Antioxidant activities ofbuckwheat extracts[J].Food Chemistry,2005,90(1):155-157.
[20]吴雪辉,黄永方,高强.肉桂精油的抗氧化作用研究[J].食品科技,2007,14(4):85-88.
[21]韩少华,朱靖博,王妍妍.邻苯三酚自氧化法测定抗氧化活性的方法研究[J].中国酿造,2009,18(6):155-157.
[22]邹元生.沙棘果油保肝作用的研究[J].沙棘,2005,18(3):27-32.
[23]闫克玉,杜紫娟,王勇.沙棘籽油的提取及其在卷烟中的应用[J].河南农业科学,2010(5):44-47.
Study on Antioxidant Activity of Compound Protein Polypeptide Solution Intensified of Sea Buckthorn Oil
LI Le,CHENShu-jun,KANGJun-jie,XUXiao-xia,PANGZhen-peng,LIUXiao-juan,HUJie,SHI Yue
(College ofLife Sciences,Shanxi University,Taiyuan 030006,China)
Compound protein solution was made of walnut,oats,quinoa protein as raw material,evaluated the nutritional value of protein products through the ratio coefficient of amino acid in accordance with the principle of complementary protein and the reference model ofessential amino acids,the three kinds of proteins were mixed in different proportion of scientific compound.Used the 3 kinds of protease including alkaline,neutral and flavor hydrolysis,and then intensified by sea buckthorn oil,study the change of the antioxidant activity of the compound protein polypeptide solution intensified by sea buckthorn oil before and after,through measured the total reducing power,DPPH radical scavenging activity,hydroxyl radical scavenging activity,superoxide anion radical scavenging activity,the total antioxidant activity.The results showed that 3 kinds of enzyme with the optimal conditions of enzymolysis said that the polypeptide concentration was 17.43 mg/mL,the halfa clearance rate ofthe reducing power ofthe compound protein polypeptide solution and the sea buckthorn oil compound protein polypeptide solution were 3.84,1.86 mg/mL,the half a clearance rate of the DPPH radical were 94.72, 74.29μg/mL,the half a clearance rate of the hydroxyl radical were 1.52,1.01 mg/mL,the half a clearance rate of the superoxide anion radical were 2.09,1.33 mg/mL,the total antioxidant activityoftwokinds ofpolypeptide solution were 26.76,65.74 U/mL.The antioxidant activityofthe sea buckthorn oil compound protein polypeptide solution was better than that ofthe compound protein polypeptide solution, and both ofthem had antioxidant activity in vitro,the total reducing power,the scavenging activity ofthe DPPH radical,hydroxyl radical, superoxide anion radical had a dose effect relationship with the concentration.
sea buckthorn oil;compound protein polypeptide solution;antioxidant activity
TS225.1
A
1002-2481(2016)04-0474-07
10.3969/j.issn.1002-2481.2016.04.13
2015-12-23
李乐(1992-),女,山西长治人,在读硕士,研究方向:食品新工艺与食品安全。陈树俊为通信作者。
