小麦叶锈病成株抗性研究进展与展望
2017-01-06张小辉畅志坚乔麟轶郭慧娟詹海仙李欣任永康张晓军
张小辉,畅志坚,乔麟轶,郭慧娟,詹海仙,李欣,任永康,张晓军
(1.山西大学生物工程学院,山西太原030006;2.山西省农业科学院作物科学研究所,作物遗传与分子改良山西省重点实验室,山西太原030031;3.农业部黄土高原作物基因资源与种质创制重点实验室,山西太原030031)
小麦叶锈病成株抗性研究进展与展望
张小辉1,畅志坚2,3,乔麟轶2,郭慧娟2,詹海仙2,李欣2,任永康2,张晓军2
(1.山西大学生物工程学院,山西太原030006;2.山西省农业科学院作物科学研究所,作物遗传与分子改良山西省重点实验室,山西太原030031;3.农业部黄土高原作物基因资源与种质创制重点实验室,山西太原030031)
小麦叶锈病是由叶锈菌(Puccinia triticina)侵染引起的一种真菌性病害,是我国小麦的主要病害之一。其抗性分为苗期抗性和成株期抗性,苗期抗性具有较好的小种专化抗性,成株期抗性则具有较好的持久性,因此,选育成株期抗性品种对于减少因叶锈病危害造成的产量损失至关重要。主要综述了小麦叶锈病成株抗性(Adult-plant resistance,APR)的研究进展和发展现状,并展望了叶锈病成株抗性基因在小麦育种中的应用前景。已经有研究报道了位于小麦16条染色体上的70个叶锈病成株抗性数量遗传位点(quantitative trait loci,QTL),其中,位于染色体1BS,1BL,2AL,2BS(2个),2DL,4DL,5BL,6AL,7BL和7DS上的11个位点对叶锈病的抗性具有多效性。分子标记类型的增加和测序技术的改进,尤其是高通量基因分型技术的发展,将会促进这些数量性状位点的精细定位与克隆,使这些抗叶锈病基因快速应用于小麦抗性育种,增强小麦新品种抗叶锈病的持久性。
小麦叶锈病;苗期抗性;成株抗性;QTL;分子标记
1 小麦抗病基因研究的意义
小麦(Triticum aestivum L.)是世界三大粮食作物之一,从北纬67°至南纬45°都有种植,年总产量超过6 000亿kg,仅次于水稻与玉米[1]。我国是世界上最大的小麦生产国和消费国[2],其种植面积占我国粮食作物总面积的22%左右,产量占粮食总产量的20%以上。因此,小麦高产、稳产对提高我国小麦综合生产能力、确保国家粮食安全等意义重大。
小麦叶锈病是由叶锈菌(Puccinia triticina)侵染小麦叶部引起的一种世界性真菌病害,具有分布范围广、传播快、危害大等特点。它能减少感病品种的穗粒数,降低粒质量,发病严重时会使小麦减产40%以上[3]。其大规模暴发主要发生于温暖、潮湿地区,我国西南麦区及长江中下游麦区曾是叶锈病的重灾区,1969,1973,1975,1979年叶锈病大面积暴发给小麦生产造成了严重损失[4]。近年来,该病有由南向北逐渐发展的趋势,2012年在河南、陕西、甘肃、四川、安徽等地造成了一定的损失[5]。
虽然化学防治和栽培措施能够在一定程度上减少小麦叶锈病造成的损失,但是效果并不明显,且易带来环境污染等安全隐患。实践证明,培育和推广抗病品种可以有效减少叶锈病所带来的经济损失,且最为安全、有效、持久。因此,广泛收集抗原并对其抗病基因进行筛选鉴定,培育新的持久抗病品种[6],是小麦育种的关键环节。
2 小麦叶锈病抗性分类
植物抗病性是指植物对病原物危害的抵御能力,由植物本身的基因型与病原物基因及环境条件相互作用的结果决定[7]。小麦叶锈病抗性按其生长发育阶段可分为苗期抗性和成株抗性。苗期抗性是由小种专化抗性或主效基因抗性控制,该基因可以和叶锈菌的无害基因产生特异性的相互作用,从而产生过敏性坏死反应,抑制病原菌的进一步侵染,属于单基因抗性,表现为全生育期抗性[8]。截至目前,国际上已在小麦染色体上定位并正式命名了72个抗叶锈病基因,但大多数均属于小种专化抗性。单基因抗性在病原菌流行中往往会促使病原菌小种发生变异而产生新的小种,原有的抗病品种很快丧失抗病性,造成病害更大范围的流行。因此,必须通过基因聚合及多系抗性品种策略来丰富基因战略部署中有效抗性基因的数量,以便优化基因配置、延缓病原菌小种变异速度,从而延长抗病品种抗性的有效期,避免因病原菌小种变异所带来的病害流行而造成的巨大损失。
另一种抗性类型为非小种专化抗性,一般受多个基因控制,没有明显的生理小种专化性,被称作“水平抗性”或“田间抗性”[9]。这种抗性一般在苗期不能完全表达,表现为部分侵染或中低程度侵染,但在成株期则表现出较好的耐病性,对产量及其他农艺性状影响较小,因此,又称为慢锈性或成株抗性(Adult-plant resistance,APR)。它是由控制数量性状的基因构成数量性状位点,对多数病原菌生理小种都有一定的抗性,但都不是完全免疫的,在生理上表现出潜伏期长、侵染率低、产孢量少、孢子堆小等特点[10]。一般认为,高水平的成株抗性是由具有潜在抗性的多个微效基因共同作用来实现的[11]。在这种情况下,病原菌以共存状态存在,每个生理小种在寄主上都有一定的生存环境,其选择压力大大降低,减少了产生新变异的可能性。因而,成株抗性较苗期抗性表现出更好的持久性[12]。但是,国际上正式命名的72个抗叶锈病基因中,对叶锈病具有成株抗性的仅有Lr12,Lr13,Lr22,Lr34,Lr35,Lr37,Lr46,Lr48,Lr49,Lr67和Lr68等11个基因。
3 小麦叶锈病成株抗性研究进展
近年来,分子标记技术发展迅速,小麦叶锈病成株抗性基因的发掘与鉴定随之得到了快速发展,多种标记类型被广泛应用于基因定位,利用不同的遗传群体包括RILs(Recombinant Inbred Lines,重组自交系)、DHs(Doubled Haploid Lines,双单倍体系)等,并取得了卓有成效的研究成果,这些标记主要包括RFLP(限制性片段长度多态性)、RAPD(随机扩增多态性DNA)、AFLP(扩增片段长度多态性)、SSR(简单重复序列)和SNP(单核苷酸多态性)等。
RFLP是应用较早的一种基于DNA水平上的分子标记,使用标记过放射性同位素的探针与酶切过的基因组DNA进行杂交,放射性标记经过显影后,可以有效检测目标区段之间的差别[13]。RFLP属于第一代分子标记技术,标记具有共显性,且结果稳定可靠,因此,其被广泛应用于抗叶锈病基因的分子标记中。目前已利用该技术定位了14个小麦抗叶锈病基因Lr1,Lr9,Lr10,Lr19,Lr20,Lr24,Lr27,Lr31,Lr32,Lr34,Lr35,Lr40,Lr46,Lr47,其中,Lr34,Lr35和Lr46为成株抗性位点。
RAPD又称随机扩增多态性,以人工合成的1个或2个寡聚核苷酸(约10个碱基左右)为引物,对未知序列的基因组DNA进行PCR扩增后,进行多态性分析,从而反映整个基因组的多态性[14]。由于该技术需要的DNA量少,设计引物时无需预知DNA序列信息,也不需要探针,无放射性,且操作简单,成本低廉,因此,在小麦抗叶锈基因标记中得以广泛应用。目前,利用该技术已获得与小麦抗叶锈病基因Lr9,Lr20,Lr24,Lr25,Lr28,Lr29,Lr34,Lr41,Lr49连锁的RADP标记,其中,Lr34和Lr49为成株抗性位点。
AFLP是在RFLP和RAPD基础上发展起来的一种新型分子标记技术,它使用高频酶切和低频酶切2种限制性内切酶同时切割基因组DNA产生分子量大小不同的限制性片段[15],经过PCR扩增后可产生很高的多态性,同时结果稳定。已利用该技术成功定位了Lr19,Lr21,Lr37,Lr38,Lr41,Lr44和Lr46等7个小麦抗叶锈病基因,其中,Lr37和Lr46为成株抗性位点。
SSR标记又称微卫星DNA(Microsatellites),以广泛且随机分布于基因组不同位置的重复序列为基础,这些重复序列以1~6个碱基为基本单元组成,长度一般在300 bp以下,通过PCR扩增后能够产生比RFLP高得多的多态性,且结果稳定可靠,具有很好的重复性。目前,应用该技术已得到了Lr34,Lr39,Lr40,Lr46,Lr50的分子标记,其中,Lr34和Lr46为成株抗性位点。
除以上这些常用标记外,越来越多的新型标记技术被开发出来,如多样性序列芯片技术(Diversity arrays technology,DArT)、单核苷酸多态性(Single nucleotide polymorphisms,SNP)以及基于测序的基因分型(Genotyping-by-sequencing,GBS)技术等,其已开始应用于小麦抗叶锈病基因鉴定当中。
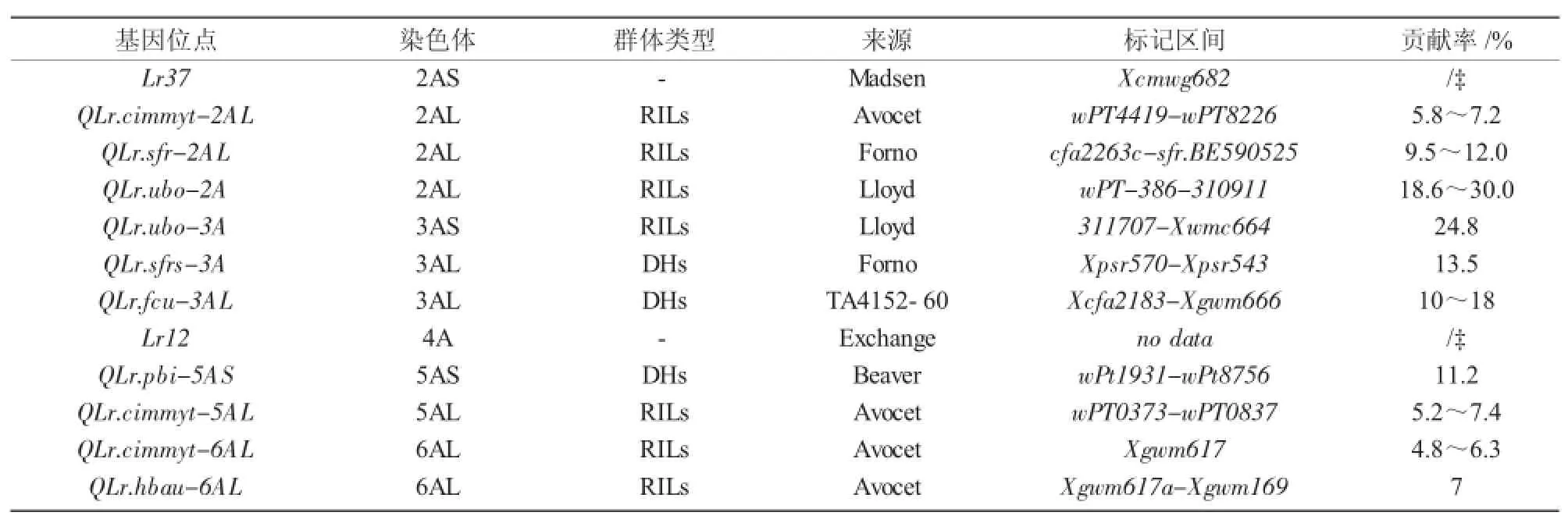
表1 定位于小麦A基因组叶锈病成株抗性基因位点
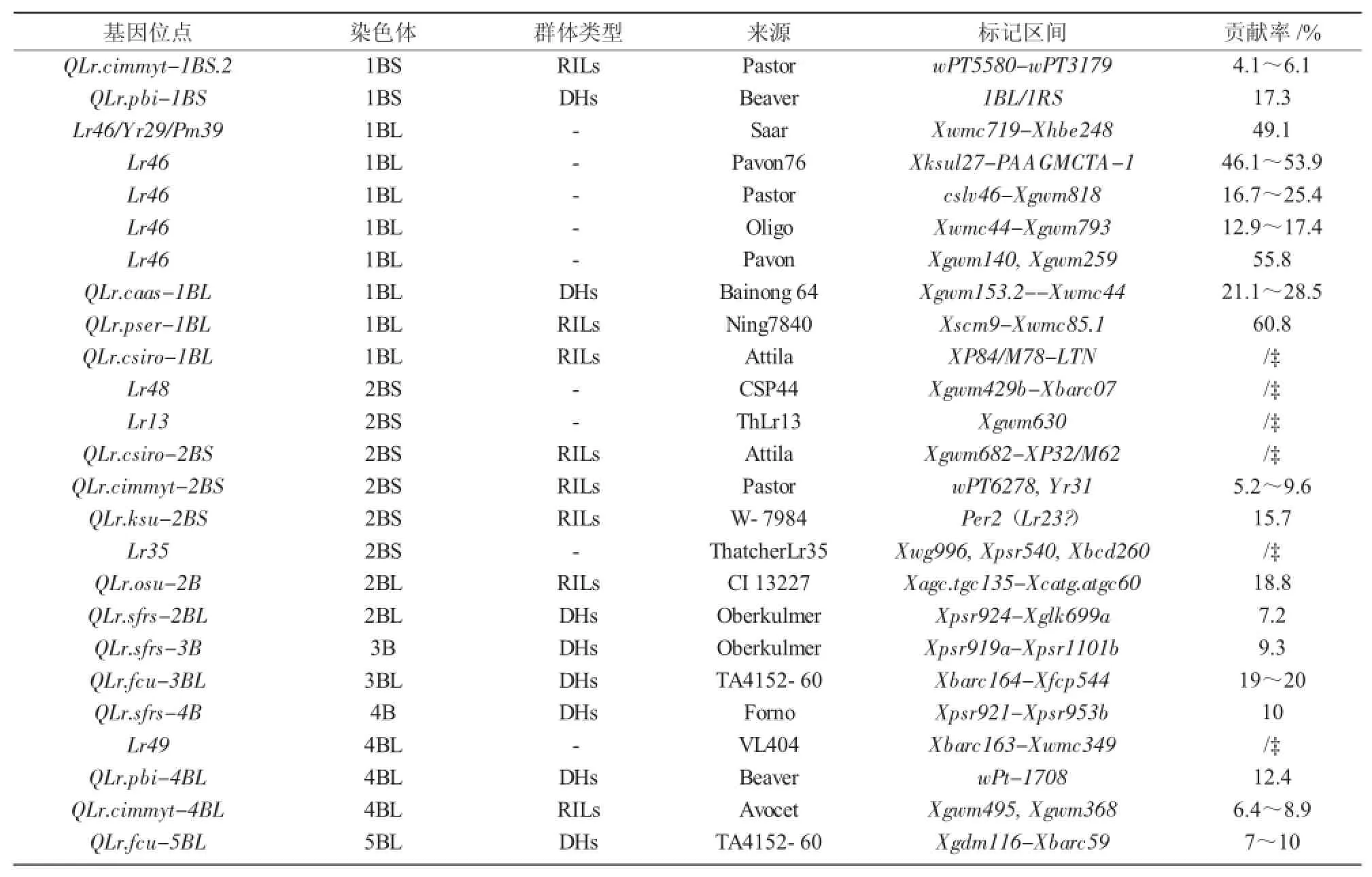
表2 定位于小麦B基因组叶锈病成株抗性基因位点
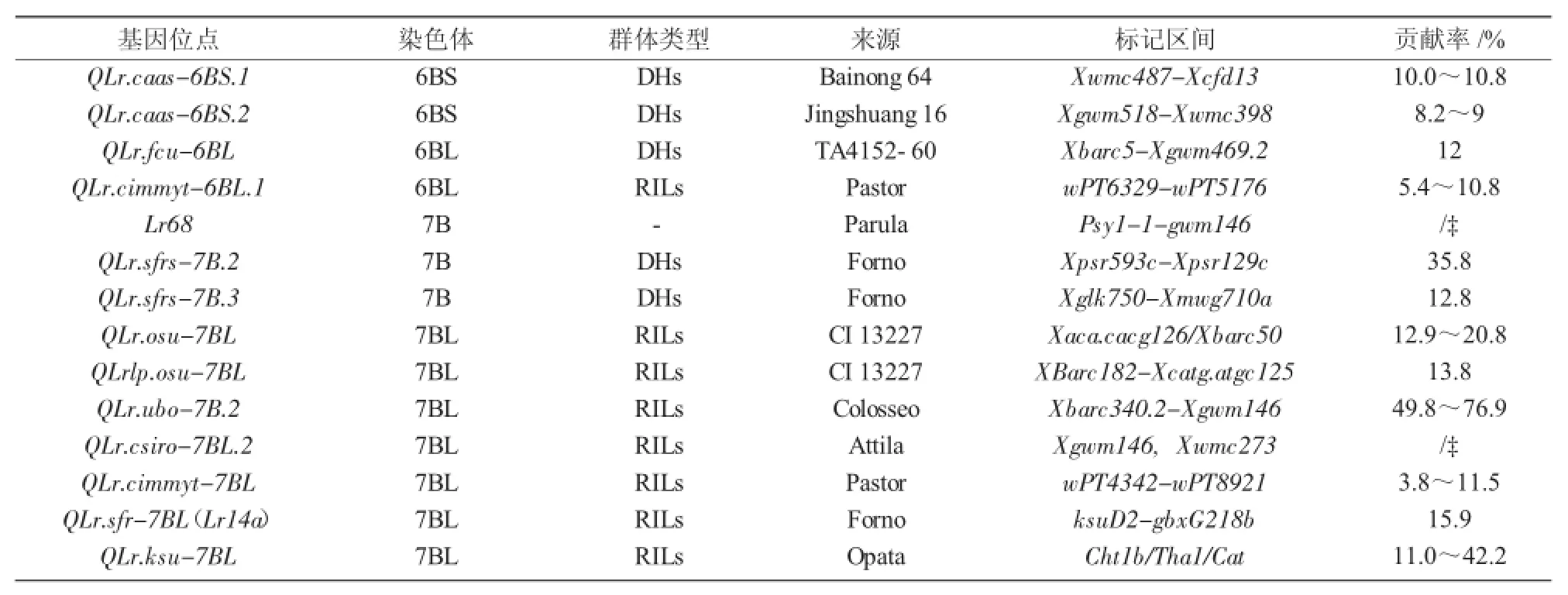
续表2
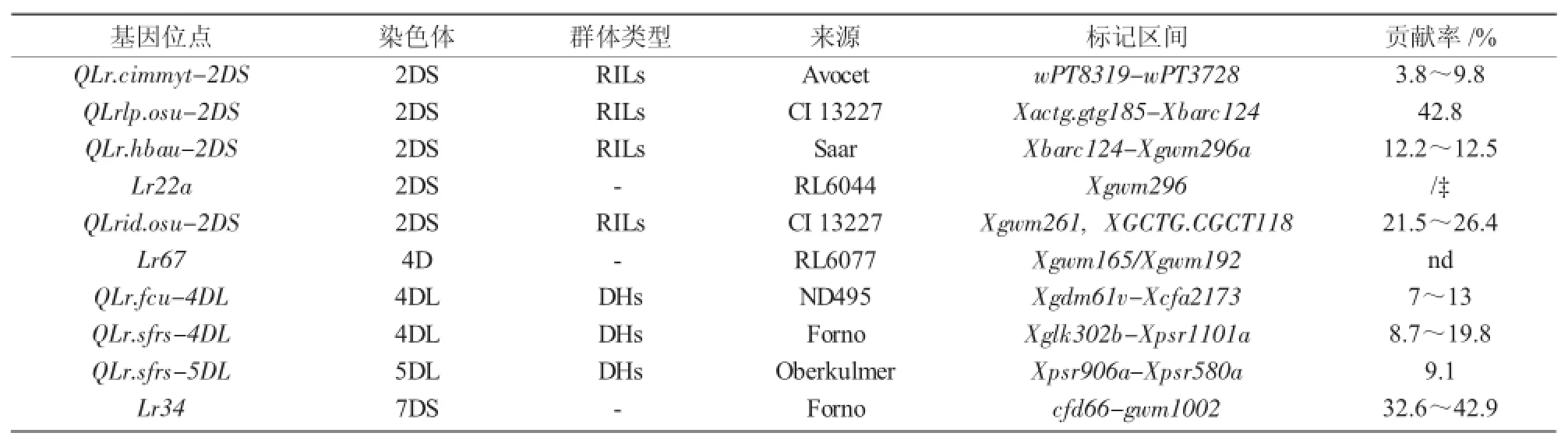
表3 定位于小麦D基因组叶锈病成株抗性基因位点
利用常规QTL连锁图谱和全基因组关联分析(GWAS)可以有效识别与叶锈病相关的成株抗性数量性状位点[16],是目前进行基因发掘、定位和功能分析的主要工具。截至目前,已利用该技术在小麦16条染色体上定位出70个叶锈病成株抗性数量性状位点(表1~3)。其中,B基因组比A和D基因组包含更多的叶锈成株抗性位点,B基因组上有39个抗性位点(表2),A和D基因组分别有12个(表1)和9个(表3),位于染色体1B和7B上的位点最多,分别有10个抗性位点,2B上的次之,有8个。在1A,7A,1D,3D,6D染色体上尚未发现有效的抗性位点。这些抗性位点大多数基因是完全相同或紧密相关的,Somers等[17]将这些抗性位点整合在小麦公用遗传图谱中,同时运用该图谱鉴定了分别位于染色体1BS,2BS,2DS,6BL,7BL上的5个叶锈病成株抗性数量性状位点。总的来说,B基因组比A和D基因组包含更多的叶锈成株抗性数量性状位点。
4 成株抗性基因在小麦育种中的应用及展望
慢锈性是成株抗性的主要表现,将之应用于抗病育种可以有效提高小麦抗病的持久性。位于7DS的成株抗性基因Lr34对叶锈病仅仅只有中等抗性,但其抗性保持了近100 a[18]。位于1BL的Lr46表现为成株期耐锈性[19],其抗性保持了40 a以上。位于4DL的Lr67则表现出与Lr34相似的抗性效果[20]。
从1970年开始,育种家SanjayRajaram和病理学家Jesse Dubin在普渡大学受Ralph Caldwell的启发,在墨西哥国际玉米改良中心小麦育种项目中已经开始使用叶锈病成株抗性基因进行小麦抗病育种改良。其培育的Pavon76对小麦叶锈病中等水平抗性持续了近40 a,成为国际玉米小麦改良中心研究小麦叶锈病成株抗性的代表性品种。然而,直到1980年成功构建成株抗性QTL遗传图谱并将之用于小麦抗病育种后,才使得大规模培育小麦近免疫高产品种成为可能。目前,国际上已开始探索将常规育种与分子标记相结合的一种新型育种方法。首先,将大量的优良品种和高代品系进行田间抗病鉴定,并用基因推导的方法来确定具有叶锈病成株抗性的基因型;在此基础上,选择成株抗性超过50 a的优良品种和地方品种进行数量性状位点分析;然后,使用分子标记方法,通过优良品种间回交把已定位的数量性状位点转移并聚合到同一优良品种中;经过分子标记选择后获得的新品系再经田间鉴定来证实其抗病性和抗病类型。在白粉病抗性育种中,已有研究人员利用这种方法获得了一定的研究成果。Bai等[21]将鲁麦21与百农64杂交结合QTL鉴定,将其对白粉病的成株抗性聚合在一起,在21个F6选系中含有3~5个微效QTL位点。此结果证明,进行QTL聚合育种确实可以选育出具有良好抗性和持久性的小麦新品种。
5 结论
虽然成株抗性比苗期抗性具有更好的持久抗性,但并非所有成株抗性都是数量性状,也有部分成株抗性基因是小种专化型的。例如,成株抗性基因Lr13发布后仅仅几年的时间便在美国和加拿大丧失抗性[22]。许多成株抗性基因,例如Lr34和Lr46在很长时期都能保持其良好抗性。截至目前,国际上正式命名的叶锈病成株抗性基因仅有11个,它们中的大多数都与分子标记有紧密联系,随着A基因组[23]和D基因组[24]序列的公布,高通量和基因组特异性SNP阵列技术得到了迅猛发展,其必将促进叶锈病成株抗性基因的有效鉴定、精细定位与图位克隆。已克隆基因的特异标记将有助于从分子水平上对其抗性进行准确选择,使这些抗叶锈病基因有效应用于小麦抗性育种,丰富了现有的小麦成株慢锈基因库[25]。分子聚合育种技术的快速发展,也有利于增强小麦新品种抗叶锈病的持久性。
[1]薛飞.小麦抗白粉病基因的分子作图及其与白粉菌互作的表达谱分析[D].杨凌:西北农林科技大学,2012.
[2]He Z H,Rajaram S,Xin Z Y,et al.A history of wheat breeding in China[M].Mexico:International Maize and Wheat Improvement Center,2001:1-5.
[3]Khan M,Bukhari A,Dar Z,et al.Status and strategies in breeding for rust resistance in wheat[J].Philipp Agric Sci,2013,4:292-301.
[4]杜咨毅.两个小麦品种抗叶锈病和白粉病QTL研究[D].北京:中国农业大学,2015.
[5]Zhou H X,Xia X C,He Z H,et al.Molecular mapping of leaf rust resistance gene LrNJ97 in Chinese wheat line Neijiang 977671[J]. Theor Appl Genet,2013,126:2141-2147.
[6]任晓娣,杜冬冬,张河山,等.小麦河农6251苗期抗叶锈病基因的鉴定[J].华北农学报,2015,30(3):192-199.
[7]胡延吉.植物育种学[M].北京:高等教育出版社,2003.
[8]韩烨,何中虎,夏先春,等.CIMMYT小麦材料的苗期和成株抗叶锈病鉴定[J].作物学报,2011,37(7):1125-1133.
[9]邢丽芳,李在峰,刘大群.CIMMYT小麦PBW343和Muu中条锈和叶锈成株抗性QTL分析[J].河北农业大学学报,2012(5):45-50.
[10]Herrera-Foessel S A,Lagudah E S,Huerta-Espino J,et al.New slow-rusting leaf rust and stripe rust resistance genes Lr67 and Yr46 in wheat are pleiotropic or closely linked[J].Theor Appl Genet,2011,122(1):239-249.
[11]Singh R P,Huerta-Espino J,Rajaram S.Achieving near-immunity to leaf and stripe rusts in wheat by combining slow rusting resistance genes[J].Acta Phytopathol Entomol Hung,2000,35:133-139.
[12]王竹林,王德森,何中虎,等.小麦品种百农64慢白粉病抗性QTL的定位[J].中国农业科学,2006,39(10):1956-1961.
[13]Collard B C Y,Jahufer MZ Z,Brouwer J B,et al.An introduction tomarkers,quantitative trait loci(QTL)mapping and marker-assisted selection for crop improvement:The basic concepts[J].Euphytica,2005,142:169-196.
[14]Atienzar F A,Jha A N.The random amplified polymorphic DNA(RAPD)assay and related techniques applied to genotoxicity and carcinogenesis studies:Acritical review[J].Mutation Research/Reviews in Mutation Research,2006,613:76-102.
[15]Agarwal M,Shrivastava N,Padh H.Advances in molecular marker techniques and their applications in plant sciences[J].Plant Cell Reports,2008,27:617-631.
[16]Maccaferri M,Sanguineti M C,Mantovani P,et al.Association mapping of leaf rust response in durum wheat[J].Mol Breeding,2010,26:189-228.
[17]Somers D J,Isaac P,Edwards K.A high-density microsatellite consensus map for bread wheat(Triticum aestivum L.)[J].Theor Appl Genet,2004,109:1105-1114.
[18]白小军,王宪国,陈东升.宁夏小麦品种慢锈基因Lr34/Yr18的分子检测[J].麦类作物学报,2014,34(11):1480-1484.
[19]赵爱萍.中国小麦品种绵阳351-15成株抗叶锈QTL分析[D].保定:河北农业大学,2013.
[20]Hiebert C W,Thomas J B,McCallum B D,et al.An introgression on wheat chromosome 4DL in RL6077(Thatcher*6/PI 250413)confers adult plant resistance to stripe rust and leaf rust(Lr67)[J]. Theor Appl Genet,2010,121:1083-1091.
[21]Bai B,He Z H,Asad M A,et al.Pyramiding adult-plant powdery mildew resistance QTLs in bread wheat[J].Crop&Pasture Science,2012,63(7):606-611.
[22]Pretorius ZA,王绍坤.苗期鉴定小麦抗叶锈病基因Lr13[J].麦类作物学报,1985(3):31-32.
[23]Jia J Z,Zhao S C,Kong X Y,et al.Aegilops tauschii draft genome sequence reveals a gene repertoire for wheat adaptation[J].Nature,2013,496:91-95.
[24]Ling H Q,Zhao S C,Liu D C,et al.Draft genome of the wheat A-genome progenitor urartu[J].Nature,2013,496:87-90.
[25]郑嫚嫚,王翠芬,李欢,等.CIMMYT小麦Pavon76和PBW343叶锈成株抗性QTL分析[J].河南农业科学,2014,43(1):74-78.
Research Progress and Prospects of Wheat Leaf Rust Adult-plant Resistance
ZHANGXiao-hui1,CHANGZhi-jian2,3,QIAOLin-yi2,GUOHui-juan2,ZHANHai-xian2,LI Xin2,RENYong-kang2,ZHANGXiao-jun2
(1.College ofBio-engineering,Shanxi University,Taiyuan 030006,China;2.Shanxi Province KeyLaboratoryofCrop Genetics and Molecular Improvement,Institute ofCrop Sciences,Shanxi AcademyofAgricultural Sciences,Taiyuan 030031,China;3.KeyLaboratory ofCrop Gene Resources and GermplasmEnhancement on Loess Plateau,MinistryofAgriculture,Taiyuan 030031,China)
Leaf rust,caused by Puccinia triticina,is a widespread fungal diseases of wheat(Triticum aestivum L.),which is also one of the main diseases of wheat in China.It divides into seedling resistance,which has good race specific resistance and adult plant resistance,which has better durability,so the selection of adult plant varieties is crucially important to reduce the losses of production caused by leaf rust.This paper mainly summarizes the research progress and development status of adult plant resistance to wheat leaf rust,and the prospect of the application of leaf rust resistance genes in wheat breeding is also discussed.Seventy leaf rust APR quantitative trait loci(QTL)have been reported on 16 chromosomes,in which 11 loci located on chromosomes 1BS,1BL,2AL,2BS(2), 2DL,4DL,5BL,6AL,7BL,7DS showing pleiotropic effects on resistance to leaf rust.With the increase of molecular markers types and improvement of sequencing technology,especially the advent of high-throughput gene typing technology,which will promote the fine mapping and cloning of quantitative trait loci.These leaf rust resistance genes effectively use will promote to quickly apply in wheat resistance breedingand develop the durabilityofthe newvarieties ofwheat leafrust resistance.
wheat leafrust;seedlingresistance;adult-plant resistance;QTL;molecular marker
S435.121.4+3
A
1002-2481(2016)04-0552-05
10.3969/j.issn.1002-2481.2016.04.33
2015-12-21
山西省科技攻关项目(20150311001-1);山西省财政支农项目(2015ZYZX-03);山西省青年基金项目(2015021145);山西省农业科学院重点项目(YZD1501);山西省农业科学院科技攻关项目(15YGG01)
张小辉(1991-),男,山西孝义人,在读硕士,研究方向:小麦遗传育种。张晓军为通信作者。
