玻璃化保护液处理下高粱离体花粉的活力解析
2017-01-06李珍田承华赵宁胡振鑫何祥坤张秦莹于美珍张生万田怀东
李珍,田承华,赵宁,胡振鑫,何祥坤,张秦莹,于美珍,张生万,田怀东,3
(1.山西大学生命科学学院,山西太原030006;2.山西省农业科学院高粱研究所,山西晋中030600;3.山西景康农业技术推广有限公司,山西太原030000)
玻璃化保护液处理下高粱离体花粉的活力解析
李珍1,田承华2,赵宁1,胡振鑫1,何祥坤1,张秦莹1,于美珍1,张生万1,田怀东1,3
(1.山西大学生命科学学院,山西太原030006;2.山西省农业科学院高粱研究所,山西晋中030600;3.山西景康农业技术推广有限公司,山西太原030000)
为了确立可显著提高高粱花粉体外存活的水性环境条件,设计了离体高粱花粉所处的干燥(CK)、磷酸盐溶液(PBS)、玻璃化保护液1(PVS1)、玻璃化保护液2(PVS2)、玻璃化保护液3(PVS3)等5种环境;采用TTC法,对4种水性溶液体系中浸渍处理15 min后的高粱花粉和干花粉的存活率进行了比较分析。结果显示,各状态下离体高粱花粉存活率大小依次为PBS<PVS3<PVS2<PVS1<CK;与PBS中的花粉存活率相比,PVS3对花粉存活率提高不显著,PVS1和PVS2可显著提高花粉存活率。表明水性环境对离体花粉的活力有显著的损伤效果;3种保护液中的甘油、乙二醇、二甲基亚砜、蔗糖等对高粱离体花粉活力有保护作用,其中,含有这4种成分的PVS1对水性环境高粱离体花粉的活力保护效果最好。研究结果有望为水性环境下高粱花粉生殖细胞基因的诱变提供技术支撑。
高粱;花粉;玻璃化保护液;离体活力
作物种质资源是人类赖以生存的基础性生物资源,在农业、酿造、饲料、能源、食品、医药等多种领域中被广泛利用[1]。作物种质资源的创新对于遏制作物品种培育与生产活动中存在的种质多样性弱化、栽培环境恶化、营养品质单一化等不良趋势以及满足作物资源的多样化社会需求具有重大的现实意义[2]。而人工诱变技术的开发与利用是作物种质创新的一种有效途径[3-4]。
国内外采用的人工诱变法主要包括重组DNA创制法、物理诱变法与化学诱变法。其中,化学诱变技术是使用烷化剂、叠氮化钠、碱基化合物等诱变剂处理植株的器官、组织或细胞,从而诱发遗传物质发生变异,具有操作简便、成本低、相对安全、染色体损伤小、基因变异率高、突变幅度大等优点[5-7]。所以,在作物育种由基因组学向蛋白组学转向的新时代,化学诱变技术无疑是一种创制具有良好应用前景的基因诱变技术。截至目前,国内外主要使用EMS[8],MNU[9]等化学诱变剂,用于水稻、小麦、玉米等农作物的组织器官或受精卵细胞、生殖细胞的诱变处理。其中,对作物花粉的离体诱变处理是提高作物化学诱变效率的一个主要方向。在对花粉的离体诱变处理中,诱变剂发挥效应的溶剂环境主要是有机溶剂环境:Coe[10]首先报道,液体石蜡油可用于短期保存花粉而不影响其生命力;随后,Neuffer[11]将此发现加以延伸,把石蜡油作为化学诱变剂的载体,处理玉米花粉,获得成功,突破了化学药剂不能直接诱变花粉的瓶颈,该方法是当今国外诱变花粉的主要手段之一[12]。但是离体花粉的水性环境诱变处理还未见详细报道。日本学者Satoh等[13]使用pH值4.8~5.2的MNU磷酸盐溶液(1.0 mmol/L)、避光条件下对水稻品种(金南风/台中65号)穗部进行了诱变处理,成功实现了对其受精卵DNA的有效诱变和突变体的开发。经过对比发现,MNU的诱变效率远远高于以石蜡油为溶剂载体的EMS的诱变效率[14]。因此,如何提高水性环境体系下花粉的活力,成为进一步开发高效的离体高粱花粉生殖细胞基因MNU诱变技术亟待解决的难题。
高粱是我国重要的旱地农作物之一,开展对其花粉的诱变处理技术,对高粱种质资源创新与优异品种培育具有重要的意义。本研究对预先设计的4种水性环境下离体高粱花粉的存活率进行比较分析,以探索出一种可显著提高其活力的适宜保护液配方,将为高粱的遗传育种提供数据及技术支撑。
1 材料和方法
1.1 供试材料
选取高粱m02-16作为供试材料,在山西省农业科学院高粱研究所试验基地种植,采集盛花期花粉用于试验。
1.2 试验方法
1.2.1 用于离体高粱花粉处理的水性环境设计高粱花粉离体处于水性环境时,极易吸水胀破,活力降低。Gayle等[15]报道,甘油(Glycerol)、乙二醇(EG)、二甲基亚砜(DMSO)、蔗糖(Suc)4种成分对身体细胞具有保护作用。冯慧云等[16]报道,Glycerol与水分子具有较好的亲和性,并且能在组织细胞外壁形成一层保护膜,有利于减少水分子的侵入和外界的机械损伤,Sommerfeld等[17]报道,EG容易渗透进入细胞,降低胞内盐溶质浓度,置换部分自由水,发生水合作用。方志聪等[18]报道,DMSO能够减轻羟基自由基对细胞的破坏,改变生物膜对电解质等的通透性,弱化水分子进入细胞,从而起到保护作用。蔗糖分子量较大,不能渗入细胞内,对于维持细胞内外正常渗透压、防止细胞过度膨胀具有重要意义[15-18]。根据这些报道,本研究设计磷酸盐(PBS)与3种保护液(PVS)构建4种水性环境(表1)。

表1 4种水性环境主要配方及组成成分%
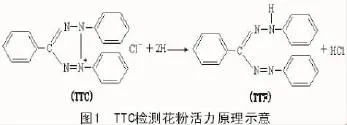
1.2.2 各状态下离体高粱花粉的活力测定采用TTC法测定花粉活力,原理如图1所示。参考崔桂梅等[19]报道的方法,配制含有0.1 mol/L磷酸盐的2%TTC溶液(pH值7.2)进行染色,显微镜下检测离体高粱花粉的胀破率和存活率。
花粉胀破率=破裂的花粉粒数/总的花粉粒数×100%;花粉存活率=显红色的花粉粒数/总的花粉粒数×100%。
1.3 数据分析
采用SPSS 19.0数据软件对各状态下离体高粱花粉活力的显著性进行分析;采用Duccan检验法进行P<0.05水平上的显著性分析。数据采用平均值±标准差(Mean±SEM)表示。
2 结果与分析
2.1 各状态下离体高粱花粉活力分析
由表2,3可知,刚收集到的干花粉活力很高,经过PBS处理后,花粉胀破率高达62.33%,存活率急剧降低,仅为33.53%;经3种配方PVS处理后,胀破率均有所下降但存活率有所上升(具体大小表现为CK>PVS1>PVS2>PVS3>PBS)。其中,研究发现,相应组的胀破率与存活率之和并非为100%,原因是因为数据统计过程中会存在偶然误差:小于100%是由于有些花粉粒并未着色但是没有破裂,大于100%是由于有些已着色的花粉粒观察过程中随时间推移消耗花粉粒出现破裂。总之,TTC检测结果说明保护液处理后有助于提高离体高粱花粉存活率。

表2 不同处理下花粉胀破率比较%

表3 不同处理下花粉存活率比较%
2.2 各状态下离体高粱花粉活力的显著性分析
使用SPSS 19.0数据分析软件,对表2,3进行Duncan显著性分析得出,干花粉和4种水性环境下离体高粱花粉胀破率和存活率的变化特征,如图2,3所示。

由图2,3可知,与CK相比,经过PBS处理后离体高粱花粉活力显著降低,存活率与胀破率呈负相关;经过保护剂处理后,三者活力与PBS相比均有所上升,其中,PVS1,PVS2与PBS相比,对离体高粱花粉存活率的影响均显著,且PVS1>PVS2;PVS3与PBS相比,对离体高粱花粉存活率的影响不显著。说明PVS1配方保护液能够显著提高水性环境离体高粱花粉的存活率。
2.3 PBS与PVS1处理离体高粱花粉的形态学分析
PBS与PVS1保护液处理后离体高粱花粉TTC染色结果分别如图4所示。经PBS浸渍处理后,离体高粱花粉明显出现大量胀破现象,且花粉内容物外流(如箭头所示),花粉颗粒呈现黑色或近透明色,说明该条件下高粱花粉存活率极低(图4-A)。

经PVS1保护液处理后,高粱花粉虽仍有内容物外流现象,但胀破情况出现明显改观,花粉颗粒大部分呈现出洋红色,形态保持相对完整(如箭头所示),存活率提高(图4-B)。从形态上分析表明,PVS1保护液处理能够显著提高水性环境下离体高粱花粉的存活率。
3 结论与讨论
据报道,Glycerol,EG,DMSO,Suc等4种物质对细胞具有保护作用[15-18]。本研究结果表明,含有Glycerol,EG,DMSO或Suc成分的PVS溶液可不同程度保护离体花粉活力;其中,混合使用4种成分的PVS1保护液可显著降低水分对离体高粱花粉的损伤,对花粉活力的保护效果最好。期望在此配方的基础上,能进一步对化学诱变处理环境进行全面分析、设计与实施。截至目前,作物组织细胞的化学诱变处理环境主要有有机溶剂环境与水性环境。EMS-石蜡油是当今国内外主要使用的有机诱变环境;而Satoh等[20]的水稻受精卵基因的MNU诱变研究表明,MNU是一种水性环境下对细胞基因的高效诱变剂。本研究结果有望为水性溶液环境下的高粱生殖细胞基因的诱变提供借鉴,对于高粱的种质创新与优异品种培育具有重要的意义。
[1]杨克诚.21世纪种质资源创新与利用的思考[C]//中国玉米品种科技论坛论文集.合肥:全国农业科技推广服务中心,2007.
[2]卢新雄,陈晓玲.我国作物种质资源保存研究进展[J].中国农业科学,2003,36(10):1125-1132.
[3]韦祖生,李开绵.作物诱变育种及突变体鉴定与筛选研究进展[J].江西农业学报,2007,19(10):38-41.
[4]王元东,赵久然,郭景伦,等.诱变育种在创造玉米新种质中的应用[J].北京农业科学,1999,17(2):12-16.
[5]赵永亮,宋同明,马惠平.利用花粉化学诱变快速创造特用玉米新种质[J].作物学报,1999,25(2):157-161.
[6]Шепель Н А,盛殿阁.高粱的化学诱变育种[J].国外农学:杂粮作物,1981(1):18-23.
[7]李清国,付晶,钮力亚,等.化学诱变及其突变体筛选在育种中的应用[J].河北农业科学,2010,14(5):68-72.
[8]刘治先,Allen D Wright,Ming T Chang.高油酸玉米突变体的诱导和遗传分析[J].作物学报,1998,24(4):447-451.
[9]Satoh H,Omura T.Induction of mutation by the treatment of fertilized egg cell with N-mthyl-N-nitrosourea in rice[J].J Fac Agr Kyushu Univ,1979,24:165-174.
[10]Coe E H Jr.Liquid media suitable for suspendingmaize pollen before pollination[J].Proc MoAcad Sci,1976,3:7-8.
[11]Neuffer M G.Chemical mutagens in mineral oil very effective on corn pollen[J].Maize Genet Coop Newa Lett,1968,42:124.
[12]Neuffer MG.Paraffin oil technique for treatimg mature corn pollen with chemical mutagens[J].Maydica,1978,22:21-28.
[13]Satoh H,Nishi A,Fujita N,et al.Isolation and characterization of starch mutants in rice[J].J Appl Glycosci,2003,50:225-230.
[14]Satoh H,Matsusaka H,Kumamaru T.Use of N-methyl-N-nitrosourea treatment offertilized eggcells for saturation mutagenesis ofrice[J].BreedingScience,2010,60:475-485.
[15]Gayle M Volk,Jackie L Harris,Kate E Rotindo.Survival of mint shoot tips after exposure to cryoprotectant solution components[J]. Cryobiology,2006,52:305-308.
[16]冯慧云,余立祥,刘星海,等.甘油对离子注入动物细胞的保护效应[J].中国科学院研究生学报,2002,19(4):372-375.
[17]Sommerfeld V,Niemann H.Cryopreservation of bovinein vitro produced embryos using ethylene glycol in controlled freezing or vitrification[J].Cryobiology,1999,38(2):95-105.
[18]方志聪,戚智.二甲基亚砜对生物膜的作用机理[J].生物物理学报,2012,28(8):638-643.
[19]崔桂梅,孙毅.玉米花粉体外萌发方法改进及其对花粉介导转基因的作用[J].植物学报,2012,47(2):155-161.
[20]Satoh H,Omura T.Newendosperm mutations induced by chemical mutagens in rice,Oryza sativa L.[J].Japn J Breed,1981,31(3):316-326.
Analysis on Sorghum Pollens Viabilityin vitroTreated in Protective Solution of Vitrification
LI Zhen1,TIANCheng-hua2,ZHAONing1,HUZhen-xin1,HE Xiang-kun1,ZHANGQin-ying1,YUMei-zhen1,ZHANGSheng-wan1,TIANHuai-dong1,3
(1.College ofLife Sciences,Shanxi University,Taiyuan 030006,China;2.Institute ofSorghum,Shanxi AcademyofAgricultural Sciences,Jinzhong030600,China;3.Shanxi JingKangAgricultural TechnologyPromotion Co.,Ltd.,Taiyuan 030000,China)
To establish the suitable aqueous environmental conditions for significantly improving the viability ofsorghum pollens in vitro,five kinds of in vitro systems were designed which were dry(CK),phosphate buffer solution(PBS),protective vitrified solution 1(PVS1),protective vitrified solution 2(PVS2),protective vitrified solution 3(PVS3).The pollens viability of sorghum in four aqueous environmental systems,soaked 15 minutes,were compared with CKpollen byusingTTCmethod.The results showed that the sort order of pollen viabilitywas as follows:PBS<PVS3<PVS2<PVS1<CK.In comparison with the pollen viabilityin PBS,PVS3 had noobviously effect,but PVS2 and PVS1 significantly improved the pollen viability in vitro.These results indicated that the viability of the pollens in vitro were significantly decreased in the aqueous environment systems and the three kinds of PVS,containing glycerol,ethylene glycol, DMSO,sucrose,had obvious protective effects on the pollen viability in vitro of sorghum.Therefore,the PVS1,containing these four components,had more significantly effects for raising the pollen viability in aqueous environment systems.The results could provide technical support for the mutagenesis ofgenes ofsorghumpollen germcells in aqueous system.
sorghum;pollen;vitrification protection solution;viability in vitro
S514
A
1002-2481(2016)04-0463-04
10.3969/j.issn.1002-2481.2016.04.10
2016-01-27
山西省科技创新计划项目(2014101025)
李珍(1989-),女,山西临汾人,在读硕士,研究方向:作物遗传资源。田怀东为通信作者。
