花粉介导的花青素调节基因NtAn2转化玉米研究
2017-01-06郭天璐张欢欢杜建中郝曜山崔贵梅王亦学孙毅
郭天璐,张欢欢,杜建中,郝曜山,崔贵梅,王亦学,孙毅,
(1.山西大学生物工程学院,山西太原030006;2.山西省农业科学院生物技术研究中心,山西太原030031)
花粉介导的花青素调节基因NtAn2转化玉米研究
郭天璐1,张欢欢2,杜建中2,郝曜山2,崔贵梅2,王亦学2,孙毅1,2
(1.山西大学生物工程学院,山西太原030006;2.山西省农业科学院生物技术研究中心,山西太原030031)
利用超声波辅助花粉介导法将花青素基因NtAn2导入玉米自交系郑58,并优化超声波辅助花粉介导基因转化方法的遗传转化体系。以新鲜的郑58玉米花粉为试验材料,检测其在不同浓度的蔗糖溶液中的体外萌发率;通过正交试验设计,对超声波处理功率、处理时间、处理次数3个因素进行优化,以确定最优转化组合;对收获的籽粒进行PCR检测。结果表明,玉米自交系郑58的花粉最适宜的蔗糖溶液浓度为20%;超声波处理最佳参数为:处理功率150 W,处理时间5 s/次,处理次数6次;PCR分子检测表明,其中有3粒含有阳性条带,且这3粒中有2粒呈紫色,初步证实,NtAn2已被整合到玉米基因组中,并且可以被用于对转化子的直观筛选。研究确立了超声波辅助花粉介导法遗传转化的最佳体系,为提高该植物基因转化方法的效率奠定了基础。
超声波;花粉介导;转基因;玉米
作物转基因研究对于提高其产量、抗病虫能力、抗逆性和改进品质等方面具有重要意义。但由于该项技术在食品和环境安全方面尚存在较大争议,因此,在更大范围内应用还存在一定的障碍。产生争议的原因之一是,转基因操作中常用的选择标记基因一般为对除草剂或抗生素有抗性的基因及一些能产生对植物细胞有毒害作用的代谢产物的基因[1]。
花青素(Anthocyanin)是一类广泛存在于植物中的天然水溶性色素,属于黄酮酚类化合物。花青素具有多种植物生理功能,其不仅可以帮助植物授粉、传播种子,同时也可以保护果实,帮助其抵御紫外线、强光及低温等自然伤害[2]。花青素具有抗氧化作用,能够抑制人体内胆固醇沉积,预防动脉硬化,抗衰老,维持血压稳定,预防血管疾病,改善肝功能等。因此,近年来,花青素在医疗、食品以及安全色素等方面都成为人们研究的热点。从转基因植物营养和安全性的方面来考虑,用花青素作为标记对人和动物是有益而无害;由于其在植物中广泛存在,它对自然环境也是安全的。
目前,转基因方法仍然以农杆菌介导法和基因枪法为主,但这2种方法均须经过组织培养过程。农杆菌的宿主植物大多为双子叶植物,因此,在使用农杆菌介导法进行基因转化时,常常受到这种宿主特异性的限制,导致有些植物种特别是一些重要的禾本科植物和豆科植物的转基因研究进展缓慢。而基因枪转化法则由于一些植物种或品种的组织培养再生困难而具有很大的局限性。同时,由于植物组织培养过程中易造成体细胞变异、再生苗移栽过程中夭亡等,使本来就不高的转化率又大打折扣。这些都极大地限制了转基因技术的广泛应用。因此,不需要繁杂的植物组织培养过程,且操作简单、高效的转基因方法是诸多研究者一直努力寻求的目标。
花粉介导转基因方法的提出则引起了许多研究者的关注及兴趣[3],其操作简便、成本低、避免了组织培养的繁杂过程,且无基因型依赖。该方法以花粉这一天然转化载体实现外源基因转化,是我国具有自主知识产权的转基因技术。目前,这一转基因技术已在玉米、油菜、高粱、花生、野罂粟等植物上得到了成功的应用[4-8]。超声波辅助花粉介导法的关键是既要兼顾花粉的活力,同时又要将外源DNA导入花粉,使其随花粉的萌发导入植物胚囊,参与有丝分裂,最后直接得到转基因种子[9]。因此,花粉体外萌发试验对利用花粉作为载体介导植物的转基因方法中各项参数的建立具有非常重要的意义。
本研究将含有花青素表达基因NtAn2的植物表达载体通过超声波辅助花粉介导法导入玉米,在超声波处理前后分别检测花粉的生活力,以优化花粉处理体系中的各项参数,从而达到对试验条件的优化、提高转化效率的目的。本研究所采用的花粉介导法是一种经济、有效、实用的转化方法,同时利用花青素作为直观可视标记的特点,也可大大地提高转基因筛选的效率。
1 材料和方法
1.1 材料
供体材料:选用玉米(Zea mays L.)自交系郑58(5月上旬播种,盛花期始于7月中旬),在玉米散粉期收集试验所需花粉,该自交系材料由山西省农业科学院生物技术研究中心提供。
受体材料:植物表达载体为pCAMBIA2300,含有卡那霉素筛选基因和目的基因NtAn2(图1),由美国肯塔基大学植物与土壤系袁凌教授提供。
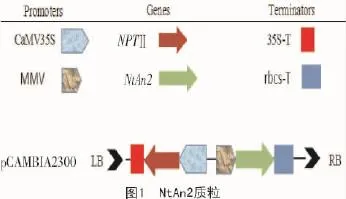
1.2 方法
1.2.1 花粉体外萌发培养基制备研究使用的是已优化的花粉粒培养基配方[9-10],可以促进花粉的萌发和生长,且存活率较高,配方如下:蔗糖,50 mg/L H3BO3,300 mg/L CaCl2,200 mg/L MgCl2,100 mg/L KNO3和35 mg/L赤霉素。
1.2.2 花粉体外萌发蔗糖浓度的优化蔗糖溶液在花粉介导转基因方法的试验中起着至关重要的作用,它既可维持花粉细胞的正常渗透压,同时又可提供花粉需要的碳源。蔗糖溶液作为媒介使花粉与外源DNA充分接触。不同的植物品种和环境条件对花粉所需蔗糖浓度存在差异。试验设置0,10%,15%,20%,30%,40%,50%共7个蔗糖溶液梯度;取新鲜玉米花粉0.2 g放在一定浓度的蔗糖溶液中,室温静置2 h,显微镜下观察花粉的萌发情况,随机选取8个视野的花粉粒进行计数。
花粉萌发率=萌发花粉粒个数/总花粉粒数×100%。
1.2.3 转化处理花粉的超声波参数的优化Joersbo[11]研究表明,超声波处理时瞬间的空化作用可使得外源DNA进入花粉,在转化过程中,超声波处理参数是影响花粉活力和转化效率的关键。处理强度过高,会影响花粉的萌发,导致萌发率降低并直接影响结实率;处理强度过低,外源基因则不能转化花粉,使转化率降低。为了探讨超声处理与花粉萌发之间的相关性,采用正交设计,包括超声波处理时间、超声波功率、超声波处理次数3个因素,每因素3个水平(表1),试验采用L9(34)正交表,共有9个处理,每个处理3次重复。取新鲜花粉0.2 g悬浮于20 mL的1.2.2试验所得最佳浓度的蔗糖溶液中,在超声波处理后,室温静置2 h后对其在光学显微镜下观察。

表1 超声波处理正交试验因素与水平
1.2.4 转化方法将玉米自交系郑58于2014年5月上旬播种,7月上中旬开花抽丝前将雌穗套袋隔离。在盛花期的10:00—12:00取当日散出的新鲜花粉,并将其置于20 mL的20%的蔗糖溶液中,并在一定的超声波处理后加入质粒DNA再进行第2轮超声波处理;然后将处理过的花粉涂抹于之前套袋隔离的玉米雌穗花丝上,并套袋挂牌标记。
1.2.5 转基因植株DNA提取及PCR检测用CTAB法提取玉米叶片的总DNA,用提取的DNA进行PCR扩增,以含目的基因的质粒作为阳性对照,以非转基因的植株叶片总DNA作为阴性对照。根据NtAn2基因序列设计特异性引物序列:上游引物为5′-ATGAATATTTGTACTAATAAG-3′;下游引物为5′-TCAACTGAGAAGTGGCATTTC-3′。PCR反应体系为20 μL。PCR扩增程序:94℃预变性10 min;94℃变性40 s,56℃退火30 s,72℃延伸1 min,共35个循环;72℃终延伸10 min。对PCR扩增产物采用1.0%琼脂糖凝胶电泳检测。
2 结果与分析
2.1 花粉体外萌发蔗糖浓度的优化
适当浓度的蔗糖溶液作为介质既可以保证花粉的正常膨压,又能促进其萌发。由表2可知,当蔗糖浓度<20%时,随着蔗糖浓度的升高,花粉体外萌发的数量增加;当蔗糖浓度达到20%时,花粉的萌发率达到了最大,平均萌发率达到76.49%;之后随着蔗糖溶液浓度的升高,花粉萌发率呈下降趋势。当蔗糖溶液浓度达到30%时,花粉出现了大量的质壁分离,破裂较多。由此可知,当溶液浓度>20%时对萌发起抑制作用,且各蔗糖溶液浓度对花粉萌发率的影响差异显著(P<0.05)。可见,蔗糖溶液浓度是影响花粉体外萌发率的重要因素。
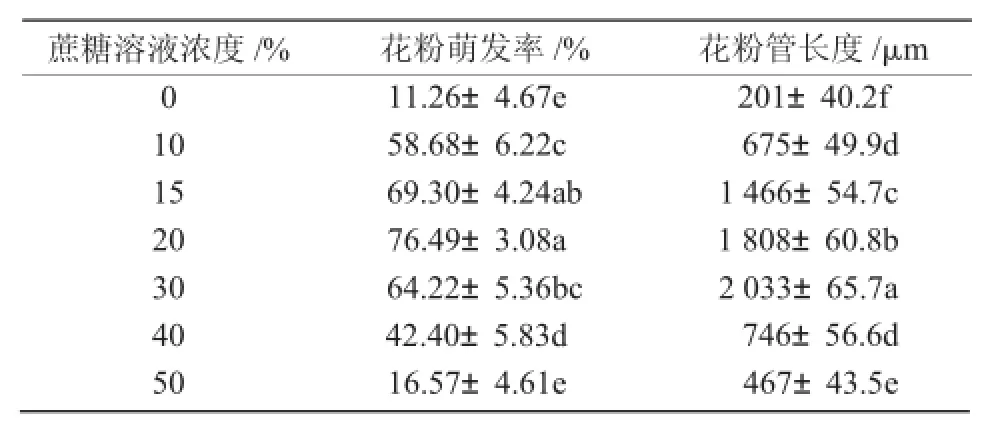
表2 玉米花粉在不同浓度蔗糖溶液中的体外萌发
2.2 花粉体外萌发超声波功率的优化
超声波处理是利用超声波瞬间释放的高能增加花粉通透性,使其处于感受态,以促进外源DNA进入花粉。但超声波处理对花粉的损伤较严重,会影响结实率。因此,应选择适宜的超声波处理参数(强度、时间、次数)以兼顾花粉的活力及外源DNA的导入。从表3可以看出,超声波各参数对花粉体外萌发率影响程度的大小顺序是:超声波次数>超声波功率>超声波时间。进一步对正交试验结果进行方差分析,其结果与直观分析结果一致,影响花粉体外萌发率的各因素中超声波的次数及超声波的功率都呈显著差异,而超声波的处理时间5,10,15 s之间差异不显著(表4)。
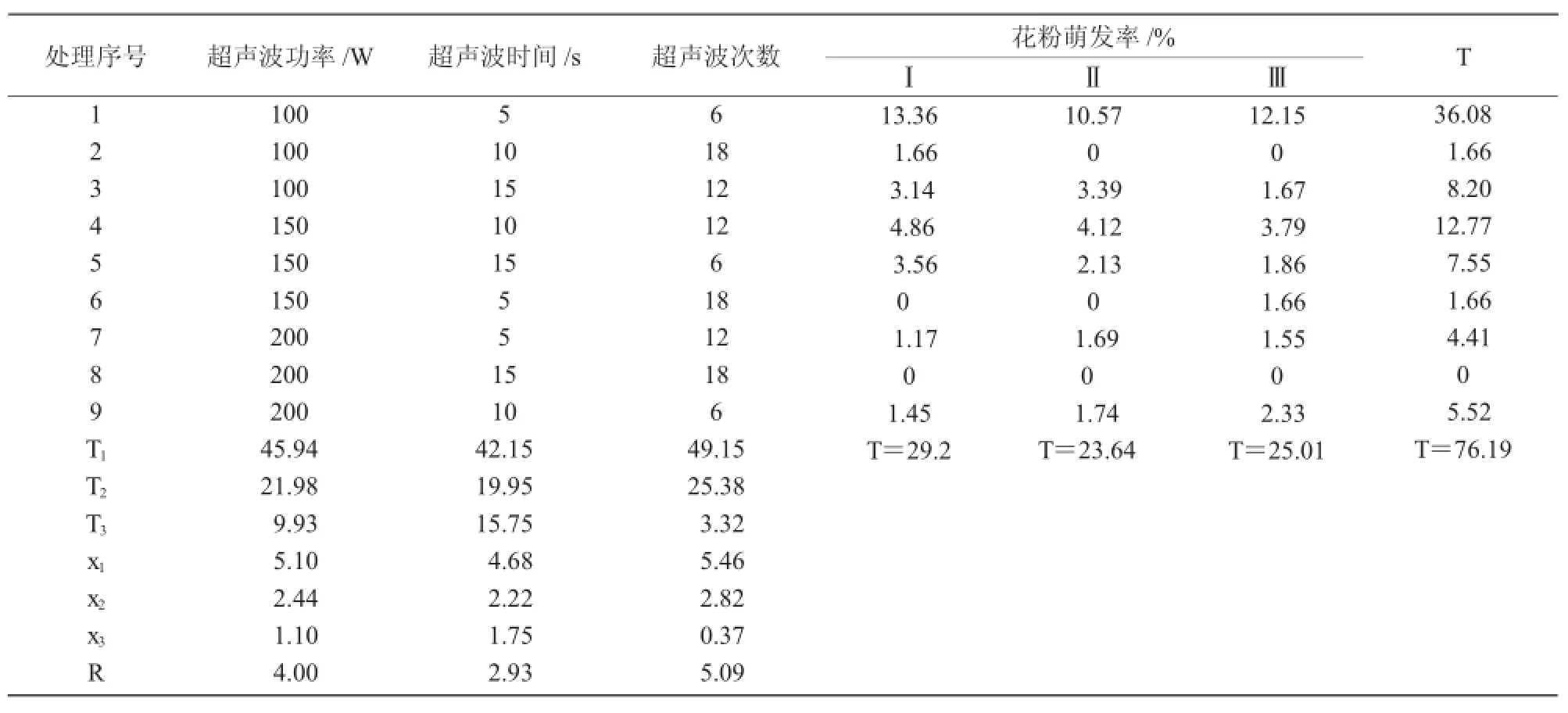
表3 不同超声波处理对花粉萌发率影响的直观分析

表4 超声波处理对花粉萌发率影响的方差分析
2.2.1 超声波功率对花粉体外萌发的影响由表5,6可知,随着超声波功率的加强,花粉的体外萌发率呈下降趋势,平均萌发率从4.78%下降到0.89%,且呈显著相关(P<0.05)。不同超声波功率间多重比较(LSD)结果说明,随着超声波的强度加大,花粉的萌发率都会下降,超声波功率为100 W时,花粉体外萌发率达到最佳,且与功率为150 W之间差异不显著,但与200 W之间的差异显著(表6)。
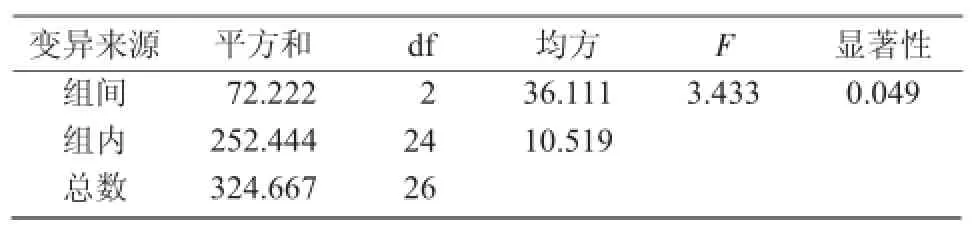
表5 超声波功率对花粉体外萌发率影响的方差分析
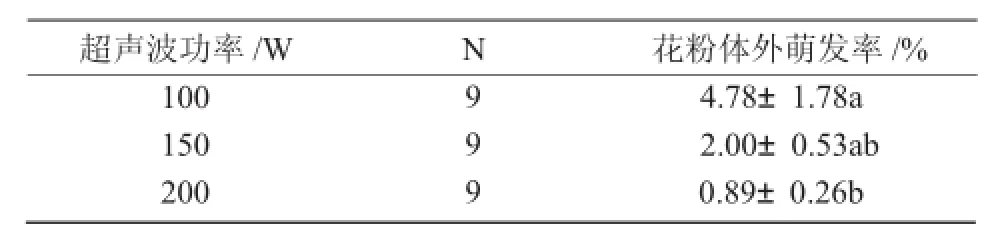
表6 超声波功率对花粉体外萌发率影响的多重比较(LSD)
2.2.2 超声波时间对花粉体外萌发的影响从图2可以看出,当超声波的处理时间从每次5 s增加到15 s时,花粉的体外萌发率呈下降趋势;当超声波处理时间为5 s/次时,花粉体外萌发率均值最高,为4.44%。超声波处理时间对花粉体外萌发率影响方差分析表明,不同的超声波处理时间对花粉体外萌发率存在一定的差异,但未达到显著水平(P>0.05)(表7)。
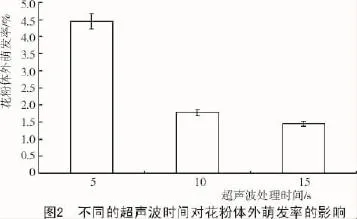
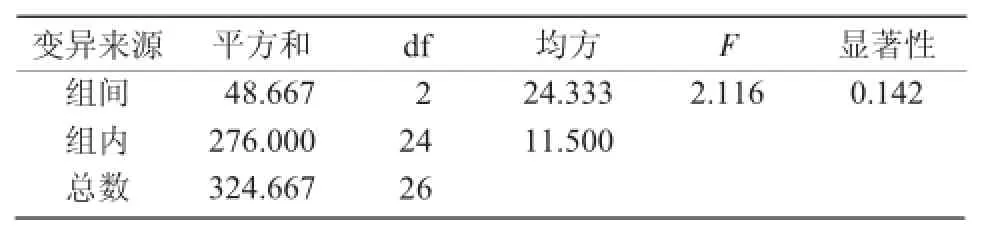
表7 超声波处理时间对花粉体外萌发率影响的方差分析
2.2.3 超声波处理次数对花粉体外萌发的影响
由表8,9可知,不同的超声波处理次数对花粉的体外萌发率影响差异显著(P<0.05),当超声波的处理次数为6次时,花粉的平均体外萌发率最高,为5%;随着超声波次数的增加,花粉的体外萌发率呈下降趋势。且超声波次数为6次与18次间差异显著(P<0.05),方差分析及多重比较结果显示,超声波的处理次数以6次为宜。
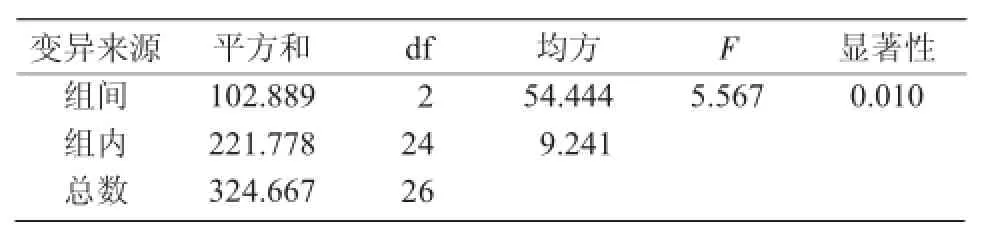
表8 超声波处理次数对花粉体外萌发率影响的方差分析
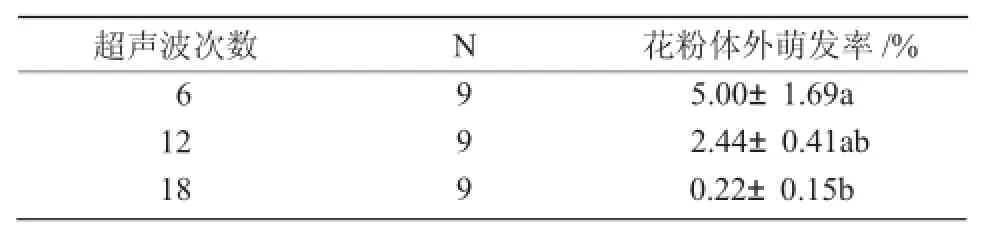
表9 超声波处理次数对花粉体外萌发率影响的多重比较(LSD)
2.3 转基因植株的PCR检测
从收获的269个籽粒的后代植株中随机选择100个单株,提取叶片DNA进行PCR检测,并设有阳性对照(质粒DNA)和阴性对照(未转化株)。结果发现,有3个单株呈阳性,其中包括2粒呈紫色的籽粒后代。PCR扩增结果(图3)表明,转化植株1,7,17可以扩增出特异性条带,尽管泳道1的扩增条带不明显,但可以看出,其与阳性质粒条带大小一致;而非转化阴性对照未扩增出相应条带。初步证明,外源基因已被整合到玉米的基因组中。且这3株的超声波处理参数为:超声波处理功率150 W,处理时间5 s/次,处理次数6次。

3 结论与讨论
本研究结果表明,最优花粉处理体系为:20%的蔗糖溶液,超声波功率150 W,超声时间5 s/次,超声次数6次。虽然在花粉体外萌发试验中超声波功率为100 W时花粉活力最优,但方差分析和多重比较结果表明,功率100,150 W时对花粉活力的影响差异不显著,因此,兼顾超声波对转化效率的作用最终选择花粉处理为功率150 W。
玉米是我国重要的粮食、饲料和生物能源作物,其花粉量大且较容易获得,非常适用于花粉介导法。将花粉作为接受外源基因的载体时,花粉细胞很容易在溶液中吸胀破裂而失去活性;在高浓度溶液中因反渗作用会产生严重的质壁分离现象,同样会影响花粉的萌发。因此,花粉介导转化的关键是要保证花粉的活力,使其保持一定的离体萌发率[12]。蔗糖溶液既可以产生一定渗透压、保持花粉正常的膨压,又能促进其萌发[13]。本试验通过不同浓度的蔗糖溶液对比试验,确定当蔗糖溶液浓度达到20%时花粉的体外萌发率最高。
Sanford等[14]、Booy等[15]都曾试图以花粉作为载体进行转化,但未获得成功。主要原因可能有2个:一是花粉的外壁比较坚硬,外源DNA很难进入花粉;二是由于外源DNA易被核酸酶降解。Joersbo等[16-17]、Xu等[18]研究结果表明,超声波可以促使外源DNA的转移。超声波处理是利用超声波高能和空化作用,使花粉处于感受态,进而使外源DNA更容易进入花粉粒中,之后再随着花粉管的生长进入到植物雌配子体胚囊中,参与合子形成,从而实现转化。在使用超声波花粉介导转基因方法时,超声波处理参数(功率、时间、次数)对提高外源基因的转化效率、并降低花粉破碎率至关重要。综合考虑这3个因素,本研究利用3因素3水平正交设计筛选出玉米花粉最佳超声波处理参数为:超声波处理功率150 W、处理时间5 s/次、处理次数6次。
本研究建立的玉米超声波花粉介导转化体系,对于提高玉米花粉介导植物基因转化效率研究提供了参考。
在转基因的过程中,得到转基因植株的数量取决于外源基因整合到目标基因的能力及转基因检测的效率[19]。因此,越来越多的科研工作者开始关注花青素基因,将其作为一种可视的选择基因,既无害健康又可以提高筛选转基因植物的效率。Doshi等[20-21]研究发现,小麦中的B-Peru和C1在组织特异的启动子驱动下,可在多种组织中顺式表达花青素,并将B-Peru和C1基因作为小麦和黑麦的标记基因。Shelagh等[22]将牵牛花中的CHI作为番茄和烟草的标记基因。
本试验成功地将外源花青素表达基因NtAn2通过超声波辅助花粉介导法导入玉米植株中,并获得紫色籽粒;并对其进行PCR检测,初步验证了外源花青素基因已被整合到植物基因组中,这种直观可视的标记基因可以大大提高转基因检测的效率,实现当代筛选,从而避免种植大量转化处理当代和后代的种子以及利用抗性筛选标记进行初筛的繁琐步骤。
[1]Miki B,McHugh,Sylvia.Selectable marker genes in transgenic plants:applications,alternativesandbiosafety[J].Journalof Biotechnology,2004(3):193-232.
[2]胡可,韩科厅,戴思兰.环境因子调控植物花青素苷合成及呈色的机理[J].植物学报,2010,45(3):307-317.
[3]Eapen S.Pollen grains as a target for introduction of foreign genes into plants:an assessment[J].Physiol Mol Biol Plants,2011,17:1-8.
[4]王景雪,孙毅,崔贵梅,等.花粉介导法获得玉米转基因植株[J].植物学报,2001,43(3):275-279.
[5]杜建中,孙毅,王景雪,等.基于花粉介导法转化的玉米自交系抗病植株的获得[J].中国农学通报,2008,24(5):79-82.
[6]Wang J X,Li Y H,Liang C.Recovery of transgenicplants by pollen mediated transformation in Brassica juncea[J].Transgenic Res,2008,17:417-424.
[7]Wang W Q,Wang J X,Yang C P,et al.Pollen-mediated transformation of Sorghum bicolor plants[J].Biotechnol Appl Biochem,2007,48:79-83.
[8]魏玉杰,张金文,何庆祥.花粉介导法将萝卜抗菌肽基因导入野罂粟的影响因素研究[J].中国农学通报,2010,26(15):32-37.
[9]崔贵梅,孙毅,郝曜山.玉米花粉体外萌发方法改进及其对花粉介导转基因的作用[J].植物学报,2012,47(2):155-161.
[10]郝曜山,孙毅,李贵全,等.玉米自交系花粉生活力的研究[J].山西农业大学学报:自然科学版,2005,25(2):161-163.
[11]Joersbo M.Advances in the selection of transgenic plants using non-antibiotic marker genes[J].Plant Physiology,2001,3:269-272.
[12]邹智,卢长明.整株转化及其在油菜上的应用和展望[J].植物学报,2009,44(2):236-244.
[13]杜春芳,刘惠民,李朋波,等.花粉介导法获得油菜转基因植株研究[J].作物学报,2006,32(5):749-754.
[14]Sanford J C,Skubik K A,Reishch B I.Attemptd pollen-mediated plant employing genomic donor DNA[J].Theor Appl Genet,1985,69:571-574.
[15]Booy G,Krens F A,Hui Zing H J.Attemptd pollen-mediated transformation ofmaize[J].Plant Physiol,1989,135:319-324.
[16]Joersbo M,Brunstedt J.Direct gene transfer to plant protoplasis by mild sonication[J].Plant Cell Rep,1990,9:207-210.
[17]Joersbo M,Brunstedt J.Sonication,a new method for gene transfer toplant[J].Physiol Plant,1992,85:230-234.
[18]Xu N,Zhao N M,Zhang L J,et al.Gene transfer by sonication[J]. Accta Biochior Biophys Sin,1990,6:281.
[19]刘继红,邓秀新.GFP及其在植物学研究中的应用[J].ChemistryofLife,2001(3):225-226.
[20]Doshi K M,Eudes F,Laroche A,et al.Transient embryo-specific expression of anthocyanin in wheat.In vitro cellular and developmental biology[J].Plant,2006,42:432-438.
[21]Doshi K M,Eudes F,Laroche A,et al.Anthocyanin expression in marker free transgenic wheat and triticale embryos[J].Plant,2007,43:429-435.
[22]Shelagh,Muir R,Geoff,et al.Overexpression of petunia chalcone isomerase in tomato results in fruit containing increased levels of flavonols[J].Nature Biotechnology,2001(5):470-490.
Study on Maize Plant Transformation with Anthocyanin Gene NtAn2by Pollen-mediated Transformation Method
GUOTian-lu1,ZHANGHuan-huan2,DUJian-zhong2,HAOYao-shan2,CUI Gui-mei2,WANGYi-xue2,SUNYi1,2
(1.College ofBio-engineering,Shanxi University,Taiyuan 030006,China;2.Research Center ofBiotechnology,Shanxi AcademyofAgricultural Sciences,Taiyuan 030031,China)
In this study,maize inbred Zheng 58 was transformed by the ultrasonication-assisted pollen-mediated transformation method with gene NtAn2 and the study was to optimize pollen-mediated genetic transformation system in maize using ultrasoncation treatment.To test the in vitro germination rate of fresh maize pollen in different concentrations of sucrose solution,three factors of ultrasonic treatment,treatment power,treatment duration and treatment times were optimized through an orthogonal design experiment. Then PCR detection was employed in the harvested seeds.The result showed that the optimum concentration of sucrose solution was 20%.The optimal parameters of the ultrasonication treatment of pollen were determined as follows:ultrasonic treatment power 150 W, processing duration 5 s,and 6 times.Two of the transgenic plants were confirmed by both color selection and PCR detection in the randomly-selected 100 kernels.It was verified that the anthocyanin gene NtAn2 was integrated into maize genome and could be used for visual selection of transformants.The optimized genetic transformation system of maize by pollen mediated-method assisted with ultrasonication treatment was established,which laid a foundation for improvingthe efficiencyofthe method.
ultrasoncation;pollen-mediated;transgene;maize
S513
A
1002-2481(2016)04-0427-06
10.3969/j.issn.1002-2481.2016.04.01
2016-02-24
转基因生物新品种培育重大专项(2014ZX08003001-002-003)
郭天璐(1991-),女,黑龙江齐齐哈尔人,在读硕士,研究方向:植物转基因技术。孙毅为通信作者。
