放养密度对大杂交鲟生长性能的影响及生理应答机制
2017-01-06李吉方温海深任远源来长青刘传忠
张 墨, 李吉方, 温海深, 步 艳, 倪 蒙, 任远源, 来长青, 刘传忠
放养密度对大杂交鲟生长性能的影响及生理应答机制
张 墨1, 李吉方1, 温海深1, 步 艳1, 倪 蒙1, 任远源1, 来长青2, 刘传忠2
(1. 中国海洋大学水产学院海水养殖教育部重点实验室, 山东青岛 266003; 2. 山东鲟龙渔业科技开发有限公司, 山东泗水 273211)
为探讨放养密度对鱼类生长及生理应答机制的影响规律和作用, 作者以大规格大杂交鲟(达氏鳇()♀×施氏鲟()♂)为实验材料, 研究了平均初始体质量约为243 g/尾, 放养密度分别为6 (SD1组)、9 (SD2组)、12 (SD3组)、15 kg/m3(SD4组)条件下, 不同放养密度处理70 d后的实验鱼生长性能变化及生理应答机制。结果显示, 放养密度对大杂交鲟肥满度影响不显著, SD2组鱼类具有最大的特定生长率和生长效率, 随着放养密度增加, 日增质量显著降低(<0.05), 特定生长率和生长效率下降。测定了血液甲状腺素(T4)、三碘甲腺原氨酸(T3)和皮质醇水平变化, 发现放养密度能引起大杂交鲟3个血液生理指标发生显著改变; 随着养殖时间推移, T3和皮质醇浓度显著升高, T4浓度显著下降 (<0.05)。这些结果说明神经内分泌活动的变化引起大杂交鲟血液生理指标变化, 进而影响实验鱼生长性能。因此, 在该养殖条件下推荐的养殖密度为9 kg/m3。
大杂交鲟(达氏鳇()♀×施氏鲟()♂); 拥挤胁迫; 特定生长率; 肥满度; 甲状腺激素; 皮质醇
鱼类作为水生低等变温脊椎动物, 外界环境的变化对其生存起着至关重要的作用。环境因子的重要影响表现在: 水环境指标(水体富营养化、溶解氧浓度、水体pH值、金属元素含量、水温变化等)、种间和个体间对空间的竞争、放养密度的大小等[1]。而放养密度过大会造成养殖对象的生存压力, 即拥挤胁迫。应激反应就是当鱼类体内内环境稳态发生变化时, 能感受到这些变化并做出有利于保持其体内新的稳态, 维持生命活动的应答。如在高密度养殖环境下, 鱼体自身会分泌一些激素来调节其生理机制, 适应该生境[2]。
激素由细胞分泌到体液中, 在经过血液或组织液传送而发挥调节作用, 皮质醇和甲状腺素不仅是调节生长发育的重要的内分泌激素, 而且在应激反应中作为主要的参与者和判定其程度的标准, 对维持鱼体内分泌稳态、分配能量物质、调整新陈代谢速率、促进鱼体的生长发育, 增加鱼体自身抗病能力等有重要的作用[3-5]。国内外关于拥挤胁迫和激素之间的关系研究已有较多报道[6], 拥挤胁迫对生理生化[7-8]、血液学[9]、新陈代谢[10-11]等许多方面均有直接影响。但对鲟鱼养殖中, 拥挤胁迫和生理指标之间的关系研究资料较少。
大杂交鲟是黑龙江流域达氏鳇♀()与施氏鲟♂()的子一代杂交种。其养殖特点是对环境的适应性强、生长周期短、抗病能力强、鱼肉富含丰富营养等特点, 近来引起养殖业者的重视, 消费者需求量也逐年上升[12]。作者以流水池塘养殖大杂交鲟为对象, 研究不同放养密度条件下, 实验鱼生长性能状况及血清皮质醇和甲状腺素等生理指标的相应变化。通过分析大杂交鲟特定生长率、摄食率、肥满度等变化规律, 认识放养密度过高而产生的应激胁迫效应机制, 为建立科学合理的流水池塘鱼类养殖模式, 优化大杂交鲟鱼最佳放养密度, 提高池塘养殖经济效益提供科学依据。
1 材料和方法
1.1 实验鱼来源与饲养
实验所用的大规格大杂交鲟是达氏鳇♀()与施氏鲟♂()的子一代杂交种。实验地点在山东省济宁市鲟龙渔业科技开发有限公司。采用工厂化流水养殖方式。所选用的实验鱼规格较整齐、体质健壮、无病无伤、体质量(234.4±5.17) g、体长(31.3±0.23) cm。实验用水为当地地下井水, 水质无污染, 经曝气池曝气, 光照充足。进水口水流速为3.30 m3/h。
1.2 实验方法
鱼种放养前3 d将池水排至15 cm深, 用500 mL甲醛溶液全池泼洒。鱼种下池前检查, 确定池水毒性消失后再放鱼种。
大杂交鲟鱼种放入池后的前3 d不投喂。3 d后开始投喂饲料。投喂时以大部分鱼抢食行为减慢食饱散开, 最后几颗饵料在水中稍停留仍能被摄食的程度, 并记录每次投饵量。每天8: 00、16: 00、23: 00各喂1次。饲料为宁波天邦股份有限公司生产的人工配合饲料。根据工厂化养殖的实际经验和前期预实验结果, 实验设计4个放养密度处理组, 分别为6、9、12、15 kg/m3, 用SD1、SD2、SD3和SD4表示, 其中SD1组密度受胁迫影响较小。每个实验组均设3个重复。用美国HACH公司生产的溶解氧测定仪, 每天9: 00和17: 00监测2次水中溶解氧、pH值、水温。实验共历时70 d。
对实验用鱼停食12 h后采血。随机挑选各密度下的大杂交鲟5尾, 快速放入含有MS-222(200 mg/L)的水桶中进行麻醉。保证将实验用鱼在捕捞过程中因剧烈挣扎而引起的应激程度降到最小。麻醉一段时间后, 在大杂交鲟尾静脉用1 mL无菌一次性注射器抽血, 血样室温放置, 分层后, 用4℃离心机12 000 r/min下, 离心10 min, 用移液枪将血清转入离心管中, 密封于–80℃保存备用。
采用天津九鼎医学生物工程有限公司所研制的试剂盒, 使用液相平衡竞争放射免疫分析法(RIA)。在γ-放射免疫计数仪(中国上海, SN-695B) 上测定皮质醇、三碘甲腺原氨酸(T3)、甲状腺素(T4), 批号为S10940110(皮质醇)、S10930055(T3)、S10930056(T4)。样品和加入的125I-Cor共同与一定量的特异性抗体产生竞争性免疫反应, 并表现在剂量反应曲线上。具体方法是: 将样品血清加入标记物和抗体, 充分混匀静置在37℃水中, 温育45 min, 之后加入分离剂充分混匀, 4℃离心机3 600 r/min下, 离心20 min, 弃上清液测量沉淀物cpm值。
相关生长指标及其计算公式如下:
肥满度=/3×100;
日增质量= (2–1) /(2–1);
特定生长率= 100(ln2–ln1) /(2–1);
生长效率= 100(2–1)/;
饲料转化率=/[(2–1)];
摄食效率= 200/[(2+1)(2–1)];
单位时间内净增质量= (2/s–1/s)/(2–1);
式中,为平均体质量;为体长(cm);为食物总摄入量(g);1与2为时间;1与2为平均体质量(g);为池塘面积(m2); ;为实验鱼尾数。
1.3 数据处理
实验数据用SPSS17.0统计软件进行处理分析, 利用单因素方差分析(One-ANOVA)和Duncan多重比较来检验放养密度对大杂交鲟激素、生长等指标的差异性,<0.05为显著性水平, 所得数据均用平均值±标准差(Mean±SD)表示。
2 实验结果
2.1 水质指标
大杂交鲟生存的水温范围较广(0~30℃)且其耐低溶解氧[13]。本实验过程中, 水温、溶解氧浓度、pH值等均处于大杂交鲟的适宜养殖环境条件下。由表1可知, 实验期间水质指标均维持在大杂交鲟生长的安全范围之内。
2.2 激素指标
三碘甲腺原氨酸(T3)在实验前30 d各密度组含量均呈上升趋势, 并在30 d时达到最大值, 且各组之间差异显著(<0.05), 且随着密度的升高, T3值降低。最高值出现在SD4组, 平均浓度值为4.05 ng/mL, 随后, 各密度组均呈回落趋势且高密度组值都高于低密度组, 60 d后趋于平缓, 但低密度组的T3含量始终高于高密度组(图1)。

表1 水质参数
注: 同一行中参数上方字母不同代表有显著性差异(<0.05), 相同则无显著性差异(>0.05)(下表同)
由图2可知, 甲状腺素(T4)的含量随着时间的增加各组呈上升趋势, 30 d时T4水平急剧升高, 40 d时各密度组都达到了最大值随密度的升高各组值呈下降趋势, 且差异显著(<0.05); 而这时三碘甲腺原氨酸随着各密度的升高呈升高趋势(图1); T4最高值出现在SD1组, 为2.44 μg/dL。之后则开始明显降低, 60 d后回落趋势缓慢。4个密度的值接近, 此时差异不显著(>0.05)。
拥挤胁迫后大杂交鲟血液皮质醇浓度也呈现先升高后降低的趋势。10 d时平均值为(0.49±0.11) μg/dL,说明放养环境是安静的, 应激实验条件相近。各密度组均在胁迫后30 d达到各组实验最高值, 且SD4组平均值最高, 为0.768 μg/dL, 与其他各组均有显著性差异(<0.05)。之后同样, 各处理组皮质醇水平开始回落, 但高密度组始终维持在最高水平(图3)。
2.3 放养密度对大杂交鲟生长性能的影响
实验开始时, 大杂交鲟的肥满度为0.64~0.67, 实验结束时, 肥满度为0.68~0.74。实验过程中, 肥满度最高值为0.74出现在SD2 组, 各密度组的肥满度指标无明显差异(>0.05)。实验过程中各密度的大杂交鲟体质量、体长均有所增长, 随着放养密度的升高, 增长幅度越小(表2)。
养殖70 d后, 各个处理组的生长性能可以看出(表3): 日增质量、食物转化率、特定增长率、生长效率、摄食效率均有显著差异(<0.05)。其日增质量、特定增长率、生长效率都随放养密度的增大而降低。日增质量在SD1组最高, 特定生长率、生长效率在SD2组最高, 净增质量SD3组最高。日增质量、饲料转化率、特定增长率、生长效率、摄食效率在SD4组与其他组之间均有显著差异(<0.05)。
3 讨论与小结
鱼类的内分泌神经系统在自身生理活动调节中占据主导地位的是下丘脑-垂体-甲状腺轴(HPT)[14], 下丘脑促甲状腺激素释放激素(TRH)经垂体门脉运至腺垂体, 在促甲状腺细胞的作用下, 由甲状腺滤泡上皮细胞分泌两种甲状腺激素, 即三碘甲状腺原氨酸(T3)和大量甲状腺素(T4), 主要作用是促进能量代谢和物质交换、促进骨骼发育。甲状腺激素保证鱼体大脑和身体的正常发育和生长[15-16]。本实验结果表明, 大杂交鲟在高放养密度下血液中T3和T4水平降低, HPT轴活性与放养密度呈负相关, 与Vijayan等[17]对溪红点鲑()的研究结果一致。可能是由于该放养密度下, 大杂交鲟对于饵料的摄入量减少, 进而使得血液中激素水平降低, 在密度胁迫下T4不断向T3转化, 皮质醇浓度反而随之增加。在高密度放养的胁迫下, 能量流动和物质循环通过分解作用和对自身生理机制的调整来实现, 其主要表现就是鱼体对于甲状腺素的调节作用[3, 18]。
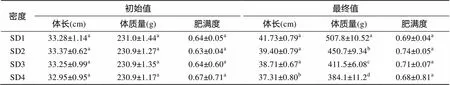
表2 不同放养密度下体长、体质量和肥满度的初始值和最终值
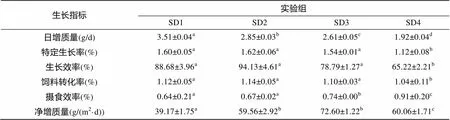
表3 大杂交鲟鱼在不同放养密度下的生长指标
当鱼类为适应其生活的水体环境, 神经内分泌系统即按环境需求对自身生理活动进行调节。这时, 下丘脑-垂体-肾间组织轴(HPI)[19]变得尤为重要。当周围水体环境对鱼体产生胁迫效应时, 在鱼体下丘脑会刺激脑垂体前叶分泌促肾上腺皮质激素释放激素(CRH), 由神经细胞分泌促肾上腺皮质激素(ACTH), 传递给肾间组织。肾间组织主要分泌的激素是皮质醇[20-21], 其对鱼类生理学研究有着至关重要的作用: 提高血液中葡萄糖的合成速率; 尤其在肝脏、肌肉等组织中, 抑制核酸合成过程, 提高肌肉中蛋白质的分解速率; 提高血液中合成的氨基酸速率; 提高组织中脂肪的氧化速率等。有研究表明, 皮质醇含量过高时, 会造成生物生长终止、体内脂肪合成速率降低, 肌肉消退, 最终导致机体消瘦[22]。但是作为一种至关重要的激素, 皮质醇与应激效应有着紧密的联系[23-25]。在鱼体受到胁迫的情况下, 皮质醇最先做出反应, 因此描述皮质醇水平的变化被公认为反应鱼体应激情况的指标[26]。例如, 尼罗罗非鱼() 随着拥挤胁迫的增大, 皮质醇含量显著增加[27]。对真鲷()的研究发现, 当拥挤胁迫持续30 d左右时, 皮质醇浓度显著升高[28], 与本实验结果相近。这可能是由于皮质醇能促进血糖的合成和加速脂肪的氧化有关。因此, 当鱼体内大量产生皮质醇时, 合成的能量物质可以有效地抵抗拥挤胁迫产生的压力。本实验中, 40 d后由于大杂交鲟也开始适应慢性拥挤胁迫, 各密度组的皮质醇浓度开始回落。有研究表明[17]皮质醇对应激过程中产生的化学能传递进行了再次作用。本实验中, 拥挤胁迫初期, 鱼体内的血浆皮质醇浓度会显著升高, 但随着时间的增加, 大杂交鲟自身开始适应周围的水体环境。此时, 皮质醇又会下降并接近原有的水平, 出现了激素指标先升高后降低的趋势, 在整个实验过程中SD1、SD2组的皮质醇水平较低, 表明该实验组的鲟鱼受到的拥挤胁迫影响相对较小。同样有研究表明[29], 虹鳟()在过高的放养密度下, 皮质醇浓度会突然升高, 8 d后下降并接近最初值, 该结论也与本实验结果相似。
鱼类的生长率、存活率和饲料转化率等受拥挤胁迫影响较大且呈负相关趋势[4]。虹鳟的生长效率在较高的环境密度胁迫下会显著降低[30]。施氏鲟稚鱼研究表明, 其特定生长率随拥挤胁迫的增加而显著降低; 随放养密度其饲料转化率显著增加[31]。本实验大杂交鲟最终体长、最终体质量、日增质量、生长效率和净增质量都随放养密度的增大而显著性降低, 表明拥挤胁迫对大杂交鲟生长性能产生了不同程度的抑制。SD4组的摄食效率显著高于其他处理组, 但其饲料转化率最低, 而SD2组摄食效率较低, 但饲料转化率最高, 且该组生长效率、净增质量均达到最高, 也表明SD2组在该条件下有明显的生长优势。这与李大鹏等[31]所做的施氏鲟在不同放养密度实验中生长效率、净增质量在最高密度组为最大的结果不同。肥满度与鱼体的体质量和体长有关, 贾瑞锦[32]指出, 气候、摄食条件和个体之间的生长差异和生理变化等因素和肥满度密切相关, 而拥挤胁迫对其影响较小, 本实验中的实验结果也证明了这一论点。
有学者认为[33]生长率下降的主要原因可能是随着放养密度的增加, 当放养密度过大时, 随着饲料转化率的降低, 会最终导致鱼体生长的滞后。神经内分泌系统分泌的皮质醇其主要作用是保护免疫系统和维持体内物质代谢的正常进行。当放养密度过大造成拥挤胁迫时, 皮质醇大量分泌, 会造成鱼体自身内环境的改变, 消耗大量体内储存的能量, 为了维持血糖平衡, 能量物质无法储存, 最终阻碍鱼体正常生长[3]。还有研究表明[34], 饲料转化率降低和对生存空间的竞争会随着拥挤胁迫的加剧而增加, 当饲料不能作为有效的能量来源提供营养时, 鱼体的生长速度就会下降, 并可能引发疾病和较高的死亡率、种间斗争。慢性拥挤胁迫对高密度组特定生长率值影响显著, 这样的结果第一可能是由于高密度组大杂交鲟摄食水平相对不均, 抢食现象严重, 导致高密度组一小部分鲟鱼个体生长速率较大, 而另外的绝大部分个体生长速率一直处于较低水平, 影响了整池试验对象的生长速度偏低; 第二是由于试验对象为了适应高密度的水体环境, 通过神经内分泌系统的一系列化学变化, 引起生理和生化指标的调控, 免疫学指标的变化, 进而通过大量消耗鱼体自身产生的能量来调节生理活动, 最终阻碍了鱼体的生长。本研究还发现, 特定生长率和生长效率在高密度组最低, 表明大杂交鲟在较高的放养密度下相互间的确存在着明显的负面影响, 因此, 一味提高放养密度并不会始终提高养殖对象产量, 对鱼体来说反而是一种生存压力, 这与Baker等[35]的观点一致。
以上研究均表明, 大杂交鲟的生长性能和生理应答机制在慢性拥挤胁迫下发生了不利变化, 进而使其生理状态发生阶段性改变。因此, 在该养殖条件下推荐的养殖密度为9 kg/m3。然而在实际养殖生产过程中, 大杂交鲟应激程度的大小的评定和应激后需要采用的有效修复措施, 是值得进一步研究的重要领域。
[1] Pickerng A D, Duston J. Administration of cortisol to brown trout, Salmo tutta L, and its effects on the susceptibility toinfection and furunculosis[J]. Journal of Fish Biology, 1983, 23: 163-175.
[2] 张廷军, 杨振才, 孙儒泳. 鱼类对高密度环境的适应[J]. 水产科技情报, 1998, 25(3): 110-113. Zhang Tingjun, Yang Zhencai, Sun Ruyong. The acclimation of fishes to high stocking density[J]. Fisheries Science & Technology Information, 1998, 25(3): 110- 113.
[3] Kazim S, Hasan Y, Cemal O, et al. The effect of lycopene on antioxidant status in rainbow trout () reared under high stocking density[J]. Aquaculture, 2014, 418: 132-138.
[4] Björn B, Agnar S, Matthías O, et al. Optimal stocking density of juvenile Atlantic cod (L.) reared in a land-based farm[J]. Aquaculture, 2012, 356: 342-350.
[5] Sumpter J P, Dye H M, Benfey T J. The effect of stress on blood ACTH,a-MSH and cortisol levels in salmonid fishes[J]. General and Comparative Endocrinology, 1986, 62(3): 377-385.
[6] Cristina E T, Amalia E M, Manuel H. Physiological effects of crowding in rainbow trout,, selected for low and high stress responsiveness[J]. Aquaculture, 2006, 258(1-4): 583-593.
[7] 于淼, 樊启学, 程鹏, 等. 急性拥挤胁迫对鲤血液中皮质醇及几项生化指标的影响[J]. 淡水渔业, 2008, 38(4): 20-24. Yu Miao, Fan Qixue, Cheng Peng, et al. Effects of acute crowding stress on cortisol and several biochemical indexes inserum[J]. Fresh Water Fisheries, 2008, 38(4): 20-24.
[8] Eva V K, Harald G, Ellen M F, et al. Changes in muscle and blood plasma proteomes of Atlantic salmon () induced by crowding[J]. Aquaculture, 2010, 309(1-4): 272-279.
[9] Ruane N M, Huisman E A, Komen J. Plasma cortisol and metabolite level profiles in two isogenic srtains of common carp during confinement[J]. Journal of Fish Biology, 2001, 59(1): 1-12.
[10] 王文博, 李爱华, 汪建国, 等. 拥挤胁迫对草鱼非特异性免疫功能的影响[J]. 水产学报, 2004, 28(2): 139-144. Wang Wenbo, Li Aihua, Wang Jianguo, et al. The effect of crowding stress on non-specific immune functions of[J]. Journal of Fisheries of China, 2004, 28(2): 139-144.
[11] Fagerlund U H M, McBride J R, Stone E T. Stress-related effects of hatchery rearing density on coho salmon[J]. Transactions of the American Fisheries Society, 1981, 110: 644-649.
[12] 郝世超, 黄璞祎, 于洪贤. 摄食水平对杂交鲟生长的影响[J]. 东北林业大学学报, 2008, 36(12): 43-45. Hao Shichao, Huang Puyi, Yu Hongxian. Effect of ration level on growth of hybrid sturgeon[J]. Journal of Northeast Forestry University, 2008, 36(12): 43-45.
[13] 孙大江, 曲秋芝, 张颖, 等. 中国的鲟鱼养殖[J]. 水产学杂志, 2011, 24(4): 67-70. Sun Dajiang, Qu Qiuzhi, Zhang Ying, et al. Sturgeon aquaculture in China[J]. Chinese Journal of Fisheries, 2011, 24(4): 67-70.
[14] Kuhn E R, Geris K L, Geyten S. Inhibition and activation of the thyroidal axis by the adrenal axis in vertebrates[J]. Comparative Biochemistry and Physiology, 1998, 120A: 169-174.
[15] 沈同, 王镜岩. 生物化学[M]. 北京: 高等教育出版社, 1991: 420-460. Shen Tong, Wang Jingyan. Biochemistry[M]. Beijing: Higher Education Press, 1991: 420-460.
[16] 于道德, 宁璇璇, 任贵如, 等. 甲状腺激素在鱼类繁殖中的作用[J]. 海洋科学, 2010, 34(7): 106-110. Yu Daode, Ning Xuanxuan, Ren Guiru, et al. Functions of thyroid hormone in fish reproduction[J]. Marine Sciences, 2010, 34(7): 106-110.
[17] Vijayan M M, Leatherland J F. High density affects cortisol secretion and tissue distribution in brook charr,[J]. Journal of Endocrinology, 1990, 124: 311-318.
[18] Ader R, Felten D L, Cohen N. Phychoneuroimmunology[M]. New York: Academic Press Inc, 1991: 12-18.
[19] Bernier N J, Perter R E. The hypothalamic-pituitary- interrenal axis and the control of food intake in teleost fish[J]. Comparative Biochemistry and Physiology, 2001, 129B: 639-644.
[20] Jeney Z, Jeney G, Maule A G. Cortisol measurements in fish[M]. USA: SOS Publications, 1992: 157- 166.
[21] 徐长安, 李军, 张士璀. 激素诱导欧氏六线鱼性腺发育的初步研究[J]. 海洋科学, 1998, 12(3): 4-5. Xu Changan, Li Jun, Zhang Shicui. Initial study on gonad development of Otaki’s gneenling induced by different hormone[J]. Marine Sciences, 1998, 12(3): 4-5.
[22] 王树启, 许友卿, 丁兆坤. 生长激素对鱼类的影响及其在水产养殖中的应用[J]. 水产科学, 2005, 24(7): 42-46. Wang Shuqi, Xu Youqing, Ding Zhaokun. Effects of growth hormone on fishes and its application in aquaculture[J]. Fisheries Sciences, 2005, 24(7): 42-46.
[23] McKenzie D J, Höglund E, Dupont-Prinet A, et al. Effects of stocking density and sustained aerobic exercise on growth, energetics and welfare of rainbow trout[J]. Aquaculture, 2014, 338: 216-222.
[24] Jennifer M R, Grant W F, Zoltan M V, et al. Whole-body cortisol is an indicator of crowding stress in adult zebrafish,[J]. Aquaculture, 2006, 258: 565-574.
[25] Gisella P, Giovanna P, Maria D, et al. Effect of stocking density and group size on growth performance, carcass traits and meat quality of outdoor-reared rabbits[J]. Meat Science, 2013, 93: 162-166.
[26] Chattopadhyay D N, Mohapatra B C, Adhikari S, et al. Effects of stocking density ofon survival, growth and production in cages[J]. Aquaculture International, 2013, 21: 19-29.
[27] Thomasl L W, Chhorn L, Mediha Yildirim-Aksoy, et al. Growth, immune function and disease and stress resistance of juvenile Nile tilapia()fed graded levels of bovine lactoferrin[J]. Aquaculture, 2007, 262: 156-162.
[28] Rotllant J, Tort L. Cortisol and glucose responses after acute stress by net handling in the sparid red porgy ()previously subjected to crowding stress[J]. Journal of Fish Biology, 1997, 51: 21-28.
[29] Barton B A, Peter R E, Paulencu C R. Plasma cortisol 1evels of fingerling rainbow trout () at rest and subjected to handling confinement, transport and stocking[J]. Canadian Journal of Fisheries and Aquatic Sciences, 1980, 27: 805-811.
[30] Ellis T, North B, Scott A P, et al. The relationship between stocking density and welfare in farmed rainbow trout[J]. Journal of Fish Biology, 2002, 61: 493-531.
[31] 李大鹏, 庄平, 严安生, 等. 光照、水流和放养密度对史氏鲟稚鱼摄食、行为和生长的影响[J]. 水产学报, 2004, 28(1): 54-61. Li Dapeng, Zhuang Ping, Yan Ansheng, et al. The influences of illumination, water current and stocking density on feeding, behavior and growth in juveniles[J]. Journal of Fisheries of China, 2004, 28(1): 54-61.
[32] 贾瑞锦, 陈超, 孔祥迪, 等. 饥饿对条纹锯鮨仔鱼的存活、摄食及生长的影响[J]. 海洋科学, 2014, 38(4): 44-49. Jia Ruijin, Chen Chao, Kong Xiangdi, et al. Effects of starvation on suriving, feeding and growth of the Yolk-sac larval of[J]. Marine Sciences, 2014, 38(4): 44-49.
[33] 李玉全, 王仁杰, 姜令绪. 密度胁迫对日本囊对虾生长和水环境的影响[J]. 海洋科学, 2013, 37(10): 53-57. Li Yuquan, Wang Renjie, Jiang Lingxu. Effects of density-stress on water quality and growth of[J]. Marine Sciences, 2013, 37(10): 53-57.
[34] Bodil K L, Peter V S, David J M, et al. The effects of stocking density and low level sustained exercise on the energetic efficiency of rainbow trout () reared at 19℃[J]. Aquaculture, 2012, 324: 226-233.
[35] Baker R F, Ayles G B. The effects of varying density and loading level on the growth of arctic charr(L.) and rainbow trout[J]. Journal of the World Aquaculture Society, 1990, 121, 313-326.
Effect of stocking density on growth performance and mechanism of physiological response in hybrid sturgeon
ZHANG Mo1, LI Ji-fang1, WEN Hai-shen1, BU Yan1, NI Meng1, REN Yuan-yuan1, LAI Chang-qing2, LIU Chuan-zhong2
(1. Key Laboratory of Mariculture, Ministry of Education, Ocean University of China, Qingdao 266003, China; 2. Shandong Xunlong Sci-tech CO.LTD, Sishui 273211, China)
To study the effect of stocking density on growth performance and mechanism of physiological response in hybrid sturgeon, an experiment was performed on large-sized hybrid sturgeon (♀ ×♂), with an initial weight of 243 g per fish, at a stocking density of 6 (SD1 group), 9 (SD2 group), 12 (SD3 group), and 15 kg/m3(SD4 group) over a 70-day period. Results showed that daily weight gain decreased significantly (<0.05) with increasing stocking density. Moreover, increasing density resulted in a decrease in specific growth rate and growth efficiency, with the best specific growth rate and growth efficiency in the SD2 group. However, density had an indistinguishable effect on relative fatness. In the study, serum thyroxine (T4), triiodothyronine (T3), and cortisol were significantly affected by stocking density. T3and cortisol levels increased significantly (<0.05), whereas the T4level decreased (<0.05) over breeding time. The results indicate that the change in neuroendocrine activity affect the serum physiological indices, which can influence growth performance in experimental fish. Therefore, we suggest that 9 kg/m3as an appropriate stocking density for aquaculture.
Hybrid sturgeon; crowding stress; specific growth rate; relative fatness; thyroid hormones; cortisol
(本文编辑: 谭雪静)
[Special Fund for Agro-scientific Research in the Public Interest, No.20103055]
May 12, 2015
S917.4
A
1000-3096(2016)08-0035-07
10.11759//hykx20150512001
2015-05-12;
2015-07-27
公益性行业 (农业) 科研专项经费资助项目(201003055)
张墨 (1987-), 男, 天津人, 硕士研究生, 主要从事鱼类生理学研究, E-maiL: 575839558@qq.com; 李吉方, 通信作者, 副教授, E-mail: lijif@ouc.edu.cn
