噬菌体Bp7尾丝蛋白gp37的原核表达与鉴定
2017-01-06孙虎芝任慧英
孙虎芝,任慧英,张 灿
(青岛农业大学动物科技学院,山东青岛 266109)
噬菌体Bp7尾丝蛋白gp37的原核表达与鉴定
孙虎芝,任慧英,张 灿*
(青岛农业大学动物科技学院,山东青岛 266109)
为了研究噬菌体尾丝蛋白gp37在识别宿主菌大肠埃希菌K12过程中的作用,PCR扩增获得gp37基因C端1 161 bp序列,以EGFP为荧光标签,构建重组表达质粒pET-28a-EGFP-gp37,在大肠埃希菌BL21(DE3)中IPTG诱导表达重组蛋白EGFP-gp37,亲和层析纯化蛋白。SDS-PAGE及Western blot检测结果表明,重组蛋白EGFP-gp37在大肠埃希菌BL21(DE3)为可溶性表达,表达量占菌体总蛋白量的23%。EGFP-gp37融合蛋白与大肠埃希菌K12相互作用,激光共聚焦显微镜检测结果显示,尾丝蛋白gp37能够吸附到宿主菌K12表面,表明尾丝蛋白gp37参与宿主菌受体的识别和吸附过程。
噬菌体Bp7;尾丝蛋白gp37;绿色荧光蛋白EGFP;大肠埃希菌K12
噬菌体作为一种细菌病毒,通过侵染细菌从而使其裂解,是自然界中细菌的天敌。近年来,随着抗生素的广泛使用,细菌的耐药情况日益严重,噬菌体作为抗菌制剂用于耐药菌的防治研究引起高度重视[1]。
T4类噬菌体为有尾噬菌体,在形态上相似,头部为20面体,尾部可以伸缩,由基板和长短两组尾丝构成[2]。长尾丝通过其末端的尾丝蛋白识别宿主表面的特异性受体并与之可逆性结合,从而启动噬菌体侵染宿主菌的过程,这种识别受体的特异性决定了噬菌体的宿主范围[3-4]。gp37位于T4类噬菌体长尾丝末端,其C端能够识别宿主菌表面受体,引发噬菌体的吸附过程,是T4类噬菌体识别受体的关键蛋白[5-6]。在前期研究工作中,从鸡场粪便中分离到一株噬菌体Bp7,具有宽宿主谱的特性,基因组序列分析显示其属于T4类噬菌体[7]。噬菌体Bp7基因组的功能基因预测表明,开放阅读框ORF37编码尾丝蛋白gp37,与T4类噬菌体的尾丝蛋白gp37具有同源性,因此推测其在噬菌体Bp7识别宿主菌受体过程中具有关键作用。
为了验证上述假说,本试验着眼于噬菌体Bp7尾丝蛋白gp37 的C端序列,以绿色荧光蛋白为标签,检测其与宿主菌大肠埃希菌K12的结合情况,从而确定噬菌体Bp7尾丝蛋白gp37是否参与识别宿主菌的受体,为进一步研究噬菌体Bp7与宿主菌的相互作用奠定基础。
1 材料与方法
1.1 材料
1.1.1 质粒和菌株 质粒pET-28a、质粒pEGFP-N1、质粒pGEX-6P-1-gp37、大肠埃希菌BL21(DE3)菌株、大肠埃希菌DH5α菌株,均由青岛农业大学微生物实验室保存的;大肠埃希菌K12,购自河南省微生物菌种资源库菌种保藏中心。
1.1.2 试剂 营养琼脂,购自北京奥博星生物技术有限责任公司;琼脂糖凝胶纯化回收试剂盒、质粒小量快速提取试剂盒,购自北京艾德莱生物科技有限公司;T4 DNA连接酶、DNA Marker DL 2 000、限制性核酸内切酶EcoRⅠ、SalⅠ、XholⅠ,二抗为HRP标记羊抗鼠IgG,均购自宝生物工程(大连)有限公司;一抗为鼠抗HIS标签单克隆抗体,Top Sciense公司产品;DAB试剂盒,购自Biosharp公司。
1.2 方法
1.2.1 目的基因EGFP及gp37的引物设计 参照GenBank已登录的EGFP序列(GI: CVU55762)和噬菌体Bp7的基因组序列(GI: HQ829472),以EGFP基因和尾丝蛋白gp37 C端1 161 bp为目的基因,利用Primer5.0软件设计引物,并分别在EGFP基因上下游引物P1、P2引入EcoRⅠ和SalⅠ酶切位点(下划线表示),在gp37基因上、下游引物P3、P4引入SalⅠ和XhoⅠ酶切位点(下划线表示);在EGFP基因下游引物中引入一个linker(斜体表示),引物序列如下:P1: 5′-GGC GAA TTC ATG GTG AGC AAG GGC GAG GAG-3′;P2: 5′-CCC GTC GACTCGGCTCCAGGAACGCCATCGGCTCCAGGAACGCCATCGGCTCCAGGAACGCCATTT GTA CAG CTC GTC CAT GCC-3′;P3: 5′-CAG GTC GAC GCT ACT CGT GTT TCT A-3′ ;P4: 5′-TTG CTC GAG CCC GAA GGC CCT TTC TTAT-3′ 。
1.2.2 目的基因EGFP及gp37的PCR扩增及鉴定 分别以质粒pEGFP-N1和质粒pGEX-6P-1-gp37为模板,扩增目的基因片段EGFP和gp37,PCR反应条件为:94 ℃ 5 min;94 ℃ 1 min,57 ℃ 1 min,72 ℃ 1 min,30个循环;72 ℃延伸10 min。10 g/L琼脂糖凝胶电泳检测PCR产物。
1.2.3 重组表达质粒pET-28a-EGFP-gp37的构建 分别将载体pET-28a和目的基因EGFP用EcoRⅠ与SalⅠ双酶切,产物回收后用T4连接酶连接,转入大肠埃希菌DH5α后挑菌提取质粒,将所得的质粒分别进行PCR与双酶切鉴定,选出阳性克隆,命名为pET-28a-EGFP。送上海生工生物工程技术服务有限公司测序,以确保插入基因的准确。将目的基因片段gp37与测序正确的重组质粒pET-28a-EGFP用SalⅠ与XhoⅠ双酶切,双酶切产物回收后连接,转入大肠埃希菌DH5α后挑菌提取质粒,将所得的质粒分别进行PCR与双酶切鉴定,选出阳性克隆,命名为pET-28a-EGFP-gp37。送上海生工生物工程技术服务有限公司测序,以确保插入基因的准确。
1.2.4 重组表达质粒pET28a-EGFP-gp37/BL21(DE3)的IPTG诱导表达与可溶性分析 将重组质粒pET-28a-EGFP-gp37转化到感受态大肠埃希菌BL21(DE3),随机挑取含Kana的LB平板上长出的单菌落,接种含Kana的LB液体培养基,37℃振荡培养过夜,取70 μL接种7 mL含Kana的LB液体培养基中,37℃振荡培养至OD 600 nm约为0.6~0.8,加入终浓度为0.6 mmol/L IPTG,37℃振荡培养6 h,离心,分别收集培养上清液和菌体沉淀,菌体以PBS重悬后在冰浴条件下进行超声波裂解,裂解条件为:冰浴间歇超声30 min,超声2 s,间歇2 s。超声后的菌液12 000 r/min 、4℃离心5 min,分别收集上清和沉淀,SDS-PAGE电泳检测重组蛋白的表达。
1.2.5 表达产物的纯化以及Western blot 检测 收集超声破碎后的菌液上清,用Ni-Agarose His标签蛋白纯化试剂盒进行纯化,纯化的重组蛋白经SDS-PAGE后,将凝胶转移至PVDF膜上进行免疫印迹,一抗为鼠抗HIS标签的单克隆抗体,二抗为HRP标记的羊抗鼠IgG,用底物二氨基联苯胺(DAB)显色。
1.2.6 融合蛋白EGFP-gp37与宿主菌相互作用 保存的宿主菌大肠埃希菌K12菌种进行普通营养琼脂平板复苏,37℃过夜培养,挑取单菌落,37℃、170 r/min振荡培养12 h,分别取500 μL加入到2个EP管中8 000 r/min离心3 min,用200 μL的PBS液重悬,其中一管加入200 μL纯化的融合蛋白EGFP-gp37(0.2 mg/mL),另一管加入等量的EGFP蛋白作对照,37℃作用10 min,2 000r /min离心10 min,加入1 mL的PBS液洗涤2次,激光共聚焦显微镜检测两者相互作用情况。
2 结果
2.1 目的基因EGFP及gp37基因的PCR扩增结果
分别以质粒pEGFP-N1和pGEX-6P-1-gp37为模板,扩增EGFP和gp37基因序列,10 g/L的琼脂糖凝胶电泳检测PCR扩增产物(图1)。
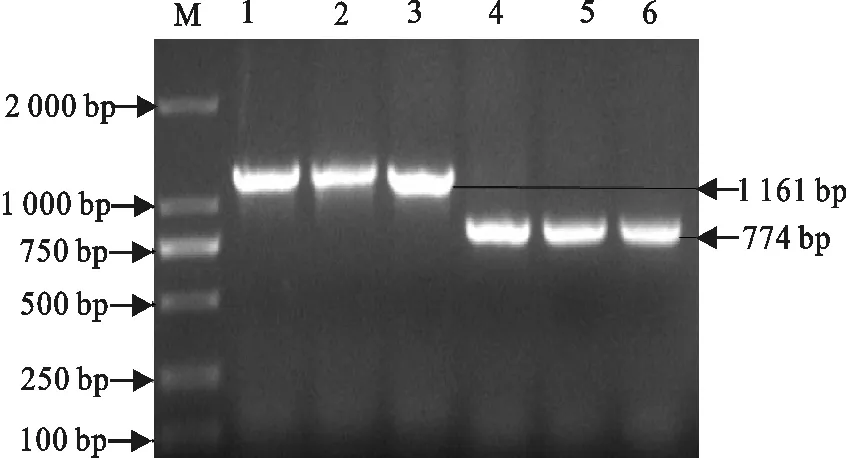
M. DNA 标准DL 2 000;1~3.扩增的gp37基因;4~6.扩增的EGFP基因
M. DNA Marker DL 2 000;1-3.PCR products of gp37 gene;4-6.PCR products of EGFP gene
图1 EGFP基因与gp37基因的PCR扩增结果
Fig.1 PCR amplification results of EGFP and gp37 gene
由图1可知,PCR扩增后分别出现特异的条带,大小约1 161 bp和774 bp,与预期的条带大小一致。
2.2 重组质粒pET-28a-EGFP-gp37的PCR鉴定与双酶切鉴定结果
用EcoRⅠ与SalⅠ双酶切EGFP和载体,构建pET-28a-EGFP质粒;用SalⅠ与XhoⅠ双酶切gp37和载体pET-28a-EGFP,构建重组质粒pET-28a-EGFP-gp37。将构建的质粒进行PCR鉴定与双酶切鉴定,10 g/L的琼脂糖凝胶电泳检测结果(图2)。对筛选出的阳性克隆送上海生工生物工程技术服务有限公司测序,测序结果表明目的基因序列正确。
由图2可见,对于构建的质粒pET-28a-EGFP,PCR扩增出774 bp的条带与目的基因EGFP一致,经过双酶切得到2个条带,其中包括与预期774 bp大小一致的条带。对于构建的重组质粒pET-28a-EGFP-gp37,PCR扩增出1 161 bp的条带与目的基因gp37一致,经过双酶切得到2个条带,其中包括与预期1 161 bp大小一致的条带。测序结果表明,获得了正确的重组质粒pET-28a-EGFP-gp37。
2.3 融合蛋白EGFP-gp37的诱导表达与可溶性分析
重组菌pET-28a-EGFP-gp37/BL21(DE3)通过IPTG的诱导表达后进行SDS-PAGE电泳分析,结果见图3。通过SDS-PAGE可以发现,融合蛋白在上清中可溶性表达,表达量约占菌体总蛋白量的23%。

M.DNA 标准DL 2 000;1.pET-28a-EGFP;2.pET-28a-EGFP双酶切鉴定;3.pET-28a-EGFP-gp37;4.pET-28a-EGFP-37双酶切鉴定
M.DNA Marker DL 2 000;1.pET-28a-EGFP;2.Double enzymes digestion of pET-28a-EGFP;3.pET-28a-EGFP-gp37;4.Double enzymes digestion of pET-28a-EGFP-gp37
图2 pET-28a-EGFP-gp37的PCR与双酶切鉴定
Fig.2 PCR and double enzymes digestion identification of EGFP pET-28a-EGFP-gp37
2.4 融合蛋白的纯化以及Western blot检测
原核表达的EGFP-gp37融合蛋白利用亲和层析纯化,洗脱时每管收集1 mL,纯化后进行SDS-PAGE检测,发现纯化第2管含量最高(图3),进行Western blot检测时,出现一条分子质量71 ku特异性的结合带(图3),根据分子质量大小推测,这条
带分子质量与目的蛋白的分子质量相同,从而证明表达的蛋白是EGFP-gp37融合蛋白。
2.5 融合蛋白EGFP-gp37与宿主菌相互作用
融合蛋白EGFP与宿主菌大肠埃希菌K12相互作用,利用激光共聚焦显微镜观察二者相互作用(图4)。

M.蛋白分子质量标准;1.空质粒的诱导表达;2.重组质粒pET-28a-EGFP-gp37的诱导表达;3.菌体裂解上清;4.菌体裂解沉淀;5~7.不同管洗脱的融合蛋白;8.Western blot
M.Protein molecular weight Marker;1.Expression induced by backbone plasmid;2.Expression of recombinant plasmid pET-28a-EGFP-gp37;3.The supernatant of lysates; 4.The deposition of lysates;5-7.Fusion proteins of different tubes;8.Western blot
图3 融合蛋白EGFP-gp37 SDS-PAGE及Western blot分析
Fig.3 SDS-PAGE and Western blot analysis of recombinant protein EGFP-gp37

A.荧光条件下拍摄;B.白光条件下拍摄;C.A与B的叠加;D.对照组
A.Shooting under the condition of fluorescence;B.Shooting under white light;C.Overlapping of A and B;D.Control group
图4 激光共聚焦检测
Fig.4 Results of laser confocal detection
由图4可知,试验组中有菌体存在的地方就有绿色荧光,而对照组中没有,这说明蛋白EGFP-37能够结合到宿主菌K12上,而EGFP蛋白不能与宿主菌K12结合,表明尾丝蛋白gp37参与噬菌体Bp7吸附大肠埃希菌K12的过程,能够吸附到宿主菌表面。
3 讨论
近年来,随着抗生素的使用以及耐药细菌的出现,噬菌体治疗也越来越受到人们的关注。本试验中的噬菌体Bp7来自鸡场粪便,并且完成了全基因组测序,基因组分析显示,噬菌体Bp7与T4类噬菌体同源性极高,生物学特征分析显示,其对鸡致病性大肠埃希菌的裂解率达45%,具有较宽的裂解谱[8]。在T4类噬菌体中,尾丝蛋白gp37参与宿主菌表面受体的识别[9],因此,本试验对噬菌体Bp7尾丝蛋白gp37进行研究,确定其在噬菌体Bp7识别宿主菌表面受体过程中的作用。
蛋白之间的相互作用可以通过多种方法进行检测,其中最常用的就是CoIP和Pull-down方法,但是需要SDS-PAGE以及转膜的操作过程,费时繁琐[10]。EGFP作为一种报告分子,可以用于检测蛋白表达、蛋白和细胞荧光示踪、蛋白质的结构及功能的研究[11]。庾庆华等报道了利用EGFP研究禽肠炎沙门菌在鸡肠道定植分布规律和芽胞杆菌在仔猪和雏鸡体内的动态分布[12]。Warren R M等[13]报道了利用绿色荧光蛋白标记噬菌体对细菌病原体进行检测。Bae H W等[14]报道了利用绿色荧光蛋白标记噬菌体蛋白,发现了抑制Ⅳ型菌毛装配所需的细菌ATP酶。本试验通过绿色荧光蛋白与尾丝蛋白gp37的融合表达,使尾丝蛋白带有绿色荧光标签,通过激光共聚焦显微镜直接观察尾丝蛋白gp37与大肠埃希菌K12的相互作用情况。自然光条件下菌体是无色的,荧光条件下检测到菌体带绿色荧光,试验结果显示,尾丝蛋白gp37能够结合到宿主菌K12表面。利用绿色荧光可追踪的特点来观察尾丝蛋白gp37与宿主菌K12的吸附过程,减少了SDS-PAGE凝胶电泳以及Western blot转膜等复杂的过程,不仅节约了时间,而且试验结果更加清晰明了。
本试验构建了重组质粒pET-28a-EGFP-gp37,实现了绿色荧光蛋白EGFP与尾丝蛋白gp37重组蛋白的融合表达,获得71 ku的可溶性蛋白EGFP-gp37。融合蛋白EGFP-gp37能够结合到宿主菌表面,表明尾丝蛋白gp37参与宿主菌受体的识别。在T4类噬菌体中尾丝蛋白gp37是噬菌体与宿主菌的相互作用过程中的关键蛋白,本研究结果将为进一步研究噬菌体Bp7与宿主菌的相互作用机制奠定了基础。
[1] 蒋 羽,李 伟,范蒙光.细菌抗噬菌体感染分子机制[J].疾病监测,2015(8):679-682.
[2] Yap M L,Rossmann M G.Structure and function of bacteriophage T4[J].Future Microbiol,2014,9(12):1319-1327.
[3] Simpson D J,Sacher J C,Szymanski C M.Exploring the interactions between bacteriophage-encoded glycan binding proteins and carbohydrates[J].Curr Opin Struct Biol,2015,34:69-77.
[4] Buth S A,Menin L,Shneider M M,et al.Structure and biophysical properties of a triple-stranded beta-helix comprising the central spike of bacteriophage T4[J].Viruses,2015,7(8):4676-4706.
[5] Brzozowska E,Smietana M,Koba M,et al.Recognition of bacterial lipopolysaccharide using bacteriophage-adhesin-coated long-period gratings[J].Biosens Bioelectron,2015,67:93-99.
[6] Bartual S G,Otero J M,Garcia-Doval C,et al.Structure of the bacteriophage T4 long tail fiber receptor-binding tip[J].Proc Natl Acad Sci U S A,2010,107(47):20287-20292.
[7] 刘霄飞,任慧英,刘文华,等.大肠杆菌噬菌体Bp7裂解性能分析[J].中国农学通报,2010(9):18-21.
[8] Zhang C,Li W,Liu W,et al.T4-like phage Bp7,a potential antimicrobial agent for controlling drug-resistantEscherichiacoliin chickens[J].Appl Environ Microbiol,2013,79(18):5559-5565.
[9] Rydosz A,Brzozowska E,Górska S,et al.A broadband capacitive sensing method for label-free bacterial LPS detection[J].Biosens Bioelectron,2016,75:328-336.
[10] 刘 文.周期蛋白依赖的激酶10、磷脂酶C伽马1及热休克蛋白90在昆虫蜕皮激素信号转导途径中的功能研究[D].山东济南:山东大学,2014.
[11] Kan S C,Chen C M,Lin C C,et al.Deciphering EGFP production via surface display and self-cleavage intein system in different hosts[J]. J Taiwan Instit Chem Engine,2015,55:1-6.
[12] 王高玲,李 涛,史冰田,等.hilA基因两端51 bp序列对示踪标记性绿色荧光蛋白在禽肠炎沙门氏菌中倍增表达效率的鉴定[J].中国预防兽医学报,2015(6):409-413.
[13] Van der Merwe R G,van Helden P D,Warren R M,et al.Phage-based detection of bacterial pathogens[J].Analyst,2014,139(11):2617-2626.
[14] Chung I Y,Jang H J,Bae H W,et al.A phage protein that inhibits the bacterial ATPase required for type IV pilus assembly[J].Proceed Natl Aca Sci,2014,111(31):11503-11508.
Prodaryotic Expression and Activity Determination of Tail Fiber Protein gp37 of Phage Bp7
SUN Hu-zhi,REN Hui-ying,ZHANG Can
(CollegeofAnimalScienceandTechnology,QingdaoAgriculturalUniversity,Qingdao,Shandong,266109,China)
In order to identify the tail fiber protein gp37 function in phage Bp7 adsorbing onE.coliK12,1 161 bp C terminal sequence of gp37 as amplified by PCR,and recombinant plasmid pET-28a-EGFP-gp37 was constructed with a fluorescent tag of EGFP.InE.coliBL21(DE3),the fusion protein EGFP-gp37 was induced by IPTG to express and purified by affinity chromatography.SDS-PAGE and Western blot analysis showed that protein EGFP-gp37 was expressed in supernatant ofE.coliBL21(DE3).The expression level reached 23%.The purfied protein of EGFP-gp37 was incubated withE.coliK12 and detected by laser confocal microscopy.The result showed that protein EGFP-gp37 adsorbed on the surface ofE.coliK12,which indicated that tail fiber protein gp37 participated in the receptor recognition of phage Bp7.
phage Bp7;tail fiber protein gp37;green fluorescent protein EGFP;E.coliK12
2015-10-22
青岛农业大学创新计划项目(QYC201406);山东省自然科学基金项目(ZR2013CQ024;ZR2015CM020)
孙虎芝(1991-),男,山东乳山人,硕士研究生,主要从事兽医微生物与免疫学研究。*通讯作者
S852.65;Q789
A
1007-5038(2016)05-0010-05
