PLD和Ca2+对NaCl胁迫下水稻花粉萌发的影响*
2017-01-06沈鹏,滕云,臧皓*
沈 鹏,滕 云,臧 皓*
(1.通化师范学院制药与食品科学学院,吉林通化134002;2.通化市通化县三棵榆树镇中心校,吉林通化134002)
PLD和Ca2+对NaCl胁迫下水稻花粉萌发的影响*
沈 鹏1,滕 云2,臧 皓1*
(1.通化师范学院制药与食品科学学院,吉林通化134002;2.通化市通化县三棵榆树镇中心校,吉林通化134002)
目的:研究PLD和Ca2+对NaCl胁迫下水稻花粉萌发的影响.方法:应用水稻花粉进行萌发实验.结果:NaCl和0.05%1-丁醇明显抑制水稻花粉的萌发.Ca2+存在时1-丁醇对花粉的萌发影响较小.结论:PLD和Ca2+可能参与了NaCl胁迫下水稻发育后期的花粉萌发过程,并且在该过程中起着正向调节作用.
水稻;PLD;NaCl胁迫;花粉萌发
土壤盐渍化是世界灌溉农业可持续发展的资源制约因素[1].盐胁迫通过离子毒害、渗透胁迫和氧化胁迫影响植物的代谢过程[2].在植物中,磷脂酶D (PLD)可被高浓度的NaCl快速激活.研究表明,PLD和其水解产物PA可调节植物NaCl胁迫耐性相关的基因表达,促进气孔关闭、减缓植物受害程度[3].
花粉萌发和花粉管生长是高等植物后期发育过程的一个重要环节[4].PLD在不同植物的花粉粒和萌发的花粉管中高度表达,揭示了PLD可能参与花粉发育和花粉管萌发的信号转导途径[5-6].关于PLD对盐胁迫下植物花粉发育的作用,目前的研究报道相对较少.本文主要通过药理学的方法,分析了PLD对盐胁迫下水稻生育后期花粉萌发的影响,为PLD在盐胁迫下的生理调控机理研究提供理论依据.
1 材料与方法
1.1 实验材料
水稻日本晴(Oryza sativa L.cv.Nipponbare).
1.2 实验方法
1.2.1花粉萌发实验
置水稻花粉于花粉萌发培养基上,28℃下恒温暗培养2 h.培养基成分:20%蔗糖、10%PEG4000、2.5 mM KNO3、40 mg/L H3BO3.
盐处理:于花粉萌发培养基中加入NaCl,NaCl浓度分别为0、5 mM、10 mM、15 mM、20 mM.
丁醇处理:花粉萌发培养基加入5 mM NaCl进行盐处理,分别加入1-丁醇、2-丁醇进行处理,最终浓度为0.05%.其中,1-丁醇为PLD抑制剂,2-丁醇为1-丁醇类似物.
Ca2+处理:花粉萌发培养基中加入Ca(NO3)2进行处理,使Ca2+浓度分别为0、0.05 mM、0.1 mM、0.3 mM、0.5 mM.
1.2.2花粉萌发率的测定
当花粉粒萌发时,在光学显微镜下,统计萌发及未萌发的花粉粒数,重复取3个视野,每个视野统计30~50个花粉粒.萌发率=萌发的花粉数/总花粉数×100%.
1.3 数据分析方法
采用SPSS18.0软件统计差异显著性.
2 结果与分析
2.1 NaCl对水稻花粉萌发的影响
花粉萌发实验表明,NaCl显著抑制花粉萌发和花粉管的伸长.随着NaCl处理浓度上升,水稻的花粉萌发率呈明显下降趋势(图1F).20 mM NaCl处理2 h后,水稻的花粉萌发率只有10%左右.同时,NaCl处理下的花粉管伸长量也低于对照,甚至出现只萌动而不伸长的现象(图1D,1E).说明,盐胁迫下水稻的花粉萌发和花粉管的伸长受到明显抑制.
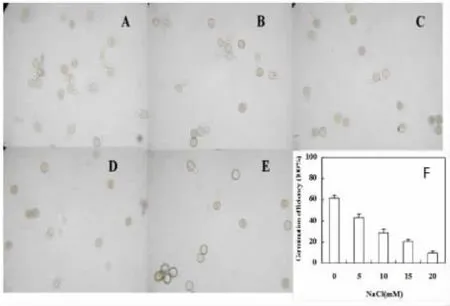
图1 NaCl对水稻花粉萌发的影响.A:对照;B:5 mM; C:10 mM;D:15 mM;E:20 mM;F:萌发率变化
2.2 1-丁醇处理对盐胁迫下水稻花粉萌发的影响
从图2可知,加入0.05%1-丁醇抑制PLD产生PA,盐胁迫下水稻花粉的萌发受到明显抑制,萌发率为对照的60%左右(图2D).由图2B可知,在0.05%1-丁醇处理下,花粉管的伸长明显受到抑制.由此可见,0.05%1-丁醇不仅降低了盐胁迫下水稻的花粉萌发率,而且也抑制了花粉管的伸长.与1-丁醇处理结果相反,在同浓度的2-丁醇处理下,盐胁迫下水稻花粉萌发和花粉管的伸长都没有明显的变化.表明,PLD可能促进了盐胁迫下水稻花粉萌发和花粉管的伸长.
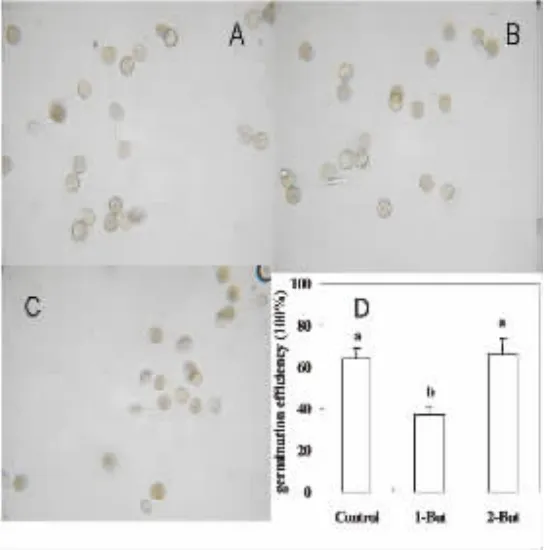
图2 1-丁醇处理对盐胁迫下水稻花粉萌发的影响.
2.3 Ca2+对水稻花粉萌发的影响
Ca2+是花粉萌发与花粉管生长最重要的信号,在花粉萌发和花粉管生长中具重要作用[7,8].本实验中,随着Ca2+的增加,水稻花粉的萌发率也随之提高,在Ca2+浓度达到0.3 mM时,花粉的萌发率达到80%左右,之后花粉随Ca2+浓度的增加萌发率反而下降,见图3(a).说明低浓度的Ca2+对花粉萌发起促进作用,而高浓度的Ca2+则起抑制作用.
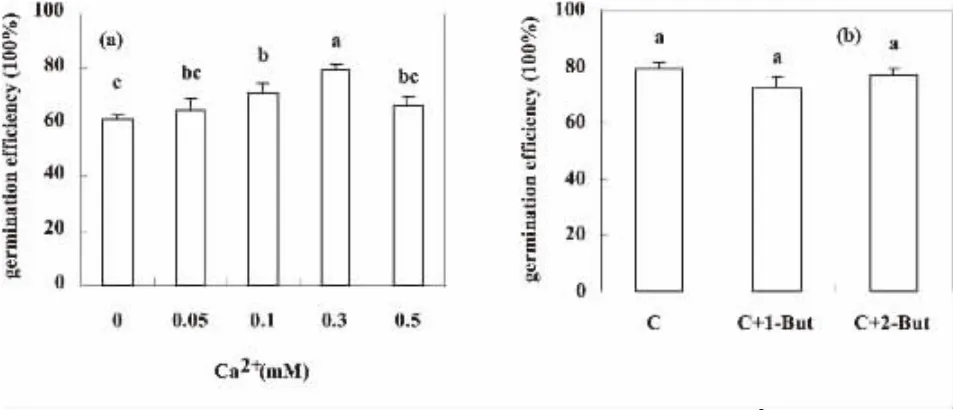
图3 不同处理对水稻花粉萌发的影响.(a):Ca2+处理;(b):丁醇处理.不同字母代表处理同对照之间达到显著性差异.
由图3(b)可知,Ca2+和1-丁醇存在时,花粉萌发率比单独用Ca2+处理略微降低,但处理间并没有达到显著差异.说明在Ca2+存在时,1-丁醇对花粉的萌发影响很小,外源Ca2+可以缓解1-丁醇对水稻花粉萌发与花粉管生长的抑制效应.
3 结论
花粉萌发实验表明,随着NaCl处理浓度的上升,水稻的花粉萌发和花粉管的伸长都受到明显的抑制.1-丁醇抑制水稻花粉萌发的启动,同时抑制花粉萌发的后期阶段花粉管的伸长,PLD和PA可能参与调节水稻花粉萌发与花粉管伸长的整个过程.同时,PLD很可能通过影响水稻花粉中的Ca2+浓度,从而调控水稻花粉萌发的信号转导过程.综合以上实验结果,PLD和Ca2+可能参与了盐胁迫下水稻的花粉萌发过程,并且水稻的耐盐性中起着正向调控的作用.
[1]李建国,濮励杰,朱明,等.土壤盐渍化研究现状及未来研究热点[J].地理学报,2012,67(9):1233-1240.
[2]利荣千,王建波,赵可夫,等.植物逆境细胞及生理学[M].武汉:武汉大学出版社,2002.
[3]Wang X.Regulatory functions of phospholipase D and phosphatidic acid in plant growth,development,and stress responses[J].Plant Physiology,2005,139(3):566-573.
[4]陈莎莎,兰海燕.植物对盐胁迫响应的信号转导途径[J].植物生理学报2011,47(2):119-128.
[5]丁彬,岳晓翔,彭建云,等.钙对NaCl胁迫下百合花粉萌发、脯氨酸含量和SOD活性的影响[J].菏泽学院学报.2006,28:98 -104.
[6]Joanne C,Solène F-N,Susana R,et al.Phospholipases in action during plant defense signaling[J].Plant Signal Behav,2011,6 (1):13-18.
[7]Iwano M,Entani T,Shiba H,et al.Fine-Tuning of the Cytoplasmic Ca2+Concentration IsEssential for Pollen Tube Growth[J].Plant Physiology,2009,150(7):1322-1334.
[8]Wu J-Y,Jin C,Qu H-Y,et al.The activity of plasma membrane hyperpolarization-activated Ca2+channels during pollen development of Pyrus pyrifolia[J].Acta Physiologiae Plantarum,2012,34 (5):969-975.
(责任编辑:王海波)
Q945 文献标志码:A
1008-7974(2016)06-0026-02
10.13877/j.cnki.cn22-1284.2016.12.008
2016-11-15
沈鹏,黑龙江哈尔滨人,博士研究生,讲师.
臧皓,博士研究生,讲师.Email:zanghao_1984@163.com
