京尼平苷及其体内代谢产物京尼平对HepG2细胞毒性的比较及机制研究
2017-01-06任艳青田宇柔何颖娜麻景梅牛丽颖王鑫国
任艳青,田宇柔,李 琛,何颖娜,麻景梅,牛丽颖,王鑫国
(河北中医学院中药药理学实验室,河北省中药配方颗粒工程技术研究中心,河北省高校中药配方颗粒应用技术研发中心,河北 石家庄 050091)
京尼平苷及其体内代谢产物京尼平对HepG2细胞毒性的比较及机制研究
任艳青,田宇柔,李 琛,何颖娜,麻景梅,牛丽颖,王鑫国
(河北中医学院中药药理学实验室,河北省中药配方颗粒工程技术研究中心,河北省高校中药配方颗粒应用技术研发中心,河北 石家庄 050091)
目的 通过比较京尼平苷(geniposide,GS)及其体内代谢产物京尼平(genipin,GP)的HepG2 肝细胞毒性,进一步明确中药栀子致肝毒性的物质基础,并探讨其毒性作用机制。方法 采用MTT法检测不同浓度GS与GP的细胞毒作用;试剂盒法测定细胞中锰-超氧化物歧化酶(Mn-SOD)、过氧化氢酶(CAT)活力及谷胱甘肽(GSH)含量;二乙酸-2′,7′-二氯荧光素(DCFH-DA)染色法测定胞内活性氧(ROS)的变化;高内涵细胞分析技术(high content screening,HCS)进行多参数细胞毒性(细胞数量、核尺寸及形态、核DNA含量、细胞膜通透性、线粒体膜电位和细胞色素C)分析。结果 GS(20~1 000 μmol·L-1)对HepG2细胞无明显细胞毒作用(P>0.05),50 μmol·L-1GP可明显抑制HepG2细胞增殖(P<0.05),IC50值为(450.00 ± 26.15)μmol·L-1;GS对胞内Mn-SOD、CAT、GSH、ROS含量无明显影响(P>0.05),GP孵育细胞后,引起胞内Mn-SOD、CAT活性明显下降,GSH含量明显降低,并可明显增加ROS的生成(P<0.05或P<0.01);50、500、1 000 μmol·L-1GP可明显降低线粒体膜电位,促进细胞色素C的释放,升高细胞膜通透性(P<0.05或P<0.01),500、1 000 μmol·L-1GP组还可观察到明显的核固缩以及核荧光强度的升高,细胞数量的明显下降(P<0.01),1 000 μmol·L-1GS对上述细胞毒性参数无明显影响(P>0.05)。结论 GP是栀子致肝细胞毒性的直接物质基础,氧化应激所导致的线粒体损伤与细胞凋亡是GP引起肝毒性的主要机制。
栀子;京尼平苷;京尼平;药物性肝损伤;氧化应激;线粒体损伤;细胞凋亡;高内涵分析
栀子为茜草科植物栀子(GardeniajasminoidesEllis)的干燥成熟果实,为保肝利胆的常用中药。京尼平苷(geniposide,GS)即栀子苷,是其含量最高的环烯醚萜苷类物质,临床常用于急慢性肝损伤、酒精性肝病、胆汁淤积性肝损伤、慢性肝炎、肝纤维化、非酒精性脂肪肝、肝功能衰竭、肝癌等肝脏疾病的治疗[1-2],现代药理研究发现京尼平苷还具有抗炎、抗氧化、抗癌、抗抑郁、神经保护、抗血管生成[3-5]等广泛的药理活性。近些年来,不少学者研究发现,实验动物长期大剂量灌服栀子具有明显的肝毒性[6-10],其肝毒性问题一直是阻碍临床用药的主要问题。目前,栀子引起肝毒性物质基础及毒效机制尚不明确,有学者提出京尼平(genipin,GP)苷是栀子肝毒性的主要物质基础,也有学者推测栀子所导致的肝毒性是由其体内代谢产物京尼平所引起,但尚缺乏直接的实验支持。本研究将不同浓度的京尼平苷与京尼平作用于人肝癌HepG2细胞,通过比较二者的肝细胞毒性,进一步明确栀子肝毒性的物质基础,并在此基础上,基于建立的高内涵多参数细胞毒性分析方法,从氧化应激损伤角度探讨其毒性作用机制,为栀子的安全性评价提供更多实验依据,同时也为寻找减轻栀子肝毒性的药物奠定基础。
1 材料与方法
1.1 药品与试剂 京尼平苷(批号140815,纯度98%)、京尼平(批号141207,纯度98%)购自南京狄尔格医药科技有限公司,均以DMSO配制成0.1 mol·L-1储备液,无血清DMEM培养基梯度稀释至工作浓度。高糖DMEM、胎牛血清购自美国Gibco公司;MTT、DMSO购自美国Amresco公司;超氧化物歧化酶(SOD)分析测试盒、过氧化氢酶(CAT)测定试剂盒、微量还原型谷胱甘肽(GSH)测试盒、活性氧(ROS)测试盒,均购自南京建成生物工程研究所;多参数细胞毒性检测试剂盒购自美国Thermo Fisher Scientific公司。1.2 仪器 MCO-15AC CO2培养箱(日本SANYO);超净工作台(力康生物医疗科技控股有限公司);TGL-16台式高速冷冻离心机(长沙湘仪离心机仪器有限公司);DMI 3000 B倒置荧光显微镜(德国Leica);150-96超声波破碎仪(赛飞中国有限公司);Multiskan FC酶标仪(美国Thermo Fisher Scientific);VTI700高内涵细胞分析系统(美国Thermo Fisher Scientific)。
1.3 细胞及细胞培养 人肝癌HepG2细胞,购自中国医学科学院肿瘤细胞库。采用高糖DMEM培养基(含体积分数为0.1 胎牛血清、1×105U·L-1青霉素、100 mg·L-1链霉素),5% CO2、37 ℃饱和湿度培养箱培养,细胞为贴壁生长,细胞生长至80%汇合时即可用胰酶消化传代,实验选用对数生长期细胞。
1.4 MTT法检测细胞毒性 HepG2细胞接种于96孔培养板,每孔约5 000个细胞,待细胞贴壁后,同步化处理24 h,加入不同浓度的GS、GP(浓度梯度均为20、50、100、250、500、1 000 μmol·L-1),每个浓度设6个复孔,作用24 h后,每孔加入MTT 继续培养4 h,小心吸弃上清,每孔加入DMSO 150 μL,振荡使结晶充分溶解,酶标仪570 nm处测定吸光度OD值,计算细胞存活率(存活率/%=OD实验组/OD对照组×100%),并根据药物浓度对应细胞增殖抑制率作线性回归,计算IC50值,即药物抑制50%细胞增殖时的浓度,实验重复3次。
1.5 试剂盒法测定细胞中Mn-SOD、CAT、GSH水平 HepG2细胞以每瓶5×105个接种于25 cm2培养瓶中,GS、GP浓度梯度均为50、100、250、500、1 000 μmol·L-1,培养24 h后,用细胞刮将细胞刮下,离心收集细胞,超声破碎后按照Mn-SOD、CAT、GSH检测试剂盒说明书操作,计算细胞Mn-SOD、CAT活力及GSH含量。
1.6 荧光探针DCFH-DA 法检测ROS水平 参照文献[11]方法,以1×108·L-1密度接种细胞于96孔板,每孔100 μL,24 h后分别加入1 000 μmol·L-1GS,50、500、1 000 μmol·L-1GP,培养24 h,药物作用时间结束后,吸弃培养基,加入30 μmol·L-1DCFH-DA探针50 μL每孔,继续孵育30 min,PBS洗涤3次后,选择激发波长485 nm,发射波长525 nm,于高内涵细胞分析系统观察细胞内ROS 染色,检测细胞平均荧光强度值。
1.7 HCS技术进行多参数细胞毒性分析 细胞接种(密度5×107·L-1、3复孔/组)、同步化、药物干预(1 000 μmol·L-1GS,50、500、1 000 μmol·L-1GP)24 h,吸弃培养液,加入活细胞染液(含非膜通透性细胞核染料和线粒体膜电位染料)每孔50 μL,置于培养箱内孵育30 min;室温进行固定、透化、封闭处理,依次加入细胞色素C小鼠单克隆一抗(1 ∶400)、DyLightTM649 羊抗鼠IgG(1 ∶500)二抗及Hoechst 33342,清洗后开启HCS系统,设定10倍物镜,每孔扫描16个视野,每种染料的扫描波长设定如下:Hoechst 33342:激发/发射光波长350/461 nm、非膜通透性细胞核染料:激发/发射光波长491/509 nm、线粒体膜电位染料:激发/发射光波长552/576 nm、细胞色素C:激发/发射光波长646/674 nm,并设定每一通道的聚焦位置及曝光强度参数,对每个孔逐一进行扫描,进行多参数细胞毒性分析:细胞数量、核尺寸及形态、核DNA含量、膜通透性、线粒体膜电位(MMP)、细胞色素C含量(其中,核DNA含量、膜通透性、MMP、细胞色素C均以细胞的平均荧光强度值表示)。
2 结果
2.1 京尼平苷及其体内代谢产物京尼平对HepG2细胞的细胞毒作用 京尼平苷(20~1 000 μmol·L-1)浓度范围内对HepG2细胞无明显细胞毒作用(P>0.05);50、100、250、500、1 000 μmol·L-1京尼平可使细胞存活率明显下降(P<0.05或P<0.01),细胞存活率依次为(90.19 ± 5.04)%、(77.84 ± 7.76)%、(66.84 ± 6.55)%、(51.60 ± 6.62)%、(30.66 ± 4.48)%,见Fig 1。实验结果表明,京尼平对HepG2细胞有明显的细胞毒作用,且随浓度的增加,细胞毒作用增强,毒性作用呈浓度依赖性,IC50值为(450.00 ± 26.15)μmol·L-1。
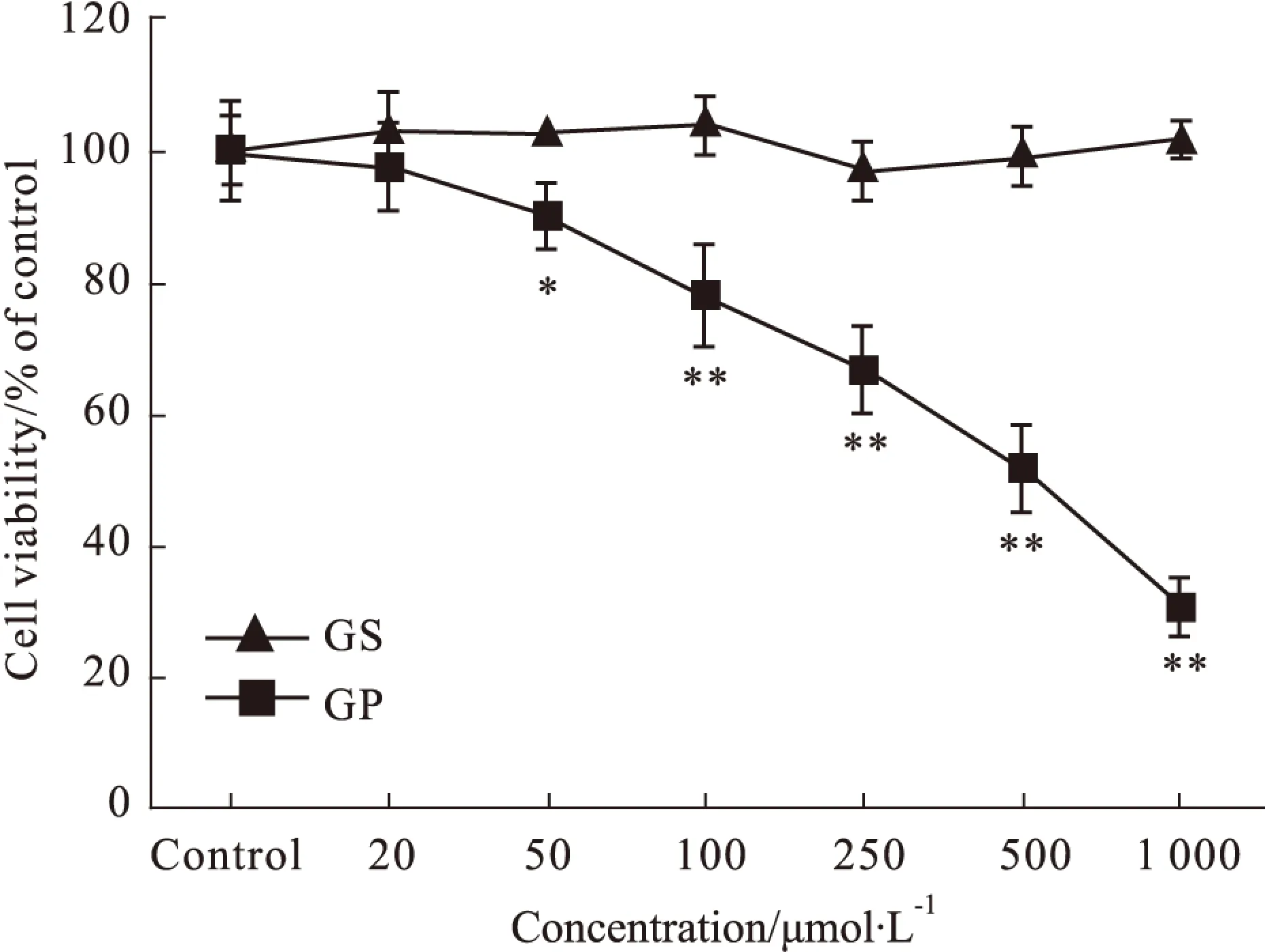
Fig 1 Cytotoxic effects of GS and its metabolite GP on

*P<0.05,**P<0.01vscontrol
2.2 京尼平苷及其体内代谢产物京尼平对胞内Mn-SOD、CAT、GSH水平的影响 不同浓度的京尼平苷(50、100、250、500、1 000 μmol·L-1)处理HepG2细胞后,对胞内Mn-SOD、CAT活力及GSH含量均无明显影响(P>0.05);50、100、250、500、1 000 μmol·L-1京尼平可明显降低胞内Mn-SOD、CAT活性及GSH含量(P<0.05或P<0.01),且此作用随京尼平浓度的增加越明显,见Fig 2。
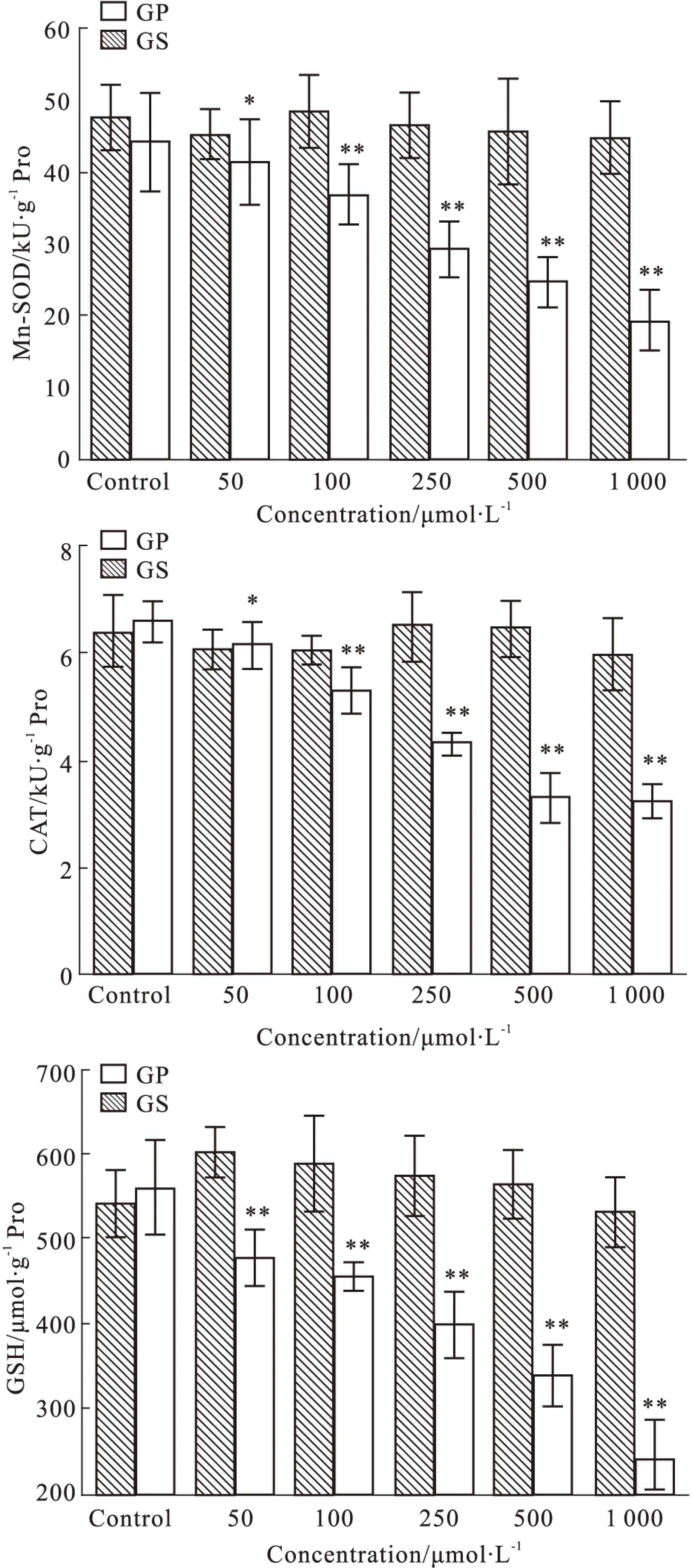
Fig 2 Effects of GS and its metabolite GP on levels of Mn-SOD,

*P<0.05,**P<0.01 vscontrol
2.3 京尼平苷及其体内代谢产物京尼平对胞内ROS水平的影响 对照组HepG2细胞荧光强度很弱,表明细胞内活性氧的量很少;1 000 μmol·L-1京尼平苷对细胞内活性氧水平无明显影响(P>0.05);50、500、1 000 μmol·L-1京尼平孵育HepG2细胞后,细胞荧光强度明显增强(P<0.01),说明京尼平可以诱导细胞内总活性氧水平明显升高,并呈现明显的浓度依赖性,见Fig 3。
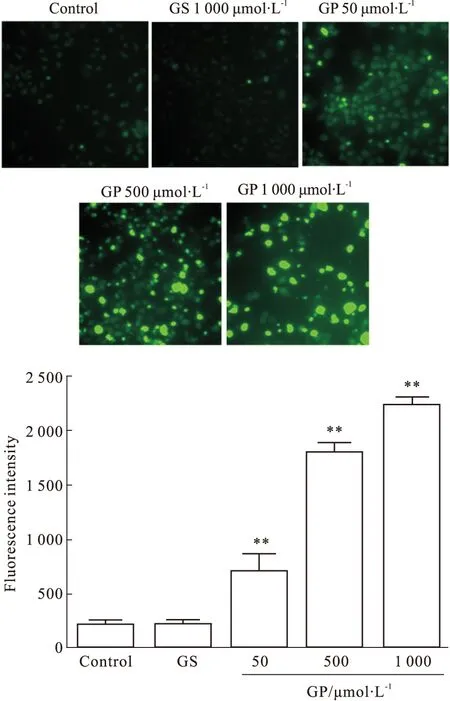
Fig 3 Effects of GS and its metabolite GP on ROS levels

**P<0.01vscontrol
2.4 京尼平苷及其体内代谢产物京尼平对HepG2细胞多参数细胞毒性的影响 正常对照组细胞线粒体膜电位正常,细胞色素C释放较少,细胞膜通透性低,核形态完好,荧光强度低;1 000 μmol·L-1京尼平苷孵育细胞,对以上指标均无明显影响(P>0.05),未观察到明显的凋亡特征,提示京尼平苷的细胞毒性不明显,与MTT结果具有较好的一致性。50 μmol·L-1京尼平可明显降低线粒体膜电位(P<0.01),促进细胞色素C的释放(P<0.01),升高细胞膜通透性(P<0.05),提示京尼平可诱导细胞发生早期凋亡;500、1 000 μmol·L-1京尼平除对线粒体及通透性有影响外,还可观察到细胞核的固缩及核内染色质的凝集(P<0.01),核荧光强度明显升高(P<0.01)以及细胞数量的明显下降(P<0.01),提示京尼平诱导细胞发生晚期凋亡,通过高内涵分析可发现,京尼平对HepG2细胞具有明显的细胞毒作用,毒性作用机制与其导致的线粒体损伤与细胞凋亡有关,见Fig 4。
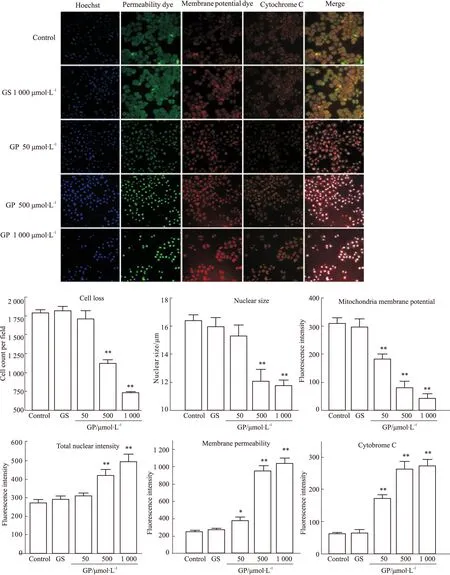
Fig 4 Effects of GS and its metabolite GP on multiparameter cytotoxicity in HepG2 cells by HCS assays (×100) ±s,n=3)
*P<0.05,**P<0.01vscontrol
3 讨论
近些年来,中药及其成分引起的药物性肝损伤(drug-induced liver injury,DILI)发病率逐年升高[12],越来越引起国内外学者的重视。因此,通过现代毒理学研究手段,阐明中药肝毒性的物质基础及毒性作用机制对于防治中药源性肝损伤具有重要的意义。高内涵分析技术(high content screening,HCS)现已成为国际通用的DILI研究手段[13],Persson等[14]采用HCS技术对100种已知肝毒性药物(对氨基水杨酸、碘胺酮等)的HepG2细胞毒性进行了重新评估。Tolosa等[15]也以HepG2细胞为观察对象,采用HCS技术对78种肝毒性成分(炔雌醇、碘胺酮等)作用于HepG2细胞3、24 h毒性进行了分析,均显示HCS技术在DILI及毒性作用机制研究中具有高度的敏感性与特异性[16]。
栀子导致的DILI已被共识,不少学者从整体动物水平探讨了栀子水提物、醇提物及京尼平苷所导致的肝损伤。本研究以HepG2细胞为对象,对比分析京尼平苷及其代谢产物京尼平的肝细胞毒性差异,发现不同浓度的京尼平苷孵育HepG2细胞,均未产生明显的细胞毒作用,提示京尼平苷不是栀子产生肝毒性的物质基础。京尼平对HepG2细胞具有明显的肝细胞毒性,毒性作用呈浓度依赖性,IC50值为(450.00 ± 26.15)μmol·L-1,明确了京尼平是引起肝毒性的直接物质基础,可以推论栀子的肝毒性是栀子药材中的京尼平苷经肠道细菌β-葡萄糖苷酶水解后的代谢产物京尼平所引起,与文献推测一致[4]。
氧化应激损伤是中药源性DILI的主要机制[17],氧化应激是指ROS的产生与机体内抗氧化防御系统的清除之间失衡[18]。Mn-SOD、CAT、GSH是体内重要的抗氧化系统[12,17],为了明确京尼平导致的DILI与氧化应激的关系,我们测定了胞内Mn-SOD、CAT活力及GSH、ROS含量,发现京尼平可明显降低Mn-SOD、CAT活性及GSH含量,说明细胞抗氧化能力下降,同时伴随着ROS的大量增多,说明京尼平诱导的肝细胞毒性与氧化应激密切相关。线粒体是氧化应激损伤的重要靶细胞器[19],线粒体膜电位的变化可以反映出线粒体受损的程度,并被认为是细胞凋亡的早期事件,同时由于线粒体的损伤导致细胞色素C的大量释放[20],进而触发细胞凋亡级联反应,引起细胞的凋亡。我们采用国际先进的HCS体外毒性评价技术,从线粒体功能及细胞凋亡的角度对京尼平所导致的肝细胞毒性进行了分析,通过HCS多参数细胞毒性测定对线粒体膜电位、细胞色素 C 含量、膜通透性、核尺寸及形态、核DNA含量、细胞数量等指标进行同时分析。在研究中,我们发现,50 μmol·L-1京尼平组细胞线粒体膜电位下降,大量细胞色素C释放到胞质中,细胞膜通透性明显增加,提示线粒体膜电位水平、细胞色素C含量及细胞膜通透性是京尼平诱导细胞凋亡的早期敏感性指标;随着京尼平孵育浓度的加大,还伴随着核形态的破坏,表明京尼平可诱导细胞发生晚期凋亡,而京尼平苷未观察到明显的肝细胞毒性。
通过以上研究可以发现,京尼平具有明显的肝细胞毒性作用,是栀子致肝毒性的直接物质基础,氧化应激所导致的线粒体损伤与细胞凋亡是京尼平引起肝毒性的主要作用机制之一。以上研究结果为栀子的安全性评价提供了资料,为栀子的临床合理应用提供了实验依据,有关京尼平对线粒体凋亡通路相关蛋白表达的影响,课题组正在进一步深入研究。
[1] Meng S X, Peng J H, Feng Q, et al. The role of genipin and geniposide in liver diseases: a review [J].AlternIntegrMed, 2013, 2:117.
[2] 杨 扬, 吴小琴, 李小枫, 等. 栀子柏皮汤及含栀子配伍组对免疫性肝损伤小鼠的保护作用 [J]. 中国药理学通报, 2015, 31(12):1764-9.
[2] Yang Y, Wu X Q, Li X F, et al. Study on the protective effect in immunological liver injury in mice of Zhizi BaiPi Soup and its disassembled prescription [J].ChinPharmacolBull, 2015, 31(12):1764-9.
[3] Ma T T, Li X F, Li W X, et al. Geniposide alleviates inflammation by suppressing MeCP2 in mice with carbon tetrachloride-induced acute liver injury and LPS-treated THP-1 cells [J].IntImmunopharmacol, 2015, 29(2):739-47.
[4] Gao L N, Zhang Y, Cui Y L, Yan K. Evaluation of genipin on human cytochrome P450 isoenzymes and P-glycoproteininvitro[J].Fitoterapia, 2014, 98:130-6.
[5] 王 磊, 辛文锋, 张文生. 栀子苷治疗阿尔采末病及神经保护的分子机制研究进展 [J]. 中国药理学通报, 2012, 28(5):604-7.
[5] Wang L, Xin W F, Zhang W S. Reserach advances of the molecular mechanism of geniposide on therapy of Alzheimer’s disease and effects in neuroprotection [J].ChinPharmacolBull, 2012, 28(5):604-7.
[6] 杨洪军, 付梅红, 吴子伦, 等. 栀子对大鼠肝毒性的实验研究 [J]. 中国中药杂志, 2006, 31(13):1091-3.
[6] Yang H J, Fu M H, Wu Z L, et al. Experimental studies on hepatotoxicity of rats induced byFructusGardeniae[J].ChinJChinMaterMed, 2006, 31(13):1091-3.
[7] 王 波, 杨洪军, 高双荣, 等. 栀子对大鼠肝肾毒性的病理学观察 [J]. 中国实验方剂学杂志, 2007, 13(5):45-8.
[7] Wang B, Yang H J, Gao S R, et al. The pathological observation of toxicity on kidney and haper byFructusGardeniaein rats [J].ChinJExpTraditMedForm, 2007, 13(5):45-8.
[8] 张海燕, 邬伟魁, 李 芳, 等. 栀子保肝利胆作用及其肝毒性研究 [J]. 中国中药杂志, 2011, 36(19):2610-4.
[8] Zhang H Y, Wu W K, Li F, et al. Study on liver protection, cholagogic effect and hepatotoxicity ofGardeniaeFructus[J].ChinJChinMaterMed, 2011, 36(19):2610-4.
[9] Ding Y, Zhang T, Tao J S, et al. Potential hepatotoxicity of geniposide, the major iridoid glycoside in dried ripe fruits ofGardeniajasminoides(Zhi-zi) [J].NatProdRes, 2013, 27(10):929-33.
[10]谢志忻, 钟 云, 黄丽萍, 余日跃. 栀子的降脂作用与安全性评价研究 [J]. 中药药理与临床, 2014, 30(5):105-8.
[10]Xie Z X, Zhong Y, Huang L P, Yu R Y. Experimental studies on the lipid-lowering effect and safety evaluation ofGardeniaformula[J].PharmacolClinChinMaterMed, 2014, 30(5):105-8.
[11]阎新燕, 司玲玲, 高彩霞, 等. 异甘草素诱导人黑色素瘤A375细胞凋亡研究[J]. 中国药理学通报, 2015, 31(10):1426-32.
[11]Yan X Y, Si L L, Gao C X, et al. Isoliquiritigenin induced apoptosis in human melanoma A375 cells[J].ChinPharmacolBull, 2015, 31(10):1426-32.
[12]陈宇征, 吕文良. 中药导致药物性肝损伤的机制研究进展 [J]. 中国中医基础医学杂志, 2015, 21(11): 1476-8.
[12]Chen Y Z, Lyu W L. Progress in the mechanism of drug-induced liver injury induced by traditional Chinese medicine[J].ChinJBasicMedTraditChinMed, 2015, 21(11):1476-8.
[13]Persson M, Løye A F, Jacquet M, et al. High-content analysis/screening for predictive toxicology:application to hepatotoxicity and genotoxicity[J].BasicClinPharmacolToxicol, 2014,115(1):18-23.
[14]Persson M, Løye A F, Mow T, Hornberg J J. A high content screening assay to predict human drug-induced liver injury during drug discovery[J].JPharmacolToxicolMethods, 2013, 68(3):302-13.
[15]Tolosa L, Pinto S, Donato M T, et al. Development of a multiparametric cell-based protocol to screen and classify the hepatotoxicity potential of drug[J].ToxicolSci, 2012, 127(1):187-98.
[16]Tolosa L, Gómez-Lechón M J, Donato M T. High-content screening technology for studying drug-induced hepatotoxicity in cell models [J].ArchToxicol, 2015, 89(7):1007-22.
[17]谢丽华, 樊 星, 李泽君, 等. 转录组学技术在中药肝毒性研究中的应用[J]. 中草药, 2015, 46(10):1536-41.
[17]Xie L H, Fan X, Li Z J, et al. Application of transcriptomic technologies in hepatotoxicity induced by Chinese materia medica[J].ChinaTraditHerbDrugs, 2015, 46(10):1536-41.
[18]赵静宇, 汪梦霞, 赵自明, 等. 基于Nrf2 信号通路的三七总皂苷对Aβ25-35诱导PC12 细胞凋亡的保护作用机制研究[J]. 中国药理学通报, 2016, 32(3):343-9.
[18]Zhao J Y, Wang M X, Zhao Z M, et al. Protective effect of Panax Notoginseng Saponins of Nrf2 signaling pathway on apoptosis of PC12 cells induced by Aβ25-35[J].ChinPharmacolBull, 2016, 32(3):343-9.
[19]Syed M, Skonberg C, Hansen S H. Mitochondrial toxicity of diclofenac and its metabolites via inhibition of oxidative phosphorylation (ATP synthesis) in rat liver mitochondria: possible role in drug induced liver injury (DILI)[J].ToxicolInVitro, 2016, 31:93-102.
[20]Mohana S, Abdelwahab S I, Kamalidehghan B, et al. Involvement of NF-κB and Bcl2/Bax signaling pathways in the apoptosis of MCF7 cells induced by a xanthone compound Pyranocycloartobiloxanthone A[J].Phytomedicine, 2012, 19(11):1007-15.
Cytotoxic effect of geniposide and its metabolite genipin on HepG2 cells and mechanism
REN Yan-qing,TIAN Yu-rou,LI Chen,HE Ying-na,MA Jing-mei,NIU Li-ying,WANG Xin-guo
(PharmacologicalLabofTraditionalChineseMedicine,HebeiUniversityofChineseMedicine,HebeiTCMFormulaGranuleEngineering&TechnologyResearchCenter,TCMFormulaGranuleResearchCenterofHebeiProvinceUniversity,Shijiazhuang050091,China)
Aim To compare the cytotoxicity of geniposide (GS) and its metabolite genipin (GP) on human hepatocelluar HepG2 cells and explore the substance and mechanism of hepatotoxicity induced byFructusGardeniae. Methods The cytotoxic effect of GS and GP was analyzed by MTT method; the antioxidant enzyme activities of manganese superoxide dismutase (Mn-SOD), catalase (CAT) and levels of glutathione (GSH) were detected by respective kits; the change of intracellular reactive oxygen species (ROS) was measured by 2′,7′-dichlorofluorescin diacetate (DCFH-DA) staining method; multiparameter cytotoxicity analysis (cell loss, nuclear size and morphological changes, DNA content, cell membrane permeability, mitochondrial membrane potential changes, cytochrome C release) were measured simultaneously by high content screening (HCS) assays. Results No cytotoxicity was found in GS (20~1 000 μmol·L-1) groups (P>0.05) , but GP was found to exert obvious cytotoxic effect, and 50 μmol·L-1GP could obviously inhibit HepG2 cell proliferation (P<0.05), and the IC50value was (450.00 ± 26.15) μmol·L-1; GS showed no obvious effects on Mn-SOD, CAT, GSH, ROS (P>0.05) , GP could significantly decrease the activity of Mn-SOD, CAT and the level of GSH, and obviously increase the content of ROS (P<0.05 orP<0.01); treatment with 50, 500, 1 000 μmol·L-1GP resulted in loss of mitochondrial membrane potential, cytochrome C release and increased cell permeability (P<0.05 orP<0.01), 500, 1 000 μmol·L-1GP could also show abvious nuclear condensation, increased total nuclear intensity and cell loss (P<0.01). Opposed with GP, GS had no significant effect on the cytotoxic parameters (P>0.05). Conclusion GP is the direct substance of hepatotoxicity induced byFructusGardeniae, and the mechanism might be associated with oxidative stress, mitochondria injury and apoptosis.
FructusGardeniae; geniposide; genipin; drug-induced liver injury; oxidative stress; mitochondria injury; cell apoptosis; high-content screening assays
时间:2016-12-5 15:14
http://www.cnki.net/kcms/detail/34.1086.R.20161205.1514.046.html
2016-06-27,
2016-08-31
河北省自然科学基金资助项目(No H2014206302);河北省中医药管理局科研计划项目(No 2014007);河北中医学院青年教师科研基金项目(No QNZ2014007)
任艳青(1984-),女,硕士,研究方向:中药药理学,Tel:0311-89926307,E-mail:renyanqing2006@163.com; 王鑫国(1966-),男,教授,研究方向:中药药理学,通讯作者,Tel:0311-89926208,E-mail:wangxinguozy@163.com
10.3969/j.issn.1001-1978.2016.12.023
A
1001-1978(2016)12-1755-07
R284.1;R322.47;R329.24;R329.25;R991