基于氧化石墨烯荧光适体传感器的多巴胺检测
2017-01-05姜利英周鹏磊肖小楠闫艳霞陈青华姜素霞
姜利英, 周鹏磊, 肖小楠, 张 培, 刘 帅, 闫艳霞, 陈青华, 姜素霞
(郑州轻工业学院 电气信息工程学院, 河南 郑州 450002)
基于氧化石墨烯荧光适体传感器的多巴胺检测
姜利英*, 周鹏磊, 肖小楠, 张 培, 刘 帅, 闫艳霞, 陈青华, 姜素霞
(郑州轻工业学院 电气信息工程学院, 河南 郑州 450002)
以修饰有荧光基团(FAM)的多巴胺核酸适体作为识别元件,氧化石墨烯为猝灭剂,构建了光学适体传感器用于检测多巴胺。通过π-π堆积作用力,氧化石墨烯以共振方式把核酸适体上FAM能量转移到其表面,荧光信号消失;加入多巴胺后荧光恢复,荧光强度恢复的大小与多巴胺浓度呈正相关关系。实验优化结果表明,在反应时间5 min和10 μg/mL氧化石墨烯条件下,氧化石墨烯可以达到对FAM的最高猝灭效率;25 min孵育后,多巴胺恢复荧光强度达到稳定;传感器线性检测范围为1~500 μmol/L,检测限达到1 μmol/L。所制备传感器具有检测范围宽、检测速度快、特异性强以及检测成本低等优点。
氧化石墨烯; 荧光; 适体传感器; 多巴胺
1 引 言
多巴胺 (Dopamine, DA)是神经递质类物质[1-3],参与人体多项生理功能的调节,如激励[4]、运动[5]、情绪[6]等。DA系统功能紊乱可以引起多种疾病,如帕金森症[7]、精神分裂症[8]、注意力缺陷多动症[9]等。目前检测DA的常用方法包括酶法[10]、分光光度法[11]、高效液相色谱法[12]等,但均存在操作过程复杂、检测设备昂贵、检测成本高等缺点。
核酸适体由于具有高亲和性和高特异性的特点,被广泛用于生物传感器研究。纳米技术[13]与适体传感器的结合进一步提高了传感器的灵敏度和精确度。氧化石墨烯[14](Graphene oxide, GO)具有优良的光、电、力学特性,已被越来越多地用于生物传感器的构建。GO能与荧光标记的核酸结合并进行能量转移,从而猝灭FAM-适体的荧光。Wen等[15]以GO作为基层的化学适体传感器检测出了ATP的浓度。Kun等[16]利用GO的π-π碱基堆积力吸附标记有FITC的IgE适体,并通过能量转移猝灭FITC从而检测出IgE浓度。本文利用GO的纳米特性,结合核酸适体标记FAM制备了光学适体传感器,实现了对多巴胺的检测。
2 实 验
2.1 仪器与试剂
F-7000型荧光分光光度计(HITACHI);ME204型天平(梅特勒-托利多仪器(上海)有限公司);FE20K酸度计(梅特勒-托利多仪器(上海)有限公司);DHG-9030A型电热恒温鼓风干燥箱(上海精宏实验设备有限公司);GL-16Ⅱ型离心机(上海安亭科学仪器厂);07HWS-2数显恒温磁力搅拌器(杭州仪表电机有限公司);KQ 2200E型超声波清洗器;LA612型 ELGA Lab Water水浴锅。
多巴胺适体由上海生工生物工程股份有限公司合成,序列:5′-FAM-GTCTCTGTGTGCGCCA-GAGAACACTGGGGCAGATATGGGCCAGCACAG-AATGAGGCCC-3′。氧化石墨烯溶液购自苏州恒球科技有限公司。多巴胺盐酸盐、氢氧化钠、浓盐酸、NaCl、tris-HCl、L-Ascorbic acid(AA)、肾上腺素(L-A)和去肾上腺素(L-NA)均购自索莱宝科技有限公司。实验用水为18.2 MΩ超纯水,由ELGA Lab Water制得。
2.2 荧光适体传感器的制备
用电子天平和酸度计配制出pH=7.4的浓度为50 mmol/L的tris-HCl缓冲液,其中含有30 mmol/L的NaCl。吸取一定体积的缓冲液,加入适体中离心。配制出 10 nmol/L的荧光适体和10 μg/mL的氧化石墨烯的猝灭溶液。随后向猝灭溶液中加入DA。常温孵育25 min后,取3 mL加入石英比色皿。设定荧光分光光度计激发波长为480 nm,入射出射狭缝均为10 nm,荧光发射光谱检测范围为510~600 nm。
2.3 传感器检测原理及方法
图1为传感器检测原理。当没有加入目标底物DA时,通过π-π堆积作用,核酸适体FAM荧光能量被传递到氧化石墨烯,荧光猝灭;加入DA后,核酸适体与DA特异性结合而从氧化石墨烯的表面游离,由于π-π堆积作用的消失,荧光信号恢复。
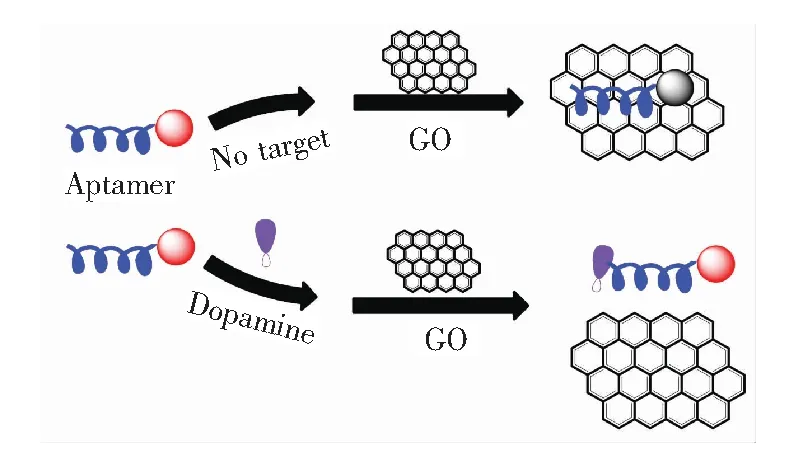
图1 荧光适体传感器检测DA的原理图
Fig.1 Schematic illustration of the detection of DA based on GO FRET aptasensor
3 结果与讨论
3.1 纳米荧光适体传感器特性
传感器的光学特性如图2所示,曲线a是FAM-DNA猝灭前的荧光发射光谱,曲线d是在FAM-DNA中加入氧化石墨烯后的猝灭光谱。由图可以看出,加入氧化石墨烯后,85.1%的荧光信号被猝灭。曲线b和c是在曲线a基础上分别以不同顺序加入DA和GO的光谱。可以看出,无论DA和GO的加入顺序如何,荧光信号都能有一定程度的恢复。这说明DA的加入可以使荧光信号恢复,构建的荧光适体传感器可以用于DA检测。同时可以看出,GO和DA的加入顺序对实验有一定的影响。这可能是先加DA时,FAM-DNA会与DA优先结合形成四联体,阻碍FAM-DNA与GO的堆积作用。若能采用某种放大策略最大化释放被猝灭的荧光信号,则能进一步提高传感器的灵敏度。
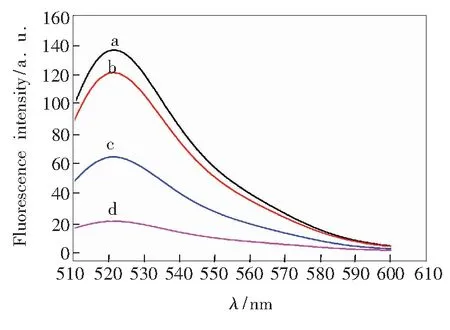
图2 不同条件下的传感器荧光发射光谱:(a) FAM;(b) FAM +DA+GO;(c) FAM+GO+DA;(d) FAM +GO。
Fig.2 Fluorescence spectra of FAM-DNA under different conditions: (a) FAM; (b) FAM +DA+ GO; (c) FAM +GO+DA; (d) FAM + GO.
3.2 实验条件优化
本实验分别对氧化石墨烯浓度及孵育时间进行了优化研究。在室温、FAM-DNA浓度10 nmol/L和猝灭时间5 min条件下,分别加入2,4,6,8,10,12,14,16 μg/mL的氧化石墨烯,检测猝灭后的荧光发射谱,结果见图3。图3(a)为分别加入2,4,6,8,10,12,14,16 μg/mL的氧化石墨烯与10 nmol/L 的FAM-DNA反应的发射光谱。可以看出,随着氧化石墨烯浓度的增加,荧光强度越来越小。由图3(b)可以看出,在氧化石墨烯浓度高于10 μg/mL后,猝灭效率(F/F0)下降,且荧光猝灭程度较高,故选择10 μg/mL的氧化石墨烯作为猝灭浓度。
FAM-DNA加入氧化石墨烯后,分别检测5,10,15,20,25,30,40,50,60 min的荧光强度,结果见图4。可以看出,猝灭在5 min内就已经完成,故猝灭时间定为5 min。猝灭完成后加入DA孵育,检测5,10,15,20,25,30,40,50,60 min的荧光强度。由图4可以看出, 25 min内荧光强度逐渐恢复,25~60 min荧光强度稳定,故选择25 min为孵育时间。
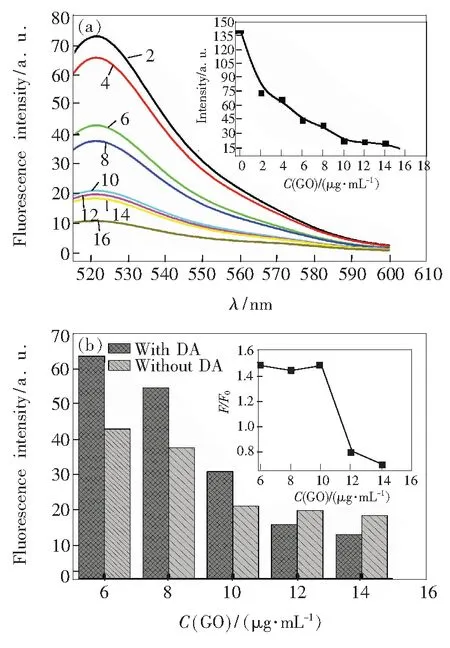
图3 (a) FAM-DNA在不同GO浓度条件下的荧光发射光谱;(b)不同浓度的GO在加入和未加入DA后的相对荧光强度(F/F0),其中 DA浓度为1 μmol/L。
Fig.3 (a) Fluorescence spectra of FAM-DNA in the presence of different GO concentrations. (b) Effect of GO concentration on the fluorescence intensity of FAM-DNA in the absence and presence of DA (1 μmol/L).
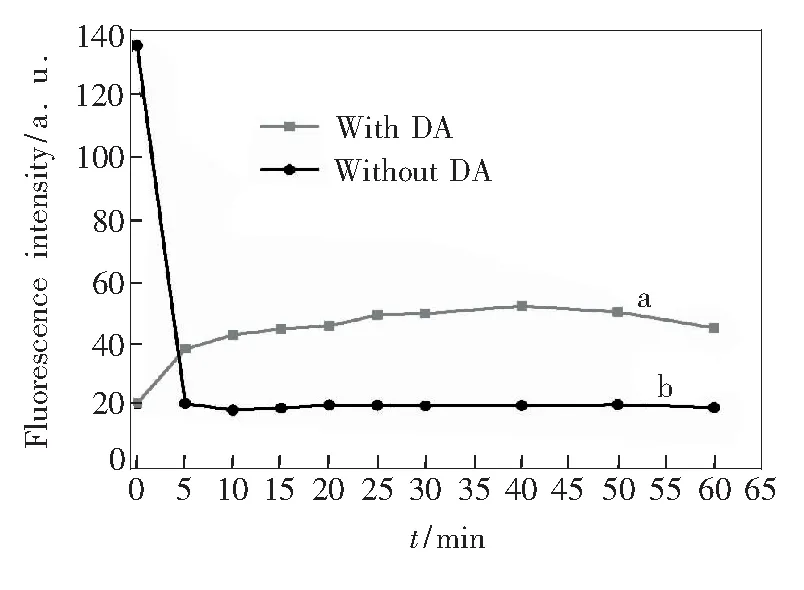
图4 不同时间下,未加入DA和加入DA时的FAM-DNA-GO的荧光强度,DA浓度为85 μmol /L。
Fig.4 Fluorescence intensity of FAM-labeled aptamer in the presence of GO (10 μg/mL) without and with DA (85 μmol/L). The aptamer concentration is 10 nmol/L.
3.3 DA浓度与荧光强度的关系
在10 nmol/L FAM-DNA、10 μg/mL GO溶液中,分别加入1,35,50,85,100,200,375,400,500 μmol/L的DA,在室温下孵育25 min,然后分别测出DA荧光恢复后的发射光谱。可以看出,随着DA浓度的逐渐增大,荧光强度逐渐增大,线性关系为y=36.660+0.1474x,其中y代表荧光强度,x代表DA浓度,相关度达到0.988。表1为不同方法检测DA的线性范围、检测限及所用适体类型。通过比较可以看出,本实验方法具有应用意义。
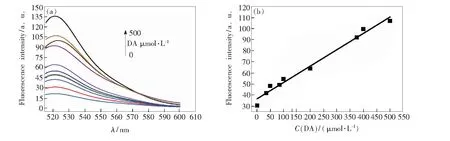
图5 不同浓度DA和荧光强度的关系。(a)DA浓度在1~500 μmol/L变化时的FAM荧光发射光谱;(b) DA浓度和荧光强度的线性拟合曲线。
Fig.5 Dependence of fluorescence intensity on the concentration of DA. (a) Fluorescence spectra of FAM-DNA-GO with different DA concentrations from 1 to 500 μmol/L. (b) Fluorescence intensity of FAM-DNA-GOvs. DA concentration.

表1 不同方法对DA的检测
3.4 特异性实验
DA有多种结构相似物,通过特异性实验可以检验传感器的分辨力。分别检测浓度均为200 μmol/L的DA、肾上腺素、去肾上腺素和维生素C的荧光强度,结果见图6,其中F0和F分别表示加入不同选择性物质前后的荧光强度,FDA表示多巴胺的荧光强度。可以看出,本实验构建的传感器特异性较强,分辨DA性能较好。
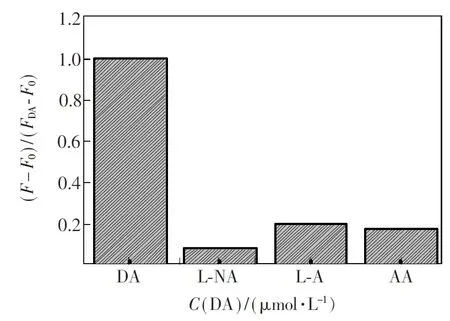
图6 本文方法对DA检测的特异性研究结果
Fig.6 Selectivity of the DA analysis using the method shown in Fig. 1
3.5 实际样品的分析
多巴胺加入到正常人的血清中,配成不同浓度的待测溶液。我们采用同样的实验方法,对样品的荧光强度进行检测,每个浓度样品平行测定3次,结果如表2所示。可以看出,样品实际荧光强度均值与标准曲线的相对偏差均小于5%,测定结果误差较小,表明该方法具有较好的准确度。
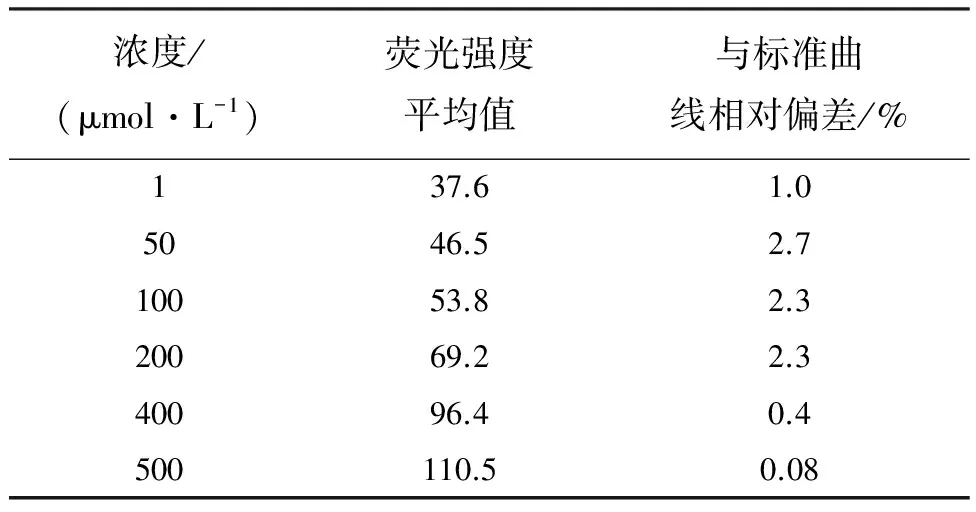
表2 实际样品中多巴胺的测定结果
4 结 论
以修饰有荧光基团的多巴胺核酸适体作为识别元件,氧化石墨烯为猝灭剂,构建了光学适体传感器用于检测多巴胺。通过π-π堆积作用力,氧化石墨烯以共振方式把核酸适体上FAM能量转移到其表面,荧光信号消失;加入多巴胺后荧光恢复,荧光强度恢复的大小与多巴胺浓度呈正相关关系。所制备的传感器具有灵敏度高、操作简单等特点,传感器线性检测范围为1~500 μmol/L,检测限达到1 μmol/L。
[1] BANERJEE S K. Dopamine: an old target in a new therapy [J].J.CellCommun.Signal., 2015, 9(1):85-86.
[2] BEAULIEU J M, ESPINOZA S, GAINETDINOV R R. Dopamine receptors-IUPHAR review 13 [J].Br.J.Pharmacol., 2015, 172(1):1-23.
[3] MCCUTCHEON J E. The role of dopamine in the pursuit of nutritional value [J].Physiol.Behav., 2015, 152:408-415.
[4] PALMATIER M I, KELLICUT M R, SHEPPARD A B,etal.. The incentive amplifying effects of nicotine are reduced by selective and non-selective dopamine antagonists in rats [J].Pharmacol.Biochem.Behav., 2014, 126:50-62.
[5] GEPSHTEIN S, LI X Y, SNIDER J,etal.. Dopamine function and the efficiency of human movement [J].J.Cogn.Neurosci., 2014, 26(3):645-657.
[6] DOMSCHKE K, WINTER B, GAJEWSKA A,etal.. Multilevel impact of the dopamine system on the emotion-potentiated startle reflex [J].Psychopharmacology, 2015, 232(11):1983-1993.
[7] THURM F, SCHUCK N W, FAUSER M,etal.. Dopamine modulation of spatial navigation memory in Parkinson’s disease [J].Neurobiol.Aging, 2016, 38:93-103.
[8] ABI-DARGHAM A. Dopamine dysfunction in schizophrenia [J].Schizophr.Res., 2014, 160(1-3):e6-e7.
[9] MERGY M A, GOWRISHANKAR R, DAVIS G L,etal.. Genetic targeting of the amphetamine and methylphenidate-sensitive dopamine transporter: on the path to an animal model of attention-deficit hyperactivity disorder [J].Neurochem.Int., 2014, 73:56-70.
[10] MIR T A, SHINOHARA H, SHIMIZU Y. Enzyme-luminescence method: tool for evaluation of neuronal differentiation based on real-time monitoring of dopamine release response from PC12 cells [J].Anal.Methods, 2011, 3(4):837-841.
[11] SONG Y Z, ZHOU J F, SONG Y,etal.. Synthesis of netlike gold nanoparticles using ampicillin as a stabilizing reagent and its application [J].Mater.Res.Bull., 2012, 47(12):4266-4270.
[12] ZHOU Y P, YAN H L, XIE Q J,etal.. Simultaneous analysis of dopamine and homovanillic acid by high-performance liquid chromatography with wall-jet/thin-layer electrochemical detection [J].Analyst, 2013, 138(23):7246-7253.
[13] 李晓坤,张友林,孔祥贵. 量子点尺寸对量子点和金纳米粒子之间的荧光共振能量转移的影响 [J]. 发光学报, 2014, 35(6):649-653. LI X K, ZHANG Y L, KONG X G. Influence of the size of quantum dot on fluorescence resonance energy transfer between quantum dots and Au nanoparticles [J].Chin.J.Lumin., 2014, 35(6):649-653. (in Chinese)
[14] RAMAZANI S, KARIMI M. Electrospinning of poly(ε-caprolactone) solutions containing graphene oxide: effects of graphene oxide content and oxidation level [J].Polym.Compos., 2016, 37(1):131-140.
[15] PU W D, ZHANG L, HUANG C Z. Graphene oxide as a nano-platform for ATP detection based on aptamer chemistry [J].Anal.Methods, 2012, 4(6):1662-1666.
[16] HU K, YANG H, ZHOU J,etal.. Aptasensor for amplified IgE sensing based on fluorescence quenching by graphene oxide [J].Luminescence, 2013, 28(5):662-666.
[17] ZHENG Y, WANG Y, YANG X R. Aptamer-based colorimetric biosensing of dopamine using unmodified gold nanoparticles [J].Sens.Actuat. B:Chem., 2011, 156(1):95-99.
[18] HUN X, XU Y Q, XIE G L,etal.. Aptamer biosensor for highly sensitive and selective detection of dopamine using ubiquitous personal glucose meters [J].Sens.Actuat. B:Chem., 2015, 209:596-601.
[19] XU J Y, LI Y, WANG L K,etal.. A facile aptamer-based sensing strategy for dopamine through the fluorescence resonance energy transfer between rhodamine B and gold nanoparticles [J].DyesPigm., 2015, 123:55-63.
[20] JIAO L Y, LU G J, ZHANG C X,etal.. Aptamer and graphene-based electrochemical biosensor for dopamine determination with high sensitivity and selectivity [J].MicroNanoLett., 2013, 8(12):903-905.
[21] LIU S, XING X R, YU J H,etal.. A novel label-free electrochemical aptasensor based on grapheme-polyaniline composite film for dopamine determination [J].Biosens.Bioelectron., 2012, 36(1):186-191.
[22] FARJAMI E, CAMPOS R, NIELSEN J S,etal.. RNA aptamer-based electrochemical biosensor for selective and label-free analysis of dopamine [J].Anal.Chem., 2013, 85(1):121-128.

姜利英(1981-),女,河南郾城人,博士,教授,2007年于中国科学院电子学研究所获得博士学位,主要从事生物传感器及检测微系统方面的研究。
E-mail: jiangliying@zzuli.edu.cn
Fluorescent Aptamer Biosensor for The Detection of Dopamine with Graphene Oxide
JIANG Li-ying*, ZHOU Peng-lei, XIAO Xiao-nan, ZHANG Pei, LIU Shuai, YAN Yan-xia, CHEN Qing-hua, JIANG Su-xia
(InstituteofElectricalandInformationEngineering,ZhengzhouUniversityofLightIndustry,Zhengzhou450002,China)
A fluorescent aptamer biosensor was constructed for the determination of dopamine. The dopamine aptamer modified 6-carboxyfluorescein (FAM) was used as the recognition element, and graphene oxide was the quencher. Through π-π stacking interaction, FAM energy can be transferred to the surface of the graphene oxide in resonant manner, and the fluorescence disappears. In the presence of DA, the fluorescence can be recovered and the fluorescence intensity is found to be in proportion to the concentration of DA. The optimized research results show that 10 μg/mL graphene oxide may achieve maximum quenching efficiency within 5 min reaction time. The fluorescence intensity can reach a stable recovery after 25 min incubation. The response to dopamine proves to be linear with the correlation coefficient up to 0.988 in the relevant concentration range of 1-500 μmol/L, and the detection limit is 1 μmol/L. The biosensor is characterized by its wide range of measurement, fast detection, low cost and so on.
graphene oxide; fluorescence; aptamer biosensor; dopamine
2016-02-29;
2016-03-24
国家自然科学基金(61002007,61271147); 郑州轻工业学院博士科研基金(2014BSJJ04); 郑州轻工业学院2014年度研究生科技创新基金(2014010); 基于集成共面薄膜金电极的核酸适体传感器项目(2014XJJ019)资助
1000-7032(2016)07-0881-06
TP212
A
10.3788/fgxb20163707.0881
*CorrespondingAuthor,E-mail:jiangliying@zzuli.edu.cn
