大葱AfCER1基因的克隆及表达分析
2017-01-05裴雁曦王永勤
奥 娜,赵 泓,裴雁曦,王永勤
(1.山西大学生命科学学院,山西太原030006;2.北京市农林科学院蔬菜研究中心,农业部华北地区园艺作物生物学与种质创制重点实验室,蔬菜种质改良北京市重点实验室,北京100097)
大葱AfCER1基因的克隆及表达分析
奥 娜1,2,赵 泓2,裴雁曦1,王永勤2
(1.山西大学生命科学学院,山西太原030006;2.北京市农林科学院蔬菜研究中心,农业部华北地区园艺作物生物学与种质创制重点实验室,蔬菜种质改良北京市重点实验室,北京100097)
基于大葱RNA-seq转录组数据库中蜡质相关基因AfCER1的序列设计引物,利用RT-PCR(Reverse transcription-polymerase chain reaction)和RACE(Rapid amplification of cDNA ends)技术获得AfCER1(Allium fistulisum CER1)的全长cDNA序列,并通过生物信息学手段分析基因的序列;利用RT-PCR和Real-time PCR分析AfCER1基因在大葱野生型和突变型植株中的空间表达模式。结果表明,AfCER1基因全长为2 144 bp,包含一个1 857 bp完整的开放阅读框(ORF),编码618个氨基酸。蛋白序列比对分析表明,AfCER1与其他物种的CER1具有相似的结构域:脂肪酸羟化酶结构域和WAX2-C结构域。由RT-PCR的结果可知,AfCER1基因在大葱的根、叶鞘、叶片等部位均有表达,且在野生型和突变型植株中的表达量有差异。Real-time PCR分析表明,在大葱的根和叶鞘及刚见光的叶片中,AfCER1在突变型植株中的表达量相对野生型少;而在见光较多的叶片部位,AfCER1在突变型植株中的表达量却比野生型多。研究可为大葱蜡质合成的分子机制提供理论基础。
大葱;蜡质;AfCER1;基因克隆;表达分析
表皮蜡质是大多数陆地植物角质层的重要组成部分,覆盖于陆地植物的表皮,可以减缓陆地植物对生物和非生物的胁迫,如防止干旱、病虫害,病原体和紫外辐射对植物的侵害[1-2],是植物的保护屏障。受遗传多样性和后天发育的影响,不同植物物种、器官和组织中蜡质的成分和含量不同[3-5]。如拟南芥[6-8]、水稻[9-10]和番茄[11-12]的突变型与野生型植株相比蜡质发生改变,表现为植物地上部分的表面蜡质晶体稀少,对干旱的敏感性增强。另外,角质层蜡质减少也与器官融合和繁殖率下降相关[6,13-14]。
蜡质的各种脂类组分由饱和的超长链脂肪酸及其衍生物组成。C16和C18脂肪酸在质体中合成后输出到内质网中,经过脂肪酸延伸酶复合体催化生成C20~C34的超长链脂肪酸(VLCFAs)[15-16]。在拟南芥中,茎的表皮蜡由烷烃、醛、脂肪酸、伯醇、蜡酯、仲醇类和酮类组成,其中,80%~90%是烷烃、仲醇和酮[17-18]。蜡质的主要成分由2个途径合成:酰基还原途径合成伯醇和烷基酯,脱羰基途径合成醛类、烷烃、酮和仲醇[18]。在拟南芥cer1-1突变体中烷烃、仲醇、酮含量下降,而醛的含量增加[19-21],推测CER1基因编码的是一种醛脱羰酶[19-20]。最近研究表明,CER1与CER3和细胞色素b5亚型(CYTB5s)相互作用[22]。此外,在双子叶和单子叶物种中,CER1蛋白结构具有保守性,且富含组氨酸的基序,表明生物体中的CER1同源蛋白拥有相似的功能[19]。
表皮蜡质的形成机制和调控已成为研究热点。大葱(Allium fistulosum)是我国传统的蔬菜和调味品之一,其叶片表皮覆盖有明显的蜡质,是研究蜡质合成机制的最佳材料,但迄今仍未见大葱蜡质合成的相关基因及蜡质形成分子机制的研究报道。
本试验克隆了大葱的蜡质相关基因AfCER1,并对其基因序列、蛋白序列进行了生物信息学分析,最后分析了AfCER1在大葱野生型和突变型植株中的空间表达模式,旨在初步了解大葱中的AfCER1基因,并预测AfCER1在大葱蜡质形成中的重要作用,为大葱蜡质合成的分子机制提供理论基础。
1 材料和方法
1.1 材料
供试大葱材料来自北京市农林科学院蔬菜研究中心试验田,从试验田中采集“鞭秆”大葱的野生型和突变型植株(图1-A),突变型植株与野生型相比表现为叶片少蜡、有光泽。为了研究蜡质AfCER1基因在植株各部位的表达量,试验将植株细分为五大部分:根、鳞茎盘、叶鞘(图1-B)、倒数第3叶出叶口及叶片,其中,叶鞘又分别从1/4,1/2,3/4长度处取材,叶片分为见光叶片和不见光叶片,见光叶片又分别从1/4,1/2,3/4部位取材,不见光叶片从最长叶叶片1/2处、最长叶叶鞘1/2处取材,每株植株总计11个取材部位。所有取材部分均取自5株植物的混合样品,取材完毕后将样品放于液氮中运回实验室立即提取RNA并反转录为cDNA。克隆AfCER1基因用的材料为大葱的见光叶片混合材料,RT-PCR和Real-time PCR选用11个取材部位的cDNA。
本试验所用引物采用Primer 5软件进行设计(表1),由北京三博远志生物技术有限责任公司合成,试验中所有引物浓度均为10 μmol/L。

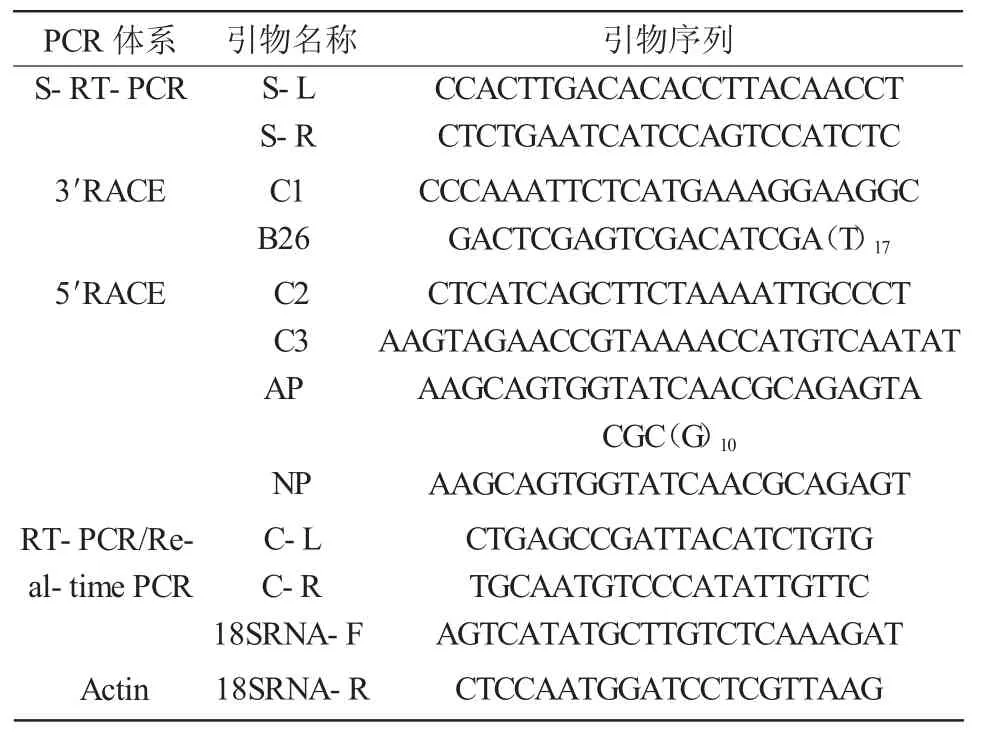
表1 引物及序列
1.2 方法
1.2.1 大葱RNA的提取及第1链cDNA的合成大葱各部位总RNA提取步骤参照华越洋RNA提取试剂盒具体说明书(北京华越洋生物科技有限公司)。以RNA为模板、寡聚核苷酸B26为引物合成第1链cDNA,详细步骤参照PrimeScriptⅡ1st Strand cDNASynthesis Kit(TaKaRa,大连)说明书。
1.2.2 RACE获得3′端cDNA序列 根据实验室前期研究工作,已经对大葱叶片进行了RNA-seq测序,从数据库中选取CER1基因序列的保守区设计引物S-L和S-R,得到基因的中间序列,根据测序结果设计3′端特异性引物C1,以叶片cDNA为模板、C1和B26为引物,进行PCR扩增。PCR反应程序为:94℃预变性3 min;94℃30 s,58℃30 s,72℃1 min,共32个循环;72℃5 min。琼脂糖凝胶电泳回收PCR产物,参照Quick Gel Extraction Kit说明书(北京全式金生物技术有限公司),使用TransGen载体将目的片段连接到pEASY-T5载体(北京全式金生物技术有限公司)上,转化至DH5α大肠杆菌(北京全式金生物技术有限公司)中,挑取白斑进行12 h左右的培养,菌液PCR鉴定后将阳性克隆送北京奥科鼎盛生物科技有限公司测序。
1.2.3 RACE获得5′端cDNA序列 根据CER1基因中间片段测序结果设计5′端的特异性引物C2和C3,结合5′锚定引物AP和巢式引物NP,进行巢式PCR扩增。第1轮以加Poly(c)尾的cDNA为模板,以AP和C2为引物,扩增程序为:94℃预变性3min;94℃30 s,56.5℃30 s,72℃1 min,共32个循环;72℃5 min。第2轮以第1轮PCR扩增产物为模板,以NP和C3为引物扩增,扩增程序为:94℃预变性3 min;94℃30 s,55.5℃30 s,72℃1 min,32个循环;72℃5 min。克隆的目的片段克隆到T载体后送北京奥科鼎盛生物科技有限公司测序。
1.2.4 比对同源蛋白序列和构建系统进化树 使用DNAMAN软件将测序后获得的cDNA两端序列与中间序列进行拼接,得到大葱CER1的全长序列。为了分析大葱与其他物种CER1基因的同源性,将该基因的蛋白序列及其他物种的同源蛋白序列进行比对分析,同时使用MEGA 6.0软件将CER1基因序列和其他物种的CER1基因序列用邻近相连法构建系统发育树,并进行Bootstrap1000次检测分析。
1.2.5 RT-PCR和Real-time PCR分析AfCER1的空间表达模式 以各个部位的cDNA为模板、C-L和C-R为引物,进行RT-PCR扩增。洋葱18SRNA引物作为内参基因,特异引物为18SRNA-F和18SRNA-R。再以各个部位的cDNA为模板、C-L和C-R为特异引物,18SRNA-F和18SRNA-R为内参引物,用荧光染料法(SYBR Green,天根生化科技(北京)有限公司)进行实时荧光定量表达分析,使用罗氏公司的Roche480实时定量PCR扩增仪,每个试验重复3次。使用Microsoft Excel处理得到的数据,参照2-ΔΔCt计算法计算相对表达量。
2 结果与分析
2.1 AfCER1序列及其分析


AfCER1基因中间片段、3′端目的片段和5′端目的片段分别为645,492,1 236 bp(图2)。利用DNAMAN软件将3条序列进行拼接,得到AfCER1基因全长(2 144 bp)。分析结果显示,在野生型和突变体植株中克隆得到的AfCER1序列一致,基因全长包含1个48 bp的5′非编码区;1个1 857 bp完整的开放阅读框(ORF),编码618个氨基酸,推测蛋白分子量为71.08 kD,等电点为8.99;1个239 bp的3′非编码区,该非编码区含有植物mRNA典型的Poly(A)尾序列。蛋白序列分析表明,AfCER1含有2个结构域,其N端含有一个脂肪酸羟化酶区域,C端含有一个被命名为WAX2-C的功能未知域(图3)。
2.2 蛋白序列比对及其系统进化分析
将预测的AfCER1序列在NCBI数据库中进行BLAST检索,结果表明,其氨基酸序列与香蕉MaCER1-like(68%)、谷子 SiCER1-like(66%)、玉米ZmCER1(65%)、野生稻ObCER1-like(65%)、小麦TaCER1(63%)、番茄 SlCER1-like(63%)、葡萄VvCER1-like(63%)、黄瓜CsCER1(62%)、莲NnCER1(62%)、巨桉EgCER1-like(61%)等物种CER1的氨基酸序列有很高的同源性。大葱CER1的蛋白结构中有典型的脂肪酸羟化酶结构域和WAX2 C-末端结构域,其脂肪酸羟化酶结构域的序列中包含3个保守的HXHH基序,而WAX2C-末端结构域存在一个保守的LEGW序列基序(图4)。

进化树分析可知,按照序列的远近分为双子叶植物和单子叶植物,大葱作为单子叶植物,与双子叶植物的苹果、番茄、马铃薯等亲缘关系相对较远,而与油棕、香蕉等亲缘关系相对较近(图5)。

2.3 AfCER1基因在大葱不同部位的表达分析
为了确定AfCER1基因在野生型和突变型大葱中的空间表达模式,对大葱的不同部位进行了半定量RT-PCR分析,结果表明,AfCER1基因在大葱的根、叶鞘、叶片等部位均有表达,在根、不见光最长叶叶片1/2处的野生型和突变型中均只有少量表达;在鳞茎盘、叶鞘3/4处和叶片1/4处野生型和突变型的表达量有明显差异,其余部位的表达量差异不显著(图6)。

2.4 AfCER1在大葱中的空间表达模式
为了进一步阐明AfCER1在大葱不同部位的表达模式,对大葱的不同部位进行了实时荧光定量PCR(Real-time PCR),结果表明,在大葱的根、叶鞘及刚见光的叶片中,AfCER1在突变型植株中的表达量相对野生型少,而在见光较多的叶片部位AfCER1在突变型中的表达量较野生型多。在表型蜡质含量明显差异的2个大葱品种中,AfCER1基因的表达量有明显的差异(图7)。

3 讨论
3.1 AfCER1可能是整合膜蛋白
大葱AfCER1蛋白序列与其他物种的CER1序列有较高的相似性,且所有的CER1均有2个典型的结构域:脂肪酸羟化酶结构域和WAX2-C结构域,其中,同源蛋白区脂肪酸羟化酶结构域含有3个保守的富含组氨酸的基序(HX3H,HX2HH和HX2HH,其中X代表任意氨基酸),该域对酶的活性有着重要的作用[23],包含这种结构域的酶可能是一种整合膜蛋白,参与胆固醇和植物表皮蜡的合成;而在烷类中起作用但功能仍未知的WAX2 C-末端结构域[6],经常会在真核生物中发现,存在一个保守的LEGW序列基序,可能与脂肪酸羟化酶区域有关。
3.2 AfCER1基因可能影响大葱表皮蜡质的积累
陆生植物表皮蜡质存在于地上部器官的组织表皮,且蜡质是在表皮细胞中合成并运输到表皮外[24]。大部分植物蜡质的主要成分是烷类,占蜡质总量的50%~80%[18-20]。关于蜡质基因研究较为透彻的植物是拟南芥,其中包括CER1在内的很多蜡质基因已被鉴定和研究。在拟南芥cer1突变体中,烷类及其衍生物的含量下降较为明显,而醛类的含量有所上升,是编码醛脱羧酶的基因,可以将醛催化成烷烃[21]。另外,有研究表明,定位于内质网的CsCER1在黄瓜蜡质烷类的合成中起到了关键作用[25];在大桐岩中,SsCER1基因也是一个蜡质基因,与蜡质的形成相关[26]。
拟南芥中CER1的表达量分析显示,表达量的改变可以影响超长链烷烃的合成,进而影响蜡质的合成。T-DNA插入等位基因突变体的蜡质缺乏超长链烷烃及其衍生物,而CER1过表达显著地增加了奇数碳的烷烃和异支链烷烃的积累[20]。而本研究中比较了AfCER1在大葱的野生型和突变型植株中的表达,结果表明,AfCER1在大葱的各个部位均有表达,说明蜡质遍布于植株的各个部位,但是在大葱野生型和突变体植株的不同部位,AfCER1的表达量发生了很大的改变,尤其在突变体的叶片部位,AfCER1的表达量较高,大葱叶片中AfCER1的调节作用可能与拟南芥中CER1过表达时的作用相似,导致生成奇数碳的烷烃和异支链烷烃增多,进一步影响蜡质的积累。综上推测,AfCER1可能参与了大葱表皮蜡质的合成,但是具体的调节作用及代谢途径,仍需进一步验证。
[1]Eigenbrode S D,Espelie K E.Effects of plant epicuticular lipids on insect herbivores[J].Annual Review of Entomology,1995,40(1):171-194.
[2]Li-Beisson Y,Shorrosh B,Beisson F,et al.Acyl-lipid metabolism [C]//The arabidopsis book.Rockville:American Society of Plant Biologists,2010.
[3]Lemieux B.Molecular genetics of epicuticular wax biosynthesis[J]. Trends in Plant Science,1996,1(9):312-318.
[4]Post-Beittenmiller D.Biochemistry and molecular biology of wax production in plants[J].Annual Review of Plant Biology,1996,47(1):405-430.
[5]von Wettstein-Knowles P.Biosynthesis and genetics of waxes[M]// Hamilton R J.Waxes:chemistry,molecular biology and functions. Dundee,Scotland:Oily Press,1995:91-130.
[6]Chen X,Goodwin S M,Boroff V L,et al.Cloning and characterization of the WAX2 gene of Arabidopsis involved in cuticle membrane and wax production[J].The Plant Cell,2003,15(5):1170-1185.
[7] Lü S,Song T,Kosma D K,et al.Arabidopsis CER8 encodes LONG-CHAIN ACYL-COA SYNTHETASE 1(LACS1)that has overlapping functions with LACS2 in plant wax and cutin synthesis [J].The Plant Journal,2009,59(4):553-564.
[8]Weng H,Molina I,Shockey J.Organ fusion and defective cuticle function in a lacs1 lacs2 double mutant of Arabidopsis[J].Planta,2010,231(5):1089-1100.
[9]IslamMA,Du H,NingJ,et al.Characterization ofGlossy1-homologous genes in rice involved in leaf wax accumulation and drought resistance[J].Plant Molecular Biology,2009,70(4):443-456.
[10]Yu D,Ranathunge K,Huang H,et al.Wax Crystal-Sparse Leaf 1 encodes a beta-ketoacyl CoA synthase involved in biosynthesis of cuticular waxes on rice leaf[J].Planta,2008,228(4):675-685.
[11]Saladié M,Matas A J,Isaacson T,et al.A reevaluation of the key factors that influence tomato fruit softening and integrity[J].Plant Physiology,2007,144(2):1012-1028.
[12]Leide J,Hildebrandt U,Reussing K,et al.The developmental pattern of tomato fruit wax accumulation and its impact on cuticular transpiration barrier properties:effects of a deficiency in a beta-ketoacylcoenzyme a synthase(LeCER6)[J].Plant Physiology,2007,144(3):1667-1679.
[13]Kurata T,Kawabata Awai C,Sakuradani E,et al.The YOREYORE gene regulates multiple aspects of epidermal cell differentiation in Arabidopsis[J].The Plant Journal,2003,36(1):55-56.
[14]Fiebig A,Mayfield J A,Miley N L,et al.Alterations in CER6,a gene identical to CUT1,differentially affect long-chain lipid content on the surface of pollen and stems[J].The Plant Cell,2000,12(10):2001-2008.
[15]Jetter R,Kunst L,Samuels A L.Composition of plant cuticular waxes[J].Annual Plant Review:Biology of the Plant Cuticle,2008,23:145.
[16] Bernard A,Joubès J.Arabidopsis cuticular waxes:advances in synthesis,export and regulation[J].Progress in Lipid Research,2013,52(1):110-129.
[17]Rashotte A M,Jenks M A,Nguyen T D,et al.Epicuticular wax variation in ecotypes of Arabidopsis thaliana[J].Phytochemistry,1997,45(2):251-255.
[18]Samuels L,Kunst L,Jetter R.Sealing plant surfaces:cuticular wax formation byepidermal cells[J].Plant Biology,2008,59(1):683.
[19]Aarts MG,Keijzer C J,Stiekema W J,et al.Molecular characterization of the CER1 gene of Arabidopsis involved in epicuticular wax biosynthesis and pollen fertility[J].The Plant Cell,1995,7(12):2115-2127.
[20]BourdenxB,Bernard A,Domergue F,et al.Over expression of Arabidopsis ECERIFERUM1 promotes wax very-long-chain alkane biosynthesis and influences plant response to biotic and abiotic stresses[J].Plant Physiology,2011,156(1):29-45.
[21]McNevin J P,Woodward W,Hannoufa A,et al.Isolation and char-acterization of eceriferum(cer)mutants induced by T-DNA insertions in Arabidopsis thaliana[J].Genome,1993,36(3):610-618.
[22]Bernard A,Domergue F,Pascal S,et al.Reconstitution of plant alkane biosynthesis in yeast demonstrates that Arabidopsis ECERIFERUM1 and ECERIFERUM3 are core components of a very-long-chain alkane synthesis complex[J].The Plant Cell,2012,24(7):3106-3118.
[23]Taton M,Husselstein T,Benveniste P,et al.Role of highly conserved residuesin the reaction catalyzed by recombinant Δ7-sterol-C5(6)-desaturase studied by site-directed mutagenesis[J].Biochemistry,2000,39(4):701-711.
[24]Kunst L,Samuels AL.Biosynthesis and secretion of plant cuticular wax[J].Progress in Lipid Research,2003,42(1):51-80.
[25] Wang W,Zhang Y,Xu C,et al.Cucumber ECERIFERUM1(CsCER1),which influences the cuticle properties and drought tolerance of cucumber,plays a keyrole in VLC alkanes biosynthesis[J].Plant Molecular Biology,2015,87(3):219-233.
[26]岑斌.大岩桐蜡质基因SsCER1的克隆及其功能分析 [D].杭州:杭州师范大学,2008.
Cloning and Expression Analysis of AfCER1Gene in Welsh Onion
AO Na1,2,ZHAO Hong2,PEI Yan-xi1,WANG Yong-qin2
(1.College of Life Sciences,Shanxi University,Taiyuan 030006,China;2.Key Laboratory of Biology and Genetic Improvement of Horticultural Crops(North China),Ministry of Agriculture,Beijing Vegetable Germplasm Improvement Laboratory,Beijing Vegetable Research Center,Beijing Academy of Agriculture and Forestry Sciences,Beijing100097,China)
The wax-related gene CER1 primer design was based on RNA-seq transcriptome database of welsh onion,the AfCER1 gene full sequence length was obtained by RT-PCR(Reverse transcription-polymerase chain reaction)and RACE(Rapid amplification of cDNA ends)technology,and then analyzed its basic structure in NCBI.The differentially expression in wild and mutant plants was analyzed using RT-PCR and Real-time PCR technology.The results showed that the AfCER1 full-length cDNA was 2 144 bp,and contained an 1 857 bp open reading frame(ORF)which encoded 618 amino acids.The protein sequence alignment result showed that AfCER1 had a fatty acid hydroxylase region and a WAX2-C domain,which was similar to the CER1 functional domains of other species. RT-PCR results indicated that AfCER1 gene was expressed in root,leaf sheath and leaf,there were differences in the expression of wild and mutant plants.Real-time PCR results indicated that AfCER1 less expressed in mutant compare to wild in root,leaf sheaths and leaves.However,AfCER1 gene higher expressed in the lighted leaves of mutant plants.This study provides a theoretical basis for the molecular mechanism of wax synthesis of welsh onion.
welsh onion;wax;AfCER1;gene cloning;expression analysis
S633.1
A
1002-2481(2016)05-0569-07
10.3969/j.issn.1002-2481.2016.05.01
2016-02-25
国家自然科学基金项目(31372066);北京市农林科学院科技创新能力建设专项(KJCX201101010)
奥 娜(1989-),女,山西吕梁人,在读硕士,研究方向:大葱表皮蜡质形成机制。裴雁曦、王永勤为通信作者。
