白术对脑老化小鼠记忆能力和突触结构的影响
2017-01-05高群于新宇
高群,于新宇
(菏泽医学专科学校,山东 菏泽 274000;大连大学医学院,辽宁 大连 116000)
白术对脑老化小鼠记忆能力和突触结构的影响
高群,于新宇
(菏泽医学专科学校,山东 菏泽 274000;大连大学医学院,辽宁 大连 116000)
目的探讨白术对D-半乳糖致脑老化小鼠学习记忆及海马突触结构的影响。方法采用连续皮下注射D-半乳糖的方法,建立脑老化小鼠模型,通过Morris水迷宫检测小鼠的记忆能力,用透射电镜和形态计量法分析白术对脑老化小鼠CA3区Gray I型突触结构参数的影响。结果水迷宫实验:脑老化组的逃避潜伏期显著长于对照组P<0.05,而RAM低、中、高组的逃避潜伏期显著短于脑老化组(P<0.05,P<0.01。海马CA3区Gray I型突触结构观察:与对照组相比,脑老化组小鼠的突触界面曲率、突触后致密物厚度均显著减小(P<0.05;P<0.01),突触间隙宽度显著增大(P<0.05);白术组小鼠的突触界面曲率、突触间隙宽度、突触后致密物厚度与对照组基本相近似(P>0.05)。结论白术可以改善脑老化所致小鼠海马CA3区Gray I型突触结构的改变,改善学习记忆能力。
白术;脑老化;学习记忆能力;突触;超微结构
学习和记忆是构成人脑智能的要素,是大脑认知功能的重要组成部分。学习记忆功能的减退常常伴随着年龄的增长而发生,这是由于大脑的老化是全身机能老化的基础。近年来,大量研究表明自由基的产生与脑老化密切相关,并认为脑氧化应激损伤在脑老化的发生发展中起重要作用。脑老化机制的研究,为治疗和延缓脑衰老相关药物的开发提供了重要理论依据。白术(RAM)是菊科植物白术的干燥根茎,现代药理学研究表明,白术有较强的清除自由基、抑制氧化应激等作用。研究表明,白术可抑制兴奋毒性诱导神经细胞凋亡[1]改善三氯化铝所致动物的学习记忆能力[2],从而发挥神经保护作用。但尚未见白术对脑老化引起的学习记忆障碍的研究报道。本实验通过D-半乳糖致脑老化动物模型,考察白术对脑老化动物学习记忆功能影响,并从突触可塑性的角度探讨其作用机制,旨在为延缓和治疗脑衰老化相关药物的研发提供基础理论。
1 材料与方法
1.1 动物昆明种小鼠购于“大连大学实验动物中心”
1.2 药材与试剂 白术购于毫州饮片有限责任公司,白术水提物的制备4.0 kg白术粉碎后,凉水浸泡1 h,然后分3次加水、煮沸药材,每次煮沸30min,合并3次药液,过滤后蒸发浓缩,最终得水提取物3.06 kg,提取物置于冰箱内冷藏保存。D-半乳糖购于上海试剂二厂。戊二醛、锇酸、丙酮、醋酸铀购于上海化学试剂有限公司。
1.3 仪器 Morris水迷宫(DMS-2型)为上海欣软信息科技有限公司产品。自动纯水仪为上海沪西分析仪器厂产品。低温冰箱为上海美菱公司产品。HT7700型透射电子显微镜(日本日历)。超薄切片机为北京中镜仪器科仪技术有限公司。
1.4 方法 小鼠随机分组5组:空白对照组;脑老化组(模型组);3种不同剂量的白术组,每组12只,雌雄各半。小鼠适应环境2 d后,D-半乳糖模型组和白术组参照文献和药典[3,4]所述方法建立衰老动物模型:每日皮下注射120mg/(kg·d)D-半乳糖(新鲜配置);空白对照组每日皮下注射等量生理盐水;3个白术剂量组每日灌胃700mg/(kg·d)、1050mg/(kg·d)、1400 mg/(kg·d)三种剂量的白术水溶物,空白对照组合和D-半乳糖模型组灌胃等量生理盐水,连续6周。
1.4.1 Morris水迷宫测试测试在第7周进行,历时6 d。前5天进行定位航行实验,隐蔽平台置于第西南象限中央水下面0.5~1 cm,每天训练小鼠4次,每次60 s,仪器自动记录从入水到找到隐蔽平台并立于其上所需要的时间(逃避潜伏期),数据取4次均值。第6 d进行空间探索实验,撤去平台,然后在标记的S点将小鼠面向池壁边缘轻放入水中,记录小鼠30 s内在四个象限的游泳时间,其中西南象限的时间为记忆保持的时间,用来判断动物记忆储存及提取再现。
1.4.2 形态学检测Morris水迷宫测试结束后,选择对学习记忆行为有显著影响的小鼠(白术组)及对照组、脑老化组小鼠,经10%水合氯醛腹腔注射麻醉后,掀开其颅盖骨,迅速取出脑,参照小鼠脑立体定位解剖数据[5],取海马CA3区,固定于3%戊二醛液中,并做好各组标记,用0.1mol/LPBS清洗三次,1%锇酸固定2 h,再0.1mol/LPBS清洗三次,每次10min。乙醇、丙酮中逐级脱水,100%丙酮和环氧树脂Epon 812(1∶1)混合液浸泡2~4 h,环氧树脂Epon 812各聚合12 h。LKB 11800型修块机修块、定位,超薄切片机切片,醋酸双氧铀染液染色,透射电子显微镜观察海马CA3区神经元超微结构,电镜下拍摄各组海马CA3区Gray I型突触照片(每组各30张),照片先经Photoshop软件进行图像效果处理后,用CIA-I型图像分析系统分别测量突触界面曲率(突触界面弧长/弦长)、突触间隙宽度、突触后致密物厚度,每组各测量30个突触。
1.5 统计学处理 应用SPSS16.0软件,所获数据采用方差分析和t检验。
2 结果
2.1 白术对脑老化小鼠学习记忆能力的影响 水迷宫定位航行实验:随着训练学习天数的增加,各组小鼠的逃逸潜伏期均呈缩短趋势。训练第2 d时,脑老化组小鼠逃逸潜伏期与对照组相比,P<0.05,有显著性差异。白术高剂量组小鼠的逃逸潜伏期显著短于脑老化组,P<0.05,有显著性差异。训练第3 d始,白术中、高剂量组小鼠的逃逸潜伏期均明显短于脑老化组(P<0.05;P<0.01)。空间探索实验:脑老化组小鼠在原放置平台的象限(西南象限)内停留时间显著缩短,P<0.05,有显著性差异。在该象限的穿越次数显著减少,P<0.05,有显著性差异。白术中、高剂量组小鼠在原放置平台的象限内停留时间显著延长,P<0.05;P<0.01,有显著性差异。见图1。

图1 白术对脑老化小鼠学习记忆的影响(水迷宫实验)
2.2 白术对脑老化小鼠海马突触结构的影响 脑老化组小鼠海马CA3区Gray I型突触的突触界面曲率、突触后致密物厚度均显著减小,P<0.05;P<0.01,有显著性差异。突触间隙宽度显著增大,P<0.05,有显著性差异。与脑老化组相比,白术剂量组小鼠海马CA3区Gray I型突触的突触界面曲率、突触后致密物厚度均显著增大,P<0.05;P<0.01,有显著性差异。突触间隙宽度显著减小,P<0.05,有显著性差异。三个突触结构相关参数值与对照组基本相近似,P>0.05,无显著性差异。白术低、高剂量组之间,P<0.05,有显著性差异。各组小鼠CA3区Gray I型突触结构参数测量。见图2和表1。
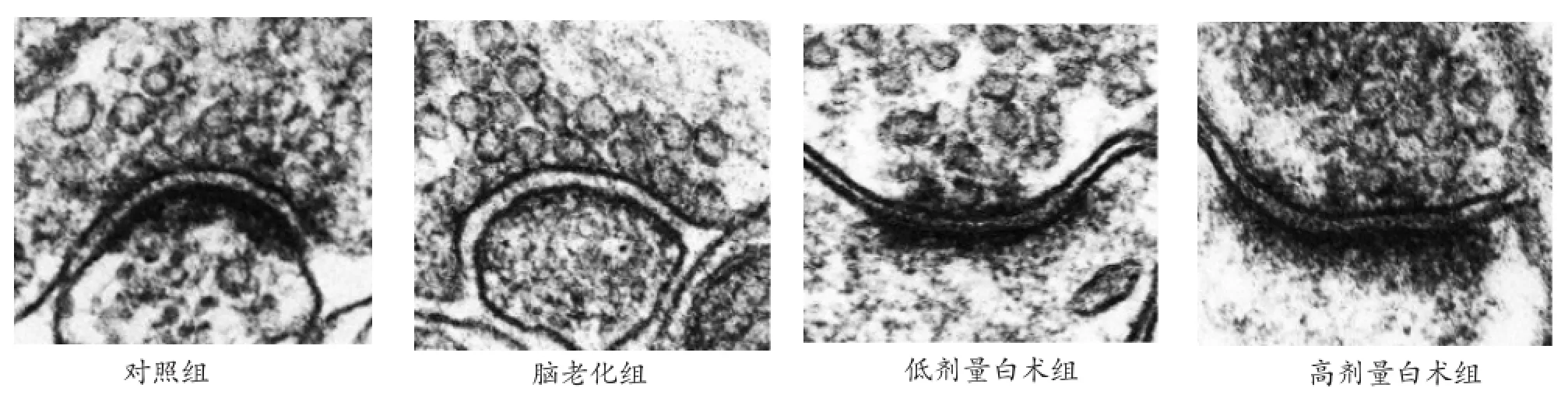
图2 各组小鼠CA3区Gray I型突触照片(×50,000)
表1 各组小鼠突触结构参数的的比较±s,nm)
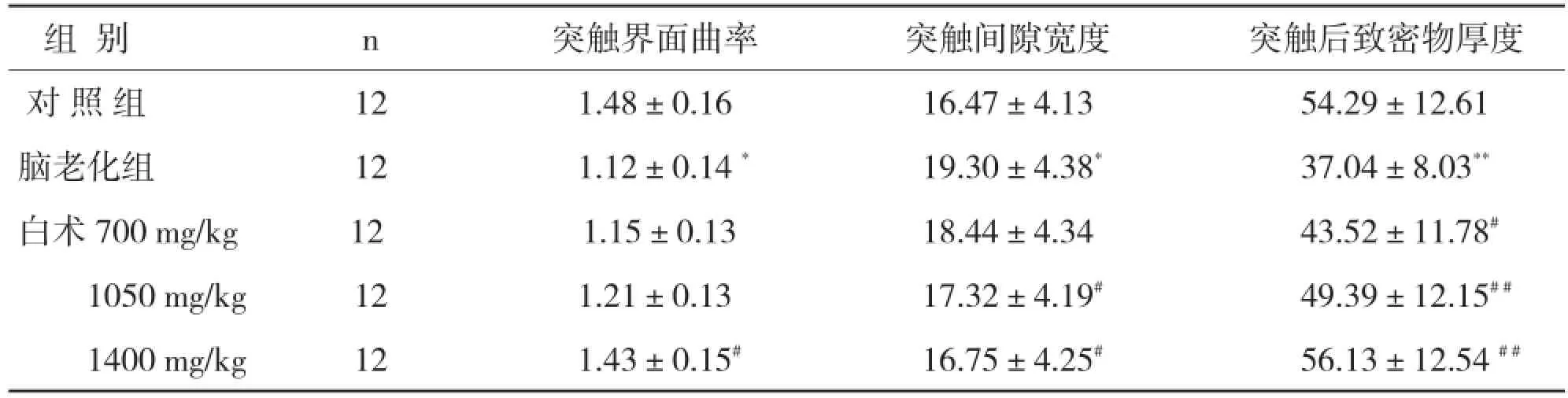
表1 各组小鼠突触结构参数的的比较±s,nm)
与对照组比较,*P<0.05,**P<0.01;与脑老化组比较,#P<0.05,##P<0.01。
组别 n 突触界面曲率 突触间隙宽度 突触后致密物厚度对照组 12 1.48±0.16 16.47±4.13 54.29±12.61脑老化组 12 1.12±0.14* 19.30±4.38* 37.04±8.03**白术700mg/kg 12 1.15±0.13 18.44±4.34 43.52±11.78#1050mg/kg 12 1.21±0.13 17.32±4.19# 49.39±12.15##1400mg/kg 12 1.43±0.15# 16.75±4.25# 56.13±12.54##
3 讨论
大脑是一个具有高度复杂性的有机体,这种复杂性表现在其结构与神经化学活动为了适应环境的变化而处于调整和改变中,即可塑性。神经可塑性是神经系统的一个重要特征,是神经活动的一个重要体现,是学习记忆的神经生物学基础[6]。在神经活动过程中,突触结构及功能、神经递质受体的结构及功能、神经环路结构及功能以及电生理等方面均可存在这种可塑性的变化[7]。研究显示,改变突触传递可塑性可影响学习记忆活动,而同时在学习记忆相关脑区可见突触的可塑性变化。突触界面是突触前成分与突触后成分相互接触的面,常有一定的弯曲度,称为突触界面曲率。弯曲是度增大是增加接触面的一种方式,能保证突触前成分释放的递质到达突触后膜上的靶受体,保障神经信息传递的有效性[8,9]。突触间隙的大小对突触活动的动力学,即突触囊泡包裹着的神经递质传递的速度有重要的影响。突触间隙增大,将延缓神经递质传递的速度。以往研究表明,突触界面结构是敏感易变的指标,易受一些因素(传入信号、药物、脑损伤、机体内外环境变化、行为和年龄等)的影响而发生可塑性变化,并且这种变化与宏观上学习记忆行为的变化相一致,其中以突触后致密物(postsynaptic density,PSD)最为敏感[10,11]。PSD是位于突触活性区突触后膜胞质侧的一层致密物质,呈圆盘状或不规则状,直径300~500nm,厚约50 nm,由特化的细胞骨架、多种调节蛋白和酶构成。这些蛋白和酶对突触的信号传导起关键的调控作用,它们的数量和构象变化均可引起PSD超微结构的可塑性变化,即PSD厚度的变化[12,13]。白术可能通过通改变脑老化小鼠突触的某些结构参数(突触界面曲率、突触后致密物厚度,突触间隙宽度),从而以改善脑老化小鼠的学习记忆能力。
[1]Gao Q,Ji ZH,Yang Y etal.Neuroprotective effectof rhizoma atractylodis macrocephalae against excitotoxicity-induced apoptosis in cultured cerebral corticalneurons[J].Phytother Res,2012,21(2):234 -237.
[2]刘洋,廖春梅.双白术内酯对三氯化铝致痴呆模型小鼠的作用研究[J].湖南师范大学学报(医学版),2006,3(3):25-26.
[3]王威,李崧,董会萍,等.不同剂量D-半乳糖致昆明小鼠脑老化模型实验的研究[J].中国老年学杂志,2009,29(3):260-262.
[4] 国家药典委员会.中华人民共和国药典[M].北京:化学工业出版社,2010.
[5]Franklin B J,PaxinosG.Themouse brain in stereotaxic coordinates [M].Academic Press,San Diego,1997.
[6]Volk LJ,Bachman JL,Johnson R,etal.PKM-zeta isnot required for hippocampal synaptic p lasticity,learning and memory[J].PKM-zeta-Nature,2013,493(7432):420-423.
[7]Li Y,Meloni EG,Carlezon WA,et al.Learning and reconsolidation implicate different synaptic mechanisms[J].Proc Natl Acad SciUSA,2013,110:4798-4803.
[8]朱俊德,肖朝伦,余资江,等.褪黑素对阿尔茨海默病模型大鼠学习记忆能力及海马CA3区神经元的保护作用[J].解剖学报,2011,42(4):441-446.
[9]Marrone D F,Petit T L.The role of synaptic morphology in neural plasticity:structural interactions underlying synaptic power[J].Brain Res,2002,38(3):291-308.
[10]Briones T L,Suh E,Jozsa L et al.Behaviorally-induced ultrastructural plasticity in the hippocampal region after cerebral ischemia. Brain Res,2004,997(2):137-146.
[11]Xu X H,Ye L J,Ruan Q.Environmental enrichment induces synaptic structural modification after transient focal cerebral ischemia in rats[J].Exp BiolMed,2009.
[12]Chen X B,Winters C,Azzam R etal.Organization of the core structure of the postsynaptic density[J].Proc Natl Acad Sci USA,2008, 105(11):4453-4458.
[13]Yen Y H,Chuang CF,Chang CW etal.A study of the spatialprotein organization of the postsynaptic density isolated from porcine cerebral cortex and cerebellum[J].Mol Cell Proteomics,2011,10(10): 110-118.
Effect of Rhizoma Atractylodis Macrocephalae on Learning-memory and Synaptic Structure in Aging Mice
Gao Qun,Yu Xinyu
(Heze Medical College,Heze 274000,Shandong;Dalian University,Dalian 116000,Liaoning)
Ob jec tiveTo observe the effects of rhizoma atractylodis macrocephalae(RAM)on learning-memory and synaptic structure in D-galactose-induced brain aging m ice.MethodsD-galactose was injected subcutaneously for the brain aging model.Learning-memory abilitywas tested by Morris water maze test and The structure of Grey Itype synapses in hippocampal CA 3 area were observed under transmitted electron microscope.ResultsMorris water maze test:In brain aging group,the escape latency was significantly prolonged,(P<0.05).The escape latency in 3 RAM group was significantly shorter (P<0.05,P<0.01).The structure of Grey I type synapses in hippocampalCA3 area.In brain aging group,the curvature of synapse interface and thickness of postsynaptic desity were significantly decreased(P<0.05,P<0.01),and the width of synaptic cleft was significantly increased(P<0.05)compared with control group.In RAM-treated groups,the curvature of synapse interface,width of synaptic cleft and thickness of postsynaptic desity were approximately the same as that of control group(P>0.05).ConclusionRAM could significantly increase the ability of learning-memory in brain agingmice.the mechanism related to the protective effect on synapese in hippocam pal CA 3 area.
Rhizoma atractylodis macrocephalae; Brain aging; Learning and memory ability; Synapses; Ultrastructure
R28;R742;Q75
:A
:1008-4118(2016)02-0001-04
10.3969/j.issn.1008-4118.2016.02.001
2016-02-18
高群(1986-),女,汉,硕士,山东临沂人。研究方向:神经生物学。
于新宇。E-mail:xybio@sina.com
