低氧促进小鼠卵泡颗粒细胞凋亡
2017-01-05杜学海漫晓丹宁彩波周成利王宝东刘红林
杜学海,漫晓丹,宁彩波,周成利,王宝东,刘红林*
(1.辽宁省畜牧业经济管理站,辽宁 沈阳 110032;2.南京农业大学动物科技学院,江苏 南京 210095)
低氧促进小鼠卵泡颗粒细胞凋亡
杜学海1,漫晓丹2,宁彩波2,周成利1,王宝东1,刘红林2*
(1.辽宁省畜牧业经济管理站,辽宁 沈阳 110032;2.南京农业大学动物科技学院,江苏 南京 210095)
为研究低氧是否能促进小鼠卵泡颗粒细胞凋亡,将体外培养的小鼠卵泡颗粒细胞分成对照组和低氧处理组。对照组的细胞一直在常规的二氧化碳培养箱内培养,低氧处理组的细胞先在常规二氧化碳培养箱内培养一段时间后放入三气培养箱内(1%的氧气,5%的二氧化碳,94%的氮气)培养,一定时间后收集两组细胞样:用流式细胞仪结合Annexin V/PI双染色法检测细胞凋亡情况;用荧光定量PCR检测HIF1α及BNIP3基因在两组细胞中的mRNA转录水平;用TUNEL染色法检测两组细胞的DNA断裂情况;在小鼠颗粒细胞中过表达HIF1α,检测BNIP3基因的mRNA转录情况。结果表明:与对照组相比,低氧处理能够显著促进体外培养的小鼠卵泡颗粒细胞凋亡;低氧处理组HIF1α和BNIP3基因的mRNA转录水平显著高于对照组;低氧处理的小鼠卵泡颗粒细胞内有明显的核固缩现象,但DNA断裂多发生在胞质内;在小鼠颗粒细胞中过表达HIF1α能够引起BNIP3的mRNA转录水平升高。这些结果表明低氧处理能促进小鼠卵泡颗粒细胞的凋亡及细胞内HIF1α与BNIP3基因的表达量升高;由低氧处理后小鼠卵泡颗粒细胞内DNA断裂多发生在细胞质内,推测低氧引起小鼠颗粒细胞凋亡可能是通过线粒体凋亡途径实现的。
低氧;HIF1α;BNIP3;小鼠卵泡颗粒细胞;凋亡机制
低氧诱导因子1(hypoxia inducible factor1,HIF1)是缺氧条件下广泛存在于哺乳动物和人体内的一种转录因子,在哺乳动物的生长发育、生理和病理反应过程中起着重要作用[1]。HIF1由HIF1α和HIF1β两个亚单位组成,其中HIF1α是主要的氧调节亚基,也是功能亚基,一般认为HIF1β在细胞内的表达量是恒定的,HIF1在细胞内的表达量主要有HIF1α决定[2]。在低氧条件下,HIF1α很稳定,并会移位到细胞核中,与核中的HIF1β结合形成异二聚体HIF1发挥调节作用[3],研究发现HIF1调控的下游靶基因近80种,主要与血管生成、细胞糖代谢、细胞增殖、细胞存活和细胞凋亡等细胞生物学行为有关[4]。在常氧条件下,HIF1通过泛素-蛋白酶体路径迅速降解,所以低氧诱导被认为是细胞内产生HIF1α应答的主要原因[5]。BNIP3是一种促凋亡蛋白,属于Bcl-2家族成员的BH3-only促凋亡蛋白亚类,其分子中仅含有BH3结构域和羟基末端的跨膜结构TM[6]。BNIP3可通过BH3结构与抗凋亡蛋白Bcl-2/Bcl-XL等形成异二聚体促进细胞凋亡[7];也可依赖于其羟基末端TM结构的线粒体锚定作用促进细胞凋亡[8]。BNIP3启动子区含有一个与HIF1转录相关的功能结合位,即缺氧反应元件(hypoxia-respome element,HRE),其在低氧条件下与HIF1发生紧密结合[8];在细胞系内过表达HIF1α能促进BNIP3的表达[8],低氧处理牛黄体细胞48 h可见明显核固缩和DNA碎片等细胞凋亡特征以及BNIP3和caspase-3的表达增加[9]。这些研究报道表明BNIP3是一种低氧应答基因,且受HIF1(HIF1α)的直接调控[8]。动物机体内各组织器官常因供血不足而引发低氧应激并进一步诱发包括细胞凋亡在内的多种细胞应答反应[7]。哺乳动物卵泡发育过程中也存在低氧应激,卵泡在发育过程中会逐渐变大并在其内部形成很大的腔隙,腔隙中存在大量卵泡液,卵丘颗粒细胞和卵母细胞就被卵泡液包裹其中,被卵泡液包裹的卵丘颗粒细胞和卵母细胞周围的脉管分布减少,供血迅速下降,形成低氧环境[5]。那么低氧应激能否直接促进小鼠卵泡颗粒细胞的凋亡,如果能
1.1试验材料
1.1.1 试验动物 试验所用小鼠为3~4周龄健康雌性昆明白小白鼠,购自南京市青龙山动物繁殖中心。
1.1.2 主要试验试剂 荧光定量试剂盒购、大肠埃希菌(Escherichiacoli,E.coli)DH 5α、T4DNA连接酶、PCR产物扩增酶以及所用限制性内切酶均购自TaKaRa公司;pcDNA3.1由本实验室保存;DNA产物纯化与质粒提取试剂盒购自TIANGEN生物公司;PMSG购自宁波第二激素场;点突变试剂盒购自诺唯赞生物公司;TUNEL荧光试剂盒购自Roche公司;Annexin V-FITC染色试剂盒购自碧云天生物公司;细胞培养所用的耗材及转染试剂lip2000购自Invitrogen公司;培养基、PBS及血清购自Life technologies公司。
1.2试验方法
1.2.1 小鼠卵泡颗粒细胞的获得与培养 小鼠腹腔注射PMSG(10 U)46 h后,颈椎脱臼处死,无菌条件下迅速取出双侧卵巢,立即放入盛有完全培养基的小培养皿(35 mm×15 mm)内,在体式显微镜下用1 mL注射器针头扎破卵泡,释放出颗粒细胞。积攒一定量颗粒细胞后,用移液枪吸出,吹打均匀后加入含有完全培养基的6孔培养板中培养。2~3 d换一次液,待孔内细胞贴壁达到80%左右做试验处理。
1.2.2 Annexin V-FITC凋亡染色 体外培养的小鼠卵泡颗粒细胞,经不同氧浓度处理后,收集上层细胞培养液(含有因处理死亡的细胞),PBS洗1次,用不含EDTA的胰酶室温消化颗粒细胞5 min,把收集的培养液和消化下来的细胞混合1 000 r/min离心5 min,弃上清,然后用PBS重悬细胞。重复PBS洗涤2~3次,细胞计数后取50 000~100 000个细胞1 000 r/min离心5 min后,弃上清加入195 μL Annexin V-FITC反应缓冲液和5 μL的annexin其机制又是什么。带着这些问题,笔者做了一系列试验并证实了低氧能够促进体外培养的小鼠卵泡颗粒细胞凋亡,且其凋亡机制可能是BNIP3介导的线粒体凋亡通路。
1 材料与方法
V-FITC染料25℃反应10 min,1 000 r/min离心5 min后,弃上清,加入190 μL的PI反应缓冲液和10 PI染料,轻微震荡混匀,避光放在冰上待流式细胞仪检测。
1.2.3 细胞总RNA的提取与反转录 采用Trizol提取法(Invitrogen公司)提取体外培养的小鼠卵泡颗粒细胞总RNA,详细步骤参照说明书进行。采用15 min快速反转录酶试剂盒(TaKaRa公司)对提取的总RNA进行反转录,具体步骤见试剂盒使用说明书,获得的cDNA产物于-80℃保存备用。
1.2.4 HIF1α-pcDNA3.1真核表达载体的构建以小鼠卵泡颗粒细胞的cDNA为模板,用引物P1(见表1)扩增得到HIF1α编码区的全长。条件为98℃预变性30 s后,进行如下循环:95℃变性10 s,55℃退火30 s,72℃延伸3 min,循环35次,最后延伸7 min。所得PCR产物进行凝胶电泳,对凝胶上2 500 bp左右的条带进行胶回收,所得纯化产物用BamHI和XhoI双酶切,酶切产物进行产物纯化,与经同样酶处理的真核表达载体pcDNA3.1连接,经过转化、涂板、挑菌、扩培、测序等步骤后得到HIF1α过表达载体HIF1α-pcDNA3.1。

表1 本文所用引物Table1 Primer used in this study
1.2.5 质粒转染 采用lip2000脂质体法做转染试验:转染分对照组和试验组,试验组加入的是HIF1α-pcDNA3.1重组质粒,对照组加入的是pcDNA3.1空载质粒;转染前吸弃培养基,用2 mL无抗PBS冲洗1~2次,换1.5 mL全无培养基,放入37℃二氧化碳培养箱;配A液:3 μg质粒加入opti培养基使终体积为250 μL,B夜:10 μL脂质体加入240 μL Opti培养基使终体积为250 μL;配好后,静止5 min,B液加入A液,20 min后转染,500 μL每孔,4~6 h后换成含15%胎牛血清、1%双抗的DMEM F12培养基。
1.2.6 荧光定量PCR 采用实时荧光定量PCR仪对不同处理小鼠卵泡颗粒细胞中HIF1α、BNIP3和GAPDH基因mRNA表达水平进行检测,所用定量引物分别为P2、P3和P4(见表1)。Real-time PCR反应体系及反应条件严格参照2×SYBR Premix Ex Taq(TaKaRa公司)试剂盒使用说明书。每个样品重复3次,取其平均值,用2-△△Ct法计算各个基因表达量。
1.2.7 TUNEL凋亡检测 经处理后的小鼠卵泡颗粒细胞用PBS清洗2次,4%多聚甲醛固定15 min,PBS洗2次,每次5 min;用0.2%的Triton X-100处理5 min,PBS洗2次,每次5 min;用含0.3%BSA的封闭液封闭15 min,PBS洗2次,每次5 min;加入50 μL配置好的TUNEL反应液,并用剪好的封口膜贴在盖上,防治蒸发,于37℃湿盒内反应60 min;PBS洗3次,每次5 min;200 μL的DAPI室温作用10 min,PBS洗3次,每次5 min;于激光共聚焦显微镜下观察细胞凋亡情况。
1.3数据分析所有数据均用X±SED表示,用GraphPad Prism 5软件进行统计学分析,采用独立样本t检验比较两组间差异,P<0.05时确定为差异显著,P<0.01确定为差异极显著[10]。
2 结果
2.1低氧促进小鼠卵泡颗粒细胞凋亡同一批次分离获得的小鼠卵泡颗粒细胞进行体外培养,并分为对照组和低氧处理组,对照组一直在常规二氧化碳培养箱内培养;低氧处理组在常规二氧化碳培养箱内培养72 h后,转至低氧培养箱(三气培养箱,1%的氧气,5%的二氧化碳,94%的氧气)继续培养,48 h后收集两组颗粒细胞做Annexin V-FITC凋亡染色,流式细胞仪上检测两组细胞凋亡情况。发现低氧处理组的颗粒细胞凋亡率显著高于对照组(见图1),表明低氧处理能够促进体外培养的小鼠卵泡颗粒细胞凋亡。

图1 低氧处理促进小鼠卵泡颗粒细胞凋亡Fig.1 Hypoxia promotes the apoptosis of follicular granulosa cells in mice
2.2低氧促进小鼠卵泡颗粒细胞内BNIP3的表达有研究表明低氧应激能引起心肌细胞内BNIP3的表达量升高,进而引起心肌细胞凋亡[11-12]。BNIP3是一种线粒体促凋亡蛋白,能够引起细胞凋亡和坏死,且BNIP3的表达受HIF1a调控[8]。那么小鼠卵泡颗粒细胞中是否也存在这种关系呢?笔者做了以下试验来验证。一是采用荧光定量PCR检测低氧处理的小鼠卵泡颗粒细胞中HIF1a和BNIP3表达情况;二是在小鼠卵泡颗粒细胞中过表达HIF1a,观察BNIP3的表达情况。结果表明低氧处理组的小鼠卵泡颗粒细胞中HIF1a和BNIP3的mRNA水平显著高于常氧组(对照组);在小鼠卵泡颗粒细胞中过表达HIF1a能显著促进BNIP3的mRNA转录。这说明低氧处理能引起小鼠卵泡颗粒细胞中BNIP3的表达升高;且在小鼠卵泡颗粒细胞中BNIP3的表达同样受HIF1a的调控。
2.3低氧处理的小鼠卵泡颗粒细胞DDNNAA断裂多发生在细胞质内用TUNEL法检测体外培养小鼠卵泡颗粒细胞的凋亡情况,发现低氧处理的小鼠卵泡颗粒细胞内有明显的核固缩现象,但DNA断裂多发生在细胞质内(见图3)。由此可知细胞质内只有线粒体内含有DNA,说明低氧应激引起的小鼠卵泡颗粒细胞凋亡很可能是由线粒体功能障碍开始的。
3 讨论
动物机体内的低氧应激主要是因为供血不足产生的,如肿瘤组织中因细胞分裂生长速度太快而引起的低氧应激[13-14],牛黄体溶解时而引起的低氧应激[7],心血管系统中因间断性供血而引起的低氧应激[15]。这些现象都有一个共同点,就是应激组织细胞内的HIF1a的表达量升高,并伴随着细胞凋亡[7,13-15]。在卵泡发育过程中,卵泡颗粒细胞的快速增值,以及卵泡液不断增多,使得卵泡腔内血管分布迅速减少,供血水平迅速降低[5],便有可能产生低氧应激,也就是说,在卵泡发育过程中也存在低氧应激。本次试验发现,与对照组相比,体外培养的小鼠卵泡颗粒细胞在低氧处理条件下发生显著凋亡,细胞内HIF1α的表达量显著升高。这一试验结果与上述研究报道[7,13-15]相一致,说明低氧确实能够促进小鼠卵泡颗粒细胞的凋亡。在实时荧光定量PCR试验中发现,低氧处理不仅促进了卵泡颗粒细胞中HIF1α的转录,同时还促进了BNIP3的转录;且在卵泡颗粒细胞中过表达HIF1α能极显著地引起BNIP3的表达。这说明低氧能够促进小鼠卵泡颗粒细胞内BNIP3的表达,且BNIP3的表达很有可能受HIF1α的调控。BNIP3是Bcl-2蛋白家族中BH3-only蛋白的一种,能够参与细胞自噬和凋亡[16]。有研究表明,在低氧条件下,BNIP3能够引起线粒体缺陷并进一步引起细胞凋亡或死亡[13,16],且BNIP3的表达受HIF1α的调控[11]。在本试验中发现,低氧处理体外培养的小鼠卵泡颗粒细胞不仅出现了明显的核固缩现象,而且在胞质内还出现了DNA断裂现象。细胞质内只有线粒体中存在DNA,这说明低氧处理直接导致了线粒体的功能障碍。综合前人研究报道及上述试验结果,推测低氧应激诱导的小鼠卵泡颗粒细胞凋亡很可能是通过BNIP3介导的线粒体凋亡通路实现的。有文献表明卵泡颗粒细胞凋亡是卵泡闭锁的主要原因[17],而低氧能够促进卵泡颗粒细胞凋亡,因此卵泡发育过程中的低氧应激也可能是引起卵泡闭锁的原因之一。
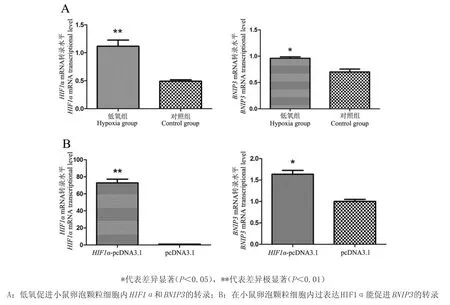
图2 低氧促进小鼠卵泡颗粒细胞内BNIP3的表达Fig.2 Hypoxia promotes the expression ofBNIP3in mouse follicular granulosa cells

图3 低氧处理引起小鼠卵泡颗粒细胞核固缩和胞质DNA断裂Fig.3 Hypoxia caused mouse follicular granulosa cells nuclear condensation and cytoplasmic DNA fragmentation
[1]Semenza G L.Targeting HIF-1 for cancer therapy[J]. Nature Reviews Cancer, 2003, 3(10): 721-732.
[2]胡恒通,彭波,马清涌,等.HIF-1α与NF-κB通路对胰腺癌缺氧调节及肿瘤进展的作用[J].西安交通大学学报:医学版,2010,3(3):274-278.
[3] Semenza G L. HIF-1 and tumor progression: pathophysiology and therapeutics[J]. Trends in molecular medicine,2002,8(4):S62-S67.
[4]Lee J W,Bae S H,Jeong J W,et al.Hypoxia-inducible factor(HIF-1)α:its protein stability and biological functions[J].Experimental & molecular medicine, 2004, 36(1): 1-12.
[5]杜学海,曹蕊,肖鹏,等.不同处理小鼠卵巢组织中HIF1α基因的表达分析及其真核表达载体构建[J].南京农业大学学报,2014,37(6):137-142.
[6]Ray R,Chen G,Velde C V,et al.BNIP3 heterodimerizes with Bcl-2/Bcl-XL and induces cell death independent of a Bcl-2 homology 3 (BH3)domain at both mitochondrial and nonmitochondrial sites[J]. Journal of Biological Chemistry,2000,275(2):1439-1448.
[7]Nishimura R,Komiyama J,Tasaki Y,et al.Hypoxia promotes luteal cell deathin bovine corpus luteum[J]. Biology of reproduction, 2008,78(3):529-536.
[8]Vasagiri N,Kutala V K.Structure,function, and epigenetic regulation of BNIP3:a pathophysiologicalrelevance[J].Molecularbiology reports,2014,41(11):7705-7714.
[9]Youle R J,Strasser A.The BCL-2 protein family: opposing activities that mediate cell death[J].Nature reviews Molecular cell biology,2008,9(1):47-59.
[10]韩杰,白子山,刘旸.刺五加多糖对免疫应激小鼠免疫器官指数和肠黏膜淋巴细胞数量的影响[J].现代畜牧兽医,2015(8):7-10.
[11]Zhou Y F,Zheng X W,Qi G X,et al.The effect of hypoxia-inducible factor 1-alpha on hypoxia-induced apoptosis in primary neonatal rat ventricular myocytes[J].Cardiovascular journal of Africa,2010,21(1):37.
[12]Regula K M,Ens K,Kirshenbaum L A.Inducible expression of BNIP3 provokes mitochondrial defects and hypoxia-mediated cell death of ventricular myocytes[J]. Circulation research,2002,91(3):226-231.
[13]Chiavarina B,Whitaker-Menezes D,Migneco G, et al.HIF1-alpha functions as a tumor promoter in cancer-associated fibroblasts,and as a tumor suppressor in breast cancer cells:Autophagy drives compartment-specific oncogenesis[J]. Cell Cycle, 2010, 9(17): 3534-3551.
[14]Greijer A E,Van der Wall E.The role of hypoxia inducible factor 1(HIF-1)in hypoxia induced apoptosis[J].Journal of clinical pathology,2004,57(10):1009-1014.
[15]Diwan A,Krenz M,Syed F M,et al.Inhibition of ischemic cardiomyocyte apoptosis through targeted ablation of Bnip3 restrains postinfarction remodeling in mice[J]. The Journal of clinical investigation,2007,117 (10):2825-2833.
[16]Brunelle J K,Letai A.Control of mitochondrial apoptosis by the Bcl-2 family[J].Journal of cell science,2009,122(4):437.
[17]Du X H,Zhou X L,Cao R,et al.FSH-induced p38-MAPK-mediated dephosphorylation at serine 727 of the signal transducer and activator of transcription 1 decreases Cyp1b1 expression in mouse granulosa cells[J].Cellular signalling,2015,27(1):6-14.
Hypoxia promotes the apoptosis of follicular granulosa cells in mice
Du Xuehai1,Man Xiaodan2,Ning Caibo2,Zhou Chengli1, Wang Baodong1,Liu Honglin2*
(1.Liaoning Provincial Animal Husbandry Economy station,Liaoning Shenyang 110032; 2.College of Animal Sciences and Technology,Nanjing Agricultural University,Jiangsu Nanjing 210095)
The study was conducted to examine whether hypoxia induces granulosa cells apoptosis in mouse follicular.The cultured mouse granulosa cells were divided into control and hypoxia groups,the control group cells were cultured in carbon dioxide incubator,the hypoxia group cells were cultured in three gas(1%oxygen,5%carbon dioxide,94%nitrogen)incubator after a certain period of time in carbon dioxide incubator.The samples were collected after a certain period of time:Cells apoptosis were detected by flow cytometry with Annexin V/PI double staining;the mRNA transcription levels of HIF1αand BNIP3 were detected by real-time PCR;intracellular DNA breakage were detected by TUNEL;the mRNA transcription levels of HIF1αand BNIP3 were detected after overexpression of HIF1α in cultured mouse granulosa cells.The results indicated: Compared with the control group, hypoxia can significantly promote the apoptosis of cultured mouse granulosa cell;hypoxia can increase the mRNA transcription levels of HIF1αand BNIP3;hypoxia can cause the mouse follicular granulosa cells nuclear condensation and cytoplasmic DNA fragmentation;overexpression of HIF1α can increase the mRNA transcription levels of BNIP3 incultured mouse granulosa cells.These results indicate that hypoxia promotes the apoptosis of mouse follicular granulosa cells probably through mitochondrial apoptosis pathway.
Hypoxia;HIF1α;BNIP3;Mouse follicular granulosa cells;Apoptosis mechanism
S814.1 < class="emphasis_bold"> 文献标识码:B
B
1672-9692(2016)08-0018-06
2016-06-03
杜学海(1987-),男,硕士研究生,主要从事动物遗传育种与繁殖相关工作。
刘红林(1966-),男,教授,博导,主要从事动物育种学与动物发育生物学研究工作。
