牛致病性大肠杆菌菌影的制备
2017-01-05王士霞常春龙翟军军倪宏波
王士霞,常春龙,翟军军,倪宏波
(黑龙江八一农垦大学,黑龙江 大庆 163319)
牛致病性大肠杆菌菌影的制备
王士霞,常春龙,翟军军,倪宏波*
(黑龙江八一农垦大学,黑龙江 大庆 163319)
制备牛源大肠杆菌菌影,为其作为疫苗及载体奠定基础。将裂解质粒PHH43-E电转入牛大肠杆菌中,并通过温度的改变诱导细菌裂解,即其在37℃条件下生长到对数生长期,然后进行42℃升温诱导。经温控诱导裂解质粒表达后可将细胞壁裂解,形成细菌空壳,成功制备了菌影。
牛;致病性大肠杆菌;菌影;制备
菌影(bacterial ghosts)又称菌蜕,是无繁殖能力、缺乏细胞浆和核酸的细菌空壳,通过噬菌体PhiX174的裂解基因E在革兰氏阴性菌内表达而形成[1-3]。裂解基因E表达后,细菌的内外膜融合形成跨膜孔道,在渗透压的作用下,细菌基因组和胞浆等内容物通过跨膜孔道排出,留下细菌空壳,即形成一种空的“菌影”[4-5]。菌蜕完好地保留了菌体表面的各种抗原的天然结构和粘附活性,可以类似活菌体诱导机体产生良好的免疫保护反应[6-7],此外,研究表明菌影还具有极好的载体和佐剂功能[8],目前,裂解基因E诱导制备菌影的技术已经广泛用于多种革兰氏阴性菌菌影的制备[9-10]。
成功制备菌蜕的关键是噬菌体phiX174的裂解基因E在宿主细胞内的高效表达。目前的表达系统有:温度敏感型λpL/pR-cI857启动子/阻遏子系统、化学诱导型LacpO-LacIq启动子/阻遏子系统、Pm-xylS启动子/阻遏子系统或者tol表达系统。目前应用最多的是λpL/pR-cI857启动子/阻遏子表达系统。
本试验拟利用λpL/pR-cI857启动阻遏系统,通过改变温度调控裂解基因E的表达,来制备制备致病性大肠杆菌菌影,为进一步研制和开发大肠杆菌新型疫苗及新型佐剂进行前期的探索。
1 材料与方法
1.1材料裂解质粒pHH43-E质粒由中国农业科学院哈尔滨兽医研究所细菌室惠赠;牛源致病性大肠杆菌为本实验室分离并保存;Taq DNA聚合酶购自美国Fermentas公司;DL2000 DNA marker购自Takara(大连)公司;氯霉素购自Sigma公司。
1.2方法
1.2.1 大肠杆菌感受态的制备 按照文献[11],-80℃冰箱中保存备用。
1.2.2 质粒的电转及鉴定 将1.2.1制备的感受态细胞从-80℃冰箱中取出置冰上待融化后加入1 μL的裂解质粒pHH43-E,按照常规电转的方法进行电转,参数为12.5 kV/cm、200 Ω、25µF、4.9 ms。将电转后的质粒摇菌并涂板,放置37℃温箱过夜培养。第2天挑取单菌落进行37℃摇菌,并进行菌液PCR鉴定。
1.2.3 裂解条件的优化 在5 mL含34 μg/mL氯霉素的LB培养液中接种含裂解质粒的菌株,37℃过夜震荡培养。转接后37℃培养至OD600值分别为0.4、0.6、0.8、1.0、1.2。然后升温至42℃诱导表达。每隔15 min取样测定OD600值,直至培养物的OD600值不再下降为止。同时取适量菌液,用无菌PBS稀释适当倍数后涂板进行菌落计数(每板涂100 μL菌液)。
1.2.4 菌体裂解率的计算 取诱导之前100 μL的菌液和诱导之后的100 μL菌液分别稀释合适倍数,涂布于含有氯霉素的LB平板,37℃过夜培养,计算活菌数。
裂解率(%)=(1-诱导后CFU/诱导前CFU)×100%
2 结果
2.1溶菌质粒的鉴定以电转化后的单菌落的过夜培养物为模板进行菌液PCR鉴定,结果如图1所示,在1 429 bp处有一条特异性条带,与预期相符。

图1 裂解质粒PHH43-E成功转入大肠杆菌结果图Fig.1 Plasmid PHH43-E was successfully transferred to E.coli results map
2.2不同初始浓度诱导下的裂解情况观察42℃诱导后,裂解情况观察结果,与对照组相比,0.4和0.6时,差别最明显,因此,0.4和0.6时,裂解效果好。
2.3不同起始浓度裂解曲线分别对起始浓度为0.4、0.6、0.8、1.0和1.2时其进行了裂解曲线的绘制,但因试验中起始浓度为0.8、1.0和1.2的裂解效果不是很好,所以只对起始浓度为0.4和0.6的裂解曲线进行了分析,由图3可看出,当初始浓度为0.6时,该曲线较为平稳,且OD值也较低,菌落数较少。因此,起始浓度为0.6时为最佳起始浓度。
2.4 裂解率计算结果将升温诱导之前和诱导结束后2~3 h的菌液分别用无菌PBS进行105和103倍稀释,重复3次试验后取平均数,37℃恒温箱培养24 h,分别计算诱导前细菌数和诱导后菌液浓度。
裂解率=1-5.8×103/5.2×106=99.89%
3 分析与讨论
本试验将pHH43-E裂解质粒成功转入大肠杆菌中,含有裂解质粒的大肠杆菌在37℃条件下培养至对数生长期后,升温诱导制备大肠杆菌菌影。升温诱导15 min后OD600值达到最高之后下降,在诱导60 min后OD600值下降到最低,同时菌液最为澄清,并稳定持续60 min不再变化。

图2 不同初始浓度诱导下的裂解结果Fig.2 Under different initial concentration induced cracking results
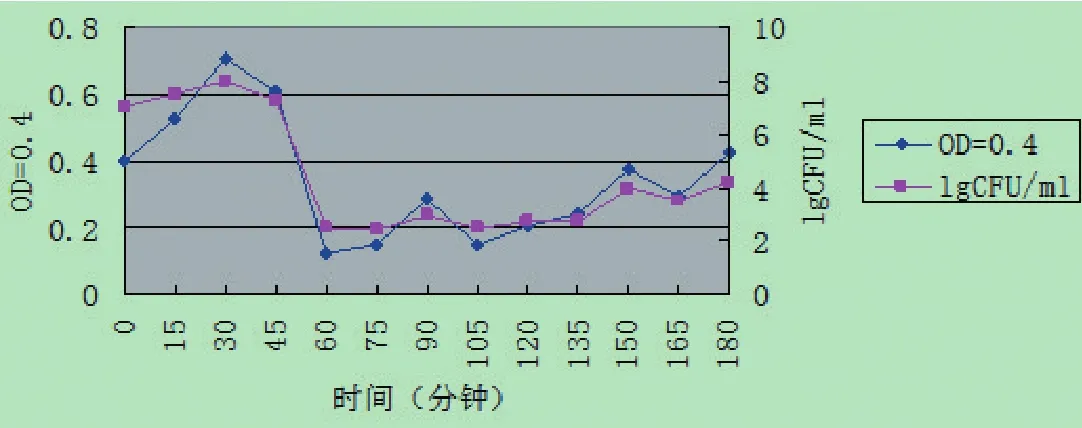
图3 裂解曲线的绘制结果Fig.3 Plot results of pyrolysis curve
将不同起始浓度的菌液同时进行升温诱导,对比其裂解是否有差异,筛选出裂解效率最高的起始浓度。结果显示,菌液起始浓度OD600值为0.4或0.6左右时升温诱导,其裂解效率要明显高于起始浓度OD600为0.8、1.0和1.2时的裂解效率。虽然起始浓度OD600值为0.4和0.6时的裂解效率相近,但是由于菌液起始浓度为0.6时,OD600值较为平稳,因此,本试验选择菌液浓度为0.6作为起始菌液诱导浓度。
本试验中采用的裂解系统为目前应用最多λpL/ pR-cI857温控表达系统。最初的λpL/pR-cI857系统在温度低于30℃时,阻遏蛋白cI857的表达使基因E被稳定抑制;温度高于30℃时,阻遏蛋白cI857热失活,导致基因E表达;在42℃时,细菌裂解达到最佳状态。由于30℃时培养细菌不利于菌体的大量繁殖,同时,当温度由30℃向42℃转变时,热冲击会对细胞表面的抗原决定簇产生影响,因此,通过基因定点突变技术,使λpL/pR启动子的操纵基因OR2中的一个碱基由T诱变为C,突变后在37℃下也能稳定抑制基因E的表达,经此改造后,该温控表达表达系统的热稳定性大大提高[12],这对细菌菌影的制备提供了便利条件。
在菌影制备过程中,100%的完全裂解往往不易实现,为了达到完全灭活,笔者采用冻干法将制备的菌影冻干两次,每次置于冻干机中冻干12 h,经过检测细菌已被完全灭活,其原因可能是细菌在冻干的过程中会有一部分活菌死亡,在不加保护剂的情况下死亡的细菌数量会更多,而且菌影中存留的活菌数量本身很低,导致菌影在冻干过程中存留的少量活菌被全部灭活,但是在此过程中,菌体可能由于反复冻融可能受到破坏,导致其免疫原性降低。因此提高菌影的打孔效率将是今后研究的重点。
参考文献
[1]Koller V J,Dirsch V M,Beres H,et al.Modulation of bacterial ghosts-induced nitric oxide production in macrophages by bacterial ghost-delivered resveratrol[J]. FEBS J, 2013,280(5):1214-1225.
[2]Yu SY,Peng W,Si W,et al.Enhancement of bacteriolysis of shuffled phage PhiX174gene E [J].Virol J,2011,8:206
[3]孙颖,金天明,冯立文,等.利用E.coli-App穿梭载体构建温控双基因裂解载体pMC-WK[J].中国兽医学报,2011,33(9):1304-1308.
[4]Ebensen T,Paukner S,Link C,et al.Bacterialghostsareanefficientdeliverysystem for DNA vaccines[J].The Journal of Immunology,2004,172:6858-6865.
[5]Witte A,Wanner G,Sulzner M,et al.Dynamics of PhiX174protein E mediated lysis of Escherichia coli[J]. Arch Microbiol, 1992 ,157 (4):381-388
[6]Szostak M,Lubitz W. Recomebinant bacterial ghosts as multivaccine vehicles[J]. Vaccines,1991,91:409-414.
[7]Witte A,Blsi U,Halfmann,et al.PhiX 174 protein E mediated lysis of Escherichia coli [J].Biochimie,1990,72:191-200.
[8] Mayr U B, Haidinger W, et al. Bacterial ghosts as an oral vaccine:a single dose of Escherichia coli O157: H7 bacterial ghosts protects mice against lethal challenge[J]. Infection and Immunity,2005,73:4810-4817.
[9]JALAVA K,EKO F O,RIEDMANN E,et al.Bacterial ghosts as carrier and targeting systems for mucosal antigen delivery[J]. Expert Rev Vaccines,2003,2(1):45-51.
[10]MAYR U B,WALCHER P,AZIMPOUR C,et al.Bacterial ghosts as antigen delivery vehicles [J]. Adv Drug Deliv Rev, 2005, 57(9): 1381-1391.
[11]Haidinger W,Mayr U B,Szostak M P,et al. Escherichia coli ghost production by expression of lysis gene E and Staphylococcal nuclease[J].Applied&Environmental Microbiology,2003,69(10):6106-6113.
[12]董洪亮,于圣青,韩先干,等.λpL/pR-cI857温控系统的改造及其对大肠杆菌菌蜕制备的影响[J].生物工程学报,2012,28(12):1423-1430.
The Preparation of bovine pathogenic Escherichia coli Ghosts
Wang Shixia,Chang Chunlong,Zhai Junjun,Ni Hongbo*
(Heilongjiang Bayi Agricultural University,Heilongjiang Daqing 163319)
Preparation bovine E.coli bacterial ghost,the as carrier vaccine and lay the foundation.The cleavage of plasmid PHH43-E electro transformed into bovine Escherichia coli,and by the change of temperature induced bacterial lysis,namely the at 37℃ for growth to logarithmic growth phase,then 42℃ for heat induced.The temperature induced cleavage of plasmid expression can be the cell wall lysis,forming bacteria ghosts,that were prepared bacterial ghosts successfully.
Cattle;Pathogenic Escherichia coli;Bacterial shadow;Preparation
S852.61 < class="emphasis_bold"> 文献标识码:B
B
1672-9692(2016)08-0006-04
2016-07-01
王士霞(1990-),女,黑龙江人,在读硕士,研究方向为分子细菌学与免疫学。
倪宏波(1972-),男,黑龙江人,教授,博士生导师,主要从事分子细菌学和免疫学研究。
