猪圆环病毒病PCR检测方法的建立与应用
2017-01-05师丽刚
师丽刚
(河南省洛阳市动物疫病预防控制中心,河南 洛阳 471002)
猪圆环病毒病PCR检测方法的建立与应用
师丽刚
(河南省洛阳市动物疫病预防控制中心,河南 洛阳 471002)
根据猪圆环病毒2型(PCV2)基因(Rep基因)保守序列设计1对引物P1和P2,扩增700 bp的目的片段,该方法对猪细小病毒、猪瘟病毒、猪伪狂犬病毒均成阴性,但可以特异地检测出PCV2;本法能检测出1.80 ng/μL圆环病毒的DNA。对扩增目的片段测序,结果显示,扩增片段属于PCV2。应用本方法对14份临床样本进行检测,结果表明,阳性样本为6份。本研究结果表明,本试验建立的PCR方法检测PCV2具有较好的敏感性和特异性,可用于PCV2感染疑似病例的诊断及分子流行病学调查。
猪圆环病毒2型;PCR;检测
猪圆环病毒2型属于圆环病毒属,是已知最小的动物病毒,PCV2基因组全长1 7681 768 bp[1]。PCV2的宿主主要是猪,各种年龄阶段的猪均可以感染,而仔猪发病较严重,6~12周比较常见。1998年由于断奶仔猪多系统衰竭综合征作为新的疾病出现而发现了PCV2[2-3],加拿大早在1990年已经发生这种疾病。早在1962年就已用PCR检测该病毒,PCV2疾病诊断标准在1985年已开始在猪群中执行[4]。中国在2000年第一次报道本病,而郎洪武等搜集了来自北京、河北等7个省市22个猪场的559份血清,并用ELISA方法检测阳性率高达42.9%,而且断奶仔猪多系统衰竭综合征(PMWS)抗体阳性随着猪的年龄增长而升高。目前,本病在世界范围内广泛流行,死亡率10%~30%不等[5]。
分析全球的不同PCV2的序列,核酸序列的一致性高达93%以上[6]。根据3.5%核酸序列的不同PCV2的序列,将PCV2分为PCV2a和PCV2b基因亚型[7]。在1980年来自Denmark报道了第三个基因亚型,命名为PCV2d[8],还有一些数据表明存在第五个基因亚型[9]。PCV2可引起断奶仔猪多系统衰竭综合征、猪皮炎肾病综合征、增生性坏死性肺炎等多种疾病[10],其中以断奶仔猪多系统衰竭综合征最常见。由PCV2引起的疾病严重制约了我国养猪业的发展,流行病学调查研究结果显示,PCV2感染广泛存在国内外猪群中,而且由于PCV2感染及与其他病原体感染造成临床症状和病理变化的多样性和复杂性,给PCV2感染的临床诊断增加了难度[11]。目前PCV2的传统检测方法有病毒分离免疫荧光试验、免疫组化法和酶联免疫吸附试验等[12]。费时长、检测灵敏度较低、准确性差、成本高、特异性低是这些方法共有的缺点,尤其不能检测亚临床感染的猪,严重制约着猪业的发展。而分子生物学检测方法则以检测速度快、灵敏度高、特异性好等特点迅速占领市场,具有良好的前景。因此,建立一种既敏感又特异的检测PCV2的方法显得尤为重要,该方法的建立将有助于进行PCV2病毒的检测。由于目前对圆环病毒引起的相关疾病尚无有效的治疗措施,而该方法可以及时发现亚临床症状的猪,以便对疾病的控制。
1.1病毒感染猪圆环病毒(PCV)、猪细小病毒(PPV)、副猪嗜血杆菌(HP)、猪伪狂犬病毒(PRV)均由洛阳市动物疫病预防控制中心实验室分离、鉴别并保存。
1.2主要试剂和主要仪器设备主要试剂:Ex Taq(5 U/μL)购自TaKaRa公司,2×Taq Mix Master(含染料)购自上海莱枫科技有限公司,病毒基因组DNA提取试剂盒购自生工生物工程(上海)有限公司,引物由上海生物工程有限公司合成,DL2000 DNA Marker购自TaKaRa公司,4 s Red Plus Nucleic Acid stain购自TaKaRa公司,琼脂糖购自BIOWEST公司。
1.3引物的设计与合成根据GenBank中PCV(2登录号为EF524532 PCV2)设计引物由上海生物工程有限公司合成,引物序列:上游引物P1:5、-TTGCTGAGCCTAGCGACACC-3、,下游引物P2:5、-TCGATCACACAGTCTCAGTAG-3、。预计扩增目的片段为700 bp。
1.4病毒基因组DDNNAA的提取按照病毒基因组DNA抽提试剂盒进行操作,提取的DNA保存在-20℃备用。
1.5PPCCRR反应
1.5.1 PCR扩增反应 PCR反应在50 μL反应体系中进行,引物Forward Primer 1 μL,Reverse Primer 1 μL,DNA模板各1 μL,Mix 25 μL,
1 材料与方法
H2O 22 μL。反应条件为95℃预变性5 min;95℃变性30 s,55℃退火30 s,72℃延伸30 s,30个循环,最后72℃延伸10 min,4℃保存。取5 μL PCR扩增产物于1%琼脂糖凝胶电泳中进行电泳测定,观察结果。
1.5.2 PCR反应条件的优化
1.5.2.1 最适模板用量的确立 分别取0.5、0.8、1、2、3、4、5、6 μL DNA模板,进行PCR反应,以确定最适的模板用量。
1.5.2.2 最适引物用量的确立 分别取不同用量的引物在50 μL的反应体系中,上、下游引物各加入0.1、0.3、0.5、0.7、1.0、1.2 μL进行PCR扩增反应,以确定最适的引物用量。
1.5.2.3 最适退火温度的确立 分别设51、53、55、57、59℃进行PCR扩增反应,以确定最适的退火温度。
1.6PCR特异性试验以阳性病料提取PCV2的DNA、PPV、HP和PRV疫苗株中提取DNA,用已建立好的方法进行扩增,与其他疾病比较,来验证该方法的特异性。
1.7PCR敏感性试验将提取的DNA用蛋白质核酸测定仪测定核酸浓度为180 ng/μL,将DNA进行10倍系列稀释1~8孔。
1.8临床应用用建立优化的PCR检测方法,对临床送检的14份疑似病料先提取DNA,对PCR阳性可增产物进行测序。
2 结果与分析
2.1扩增产物的检测及鉴定取5 μL PCR扩增产物加入到1%琼脂糖凝胶电泳中,电泳结果显示该PCR体系可以扩增出一条约为700 bp的猪圆环病毒2型的基因片段(图1),与预期大小相符合。
2.2特异性试验结果利用设计的引物对猪圆环病毒2型扩增出了700 bp的目的基因片段,而PPV、CSFV和PRV均未扩增出目的片段(图2)。
2.3敏感性试验结果将模板DNA经10倍系列稀释后分别进行PCR扩增后进行琼脂糖凝胶电泳,在浓度180×10-2ng/μL时仍出现目的片段,而在浓度180×10-3ng/μL时不出现目的片段,可检测出浓度1.80 ng/μL的模板,结果见图3。
2.4临床应用应用本方法建立的猪圆环病毒2型PCR方法检测了14份在不同地方采集的猪组织病料。结果显示阳性样品6份(图4),将阳性样品的PCR扩增产物切胶、纯化、克隆、测序,证明是猪圆环病毒2型。同时应用市场现有试剂盒进行验证,符合率为100%。
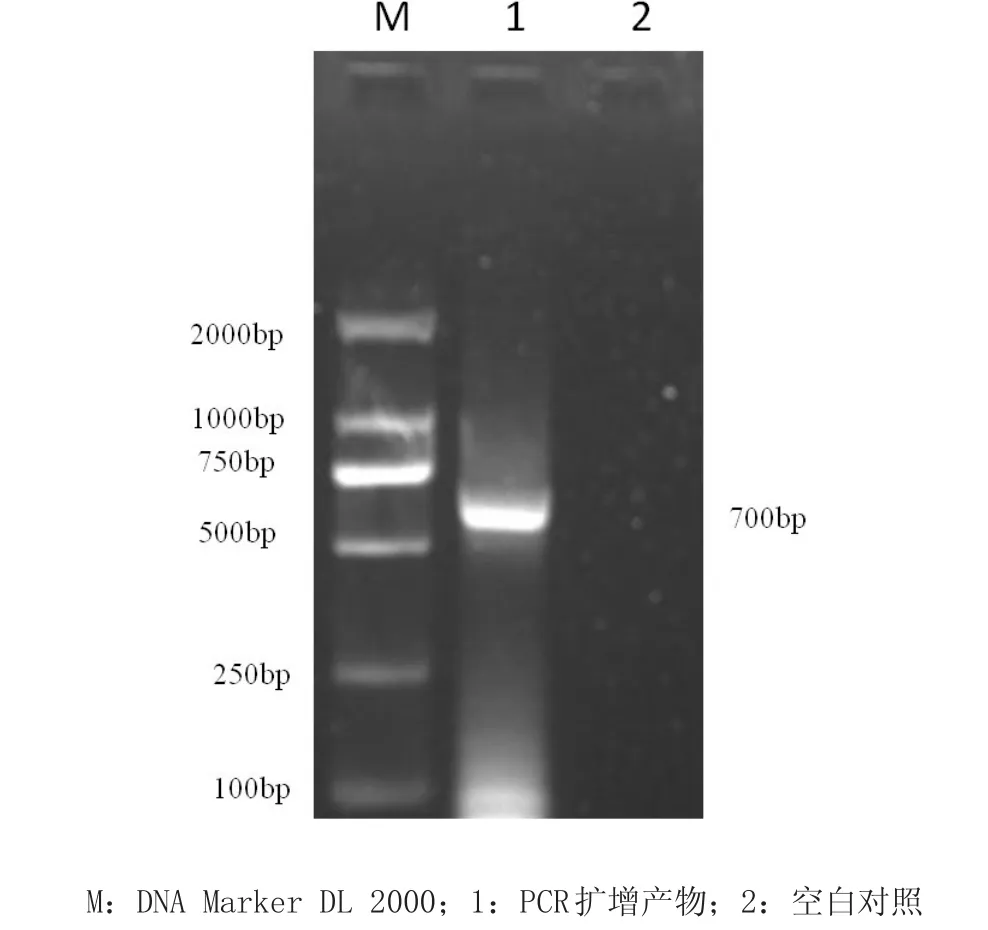
图1 PCR扩增产物凝胶电泳图Fig.1 Agarose gel electrophoresis of the PCR products

图2 PCR特异性试验结果Fig.2 The specific test results of PCR
3 讨论与结论
PCV2感染不仅可引起猪皮炎肾病综合征(porcine dermatitis andnephropathy syndrome,PDNS)、断奶仔猪多系统衰竭综合征(post-weaning multisystem wasting syndrome,PMWS)、增生性坏死性肺炎(porcine proliferative and necrotizing pneumonia,PNP)、猪繁殖与呼吸综合征以及仔猪传染性先天震颤等多种疾病,而且PCV2感染机体后侵害宿主免疫系统,并引起病猪免疫抑制,所以更易与其他病原发生混合感染或继发感染,进一步加剧了当前猪病的复杂性,包括其他病毒、细菌、寄生虫及其他重大动物传染病[13-14]。而且引起疫苗效力的下降,给国内外养猪业造成很大的经济损失,因此,为了给养猪业健康发展提供重要保障,必须防止猪群中的PCV2感染。目前针对PCV2的血清学技术大多数都是检测PCV2抗体的总量,不能决定抗体中和能力。试验表明即便在PCV2抗体高滴度情况下,PCV2也能持续存在于组织中[15-18]。因此,为了给PCV2相关疾病的防控提供技术保障,减少由于PCV2对猪场造成的经济损失,有必要建立一种更加有效且方便的的PCV2检测方法。血清学试验只能检测抗体而无法判断是否存在PCV2,而本研究这可以很好的避免血清学存在的弊端。然而,在实际应用时更应该结合组织病变、临床症状和流行病学等辅助手段进行综合诊断,尽可能地避免本研究建立的PCR方法出现假阳性结果的情况。相对于目前我国常用的免疫荧光试验和免疫组化法以及酶联免疫吸附试验等方法,而快速、敏感、准确、特异性高等是PCR检测技术的优点。但是,很多试验因素影响着PCR检测方法,比如,DNA的纯度及电泳时的用量、引物的特异性、退火的温度、病料的采取及保存等都会影响试验的结果。但最重要的还是试验中所设计引物的敏感性和特异性,快速有效地检测必须要有较高敏感性和特异性的引物。所以本研究首先针对PCR扩增反应的条件进行优化,以保证整个反应准确高效进行,减低非特异性反应,提高整个试验的准确性和敏感性。

图3 PCR敏感性试验结果Fig.3 The sensitivity test results of PCR
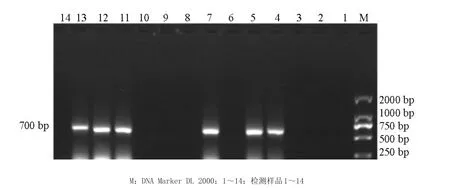
图4 临床样品的检测结果Fig.4 Detection results of Clinical samples
本研究通过优化建立的PCR检测方法,仅对于PCV2可以扩增700 bp的目的片段,而其他中的病毒无法扩增出目的片段,因此可以说明选取的病料、DNA的提取、设计的引物、PCR扩增反应的条件、琼脂糖凝胶电泳优化参数均合理;本方法对PPV、CSFV、PRV的检测结果均为阴性,只对PCV2能扩增出700 bp的特异性片段,故可以说明其具有良好的特异性;同时建立的PCR检测方法的稳定性和重复性好。该研究操作时间短,试验程序较为简便、容易操作而且价格低廉,为PCV2的诊断和流行病学的研究提供了一种简便而且有效的实验室检测方法。
[1]蒋成砚,谢昆,田婷.猪圆环病毒2型PCR检测方法的建立与应用[J].黑龙江畜牧兽医,2012,12:83-85.
[2]Hamel AL,Lin LL,Nayar GP.Nucleotide sequence of porcine circovirus associated with postweaning multisystemic wasting syndrome in pigs[J].Virol,1998,72:5262-5267.
[3]Clark EG.Post-weaning multisystemic wasting syndrome[J]. Gen virol, 1998, 79(9): 2171-2179.
[4]Jacobsen B,Kruegar L,Seeliger F,et al.Retrospectivestudyontheoccurrenceofporcine circovirus 2 infection and associated entities in Northern Germany[J].Veterinary Microbiogy,2009,138:27-33.
[5]刘健,曹火仁,周锦萍,等.猪圆环病毒2型PCR检测方法的建立及其在临床检测中应用[J].中国畜牧兽医,2010,37(7):64-66.
[6]Mankertz A,Domingo M,Folch JM,et al.Characterisation of PCV-2 isolates from Spian, Germany and France[J].virus Research,2000, 66:65-77.
[7] Segales J, Olvera A, Grau-Roma L, et al. PCV-2 genotype definition and nomenclature [J].Vet Record,2008,162(26):867-868.
[8]Guo LJ,Lu Yu,Wei YW,et al.Porcine circocvirus type2(PCV2):Genetic variation and newly emerging genotypes in China[J]. Virol, 2010,7:56-64.
[9]Novosel D,Tuboly,Csagola A,et al.Origin of porcine circovirus type 2(PCV2)from swine affected by PCV2-associated diseases in Croatia[J].Vet Record,2014,174(17):431.
[10]郭晓秋,曲哲会,刘涛.猪伪狂犬病病毒和猪圆环病毒2型多重PCR检测方法的建立与初步应用[J].中国兽医杂志,2015,51(10):34-37.
[11]郑玉姝,赵朴,刘俊伟,等.猪圆环病毒2型PCR检测方法的建立及应用[J].中国畜牧兽医,2010,37(8):66-68.
[12]李天芝,于新友,沈志强.猪圆环病毒2型分子生物学检测方法的研究进程[J].养猪,2015,3:117-120.
[13]Allan G M,Phenix K V,Todd D.Some biological and physicochemical properties of porcine circovirus[J].Israel Journal of Veterinary Medicine,1994,41:17-26.
[14]Allan G M,Mc Neilly F,Meehan B M.Isolation and characterisation of circoviruses from pigs with wasting syndromes in Spain, Denmark and Noryhern Ireland[J].Veterinary Microbiology,1999,66(2):115-123.
[15]Rodríguez-Arrioja GM,Segalés J,Calsamiglia M, et al. Dynamics of porcine circovirus type 2 infection in herd of pigs with postweaning multisystemic wasting syndrome [J]. American Journal of Veterinary Research, 2002,63:354-357.
[16]Larochelle R,Magar R,D,Allaire S.Comparative serologic and virologic study of commercial swine herds with and without postweaning multisystemic wasting syndrome[J].Canadian Journal of Veterinary, 2003, 67: 114-120.
[17]Sibila M,Calsamiglia M,Segalés J,et al. Use of a polymerase chain reaction assay and ELISA to monitor porcine circovirus type 2 infection in pigs from farms with and without postweaning multisystemic wasting syndrome[J].American Journal of Veterinary Research,2004,65:88-92.
[18]McIntosh Ka,Harding JCS,Ellis Ja,et al. Detection of Porcine circovirus type 2 viremia and seroconversion in naturally infected pigs in a farrow-to-finish barn[J].Canadian Journal of Veterinary,2006,70(1):58-61.
Development of PCR to Detect Porcine circovirus Type2 and its clinical Application
Shi Ligang
(Animal disease prevention and control center of Luoyang,Henan Luoyang 471002)
Porcine circovirus type 2(PCV2)is one of the most important pathogens in swine,a PCR method was established by using a set of primers derived from the published nucleotide sequence of the PCV2genes(Rep)in GenBank.In order to confirm its specificity,the PCR was implemented by using the template DNA,and the expected products of 700 bp were only detected in PCV2, however no specific band was detected in other virus such as PPV,CSFV,PRV.The lowest DNA consistence which could be detected by the PCR method was 1.80 ng/μL.In order to further investigate the prevalence of PCV2,14 clinic samples were detected.The data indicated that PCV2in 6 samples were positive.The experiments indicate the PCR method could be used in diagnosis and epidemiology investigating.
Porcine circovirus type 2;PCR;Detection
S858.28 < class="emphasis_bold"> 文献标识码:B
B
1672-9692(2016)08-0001-05
2016-06-19
师丽刚(1980-),男,山西省长治人,兽医师,毕业于南京农业大学兽医专业,主要从事兽医临床及实验室诊断工作。
