荧光分子成像系统及重建算法研究进展
2017-01-05宿涵张久楼陈毛毛高阳周源白净罗建文
宿涵,张久楼,陈毛毛,高阳,周源,白净,罗建文,2
1.清华大学 生物医学工程系,北京100084;2.清华大学 生物医学影像研究中心,北京 100084
荧光分子成像系统及重建算法研究进展
宿涵1,张久楼1,陈毛毛1,高阳1,周源1,白净1,罗建文1,2
1.清华大学 生物医学工程系,北京100084;2.清华大学 生物医学影像研究中心,北京 100084
精准医疗是近年来围绕生物信息学、分子医学、临床诊断学、医学影像学等学科发展起来的新型医学模式,是指针对患者的病情,通过前沿技术手段精确判定疾病的成因及确定治疗方案。最终目标为在医疗相关的各个领域内提升诊断能力、医疗水平及护理效果,实现个性化医疗。荧光分子成像是实现精准医疗的重要技术之一,与传统的结构成像不同,荧光分子影像可以提供生物体内的功能信息,可以在细胞和分子水平对生物体内的生理、病理变化过程进行在体成像。本文以精准医疗为背景,根据近年来国内外相关的研究进展,对荧光分子成像系统与重建算法进行了总结与综述,并阐述了其应用前景与价值。
精准医疗;荧光分子成像;多模态
1 概述
1.1 精准医疗
精准医疗是指结合现代信息技术对患者进行入院前预处理、诊疗、院后康复管理以提高医疗资源使用效率,使患者获益最大化的一种新型医疗模式[1]。精准医疗涵盖了多个学科领域内的相关技术与理念,如临床诊断学、分子医学、医学影像学等,提高了传统医疗模式中医疗资源的投入产出比。精准医疗利用生物标记物对患者体内病灶进行准确定位,从而精确反应出疾病的来源与病灶状态,甚至可以针对特定患者和疾病进行个性化诊疗与观察[2]。
结合当前的医疗环境背景来看,精准医疗的初期将主要围绕肿瘤类疾病进行,如对肿瘤的靶向性检测、肿瘤发展早期的预诊断研究、肿瘤切除手术中的手术导航等,提高肿瘤类疾病的诊断与治疗水平。其长远目标,在于将精准医疗的概念和技术应用到医疗相关的各个领域,全面提高早期诊断能力、医疗水平及康复护理效果,乃至于推进个性化医疗时代的到来。
1.2 分子影像
分子影像学是近年来在原有传统医学影像技术的基础之上快速发展起来的一门新兴医学影像科学,广义上指在细胞和分子水平对生物体内的生理、病理变化过程进行在体成像。传统医学影像技术中通常以生物体自身所具有的物理特性或生理特性作为成像源,这些成像源并不具有针对特定的疾病或生理功能相关的分子与细胞的特异性。相比之下,分子影像以特定分子作为成像源,其目的是在分子水平下对生物体内的生理变化过程进行实时、在体成像[3],具有高特异性、高灵敏度等特点,能够对疾病进行精准的定位,以及定性、定量的分析。因此,分子影像是医疗研究、临床医学领域中的重要成像方式之一。区别于传统的结构成像,分子影像属于功能成像,可以活体获取特定组织器官的代谢与活动信息。利用分子影像技术,可以实现肿瘤的早期诊断与定位、特定疾病的病理研究与药物研发、手术导航等功能,对精准医疗领域的发展能够发挥巨大的推动作用。
在分子影像中,分子探针是实现对特定目标进行观察和定量分析的关键技术。它可以与特定细胞或分子结合,靶向标记特定目标。由于成像原理与分子探针的不同,分子影像技术具有多种模态,包括正电子发射计算机断层成像(Positron Emission Tomography,PET)、单光子发射计算机断层成像(Single-Photon Emission Computed Tomography,SPECT)、超声成像、磁共振成像(Magnetic Resonance Imaging,MRI)、X射线计算机断层成像(X-ray Computed Tomography,X-CT)、光学成像等[4]。PET和SPECT属于核医学分子成像方法,具有穿透度深、灵敏度高、可定量分析等特性,但有较强的电离辐射;磁共振成像是空间分辨率最高的功能成像方式,但是灵敏度较低,且图像采集、重建处理时间较长;X射线计算机断层成像具有良好的分辨率,但缺点在于软组织的对比度较低,且对人体有一定的电离辐射;光学成像具有高灵敏度、无电离辐射等特性,包括荧光分子断层成像(Fluorescence Molecular Tomography,FMT)[5]、扩散光学层析成像(Diffuse Optical Tomography,DOT)[6]、光学相干层析成像(Optical Coherence Tomography,OCT)[7]、扩散荧光层析成像(Diffuse Fluorescence Tomography,DFT)[8]、光频选区成像(Optical Frequency-Domain Imaging,OFDI)[9]、荧光反射成像(Fluorescence Reflectance Imaging,FRI)[10]、共焦距显微成像(Confocal Microscopy)[11]、多光子显微成像(Multiphoton Microscopy)[12]等。
2 荧光分子成像
在光学成像中,荧光分子成像(Fluorescence Molecular Imaging,FMI)是一种重要的成像模式,利用具有特异性靶向标记功能的荧光分子探针作为对比度源,对特定细胞或分子进行标记,经过探测装置对荧光信号的采集,可以实现对特定生理、病理过程的观察。荧光分子成像具有毫米级的空间分辨率,且所使用的荧光分子探针一般具有毒性小、不参与体内生物转化过程、排泄迅速等特性,因此,荧光分子成像具有非常良好的应用前景和研究价值。
荧光分子成像是一种需要借助外部激发光源来激发生物体内的荧光分子探针产生荧光,并接收荧光信号,从而实现对体内被靶向标记的基因、蛋白信息获取的成像技术[13]。荧光分子成像常用的探针包括吲哚菁绿(Indocyanine Green,ICG)、邻苯二甲醛、量子点系列等[14]。根据对采集到的荧光数据的处理方式的不同,荧光分子成像通常可以分为二维平面成像和三维断层分子成像两类。下面将对几种典型的荧光分子成像方式进行简要的介绍。
2.1 荧光分子断层成像
荧光分子断层成像利用多个角度下特定波长的激发光对荧光分子探针标记的生物结构进行照射并激发荧光,并以高灵敏度的光学探测器件对荧光信号进行采集,最后根据荧光在生物体内的传输模型即可重建出荧光探针的三维空间分布。因此,荧光分子断层成像是一种可以提供三维影像信息的分子影像技术,具有灵敏度高、特异性强、操作简易、无电离辐射、探针毒性小、设备成本低廉等特性,可以应用于肿瘤的早期筛查、药物研发、生理病理过程研究等多个领域[15]。荧光分子断层成像根据激发光性质的区别,具有连续波模式(continuous wave,CW)、时域模式(Time-Domain,TD)和频域模式(Frequency-Domain,FD)三种模式。其中时域模式和频域模式均可以实现荧光寿命断层成像(Fluorescence Molecular Lifetime Tomography,FMLT),且时域模式下可获取时间点扩散函数,能够获得更广泛的信息[16]。
动态荧光分子断层成像(Dynamic Fluorescence molecular tomography,DFMT)是一种在FMT的基础上加入了时间维度的成像方式。该技术保留了FMT所具有的无电离辐射、成像速度快、灵敏度高、特异性强、费用低廉等特点,而且可以动态地描述荧光分子探针在生物体内吸收、分布以及排出的完整过程,是一种可以实现对生物体内特定生理、病理过程进行实时动态监测的成像技术,因而,在病理研究、药代动力学和疾病诊断等多个方面具有良好的应用价值[17]。
2.2 扩散荧光层析成像
扩散荧光层析成像是一种具有高灵敏度的能够提供特异性分子探针的空间分布信息的光学分子成像方法。这种成像方式具有无放射性损伤等特性,并可以对实现生物体内具有特异性的大分子生化过程进行三维定量观察等功能,可以应用于乳腺癌和睾丸畸形等疾病的检测等[18]。DFT作为一种分子成像方式,可以应用于疾病的早期诊断和治疗,以及小动物病理模型的生物医学基础研究[19]。
2.3 荧光反射成像
荧光反射成像利用平面波照射荧光探针及其附近的组织表面进行激发荧光,并使用光学器件获取荧光图像,可以用于进行活体在体宏观观测,如组织蛋白酶、基质金属蛋白酶等。该技术具有动物通量高、操作简单等优势,然而由于所获取的荧光图像为各个深度的荧光信号叠加而成,所以各深度的信号会有不同程度的模糊。其分辨率受到深度的限制,很难获取深层组织甚至表面未被标记的组织的形状与荧光探针浓度[20],所以这种成像方式通常只有几毫米成像深度,也因此,荧光反射成像通常被应用于二维成像来观察组织表面的形态及活动[21]。
3 理论模型与重建算法研究
3.1 光学成像物理模型研究
3.1.1 基于一种快速判断光子触界方法的Monte Carlo光传输模型
Monte Carlo方法由于其高度的灵活性和准确性而被广泛应用于光在生物组织中传输问题的研究,是验证荧光分子断层成像前向模型准确性的“金标准”。然而,耗时巨大一直都是Monte Carlo方法最大的缺点。清华大学医学院分子影像研究组研究并建立了一种快速的基于Monte Carlo方法的光传输模型[22]。该模型在判断光子触界过程中利用一种基于线段判断交点的方法代替了传统的基于射线的方法实现了模型加速。利用实验所获得的小鼠模型进行仿真实验,结果表明,该模型可以实现快速、准确的光传输过程的模拟。部分实验结果见表1。

表1 相同光子数(104),不同三角面片下,两种方法在小鼠模型中运算速度的对比[22]
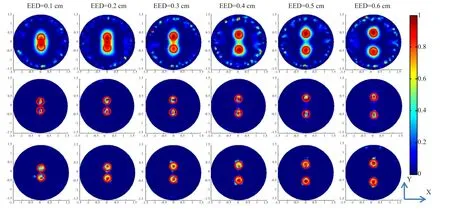
图1 不同边边距荧光目标的重建结果
3.1.2 消除时变影响的改进FMT前向模型
在传统的FMT重建算法中,会假设采集每一帧图像时,荧光分子探针的浓度是保持不变的。然而在实验、在体研究中,其浓度通常是随时间变化的,因而,重建算法不应该忽略浓度随时间变化的影像。清华大学医学院分子影像研究组建立了一种改进的FMT前向模型[23],该模型将荧光产额分布分为两个部分,一部分为常量,表示荧光目标的空间分布,另一部分表示浓度变化以及其他因素的影响。其中荧光目标的空间分布信息可以从重建结果中准确地获得。仿真和仿体实验的结果显示,采用了改进的FMT前向模型后,重建结果质量从定位精准性和抗噪声性等多个方面具有显著的提升。
3.2 FMT重建方法研究
3.2.1 基于正则化方法的FMT重建
由于光子穿过生物组织时存在很高的散射,FMT逆向问题的病态性导致重建结果的空间分辨率比较低。与L2正则化不同的是,L1正则化可以保留细节信息并且有效地降低噪声[24]。清华大学医学院分子影像研究组在2013年提出的重启L1正则化非线性共轭梯度(re-L1-NCG)算法可以提高运算速度并且节约内存[25]。该算法包括了内部和外部两次迭代,内迭代L1-NCG被用来获取L1正则化结果。外部迭代则是使用重启策略来提高L1-NCG的收敛速度。在re-L1-NCG 算法中,NCG是使用回溯线性搜索来求解L1正则化优化问题。然而,L1-NCG的收敛速度在多次迭代之后会降低。为了提高收敛速度,课题组提出的重启策略是在下降方向搜索并且重新设定在固定迭代次数之后的可行域[26]。为了验证re-L1-NCG算法在空间分辨率中所起到的作用,使用了不同边边距荧光目标的仿真和仿体数据进行研究。实验结果显示re-L1-NCG算法可以分辨出边边距0.1 cm的目标,见图1。3.2.2 FMT/PET双模成像算法
由于具有高灵敏度、非破坏性、在体成像和功能成像等优势,FMT成像技术在生物医学研究、药物研发和医学应用等方面具有广泛的应用。然而,FMT成像技术也存在分辨率低、成像深度有限等不足。清华大学医学院分子影像研究组基于已有的PET/FMT双模成像系统,提出了一种将PET先验信息融入荧光断层重建过程的迭代重加权最小二乘(IRLS)的FMT重建算法[27]。仿真和仿体实验结果表明,利用PET先验信息后,FMT重建结果的分辨率有很大改善,而且与已有的基于PET先验的重建算法相比,计算速度提高了16倍。仿体实验结果见图2。
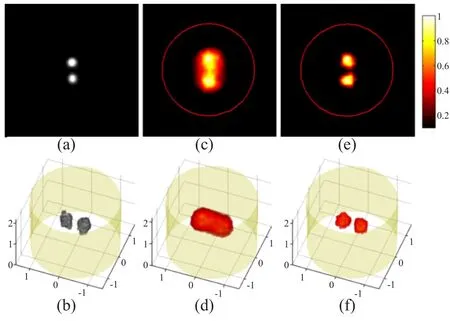
图2 间距为2 mm的仿体重建结果
3.2.3 DFMT重建方法研究
目前,在药代动力学中,用来获取药代动力学参数图像的一个主要方法是直接法,它可以将动态FMT重建和房室模型相结合,从原始边界测量数据中直接重建出参数图像。因此,该方法可以将测量噪声在一个目标函数中建模,并且在统计上更加有效。
尽管直接法具有某些特殊的优势,但是动态FMT运用于小鼠器官的药代动力学参数重建还是有一定的难度,因为FMT内在的病态性导致的空间分辨率较低。这对于确定特定器官的位置并且对感兴趣器官的药代动力学分析造成很多困难。由结构成像系统如X-CT提供的结构先验信息可以帮助解决这个问题。清华大学医学院分子影像研究组在2013年提出了使用FMT/X-CT系统获取ICG在小鼠肝脏中的参数图像[28]。X-CT系统提供的先验信息约束了FMT逆向问题并且限定了特定感兴趣器官的药代动力学分析,这是首次在动态FMT中运用结构先验信息来对药代动力学参数进行重建。清华大学医学院分子影像研究组基于Tikhonov正则化框架提出一种参数图像直接重建法,该方法结合了直接法和多模态提供结构先验信息的优势。实验证明重建结果与间接法相比有了很大的提高[29]。数值仿真实验结果见图3。
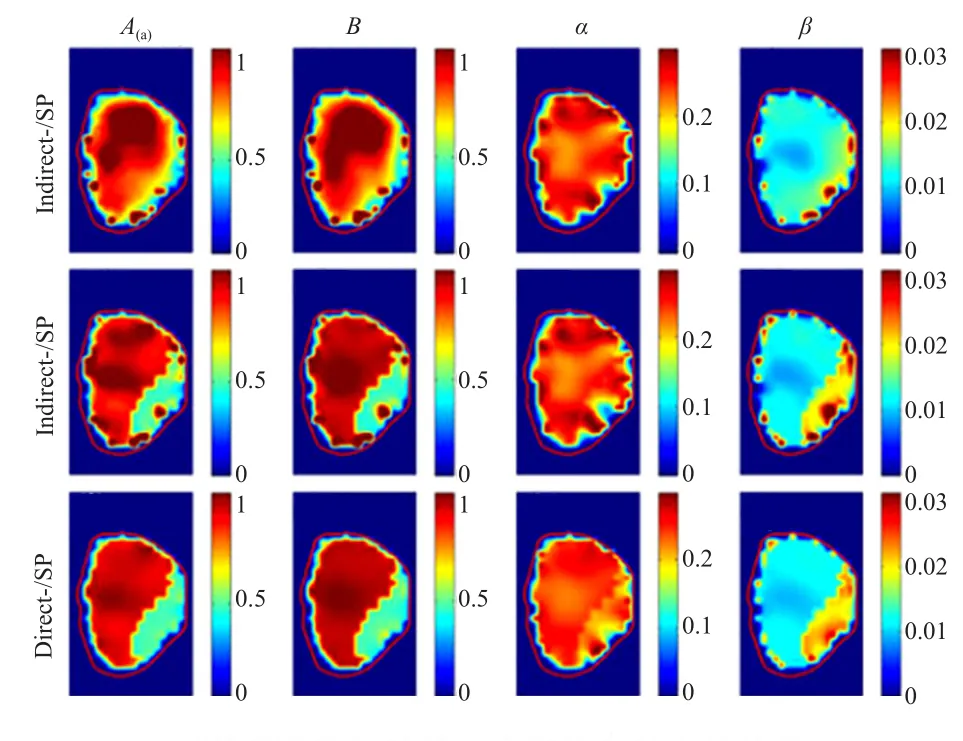
图3 DFMT的数值仿真实验参数成像结果
3.2.4 时域荧光断层成像的荧光寿命直接法重建
在时域荧光断层成像中,对于荧光寿命的重建所使用的传统方法通常基于拉普拉斯变换或傅里叶变换,这些方法一般只利用了部分采集到的数据,而且效果依赖于变换参数的选取。为了充分利用所采集的数据,清华大学医学院分子影像研究组提出了一种针对荧光寿命重建的直接重建算法[30]。仿真和仿体实验显示该方法具有较好的空间定位能力和寿命重建精度,且在不同荧光目标之间具有良好的对比度。
3.3 DFT重建方法研究
DFT主要有稳态、频域和时域三种测量模式。其中,时域DFT成像技术通过将超短脉冲激发光射入光学参数已知的组织体内,之后检测组织体表面的出射激发光和荧光时间扩展信号,并将测量所得到的数据代入到重建算法中,从而获得组织体内相关物理量的空间分布信息。
在时域DFT成像中,逆问题的求解具有很强的病态性,即重建过程对噪声具有很强的敏感性,这会导致重建图像具有很低的空间分辨率。Gao等曾于2002年提出一种利用广义脉冲谱技术的时域DFT成像方法,该方法可以通过增加变换频率在全时间分辨测量数据中采集到更多的特征数据,用以荧光重建。该方法可以在一定程度上降低逆问题的病态性,从而改善重建结果的质量。然而有研究表明,多变换频率信息通常具有比较高的相关性,因此引入该特征量不足以对病态性产生大幅度的改善,而成像结果的质量也并没有显著提高[31-32]。
天津大学高峰研究组提出了一种在无限平板时域扩散荧光层析成像方法的基础上采用多级小波变换的重建方法[33]。该方法在重建过程中,把待求参量进行离散小波变换,这既可以获得多分辨率的重见效果,又减少了在低分辨率重建过程中未知参量的个数,理论上可以有效地减弱逆问题的病态性,获得更好的成像结果。该研究组利用一种基于时间相关的单光子计数(Time-Correlated Single Photon Counting,TCSPC)技术的非接触式时域成像系统,对所提出的重建算法进行了实验验证。实验结果显示该方法与传统重建方法相比,确实显著地具有更好地量化度和更高的空间分辨率。
4 实验研究及应用
4.1 荧光分子成像相关小动物在体实验
4.1.1 小鼠肺部扩散性肿瘤的在体FMT/CT双模成像
清华大学医学院分子影像研究组基于实验室搭建的FMT/CT双模小动物成像系统,对肺部扩散性肿瘤的小鼠肺部进行了在体CT解剖结构成像和FMT功能成像[34]。利用两步重建法将CT结构信息融入到FMT的重建过程中,来提高FMT成像质量,实现同时对解剖结构和功能信息进行成像。在CT呈现的解剖结构未发现异常的情况下,FMT的重建结果显示了肺部荧光信号的增强,实现了肺部扩散性肿瘤的早期、非破坏性检测。离体成像和组织病理切片分别验证了肺部癌变的存在。重建结果见图4。

图4 肺扩散肿瘤小鼠在体FMT/CT成像
4.1.2 双模探针实现MRI与FMT的多模在体成像
多模成像将不同成像模式的优势互补地结合在一起,可以为临床前的研究工作带来极大的便利。将荧光成像与磁共振成像结合使用的多模成像,可以实现两种成像模式间的相互验证以及直接比较。清华大学医学院分子影像研究组使用了一种新颖的靶向肿瘤的双模探针来实现多模成像[35]。首先用离体实验证明该双模探针对肿瘤细胞的靶向性,随后进行了探针在体的荧光成像以及核磁共振成像,并定量分析了探针对于图像对比的增强效率。最后,通过该课题组开发的荧光分子断层成像系统以及算法,获得了可以反映探针在小鼠肿瘤内分布的荧光断层图像。通过与核磁共振得到的图像对比发现,使用双模探针进行的多模成像可以提供不同成像模式间的互相验证与直接对比。
4.2 荧光分子成像在手术中的应用
近年来,医学影像技术日益成熟,分子影像也逐渐开始应用于临床医学。由于其功能性成像的特性,相比于传统的结构成像模态,分子影像可以为医生提供有关病人状况更丰富的信息。在临床手术中,对于肿瘤边界信息的精准定位是精准医学领域内的挑战性问题。结合光学分子影像实现的手术导航技术作为一种新兴的医学成像方法,可以辅助医生在术中切除肿瘤时,精准定位肿瘤的边界。该方法可以对肿瘤进行细胞分子层面的实时、在体成像[36]。中科院分子影像重点实验室自主研发的光学分子影像手术导航系统已在汕头大学医学院附属肿瘤医院等多家医院投入使用,进行了多例乳腺癌前哨淋巴结活检手术。其结果显示光学分子影像手术导航方法可以对前哨淋巴结组织进行快速、精确的定位,其检出率与传统方法相比具有很明显的提升。徐同花等在2014年针对上述系统的图像融合算法进行了研究和改进,在算法的运行效率、图像融合效果等多个方面得到了提升[37]。
4.3 利用分子影像对肿瘤治疗进行疗效评估
FMT可以实现非侵入地在体观察组织中特定细胞或分子的活动特性,故而具有评估特定疾病治疗效果的潜力。清华大学医学院分子影像研究组利用FMT对经过顺铂治疗后的荷瘤小鼠模型进行了在体观测[38]。之前的仿体实验中,显示了FMT的定位能力和量化精度。在体实验中,在使用顺铂进行癌症治疗的同时,观测了红色荧光蛋白在肿瘤表面和内部的活动情况,以对其治疗效果进行评估。
基于18氟-脱氧葡萄糖的PET系统(18F-fluorodeoxyglucose Based Positron Emission Tomography,[18F]FDG-PET)可以对肿瘤治疗过程中肿瘤内部所摄取的18氟-脱氧葡萄糖的变化进行评价。清华大学医学院分子影像研究组利用荧光成像系统和[18F]FDG-PET系统对接受了金纳米棒-ICG复合物治疗的肿瘤小鼠模型进行了非侵入式的在体成像实验[39],并在治疗结束后对两系统所获取的图像数据进行了量化分析。分析结果显示,小鼠体内的荧光信号强度和肿瘤的新陈代谢活动强度均有明显的降低。这表明利用荧光成像系统与[18F]FDG-PET系统共同进行的双模成像,是一种可对肿瘤治疗进行分子尺度评估的非侵入式方法。
5 应用前景与展望
癌症的预诊断一直是一个热点问题,也是一个较复杂的难题。由于癌细胞并非从体外入侵,从而规避了大部分人体内免疫系统的防护作用,因而在被确诊时通常为中、晚期,这使得大部分癌症很难在早期甚至病变初期被探测到,大大提高了诊疗难度。荧光分子成像的发展,使得从分子或细胞级别对癌症进行认识和了解变为可能。如Muldoon TJ等[40]人基于高分辨率荧光成像系统对口腔内肿瘤进行特异性标记,并对各阶段肿瘤分布、形态进行了观察,建立了一种口腔内肿瘤的判别方法。
荧光分子成像由于其所具有的灵敏度高、特异性强、设备成本低廉、无电离辐射、分子探针毒性小等特点,在肿瘤的早期诊断,药物研发,特定生理、病理过程的研究中有着广阔的应用前景。近年来,荧光分子成像的重建算法得到了广泛发展,从重建速度、精度、目标形状准确度、空间分辨率等多个方面改善了重建质量。这将改善肿瘤在三维空间分布的重建结果,并对癌症的研究起到了推动性的作用[41]。
随着多功能荧光分子探针的不断发展,荧光分子成像与其他模态的成像系统相结合成为了一个重要的发展方向。如清华大学医学院分子影像研究组建立的FMT/CT双模成像系统,利用CT系统获得的解剖信息提供结构先验知识,使FMT获取的分子影像信息取得更好的重建质量。此外,该课题组基于现有的FMT/PET双模成像系统,提出了一种利用PET系统提供的先验信息进行FMT分子影像重建的重建算法,所获结果的空间分辨率以及重建速度均获得了很大的改善。
目前荧光分子成像主要被用于小动物成像研究,但部分临床研究已经获得了一定的成果更多基于原有理论的优化算法正在不断被提出,具有更好效果的荧光分子探针正在被投入使用。随着研究的继续进行,分子影像将在手术导航、特定疾病筛查等更多诊疗方法中起到关键的作用,所以分子影像在未来的精准医疗领域内具有十分广阔的应用前景。
[1] National Research Council (US) Committee on A Framework for Developing a New Taxonomy of Disease.Toward precision medicine:Building a knowledge network for biomedical research and a new taxonomy of disease[M].US:National Academies Press,2011.
[2] 徐鹏辉.美国启动精准医疗计划[J].世界复合医学,2015(1):44-46.
[3] Weissleder R,Mahmood U.Molecular Imaging[J].Radiology, 2001,219(2):316-333.
[4] 赵倩,李娟,王荣福.PET/MRI 显像技术与其他分子影像技术的比较[J].中国医学装备,2013,10(1):4-8.
[5] Bai J,Xu Z.Fluorescence Molecular Tomography.Molecular Imaging[M].Springer Berlin Heidelberg,2013:185-216.
[6] Choe R,Corlu A,Lee K,et al.Diffuse optical tomography of breast cancer during neoadjuvant chemotherapy:a case study with comparison to MRI[J].Med Phys,2005,32(4):1128-1139.
[7] Huang D,Swanson EA,Lin CP,et al.Optical coherence tomography[J].Science,1991,254(5035):1178-1181.
[8] Nouizi F,Chabrier R,Torregrossa M,et al.3D modeling for solving forward model of no-contact Fluorescence Diffuse Optical Tomography method[C].European Conferences on Biomedical Optics[A].International Society for Optics and Photonics,2009:73690C-73690C-10.
[9] Yun S,Tearney G,de Boer J,et al.High-speed optical frequencydomain imaging[J].Opt Express,2003,11(22):2953-2963.
[10] Weissleder R,Ntziachristos V.Shedding light onto live molecular targets[J].Nat Med,2003,9(1):123-128.
[11] Wilson T.Confocal microscopy[M].London:Academic Press, 1990,426:1-64.
[12] König K.Multiphoton microscopy in life sciences[J].J Microsc, 2000,200(2):83-104.
[13] Ntziachristos V.Fluorescence molecular imaging[J].Annu Rev Biomed Eng,2006,8:1-33.
[14] 王红,张华山.分离检测生物活性物质的荧光标记试剂与分子探针及其应用[J].化学进展,2007,19(5):633.
[15] 朱新建,宋小磊,汪待发,等.荧光分子成像技术概述及研究进展[J].中国医疗器械杂志,2008,32(1):1-5.
[16] O’Leary MA,Boas DA,Li XD,et al.Fluorescence lifetime imaging in turbid media[J].Opt Lett,1996,21(2):158-160.
[17] 张光磊,刘飞,张宾,等.动态荧光分子成像技术研究进展[J].国际生物医学工程杂志,2012,35(3):181-184.
[18] 王欣,高峰,李娇,等.仿 CT 扫描模式扩散荧光层析成像方法[J].天津大学学报:自然科学与工程技术版,2013,46(12):1106-1113.
[19] Abascal JF,Aguirre J,Chamorro-Servent J,et al.Influence of absorption and scattering on the quantification of fluorescence diffuse optical tomography using normalized data[J].J Biomed Opt,2012,17(3):036013.
[20] Ntziachristos V,Bremer C,Graves EE,et al.In vivo tomographic imaging of near-infrared fluorescent probes[J].Mol Imaging, 2002,1(2):82-88.
[21] Cullen JJ,Renger EH.Continuous measurement of the DCMU-induced fluorescence response of natural phytoplankton populations[J].Marine Biology,1979,53(1):13-20.
[22] Zhao X,Liu H,Zhang B,et al.Fast photon-boundary intersection computation for Monte Carlo simulation of photon migration[J].
Opt Eng,2013,52(1):019001.
[23] He W,Zhang G,Pu H,et al.Modified forward model for eliminating the time-varying impact in fluorescence molecular tomography[J].J Biomed Opt,2014,19(5):056012.
[24] Gao H,Zhao H.A multilevel and multigrid optical tomography based equation Part 1: l1 regularization[J].Opt Express,2010, 18:1854.
[25] Shi J,Zhang B,Liu F,et al.Efficient L1 regularization-based reconstruction for fluorescent molecular tomography using restarted nonlinear conjugate gradient[J].Opt Lett,2013, 38(18):3696-3699.
[26] Shi J,Liu F,Zhang G,et al.Enhanced spatial resolution in fluorescence molecular tomography using restarted L1-regularized nonlinear conjugate gradient algorithm[J].J Biomed Opt,2014,19(4):04601.
[27] Zhang B,Liu S,Cao X,et al.Fluorescence tomography reconstruction with simultaneous positron emission tomography priors[J].IEEE T Multimedia,2013,15(5):1031-1038.
[28] Zhang G,Liu F,Zhang B,et al.Imaging of pharmacokinetic rates of indocyanine green in mouse liver with a hybrid fluorescence molecular tomography/x-ray computed tomography system[J].J Biomed Opt,2013,18(4):040505.
[29] Zhang G,Pu H,He W,et al.Full-direct method for imaging pharmacokinetic parameters in dynamic fluorescence molecular tomography[J].Appl Phys Lett,2015,106(8):81-110.
[30] Cai C,Zhang L,Zhang J,et al.Direct reconstruction method for time-domain fluorescence molecular lifetime tomography[J].Opt Lett,2015,40(17):4038-4041.
[31] Xin W,Feng G,Jiao L,et al.Diffuse Fluorescence Tomography Method with CT-Analogous Scanning Mode[J].Journal of Tianjin University (Science and Technology),2013,12:9.
[32] 杨芳.基于平板检测模式的时域乳腺扩散光学层析先进方法研究[D].天津:天津大学,2010.
[33] 李娇,张燕,赵会娟,等.基于多级小波域变换的时域扩散荧光层析成像方法[J].生命科学仪器,2014,3:10.
[34] Zhang B,Gao F,Wang M,et al.In vivo tomographic imaging of lung colonization of tumour in mouse with simultaneous fluorescence and X-ray CT[J].J Biophotonics,2014,7(1-2):110-116.
[35] Zhang Y,Zhang B,Liu F,et al.In vivo tomographic imaging with fluorescence and MRI using tumor-targeted dual-labeled nanoparticles[J].Int J Nanomedicine,2014,9:33.
[36] 迟崇巍,叶津佐,王建东,等.基于光学分子影像的肿瘤靶向手术导航技术应用现状与前景[J].中华放射学杂志,2015,49(3): 233-235.
[37] 徐同花,赵建民,朱信忠,等.光学分子影像手术导航系统中图像融合算法研究[J].浙江师范大学学报:自然科学版,2014,37(3): 280-287.
[38] Liu F,Cao X,He W,et al.Monitoring of tumor response to cisplatin by subsurface fluorescence molecular tomography[J].J Biomed Opt,2012,17(4):0405041-0405043.
[39] Liu F,Zhang Y,Liu S,et al.Monitoring of tumor response to Au nanorod-indocyanine green conjugates mediated therapy with fluorescence imaging and positron emission tomography[J].IEEE T Multimedia,2013,15(5):1025-1030.
[40] Muldoon TJ,Roblyer D,Williams MD,et al.Noninvasive imaging of oral neoplasia with a high-resolution fiber-optic microendoscope[J].Head Neck,2012,34(3):305-312.
[41] Ntziachristos V,Tung C H,Bremer C,et al.Fluorescence molecular tomography resolves protease activity in vivo[J].Nat Med, 2002,8(7):757-761.
Research on the Reconstruction Algorithms and Imaging Systems for Fluorescence Molecular Imaging
SU Han1, ZHANG Jiulou1, CHEN Maomao1, GAO Yang1, ZHOU Yuan1, BAI Jing1, LUO Jianwen1,2
1.Department of Biomedical Engineering, School of Medicine, Tsinghua University, Beijing 100084, China; 2.Center for Biomedical Imaging Research, School of Medicine, Tsinghua University, Beijing 100084, China
As a newly developed medical model based on bioinformatics, molecular medicine, clinical diagnostics and medical imaging, precision medicine makes use of advanced technology to accurately trace causes of diseases and thusdetermine therapeutic regimen for different patients. The ultimate aim of precision medicine is to facilitate the diagnosis capability, medical treatment capability, and nursing effect in all medicalrelated fields, and to finally realize personalized medicine. Fluorescence molecular imaging is an essential technology involved in the realization of precision medicine. It provides in vivo functional information as well as imaging in cellular and molecular levels, which differs from traditional structural imaging. Based on recent development of related research both at home and abroad, this paper summarizes the reconstruction algorithms and imaging systems for fluorescence molecular imaging and describes the value and future of the application with precision medicine as background.
precision medicine, fluorescence molecular imaging, multi-model
R318.6
A
10.3969/j.issn.1674-1633.2016.03.004
1674-1633(2016)03-0020-06
2015-10-22
2015-12-22
罗建文,教授。
通讯作者邮箱:luo_jianwen@mail.tsinghua.edu.cn
