晚钠电流的魅影
——从交感性T波到Takotsubo综合征
2017-01-04贾忠伟
贾忠伟
晚钠电流的魅影
——从交感性T波到Takotsubo综合征
贾忠伟
交感性T波是一类与交感应激有关的心脏电生理异常,而Takotsubo综合征包含了心电生理异常和心脏机械功能异常两方面。二者有共同的发病机制,包括交感兴奋、晚钠电流(late sodium current,ⅠNaL)及钙调蛋白介导的心肌细胞电生理异常等。它们可能是同一种疾病不同的临床表现形式。
交感性T波;Takotsubo综合征;晚钠电流
交感性T波[1]是一类异常心电学表现,而Takotsubo综合征是近些年逐渐认识到的一类临床综合征,表现为心脏电-机械活动异常。虽然交感性T波见于多种临床病理生理状态,并非Takotsubo综合征患者独有,但Takotsubo综合征患者大多会呈现交感性T波样的心电图异常,而且交感性T波和Takotsubo综合征患者有着几乎相同的诱发因素。从发病机制看,不论是这种特殊的临床综合征,还是更为广泛存在的心电学异常,都可能有晚钠电流(late sodium current,ⅠNaL)异常的参与。
1 交感性T波的概念
自从1947年Byer等[2]以神经源性T波为名称报道了以T波高耸为特征的继发于脑血管病的T波异常,世界各地的学者们提出了多种称谓以描述这种心脏或心脏外事件引起的心脏复极异常的心电图表现,可以表现为T波倒置、QT间期延长、ST段改变以及T波高尖,诸如Wellen’s T波、心脏记忆性T波、峡谷样(canyo)T波等[3-4]。见图1。这些病例的共同特点是存在心脏或心脏外事件诱发的应激状态,表现为继发性/可逆性QT间期延长或T波倒置等变化。大量研究证明,这种可逆的心脏电生理学改变与心脏交感张力增大密不可分,而且,处于应激状态,出现这种心电图异常的患者,是发生尖端扭转型室性心动过速的高危患者[5-6]。
虽然出现交感性T波的诱发因素是交感张力增大,但随着病程进展,即使去除交感刺激的诱因,心脏的电生理异常也不能同步恢复,而且随着交感刺激的去除,患者可能出现心率较慢而复极明显异常的电生理状态。处于这种状态的患者,由于长短周期机制、复极离散机制等因素同时存在,其恶性室性心律失常发作的风险不仅没有降低,而且还可能升高。
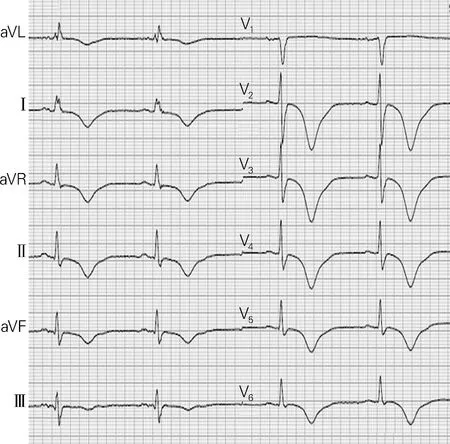
图1 一例典型的交感性T波
2 Takotsubo综合征的发病机制和心电图异常
该临床综合征包括伴有胸痛的一过性可逆性左心室功能障碍,心电图改变和轻度心肌酶升高类似急性心肌梗死。心室造影显示,左心室形状类似烧瓶圆底和窄的瓶颈, 形状很像日本用来捕捉墨鱼的瓶子,因此,历经多种争议后,2015年欧洲心脏病学会(ESC)发表的科学声明建议将其命名为Takotsubo综合征。这一综合征的特点是在生理或心理应激的基础上,心脏出现一定程度的可逆的电生理和机械功能异常[7]。随着诊断病例数的逐步增加,对这一综合征的认识也不断深入,最早报道的病例以心尖部球样扩张为特征,现如今已经认识到这一症候群涵盖了心脏电生理和机械功能异常的多种表现形式。
Takotsubo综合征的表现形式多种多样,但基本具备两大特征:① 存在引起交感张力增大的诱发因素,包括脑出血等颅内疾病,情绪应激等[8];② 心电图出现缓慢演变的ST-T改变,尤其是QT间期延长和Niagara瀑布样T波[9]。有充分证据表明心脏交感神经张力增大是Takotsubo综合征的诱发因素,文献中70%以上的Takotsubo综合征患者存在明确的精神或机体的应激因素。
3 晚钠电流的角色
最新研究发现,介导这种电生理异常的重要环节是心脏ⅠNaL异常增大,及伴随发生的细胞内钙转运调节异常,这种细胞电生理异常可由心脏交感张力增大及心肌缺血缺氧等因素诱发。
ⅠNaL的概念:ⅠNaL是一种电压依赖式钠通道电流,心肌细胞动作电位的0相除极过程是由钠离子顺离子浓度梯度迅速内流形成,绝大多数钠通道的开放持续时间为2~3 ms,此后这些通道迅速失活;但有少数钠通道激活后不完全失活,呈部分开放状态,钠离子通过这些部分开放的通道进入细胞,形成一个很小的内向电流。这种峰钠电流后的持续性内向钠电流称为ⅠNaL。
正常情况下,ⅠNaL在动作电位的复极相出现,幅度较小,持续时间约为10~100 ms,对APD和QT间期影响不大,也不影响细胞的收缩功能。而某些病理情况会引起心肌的INaL增大,导致内向电流增大,APD延长,进而出现早后除极,诱发心律失常[10]。引起 INaL增大的病理学因素包括:① 心肌细胞缺血缺氧时,细胞内持续性钠电流的幅度会增大[11]。② 有4种类型的先天性长QT综合征 (LQTS) 与其相关,包括LQT3、LQT9、LQT10、QT12。③ ⅠNaL与氧自由基:心力衰竭时氧化应激产生的大量自由基不仅可以直接作用于钠通道,导致ⅠNaL增大,而且可以激活CaMK通路。自动钙调蛋白肽2相关性抑制肽可以使钙调蛋白复合物不能与CaMKⅡ的调节结构域结合,从而不能暴露CaMKⅡ上催化结构域的氧化还原与自身磷酸化位点,选择性阻断CaMKⅡ信号通路的开启。心力衰竭时ⅠNaL的增大易化了早后除极和迟后除极的发生,两者均为各种复杂心律失常的触发因素。④ 病理条件下离子通道发生重构。
各种情况诱发的心脏交感张力增大都可能通过上述多种机制,经ⅠNaL介导,从而导致上述心脏电生理和/或机械功能异常。
不仅如此,ⅠNaL增大时,心肌细胞内钠离子浓度升高,细胞膜上的钠钙交换蛋白通过钠钙交换将钠离子转运出细胞,细胞内钙离子持续增加引起钙超载,钙超载进而激活细胞内一系列信号通路,使钠通道失活减慢。这种正反馈机制不仅会导致恶性循环,诱发恶性心律失常,而且会诱发心脏机械功能异常[12-14]。
有学者应用钠通道阻滞剂(美西律)治疗出现交感性T波(部分合并尖端扭转型室性心动过速)的患者,结果证实能有效逆转心电图上QT间期延长及T波倒置,同时减少室性心律失常发作[15-19]。
综上所述,Takotsubo综合征与交感性T波是同一种疾病的不同表现形式:二者都由交感张力增大诱发,由细胞内Ca2+/钙调蛋白依赖性蛋白激酶 Ⅱ 和INaL介导,前者表现为心脏机械功能和电生理状态同时出现异常,而后者主要表现为电生理状态的异常[20-21]。
而交感性T波也是Takotsubo综合征患者的特征性心电图表现。Takotsubo综合征与交感性T波有多重交集,虽然交感张力可能是始动因素,但随着病程进展,潜在的病理生理改变可能是INaL增大这一关键机制所导致的,其有可能同时介导心脏的电生理异常和机械运动异常,所以说交感性T波患者和Takotsubo综合征患者有共同的致病因素,区别仅仅在于是否合并心脏机械运动异常,或者机械运动异常和电生理异常是否严重程度有别。那么,是否可以认为交感性T波和Takotsubo综合征实际上是同一种疾病的不同表现形式?
临床上我们也发现一例符合Takotsubo综合征诊断的患者。该老年患者有明确的应激因素,心电图出现了典型的长QT间期和T波深倒置,符合交感性T波的临床特征,并且住院期间反复发作尖端扭转型室性心动过速。该患者不仅表现为电生理异常,伴随心电图异常,同时出现了二尖瓣反流和左室收缩功能不全。根据上述机制,β受体阻滞剂并不适用于该患者的治疗,我们予以美西律150 mg 每8 h口服一次;第二天开始患者的QT间期逐步缩短,T波倒置的程度逐渐减轻,未再发作尖端扭转型室速(图2)。

A:心电图表现QT间期延长,T波深倒置;B:尖端扭转型室性心动过速;
[1] Y-Hassan S. The pathogenesis of reversible T-wave inversions or large upright peaked T-waves: Sympathetic T-waves[J]. Int J Cardiol,2015,191:237-243.
[2] Byer E, Ashman R, Toth LA.Electrocardiograms with large, upright T waves and long Q-T intervals[J]. Am Heart J,1947,33(6):796-806.
[3] de Zwaan C, Bär FW, Wellens HJ.Characteristic electrocardiographic pattern indicating a critical stenosis high in left anterior descendingcoronary artery in patients dmitted because of impending myocardial infarction[J].Am Heart J, 1982,103(4 Pt 2):730-736.
[4] Danias PG, Katz AM. Images in cardiovascular medicine. Canyon T waves seen as narrowing of anterolateral T-wave inversionsin a patient with recurrent chest pain presumed to be due to anterolateral ischemia[J]. Circulation, 1997,96(1):344.
[5] Sharkey SW, Shear W, Hodges M, et al.Reversible myocardial contraction Abnormalities in patients with an acute noncardiac illness[J]. Chest, 1998 ,114(1):98-105.
[6] Shimizu W. T wave alternans: from cell to clinical[J]. J Cardiovasc Electrophysiol, 2001,12(4):428-430.
[7] Y-Hassan S. Acute cardiac sympathetic disruption in the pathogenesis of the takotsubo syndrome: a systematic reviewof the literature to date[J].Cardiovasc Revasc Med, 2014,15(1):35-42.
[8] Liang CW, Chen R, Macri E,et al. Preadmission beta-blockers are associated with decreased incidence of neurogenic stunned myocardium inaneurysmal subarachnoid hemorrhage[J].J Stroke Cerebrovasc Dis,2013,22(5):601-607.
[9] Prasad A1, Madhavan M, Chareonthaitawee P. Cardiac sympathetic activity in stress-induced (Takotsubo) cardiomyopathy[J]. Nat Rev Cardiol, 2009,6(6):430-434.
[10] Curran J, Brown KH, Santiago DJ, et al. Spontaneous Ca waves in ventricular myocytes from failing hearts depend on Ca2+-calmodulin-dependentprotein kinase Ⅱ[J]. J Mol Cell Cardiol, 2010,49(1):25-32.
[11] Grimm M, Brown JH. Beta-adrenergic receptor signaling in the heart: role of CaMKII[J]. J Mol Cell Cardiol,2010,48(2):322-330.
[12] Wehrens XH, Lehnart SE, Reiken SR, et al. Ca2+/calmodulin-dependent protein kinase ii phosphorylation regulates the cardiac ryanodine receptor [J]. Circ Res, 2004,94(6):e61-70.
[13] Wu L, Ma J, Li H, et al. Late sodium current contributes to the reverse rate-dependent effect of IKr inhibition on ventricularrepolarization[J]. Circulation,2011,123(16):1713-1720.
[14] Zaza A, Rocchetti M. The late Na+current--origin and pathophysiological relevance[J].Cardiovasc Drugs Ther,2013,27(1):61-68.
[15] Gao Y, Xue X, Hu D, et al. Inhibition of late sodium current by mexiletine: a novel pharmotherapeutical approach in timothy syndrome[J].Circ Arrhythm Electrophysiol,2013,6(3):614-622.
[16] Shenasa M, Assadi H, Heidary S, et al. Ranolazine: Electrophysiologic Effect, Efficacy, and Safety in Patients with Cardiac Arrhythmias[J]. Card Electrophysiol Clin,2016 8(2):467-479.
[17] Jacobshagen C.Late sodium current and calcium overload--pathogenesis and adequate treatment[J].Dtsch Med Wochenschr,2013,138(16):842-847.
[18] Pieske B, Maier LS, Bers DM, et al. Ca2+handling and sarcoplasmic reticulum Ca2+content in isolated failing and nonfailing humanmyocardium[J]. Circ Res,1999,85(1):38-46.
[19] Badri M, Patel A.Mexiletine prevents recurrent torsades de pointes in acquired long QT syndrome refractory to conventional measures[J].JACC Clin Electrophysiol,2015,5: 315-322.
[20] Schwartz PJ, Malliani A. Electrical alternation of the T-wave: clinical and experimental evidence of its relationship with the sympathetic nervous system and with the long Q-T syndrome[J]. Am Heart J,1975,89(1):45-50.
[21] Terentyev D, Viatchenko-Karpinski S, Valdivia HH, et al. Luminal Ca2+controls termination and refractory behavior of Ca2+-induced Ca2+release in cardiacmyocytes[J]. Circ Res,2002,91(5):414-420.
(本文编辑:郭欣)
The appearance of late sodium current: from sympathetic T wave to Takotsubo syndrome
JiaZhong-wei
Department of Cardiology, PLA No.254 Hospital, Tianjin 300142, China)
Sympathetic T wave is a kind of cardiac electrophysiological abnormality related to sympathetic stress. Besides cardiac electrophysiological abnormalities, Takotsubo syndrome includes cardiac mechanical dysfunction. They share the same pathogenesis including sympathetic excitation, late sodium current(ⅠNaL) and electrophysiological abnormalities of myocardial cell mediated by calmodulin, etc. However, they may be different clinical manifestations of the same disease.
sympathetic T wave; Takotsubo syndrome; late sodium current
300142 天津,解放军第二五四医院心内科
贾忠伟,副主任医师,主要从事冠心病介入治疗和心律失常的射频消融及起搏治疗,E-mail:13302002680@189.cn
R540.41
A
2095-9354(2016)06-0389-04
10.13308/j.issn.2095-9354.2016.06.002
2016-09-12)
