食源性血管紧张素转化酶抑制肽的研究进展
2017-01-04张东京高贵珍张兴桃鲍妮娜
张东京,高贵珍,张兴桃,鲍妮娜
(宿州学院,安徽 宿州 234000)
食源性血管紧张素转化酶抑制肽的研究进展
张东京,高贵珍,张兴桃,鲍妮娜
(宿州学院,安徽 宿州 234000)
血管紧张素转化酶(ACE)对于人体血压的调节起着十分重要的作用,食源性ACE抑制肽由蛋白质水解得到,其安全性比较高、无毒副影响,且易吸收、成本低,具有化学合成药物不可比拟的优越性,引起相关专家的重视。本文详尽阐述了食源性ACE抑制肽的降压机制、研究现状及其应用前景。
高血压;ACE;ACE抑制肽;食源性蛋白
0 引言
高血压是严重影响人类健康的疾病之一,世界卫生组织将其列为导致人类死亡的主要疾病之一,高血压相关疾病导致全球每年750万人死亡(占所有死亡的13%)[1]。伴随着科技的进步和人们生活水平的提高,现代人类的膳食习惯已经发生本质的变化,由于现代膳食结构中含有高脂肪和高热量,计算机智能科技的快速发展方便我们生活的同时大大减少了我们的运动,心脑血管疾病人数逐年升高,高血压已经成为困扰人类健康的重要因素。由于药物治疗存在一定的副作用,因此摄入天然食物中具有降血压作用的功能因子将成为高血压非药物治疗的重要组成部分。食源性血管紧张素转化酶抑制肽(Angiotensin Converting Enzyme Inhibitory Peptides,ACEIP)由蛋白质分解得到,其安全性能高、无毒副作用,对高血压患者来说,有降压的效果,而对血压正常者没有副作用,具有化学合成药物不可比拟的优越性[2],为解决高血压疾病开辟了又一条新途径。
1 ACE抑制肽的作用机制
如图1,肾素-血管紧张素系统(Renin-Angiotensin System,RAS)和激肽-激肽释放酶系统(Kallikrein—kinin system,KKS)主要控制和平衡人体血压,尤其是血管紧张素转化酶(ACE)的作用,可同时作用于血管紧张素Ⅰ(Asp-Arg-Val-Tyr-Ile-His-Leu-Val-Ile-His,十肽)和舒缓激肽(Bradykinin,BK,九肽)。ACE可把无活性形式的血管紧张素Ⅰ水解生成有活性的血管紧张素Ⅱ(Asp-Arg-Val-Tyr-Ile-His-Pro-Phe,八肽),血管紧张素Ⅱ可加强心肌的伸展力,并使血管平滑肌伸展。在KKS体系中,ACE钝化使血管伸展,机体血压升高[3]。ACE抑制肽对ACE的亲和力比血管紧张素Ⅰ或舒缓激肽要强,这样会影响ACE催化血管紧张素Ⅰ,使其不能分解成为血管紧张素Ⅱ,以及促进舒缓激肽变化为失活的小肽,降低血压。
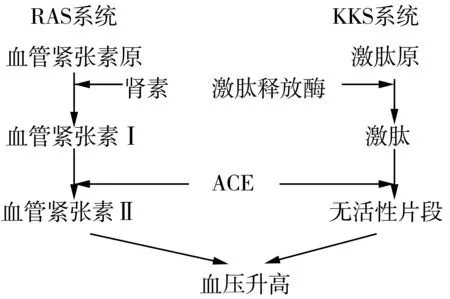
图1 ACE对血压调节作用机理
2 国内外蛋白类食物中ACE抑制肽的研究现状
目前已有科研人员从乳类蛋白、植物类蛋白及海洋生物蛋白等多种食物蛋白中提取出了ACE抑制肽。
2.1 乳源ACE抑制肽
乳制品中的蛋白是其他蛋白营养所不能比拟的,其营养价值高。据报道,乳及乳制品一方面为消费者提供重要的营养成分,另一方面还是多种功能性活性肽的主要来源材料。
2.1.1 乳酪蛋白源ACE抑制肽
牛乳中的蛋白质含有酪蛋白和乳清蛋白两种,但是主要成分是酪蛋白,占牛乳蛋白的80%[4],其结构分散程度大,许多结构都暴露在外面,这样多种蛋白酶就会分解这些蛋白质形成功能性生物活性多肽,这也是科研人员比较关注的一类蛋白质。从酪蛋白中分解制备ACE抑制肽的方法很多,比较关注的还是通过各种酶对酪蛋白进行水解获得ACE抑制肽,除此之外也有发酵酪蛋白分解ACE抑制肽。杨铭等[5]采用胃蛋白酶、胰蛋白酶模拟人体消化系统,酶解酪蛋白制备ACE抑制肽,其水解液的IC50为560 μg/mL。王桂春[6]将酪蛋白经胃蛋白酶酶解后再经胰蛋白酶和胰凝乳蛋白酶酶解,其酶解后的肽具有高ACE抑制活性;后续利用大孔吸附树脂、葡聚糖凝胶层析对酶解产物初步处理,吸附分离,并通过两步半制备反相高效液相色谱法对生物活性肽进行了分离纯化。M Miguel等[7]使用胃蛋白酶酶解酪蛋白,并测定了酶解活性肽对原发性高血压大鼠(SHR)血压的功效。结果表明,酶解肽具有较强的ACE抑制活性。Aline Holder等[8]酶解胶束酪蛋白、β-酪蛋白制备ACE抑制肽,酶解肽经纯化后其抑制作用增大,IC50分别为109 μg/mL、98 μg/mL。Rebeca Rojas-Ronquillo等[9]使用乳酸菌(Lactobacillus casei Shirota)和嗜热链球菌分别发酵酪蛋白,均得到ACE抑制肽。
2.1.2 乳清蛋白源ACE抑制肽
乳清蛋白占乳总蛋白质的17%~20%,属于全价蛋白质,被称为“蛋白质之王”。陈耿华等[10]采用中空纤维膜酶膜反应器提取分离乳清蛋白ACE抑制肽,经测定酶解产物的ACE抑制率为30%~50%,酶解物的活性、稳定性较好。李朝慧等[11]采用多种蛋白酶酶解乳清蛋白制备ACE抑制肽,其中碱性蛋白酶酶解物的ACE抑制率最大,并确定了其最优的酶解条件为:酶解温度50℃、酶解物浓度为0.05 kg/L、酶与原料的质量比5.5%、酶解时间6 h。田俊英等[12]采用胰蛋白酶酶解乳清蛋白,分析最佳水平为pH7.50、酶解温度45.0℃、酶与原料质量比0.059(即E/S=1:16.92)、底物浓度6%、酶解时间150 min,在最优酶解水平下酶解8 h可以提取高ACE抑制率的酶解物,其抑制作用率可达61.23%,酶解物依次经过超滤和葡聚糖凝胶 SephadexG-25、SephadexG-10层析后制得多肽组分,其ACE抑制率为75.95%。郭宇星等[13]选用瑞士乳杆菌(Lactobacillus helveticus)为作用菌株,探讨了其酶解乳清蛋白的效果以及发酵产物ACE抑制活性。结果表明,瑞士乳杆菌对数生长期时提取发酵物最好,16 h提取时ACE抑制率高达44.17%,活菌数为107CFU/mL。用10000D分子量膜分离发酵产品,其ACE抑制活性与未用该分子膜作用前相比提高了2.5倍,IC50达到19.63 μg/mL。结果表明喷雾干燥和冷冻干燥对ACE抑制活性没有明显的作用,采用冷冻干燥产率往往较高,可达到106.08 g/L,且IC50为50.28 μg/mL。T.G.Tavares等[14]水解乳清蛋白,水解度为18%,IC50为105.4 μg/mL,经分离分子量小于3KDa的部分IC50为25.6 μg/mL。Tania Tavares等[15]使用蛋白酶水解乳清蛋白,水解物IC50为52.9±2.9 g/mL,其中分子量低于3KDa的部分IC50为23.6±1.1 g/mL,然后将其经反相高效液相得到六种具有ACE抑制活性的组分。
2.1.3 发酵乳源ACE抑制肽
二十世纪九十年代第一次探究了从发酵乳中分离、提纯和鉴定ACE抑制肽,此后从发酵乳制品中提取制备ACE抑制肽的研究就不断出现。姜晔[16]使用瑞士乳杆菌(1004、15019)、嗜热链球菌(13957)三种菌联合发酵10%脱脂乳,并测定其对原发性高血压大鼠(SHR)血压的影响。结果表明,大鼠经灌胃后血压会有明显的降低,约在4-10h达到最低点,与单一菌株发酵得到的发酵乳相比,其降血压影响更为显著。王朝霞等[17]证实了传统的酸马奶中富含ACE抑制成分,为酸马奶的降血压影响和后续的研究开发做了一定的铺垫。姜瞻梅等[18]探讨了促进发酵乳中ACE抑制肽生成的外在影响水平。结果表明,菌株发酵凝乳(pH4.7-5.0)后,产生的肽含量迅速增加,ACE抑制活性大幅度升高,证实肽的提取率与ACE抑制活性呈正比例关系。与在42℃发酵水平相比较,37℃的发酵水平下发酵乳ACE抑制肽的产率会明显增加;与4℃水平下冷藏比较,37℃恒温对活化ACE抑制活性和肽产率影响死极显著(P<0.01)。Fatemeh Nejati等[19]使用乳酸链球菌DIBCA2制得的发酵乳IC50为5±2 μg/mL,与植物乳杆菌PU11共同发酵得到的发酵乳IC50为0.70±0.07 mg/mL,且γ-氨基丁酸(γ-amino butyric acid)的含量达到144.5 mg/kg。Jeanette Otte等[20]分别使用乳酸链球菌及瑞士乳杆菌单菌发酵牛乳,测定其ACE抑制活性。结果表明,发酵温度对其活性有明显的影响,菌株生长速率最快时其活性最高。Maryam Moslehishad等[21]使用鼠李糖乳杆菌PTCC 1637发酵牛乳和骆驼乳,经21天冷藏,发酵骆驼乳的ACE抑制活性和抗氧化性比发酵牛乳要高。
2.1.4 干酪中的ACE抑制肽
干酪后期的贮藏中,酪蛋白被蛋白酶分解为大肽,再由肽酶的作用,使其分解为小肽和一些人体所需要的氨基酸。王洁等人将瑞士乳杆菌处理硬质干酪[22]、高达干酪[23]中,并对后期贮藏过程中干酪的生物活性肽进行了抗ACE活性的体外实验。证实了含瑞士乳杆菌的干酪其ACE抑制活性比对照组高,其活性和后期贮藏时间有一定的相关性。Wei Wu等[24]研究证明碱和热处理牛乳干酪后,结果表明会影响牛乳干酪中ACE抑制肽的活性。J Meyer等[25]证实了七种瑞士干酪(Swiss cheese)成熟过程中ACE抑制活性与短肽缬氨酸-脯氨酸-脯氨酸(Val-Pro-Pro,VPP)、亮氨酸-脯氨酸-脯氨酸(Ile-Pro-Pro,IPP)的提取率呈现很好的一致性,随着后期贮藏时间的延长,多数其品种ACE抑制活性和VPP、IPP的含量会逐渐升高,但是Tilsiter和Gruyère干酪在贮藏后期ACE抑制活性和VPP、IPP含量会逐渐降低。Stephanie Rae Pritchard等[26]研究证明了三种澳大利亚切达干酪中的肽均有抑菌、抗氧化性和抗高血压活性。
2.2 源于植物中的ACE抑制肽
从植物中分离的ACE抑制肽成本低,且分离和纯化较为方便 。赵元晖等[27]对海地瓜蛋白酶解后进行提取纯化,提取出一些高活性的ACE抑制肽,其氨基酸序列为MEGAQEAQGD,IC50值为15.9 μmol/L。朱振宝等[28]采用中性蛋白酶0.8L酶解核桃分离蛋白的实验进行了研究,在优化后得出了最佳酶解水平为:酶解温度55 ℃,pH 6.81,E/S 3.43%,底物浓度2%,酶解2 h,验证试验表明,在此条件下的最大DH为8.52%,最大ACE抑制率为67.94%。FengJun Wang等[29]选取膜过滤、葡萄糖凝胶层析法、反相高效液相色谱法从核桃中提取优化ACE抑制肽,经过消化试验后,IC50值分别是0.136μM/mL和0.173μM/mL,实验数据显示ACE抑制肽在消化过程中是相对稳定的。侯雅坤[30]利用蛋白酶、木瓜蛋白酶、胃蛋白酶对核桃粕中的核桃蛋白酶解,研究了酶解液的生物活性,之后采用超滤、凝胶层析提取优化获取了ACE抑制肽。王硕[31]采用胃蛋白酶水解甘薯蛋白制备ACE抑制肽,经动物实验证实纯化的甘薯肽有降血压功能和作用,进而为探究新型的功能食品提供了一定的条件和基础。罗贤慧等[32]采用碱性蛋白酶2.4L酶解豆粕物质,确定了ACE抑制肽的最佳提取水平为:底物浓度4%、酶活力1500 U/g、pH值8.5、温度50℃,此时ACE抑制活性达到78.85%。并证实1%的β-环糊精(β-CD)对豆粕物酶解液有一定的脱苦和最大保留其ACE抑制活性的效果。Bahareh Sarmadi等[33]以可可粉为原料,去除脂肪、生物碱、多酚后,将其水解,水解物具有ACE抑制活性。V.K.Jimsheena等[34]分别采用胃蛋白酶、胰蛋白酶、胰凝乳蛋白酶、胰酶水解花生,其中结果表明胃蛋白酶提取的产物ACE抑制活性最大,经纯化后,五肽NAQRP的ACE抑制活性最大,其IC50为32±2 μmol/L。
此外,还有以小麦胚芽蛋白[35]、鹰嘴豆[36]、杏仁粕[37]、脱酚棉籽蛋白[38]、油茶粕蛋白[39]、燕麦蛋白[40]、碎米蛋白[41]等为原料,制备ACE抑制肽。
2.3 海洋生物中的ACE抑制肽
随着社会的发展和人们对高水平生活的追求,大海中很多生物受到了人们越来越多的关注,许多ACE抑制肽也逐渐在海洋类生物中分离提取。周贺霞等[42]以巴沙鱼皮为研究对象,探讨酶法提取鱼皮胶原ACE抑制肽的实验。数据表明,组合蛋白酶提取高ACE抑制活性的鱼皮胶原肽效果最佳。林琳[43]以鱿鱼皮、鳕鱼皮和鲤鱼皮为原料,探究酶解提取ACE抑制肽的最优水平为:酶与底物比为2%、pH为2.0、水解温度为45℃、水解时间5h。且采取胃蛋白酶和碱性蛋白酶复合酶进行提取得到的ACE抑制活性高于单酶提取得到。产物经膜过滤提取,分子量小于2KDa(UF-2)和分子量2~6 KDa(UC-2)物质对ACE的抑制率都很高,IC50可以达到0.71 mg/mL和0.79 mg/mL,较未经超滤处理的水解原液来说IC50有显著降低。苑园园[44]以牡蛎为原料,得到了ACE抑制肽。Masomeh Ghassem等[45]分别采用K蛋白酶和嗜热菌蛋白酶处理鲤鱼肌纤维蛋白提取ACE抑制肽,其中嗜热菌蛋白酶水解得到的水解产物ACE抑制作用最大,其IC50为0.033 mg/mL。
2.4 源于其他动物蛋白的ACE抑制肽
于志鹏[46]以蛋清蛋白为研究对象,优化了提取蛋清源ACE抑制肽的最佳条件,采取凝胶色谱法组合四极杆线性离子阱串联质(QTRAP)谱研究了蛋清源ACE抑制肽初级构造为RVPSLM,TPSPR,DLQGK,AGLAPY,RVPSL,DHPFLF,HAEIN和QIGLF,并获得了高活性肽序列。Roberta Di Bernardini等[47]使用木瓜蛋白酶水解牛胸肌分离的牛肌浆蛋白,粗提液具有一定的活性。此外,还有以蚕蛹蛋白[48]、猪骨[49]、鸭骨[50]、鸡骨[51]、发酵醍鱼酱[52]为原料,制备ACE抑制肽。综上所述,ACE抑制肽食物中广泛存在,主要研究酶解和水解食物中的ACE抑制肽的粗提液经过分离纯化后,研究其得率、分子量、结构式和ACE抑制肽的体内外活性。但是由于其分子量比较大,水溶性差,可以通过对其提取物进行分子改性或分子包埋使其溶解性增大,有助于增加人体对ACE抑制肽的吸收率,促进开发吸收率高ACE抑制肽的降血压食品提供一定的基础。
3 ACE抑制肽的前景与展望
高血压是威胁人类健康的主要疾病之一,引起了人们的高度关注,发达地区和欠发达地区,高血压疾病的发病率大幅度升高。随着社会的发展和高水平生活的追求,人们的安全概念逐渐增强,食源性ACE抑制肽安全性很高,对人体无副作用,此类降血压肽更容易被人们所采纳,因为其具有降血压的功能性,可将其应用到乳制品和面制品等食品中,而ACE抑制肽来源广泛,我国有很多的动植物种类及加工工业中产生的废弃物料均可作为其原料来源,因而ACE抑制肽在我国具有显著的社会效益和经济效益,具有巨大的潜在市场和商机。
[1] Ezzati M,Lopez AD,Rodgers A,et al.Selected major risk factors and global and regional burden of disease[J].Lancet,2002,360(9343):1347-1360.
[2] Phelan M,Kerins D.The potential role of milk-derived peptides in cardiovascular disease[J].Food Funct,2011,2(2):153-167.
[3] FitzGerald RJ,Meisel H.Milk protein-derived peptide inhibitors of angiotensin-I-converting enzyme[J].British Journal of Nutrition,2000,84 Suppl 1(1):S33-S37.
[4] 张军龙.牛奶中酪蛋白结果分析[J].基层医学论坛,2011(16):494-496.
[5] 杨铭,胡志和.酪蛋白双酶水解物ACE抑制肽的分离纯化[J].食品科学,2012(9):50-53.
[6] 王桂春.酪蛋白ACE抑制肽的制备及分离[D].江苏省:江南大学,2012.
[7] Miguel M,Contreras MM,Recio I,et al.ACE-inhibitory and antihypertensive properties of a bovine casein hydrolysate[J].Food Chemistry,2009,112(1):211-214.
[8] HolderA,BirkeA,EiseleT,et al.Selective isolation of angiotensin-I-converting enzyme-inhibitory peptides from micellar casein and β-casein hydrolysates via ultrafiltration[J].International Dairy Journal,2013,31(1):217-235.
[9] Rojas-Ronquillo R,Cruz-Guerrero A,Flores-Nájera A,et al.Antithrombotic and angiotensin-converting enzyme inhibitory properties of peptides released from bovine casein by Lactobacillus casei Shirota[J].International Dairy Journal,2012,26(2):147-154.
[10] 陈耿华,王磊,王强,等.用于连续制备乳清蛋白ACE抑制肽的酶膜反应器运行条件优化[J].农产品加工,2011(9):4-7.
[11] 李朝慧,罗永康,王全宇.乳清蛋白酶解制备ACE抑制肽的研究[J].中国乳品工业,2005(2):8-11.
[12] 田俊英,潘道东.水解乳清蛋白制备ACE抑制肽的工艺研究[J].食品科学,2009(24):152-157.
[13] 郭宇星,陈庆森,赵林森,等.瑞士乳杆菌发酵法制备乳清蛋白源性ACE抑制肽的研究[J].食品科学,2006(6):151-154.
[14] Tavares TG,Contreras MM,Amorim M,et al,Optimisation,by response surface methodology,of degree of hydrolysis and antioxidant and ACE-inhibitory activities of whey protein hydrolysates obtained with cardoon extract[J].International Dairy Journal,2012,21(12):926-933.
[15] Tavares T,Contreras MDM,Amorim M,et al,Novel whey-derived peptides with inhibitory effect against angiotensin-converting enzyme:In vitro effect and stability to gastrointestinal enzymes[J].Peptides,2011,32(5):1013-1019.
[16] 姜晔.发酵乳抗高血压特性的研究[J].江苏农业科学,2011(6):513-515.
[17] 王朝霞,陈永福,刘洋,等.传统发酵酸马奶中ACE抑制成分的分离[J].中国乳品工业,2010(7):4-6.
[18] 姜瞻梅,吴刚,霍贵成,等.发酵乳中ACE抑制肽生成的外部因素条件的研究[J].食品工业科技,2011(4).
[19] Nejati F,Rizzello CG,Cagno RD, et al.Manufacture of a functional fermented milk enriched of Angiotensin-I Converting Enzyme (ACE)-inhibitory peptides and γ-amino butyric acid (GABA)[J].LWT - Food Science and Technology,2013,51(1):183-189.
[20] Otte J, Lenhard T,Flambard B,et al.Influence of fermentation temperature and autolysis on ACE-inhibitory activity and peptide profiles of milk fermented by selected strains of Lactobacillus helveticus and Lactococcus lactis[J].International Dairy Journal,2011,21(4):229-238.
[21] Moslehishad M,Ehsani MR,Salami M,et al.The comparative assessment of ACE-inhibitory and antioxidant activities of peptide fractions obtained from fermented camel and bovine milk by Lactobacillus rhamnosus PTCC 1637[J].International Dairy Journal,2013,29(2):82-87.
[22] 王洁.硬质干酪加工工艺及其生物活性肽的研究[D].天津:天津科技大学食品科学,2006.
[23] 谭丽丽.瑞士乳杆菌KLDS 1.0432对高达干酪理化及微生物性质影响的研究[D].哈尔滨:东北农业大学食品科学,2008.
[24] Wei WU,Pan-pan YU,Feng-yang ZHANG,et al.Stability and cytotoxicity of angiotensin-I-converting enzyme inhibitory peptides derived from bovine casein[J].Journal of Zhejiang University-SCIENCE B,2014,15(2):143-152.
[25] Meyer J,Butikofer U,Walther B,et al.Hot topic:Changes in angiotensin-converting enzyme inhibition and concentrations of the tripeptides Val-Pro-Pro and Ile-Pro-Pro during ripening of different Swiss cheese varieties[J].J.Dairy.Sci,2009,92(3):826-836.
[26] Pritchard SR,Phillips M,Kailasapathy K.Identification of bioactive peptides in commercial Cheddar cheese[J].Food Research International,2010,43(5):1545-1548.
[27] 赵元晖,李八方,马敬军,等.海地瓜蛋白水解物中ACE抑制肽的分离纯化及合成[J].高等学校化学学报,2012(2):308-312.
[28] 朱振宝,周慧江,易建华,等.响应面法优化核桃ACE抑制肽的制备工艺研究[J].陕西科技大学学报(自然科学版),2012(5):67-72.
[29] FengJun Wang,XiaoYan Yin,Joe.M. Regenstein,et al.Separation and purification of angiotensinIconverting enzyme(ACE) inhibitory peptides from walnuts (Juglans regia L.) meal[J].Eur Food Res Technol,,2015,96 (14):1624-1629.
[30] 侯雅坤.核桃活性肽体外抗氧化活性及ACE抑制活性的研究[D].北京:北京林业大学农产品加工及贮藏工程,2012.
[31] 王硕.甘薯ACE抑制肽的制备及其降血压活性研究[D].北京:中国农业科学院食品科学,2011.
[32] 罗贤慧,李理.高温豆粕肽粉的苦味及ACE抑制活性研究[J].中国酿造,2012(10):120-123.
[33] Sarmadi B,Ismail A,Hamid M.Antioxidant and angiotensin converting enzyme (ACE) inhibitory activities of cocoa (Theobroma cacao L.) autolysates[J].Food Research International,2011,44(1):290-296.
[34] Jimsheena VK,Gowda LR.Angiotensin I-converting enzyme (ACE) inhibitory peptides derived from arachin by simulated gastric digestion[J].Food Chemistry,2011,125(2):561-569.
[35] Qu W,Ma H,Jia J,et al.Enzymolysis kinetics and activities of ACE inhibitory peptides from wheat germ protein prepared with SFP ultrasound-assisted processing[J].Ultrasonics Sonochemistry,2012,19(5):1021-1026.
[36] Chang Y,Alli I.In silico assessment:Suggested homology of chickpea (Cicer arietinum L.) legumin and prediction of ACE-inhibitory peptides from chickpea proteins using BLAST and BIOPEP analyses[J].Food Research International,2012,49(1):477-486.
[37] 王春艳.杏仁短肽制备及其降血压活性研究[D].北京:中国农业科学院农产品质量与食物安全,2011.
[38] 常通.棉籽蛋白发酵制备ACE抑制肽[D].南昌:南昌大学营养与食品卫生学,2011.
[39] 龚吉军.油茶粕多肽的制备及其生物活性研究[D].长沙:中南林业科技大学林产化学加工工程,2011.
[40] 韩扬.超声辅助酶法制备燕麦ACE抑制肽的研究[D].北京: 北京工商大学生物化工, 2010.
[41] 蒋艳,王泽南,王博,等.碎米蛋白ACE抑制肽制备工艺的研究[J].食品科技,2012(5):129-132.
[42] 周贺霞,马良,张宇昊.酶法生产鱼皮胶原蛋白ACE抑制肽的研究[A].见:管产学研助推食品安全重庆高峰论坛—2011年中国农业工程学会农产品加工及贮藏工程分会学术年会暨全国食品科学与工程博士生学术论坛,中国重庆[C].国务院学位委员会办公室教育部学位管理与研究生教育司、中国农业工程学会农产品加工及贮藏工程分会、西南大学研究生部.
[43] 林琳.鱼皮胶原蛋白的制备及胶原蛋白多肽活性的研究[D].青岛:中国海洋大学水产品加工与贮藏工程,2006.
[44] 苑园园.酶法水解牡蛎制备血管紧张素转换酶抑制肽的研究[D].河北农业大学农产品加工及贮藏工程,2012.
[45] Ghassem M,Arihara K,Babji AS,et al.Purification and identification of ACE inhibitory peptides from Haruan (Channa striatus) myofibrillar protein hydrolysate using HPLC-ESI-TOF MS/MS[J].Food Chemistry,2011,129(4):1770-1777.
[46] 于志鹏.蛋清源ACE抑制肽的结构鉴定及稳定性研究[D].长春:吉林大学食品科学,2011.
[47] Di Bernardini R,Mullen AM,Bolton D,et al.Assessment of the angiotensin-I-converting enzyme (ACE-I) inhibitory and antioxidant activities of hydrolysates of bovine brisket sarcoplasmic proteins produced by papain and characterisation of associated bioactive peptidic fractions[J].Meat Science,2012,90(1):226-235.
[48] 徐金玲.蚕蛹蛋白ACE抑制肽的制备及其理化性质研究[D].镇江市:江苏科技大学生物化学与分子生物学,2011.
[49] 魏庭浩.猪骨胶原多肽的制备及其血管紧张素转换酶抑制活性的研究[D].雅安:四川农业大学食品科学,2010.
[50] 张小丽.酶解鸭骨蛋白制备ACE抑制肽的研究[D].四川农业大学食品科学,2011.
[51] 王玉霞.鸡骨肽制备及其ACE抑制活性研究[D].中国农业科学院农产品加工及贮藏工程,2011.
[52] Hyun-Jin Kim,Seong-Gook Kang,Lily Jaiswal,et al.Identification of four new angiotensin I-converting enzyme inhibitory peptides from fermented anchovy sauce[J].Appl Biol Chem,2016,59(1):25-31.
[责任编辑:崔海瑛]
张东京(1987-),男,河南商丘人,助教,主要从事农产品深加工与保鲜。
安徽省教育厅自然科学基金资助项(KJ2013A242);宿州学院平台项目(2015ykf01)。
Q51
A
2095-0063(2016)06-0069-05
2016-05-25
DOI 10.13356/j.cnki.jdnu.2095-0063.2016.06.015
