国外腹腔镜手术治疗直肠癌的现状及研究进展*
2017-01-04曾焕虹综述审校
曾焕虹 综述 付 卫 审校
(北京大学第三医院普外科,北京 100083)
·文献综述·
国外腹腔镜手术治疗直肠癌的现状及研究进展*
曾焕虹 综述 付 卫**审校
(北京大学第三医院普外科,北京 100083)
结直肠癌是最常见的恶性肿瘤之一,目前,手术治疗是根治结直肠癌的主要手段。虽然腹腔镜结肠癌手术已被广泛接受,但腹腔镜直肠癌手术仍处于临床研究阶段。目前,多项研究显示腹腔镜直肠癌手术的近、远期结果与开腹手术相比无统计学差异,但也有文献报道腹腔镜直肠癌手术的病理学结果及完全切除率并不理想。腹腔镜直肠癌手术仍需要更多的Ⅰ级证据予以支持。同时,人们也在探索更多的手术方式和途径治疗直肠癌。
直肠癌; 腹腔镜
结直肠癌是最常见的恶性肿瘤之一[1~3],手术是根治结直肠癌的主要手段。1990年Jacobs等[4]首次报道腹腔镜下乙状结肠癌切除术,1992年Kokerling等[5]首次成功完成腹腔镜下直肠癌Miles手术,经过二十余年的时间,腹腔镜结直肠癌手术得到迅速发展。目前,腹腔镜结肠癌手术已被证实安全可行,远期疗效与开腹手术相当。但由于腹腔镜直肠癌手术需在狭窄的骨盆中进行分离、横断和吻合等操作,较腹腔镜结肠癌手术困难,且关于腹腔镜直肠癌手术的随机对照研究(randomized controlled trial,RCT)结果仍存在一定的争议。2016年美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)指南提出腹腔镜直肠癌手术需要遵循以下几条原则:①需要由具有微创全直肠系膜切除术(total mesorectal excision,TME)经验的外科医生来完成;②不推荐对存在环周切缘(circumferential resection margin,CRM)阳性可能的局部进展期肿瘤施行腹腔镜手术;③不推荐对肿瘤所致急性肠梗阻或穿孔施行腹腔镜手术;④术中应进行细致的腹腔探查[6]。1993年陆少美等[7]报道国内首例腹腔镜直肠癌腹会阴联合切除术。20余年来,国内腹腔镜直肠癌手术蓬勃发展,不少中心对其做了各方面的研究,但主要为回顾性分析,缺乏大样本多中心的前瞻性随机对照研究(randomized controlled trial,RCT),尤其关于长期随访结果的报道。本文对国外腹腔镜直肠癌切除术的近、远期疗效进行文献综述。
1 腹腔镜直肠癌手术围术期和病理学结果
1.1 手术时间和术中出血量
多数RCT结果显示腹腔镜直肠癌切除术的手术时间长于开腹手术,但术中出血量明显少于开腹手术[8~16]。腹腔镜直肠癌手术时间138~266 min,较开腹手术长20~59 min (表1)。腹腔镜直肠癌术中出血量100~321 ml,较开腹手术少17~234 ml[8~12,14~16]。虽然腔镜技术放大了视野,使腹腔内的解剖层次更加清晰,但是术者不能直接接触到腹腔内组织,这就要求手术全程必须有一个清晰、干净的视野。因此,术者在腹腔镜手术过程中都尽可能小心地控制出血,可能是导致腹腔镜手术时间长的原因之一。
1.2 中转开腹率
腹腔镜直肠癌术中转开腹率0.6%~34%[8~17](表1)。常见的中转开腹原因有术中出现难以控制的出血、腹腔内粘连严重、肿瘤侵犯周围组织、肥胖等。从目前的文献报道来看,多中心试验的中转开腹率普遍较高,可能与不同中心术者的腹腔镜手术水平参差不齐有关。英国MRC CLASICC试验[17]结果显示腹腔镜直肠癌手术中转开腹率高达34%,但整体腹腔镜手术的中转开腹率呈现逐年下降的趋势(1996年为38%,2002年16%),考虑这一现象的出现与术者经验逐年增加有关。欧洲COLORⅡ试验[14]的中转开腹率为16%,低于CLASICC试验报告的结果。COLORⅡ试验要求术者在进入试验前必须提供自己的腹腔镜直肠癌手术操作视频,接受评估合格后才能参与该试验研究,这一方法有效的控制了因为术者技术不同而导致的试验结果偏差。韩国COREAN试验[12]在3个大规模的直肠癌治疗中心进行RCT,同样利用手术视频事先对术者的手术水平进行质控,最终研究结果显示该试验的中转开腹率仅为1.2%。可见,通过对术者的手术水平进行质控,在大规模、治疗经验丰富的试验中心进行试验,可以有效地降低中转开腹率。
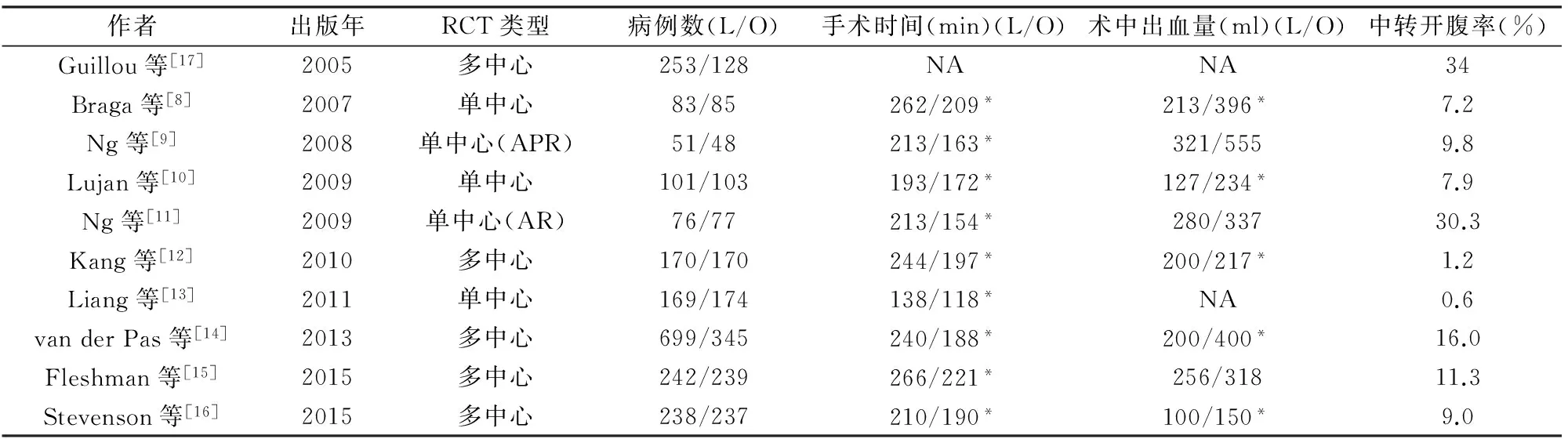
表1 RCT的手术基本情况
*差异有统计学意义。RCT(randomized controlled trial):随机对照研究;L:腔镜镜,O:开腹;APR(abdominoperineal resection):腹会阴联合切除术;AR(anterior resection):前切除术;NA(not available):文中未提及
1.3 围术期病死率和并发症情况
不同文献报道的腹腔镜直肠癌手术围术期病死率和术后并发症发生率差异较大,范围分别为0~2.6%和11.2%~53.8%[8-17](表2)。多数的RCT结果显示围术期病死率和术后并发症发生率在2组之间差异无统计意义。Vennix等[18]对腹腔镜和开腹TME的meta分析结果显示,2组术后30 d病死率(OR=0.81,95%CI:0.50~1.32,P=0.40)和并发症发生率(OR=0.94,95%CI:0.80~1.10,P=0.46)无统计学差异。Jiang等[19]的meta分析结果显示,腹腔镜直肠癌手术的术后并发症发生率低于开腹手术(OR=0.72,95%CI:0.59~0.89,P=0.002),且差异具有统计学意义。将纳入的文献分为RCT组和非RCT组,分别进行meta分析,仍然得到相同的结果。目前这些研究结果表明腹腔镜直肠癌手术是安全、可行的。
由于直肠解剖的复杂性和生理功能的特殊性,直肠癌术式相对较多,但都在前切除术(anterior resection,AR)和腹会阴联合切除术(abdominoperi-neal resection,APR)的基础上提出。AR最主要的围术期并发症为吻合口相关并发症,尤其是吻合口漏。腹腔镜直肠癌前切除术(laparoscopic anterior resection,LAR)的吻合口漏发生率为1%~13%[8,10~17]。Vennix等[18]的meta分析结果显示腹腔镜手术与开腹手术的吻合口漏发生率无统计学差异(7.7% vs. 6.3%,OR=1.01,95%CI:0.73~1.40,P=0.94)。APR最常见的围术期并发症为会阴区切口感染。Ahmad等[20]对腹腔镜直肠癌腹会阴联合切除术(laparoscopic abdominoperineal resection,LAPR)和开腹直肠癌腹会阴联合直肠癌切除术(open abdominoperineal resection,OAPR)的meta分析结果显示,在RCT(P=0.691)、非RCT(P=0.176)和全部对照试验(P=0.556)中,LAPR和OAPR的会阴区相关并发症发生率无统计学差异。Wang等[21]关于APR的病例对照研究结果显示LAPR组术后会阴区切口感染发生率与OLPR相似。
1.4 术后住院时间
目前,文献报道的结果显示腹腔镜直肠癌术后住院时间为8~13.6 d,较开腹手术缩短1~3.6 d[8~12,14,17](表2)。可能是由于腹腔镜术后患者疼痛轻,可以耐受早期下地活动,从而促进胃肠道蠕动,达到尽早通气,提前恢复饮食。

表2 RCT围术期死亡率、术后并发症情况
*差异有统计学意义;a主要并发症发生率。RCT(randomized controlled trial):随机对照研究;L:腔镜镜,O:开腹;APR(abdominoperineal resection):腹会阴联合切除术;AR(anterior resection):前切除术;NA(not available):文中未提及
1.5 CRM和淋巴结清扫数目
CRM和淋巴结清扫数目是评价直肠癌手术是否达到肿瘤学切除的指标之一,同时也是预测复发和存活的重要因素。因此,绝大多数对照试验会对腹腔镜直肠癌手术的CRM阳性率和淋巴结清扫数目进行描述。
从目前大多数研究结果来看,腹腔镜直肠癌手术的CRM阳性率与开腹手术无统计学差异[8~12,14,17](表3)。Vennix等[18]meta分析结果显示腹腔镜手术和开腹手术的CRM阳性率无显著性统计学差异(OR=0.99,95%CI:0.71~1.40,P=0.97)。Jiang等[19]的meta分析结果也表明腹腔镜手术和开腹手术的CRM阳性率无统计学差异(OR=0.71,95%CI:0.48~1.04,P=0.08)。CLASICC试验[17]的病理学结果显示LAR组的CRM阳性率高于开腹直肠前切除术 (open anterior resection,OAR) 组,但差异无统计学意义(12% vs. 6%,P=0.19),是否会对远期疗效产生不良影响成为学者们关注的重点。美国ACOSOG Z6051试验[15]Ⅲ期结果显示CRM阳性率在2组间无统计学差异,但腹腔镜手术组的CRM阳性率要高于开腹手术组(10.3% vs. 7.7%,P=0.11)。另外,澳大拉西亚ALaCaRT试验[16]Ⅲ期结果显示2组CRM阳性率分别为7%和3%,腹腔镜手术组明显高于开腹手术组(P=0.06)。除此之外,这2个试验的其他肿瘤学结果均不能提供充分的证据证明腹腔镜手术可以作为常规治疗直肠癌的方法。
美国病理学家协会建议淋巴结清扫的数目至少达到12枚[22]。从目前的研究结果来看,腹腔镜直肠癌手术的淋巴结清扫数目基本能达到该水平,并且清扫的淋巴结数目与开腹手术无统计学差异[8, 9,11~14, 17](表3)。
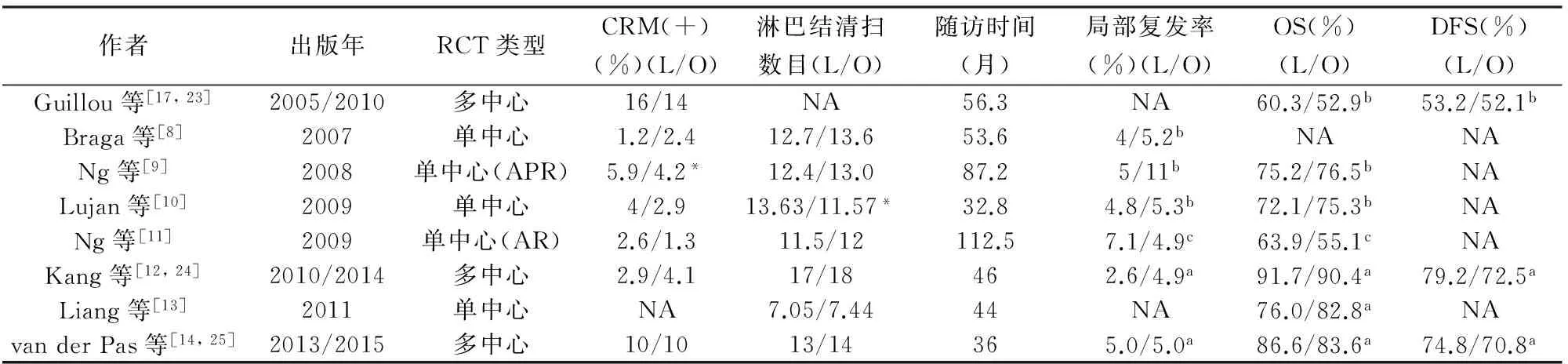
表3 RCT的CRM阳性率、淋巴结清扫、生存情况
*差异有统计学意义;a3年生存结果,b5年生存结果,c10年生存结果。RCT(randomized controlled trial):随机对照研究;L:腔镜镜,O:开腹;APR(abdominoperineal resection):腹会阴联合切除术;AR(anterior resection):前切除术;OS(overall survival):总生存期;DFS(disease-free survival):无病生存期;NA(not available):文中未提及
2 腹腔镜直肠癌切除术的远期预后
2.1 局部复发、总生存期和无病生存期情况
目前,没有研究显示腹腔镜直肠癌切除术后局部复发率和总生存期较开腹手术显著恶化。不同研究中心随访时间长短不同,因此,报道的局部复发率、总生存期、无病生存期的截点不同,3、5年局部复发率分别为2.6%~5.0%和4%~5 %,3、5年总生存率分别为76.0%~91.7%和60.3%~75.2%[8~11,13,23~25](表3)。
CLASICC试验中[23,26,27],LAR组有较高CRM阳性率,但随访中2组患者的局部复发情况和生存情况无统计学差异,LAR组和OAR组的3年局部复发率分别为7.8%和7.0%(P=0.70),5年局部复发率分别为9.4%和7.6% (P=0.74),3年总生存率分别为74.6%、66.7%(P=0.17),5年总生存率分别为62.8%和56.7%(P=0.25),同样,LAPR与OAPR的5年局部复发率和总生存率相似。COLOR Ⅱ试验[25]的3年随访结果显示,腹腔镜直肠癌手术和开腹直肠癌手术的局部复发率均为5.0%,总生存率分别为86.6%、83.6%,无病生存率分别为74.8%、70.8%,差异无统计学意义。COREAN试验[24]的3年随访结果显示,腹腔镜手术组和开腹手术组的局部复发率分别为2.6%、4.9%,总生存率分别为91.7%、90.4%,无病生存率79.2%、72.5%,差异无统计学意义。Zhao等[28]对腹腔镜直肠癌术后3年的生存情况进行meta分析,结果显示腹腔镜手术组和开腹手术组3年OS、DFS无显著性差异。
2.2 trocar孔/切口肿瘤复发
对于腹腔镜手术,trocar孔肿瘤复发也是主要关心的问题之一。CLASICC试验[23,26]随访结果显示,2组trocar孔/切口肿瘤复发率分别为2.5%和0.6%。COLORⅡ试验[25]3年随访结果显示,2组trocar孔/切口肿瘤复发率分别为0.14%和0.29%。Ng等[9]5年随访结果显示,腹腔镜手术组和开腹手术组trocar孔/切口肿瘤复发率分别为0%和2.8%。以上3个试验均表明2组trocar孔/切口肿瘤复发率无显著性统计差异。在其他几个临床试验的随访过程中未见trocar孔/切口肿瘤复发[11,13,24,29]。Vennix等[18]meta分析结果显示腹腔镜手术与开腹手术的trocar孔/切口肿瘤复发率无统计学差异(OR=2.76,95%CI:0.75~10.20,P=0.13)。随着对腹腔镜手术治疗癌症认识的加深,对trocar孔/切口肿瘤复发的重视度增加,术中对切口或trocar孔的保护力度加大,trocar孔/切口肿瘤复发率能得到更好控制。
2.3 膀胱功能和性功能
膀胱功能和性功能是用来评估直肠癌患者术后生活质量的重要指标,但目前只有少数关于腹腔镜直肠癌术后膀胱功能和性功能的研究。CLASICC试验[30]结果显示腹腔镜与开腹直肠癌手术患者术后的膀胱功能情况相似,男性的性功能状态和勃起功能状态腹腔镜手术组要差于开腹手术组,但差异无统计学意义(P=0.063,P=0.068),多因素分析显示中转开腹是男性术后发生性功能障碍的独立危险因素。COREAN试验[12]的研究结果显示,腹腔镜手术组的男性患者术前性功能评分显著低于开腹手术组(P<0.010),但术后3个月2组男性患者的性功能评分较术前均有显著提高(腹腔镜组P<0.001,开腹组P=0.0188),腹腔镜手术组男性性功能评分高于开腹手术组,但差异无统计学意义(P=0.2855)。Lim等[31]meta分析结果显示,男性患者直肠癌术后的膀胱功能、射精功能和勃起功能腹腔镜手术与开腹手术无统计学差异,总的性功能障碍发生率为34%,女性患者直肠癌术后的性功能2组间也无统计学差异。腹腔镜手术的放大作用能够起到更好的辨别和保护盆腔神经的作用,但是目前相关报道仍较少,因此,需要更多的临床研究来提供证据。
3 腹腔镜直肠癌手术的前景
在尽力完善传统腹腔镜直肠癌手术的同时,人们也在探索者新的手术方式和途径。近年来,单孔腹腔镜直肠癌切除术(single-incision laparosopic rectal resection,SILR)、经肛门直肠癌全系膜切除术(transanal total mesorectal excision,TaTME)、机器人手术正在蓬勃发展。
3.1 SILR
单孔腹腔镜手术通常是在脐部或造口处建立唯一的trocar孔进行手术操作,一方面减少发生trocar孔相关并发症的潜在风险,提高美容效果,另一方面也减少手术创伤带来的炎症反应。但是单孔腹腔镜手术操作困难,器械相互干扰,视野局限是其不可避免的缺点。Remzi等[32]2008年报道第1例单孔腹腔镜右半结肠切除术。随后单孔腹腔镜手术治疗结直肠疾病逐渐发展起来。关于SILR的对照试验还很少。Levic等[33]研究显示SILR组手术时间显著长于传统腹腔镜手术组,但术中出血量显著降低,并发症发生率和死亡率无统计学差异。Tei等[34]对50例SILR进行病例匹配研究,结果显示手术时间、术中出血量、淋巴结清扫情况、术后并发症、肿瘤学结果SILR组与传统腹腔镜手术组无显著性统计学差异,但术后住院时间显著少于传统腹腔镜手术组。Katsuno等[35]报道214例单孔腹腔镜结直肠癌手术的随访结果,5年总生存率与开腹手术组无显著性统计学差异(100% vs. 95%,P=0.125)。虽然目前的对照研究显示SILR是一个比较安全、可行的手术,但是仍然缺乏大样本的RCT,并且也缺乏关于SILR远期疗效的相关报道。
3.2 TaTME
2010年美国Sylla等[36]报道第1例基于经肛门内镜显微技术平台的直肠癌TaTME,2013年Zhang等[37]报道国内第1例TaTME。TaTME作为治疗直肠癌的一种新兴的微创技术受到广泛的关注,且相关的临床研究也不断涌现。Fernandez-Hevia等[38]将37例TaTME和腹腔镜TME对比,结果显示TaTME组手术时间显著少于腹腔镜TME组,并发症发生率无统计学差异,早期再入院率显著低于腹腔镜手术组。Velthuis等[39]将25例TaTME和腹腔镜TME进行肿瘤学方面的比较,结果显示TaTME有更高的系膜完整切除率(P<0.05),CRM阳性率等2组间差异无统计学意义。这些对照研究在一定程度上证明TaTME的安全性和可行性,但这些对照试验样本量有限。目前,COLOR Ⅲ试验[40]正在进行中,该试验是一个多中心RCT,比较TaTME与腹腔镜TME治疗中低位直肠癌的近期疗效,结果令人期待。
3.3 机器人直肠癌手术
机器人手术提供的三维立体成像使手术视野更加清晰,多角度机器臂使手术操作更加灵活,可靠的动作缩减系统使人手震颤带来的干扰被消除,提高手术的精确性和稳定性。2006年Pigazzi等[41]首次报道机器人辅助TME。随着机器人手术系统的推广,许多研究纷纷报道机器人手术的疗效和安全性。Speicher等[42]利用美国国家癌症数据库的数据对2010~2011年956例机器人低位前切除术(robotic low anterior resection,RLAR)和5547例腹腔镜低位前切除术(laparoscopic low anterior resection,LLAR)进行分析,结果显示RLAR组中转开腹率显著低于LLAR组,2组淋巴结清扫、切缘情况、死亡率、再入院率和住院时间无统计学差异。Xiong等[43]对8项包含1229例的对照试验进行meta分析,结果显示554例机器人TME与675例腹腔镜TME相比,中转开腹率、CRM阳性率、勃起功能障碍发生率均显著降低,手术时间、术中出血量、术后恢复、术后病死率和并发症发生率、住院时间、淋巴结清扫、远近断端切缘、局部复发方面差异无统计学意义。Sun等[44]对324例RLAR和268例LLAR进行meta分析,结果显示RLAR组较LLAR组显著缩短住院时间、降低中转开腹率、CRM阳性率、术后并发症发生率。Park等[45]的研究结果显示RLAR组(n=133)除中转开腹率和住院时间优于LLAR组(n=84),其他指标均无统计学差异,RLAR和LLAR 5年总生存率、无病生存率、局部复发率无统计学差异。Cho等[46]的研究结果显示虽然机器人TME手术时间显著长于腹腔镜TME,但中转开腹率、住院时间、疼痛程度、胃肠道功能恢复、CRM阳性率和术后并发症2组无统计学差异,5年总生存率、无病生存率、局部复发率亦无统计学差异。这些研究结果证明机器人直肠癌手术安全、可行,而且能够达到和腹腔镜手术相似的远期疗效,但机器人手术成本高,在一定程度上可能会限制其进一步的推广。
4 总结
目前,关于腹腔镜直肠癌手术的多中心随机对照试验研究较少,且各研究的结论并不一致,开腹手术仍是直肠癌外科治疗的标准术式。腹腔镜手术治疗直肠癌还需要更多的Ⅰ级证据支持。相信随着更多的随机对照研究结果的报道、术者经验的不断积累和腔镜手术器械的不断发展,腹腔镜直肠癌手术将与腹腔镜结肠癌手术一样得到广泛认可。
1 Siegel RL,Miller KD,Jemal A. Cancer statistics,2016. CA:A Cancer Journal for Clinicians,2016,66(1):7-30.
2 Siegel R,Desantis C,Jemal A. Colorectal cancer statistics,2014. CA:A Cancer Journal for Clinicians,2014,64(2):104-117.
3 Chen W,Zheng R,Baade PD,et al. Cancer statistics in China,2015. CA:A Cancer Journal for Clinicians,2016,66(2):115-132.
4 Jacobs M,Verdeja JC,Goldstein HS. Minimally invasive colon resection (laparoscopic colectomy). Surg Laparosc Endosc,1991,1(3):144-150.
5 Kockerling F,Gastinger I,Schneider B,et al. Laparoscopic abdominoperineal excision of the rectum with high ligation of the inferior mesenteric artery in the management of rectal carcinoma. Endosc Surg Allied Technol,1993,1(1):16-19.
6 Benson AR,Venook AP,Bekaii-Saab T,et al. NCCN Clinical Practice Guidelines in Oncology:Rectal Cancer. 2016. http://www.nccn.org/professionals/physician_gls/pdf/rectal.pdf.
7 陆少美,张自顺,颜南生,等.腹腔镜下腹会阴联合直肠癌根治术——附7例报告. 北京医科大学学报,1995,27(5):365-366.
8 Braga M,Frasson M,Vignali A,et al. Laparoscopic resection in rectal cancer patients:outcome and cost-benefit analysis. Dis Colon Rectum,2007,50(4):464-471.
9 Ng SSM,Leung KL,Lee JFY,et al. Laparoscopic-assisted versus open abdominoperineal resection for low rectal cancer:A prospective Randomized Trial. Ann Surg Oncol,2008,15(9):2418-2425.
10 Lujan J,Valero G,Hernandez Q,et al. Randomized clinical trial comparing laparoscopic and open surgery in patients with rectal cancer. Br J Surg,2009,96(9):982-989.
11 Ng SSM,Leung KL,Lee JFY,et al. Long-term morbidity and oncologic outcomes of laparoscopic-assisted anterior resection for upper rectal cancer. Dis Colon Rectum,2009,52(4):558-566.
12 Kang S,Park JW,Jeong S,et al. Open versus laparoscopic surgery for mid or low rectal cancer after neoadjuvant chemoradiotherapy (COREAN trial):short-term outcomes of an open-label randomised controlled trial. Lancet Oncol,2010,11(7):637-645.
13 Liang X,Hou S,Liu H,et al. Effectiveness and safety of laparoscopic resection versus open surgery in patients with rectal cancer:A randomized,controlled trial from China. J Laparoendosc Adv Surg Tech A,2011,21(5):381-385.
14 van der Pas MH,Haglind E,Cuesta MA,et al. Laparoscopic versus open surgery for rectal cancer (COLOR Ⅱ):short-term outcomes of a randomised,phase 3 trial. Lancet Oncol,2013,14(3):210-218.
15 Fleshman J,Branda M,Sargent DJ,et al. Effect of laparoscopic-assisted resection vs open resection of stage Ⅱ or Ⅲ rectal cancer on pathologic outcomes. JAMA,2015,314(13):1346-1355.
16 Stevenson ARL,Solomon MJ,Lumley JW,et al. Effect of laparoscopic-assisted resection vs open resection on pathological outcomes in rectal cancer. The ALaCaRT randomized clinical trial. JAMA,2015,314(13):1356-1363.
17 Guillou PJ,Quirke P,Thorpe H,et al. Short-term endpoints of conventional versus laparoscopic-assisted surgery in patients with colorectal cancer (MRC CLASICC trial):multicentre,randomised controlled trial. Lancet,2005,365(9472):1718-1726.
18 Vennix S,Pelzers L,Bouvy N,et al. Laparoscopic versus open total mesorectal excision for rectal cancer. Cochrane Database Syst Rev,2014,4:D5200.
19 Jiang J,Jiang K,Dai Y,et al. Laparoscopic versus open surgery for mid-low rectal cancer:a systematic review and meta-analysis on short- and long-term outcomes. J Gastrointest Surg,2015,19(8):1497-1512.
20 Ahmad NZ,Racheva G,Elmusharaf H. A systematic review and meta-analysis of randomized and non-randomized studies comparing laparoscopic and open abdominoperineal resection for rectal cancer. Colorectal Disease,2013,15(3):269-277.
21 Wang YW,Huang LY,Song CL,et al. Laparoscopic vs open abdominoperineal resection in the multimodality management of low rectal cancers. World J Gastroenterol,2015,21(35):10174-10183.
22 Compton CC,Fielding LP,Burgart LJ,et al. Prognostic factors in colorectal cancer. College of American Pathologists Consensus Statement 1999. Arch Pathol Lab Med,2000,124(7):979-994.
23 Jayne DG,Thorpe HC,Copeland J,et al. Five-year follow-up of the Medical Research Council CLASICC trial of laparoscopically assisted versus open surgery for colorectal cancer. Br J Surg,2010,97(11):1638-1645.
24 Jeong SY,Park JW,Nam BH,et al. Open versus laparoscopic surgery for mid-rectal or low-rectal cancer after neoadjuvant chemoradiotherapy (COREAN trial):survival outcomes of an open-label,non-inferiority,randomised controlled trial. Lancet Oncol,2014,15(7):767-774.
25 Bonjer HJ,Deijen CL,Abis GA,et al. A randomized trial of laparoscopic versus open surgery for rectal cancer. N Engl J Med,2015,372(14):1324-1332.
26 Jayne DG,Guillou PJ,Thorpe H,et al. Randomized trial of laparoscopic-assisted resection of colorectal carcinoma:3-year results of the UK MRC CLASICC Trial Group. J Clin Oncol,2007,25(21):3061-3068.
27 Green BL,Marshall HC,Collinson F,et al. Long-term follow-up of the Medical Research Council CLASICC trial of conventional versus laparoscopically assisted resection in colorectal cancer. Br J Surg,2013,100(1):75-82.
28 Zhao D,Li Y,Wang S,et al. Laparoscopic versus open surgery for rectal cancer:a meta-analysis of 3-year follow-up outcomes. Int J Colorectal Dis,2016,31(4):805-811.
29 Ng SSM,Lee JFY,Yiu RYC,et al. Long-term Oncologic Outcomes of Laparoscopic Versus Open Surgery for Rectal Cancer. Ann Surg,2014,259(1):139-147.
30 Jayne DG,Brown JM,Thorpe H,et al. Bladder and sexual function following resection for rectal cancer in a randomized clinical trial of laparoscopic versus open technique. Br J Surg,2005,92(9):1124-1132.
31 Lim RS,Yang TX,Chua TC. Postoperative bladder and sexual function in patients undergoing surgery for rectal cancer:a systematic review and meta-analysis of laparoscopic versus open resection of rectal cancer. Tech Coloproctol,2014,18(11):993-1002.
32 Remzi FH,Kirat HT,Kaouk JH,et al. Single-port laparoscopy in colorectal surgery. Colorectal Dis,2008,10(8):823-826.
33 Levic K,Bulut O. The short-term outcomes of conventional and single-port laparoscopic surgery for rectal cancer:a comparative non-randomized study. Minim Invasive Ther Allied Technol,2014,23(4):214-222.
34 Tei M,Wakasugi M,Akamatsu H. Comparison of short-term surgical results of single-port and multi-port laparoscopic rectal resection for rectal cancer. Am J Surg,2015,210(2):309-314.
35 Katsuno G,Fukunaga M,Nagakari K,et al. Short-term and long-term outcomes of single-incision versus multi-incision laparoscopic resection for colorectal cancer:a propensity-score-matched analysis of 214 cases. Surg Endosc,2016,30(4):1317-1325.
36 Sylla P,Rattner DW,Delgado S,et al. NOTES transanal rectal cancer resection using transanal endoscopic microsurgery and laparoscopic assistance. Surg Endosc,2010,24(5):1205-1210.
37 Zhang H,Zhang YS,Jin XW,et al. Transanal single-port laparoscopic total mesorectal excision in the treatment of rectal cancer. Tech Coloproctol,2013,17(1):117-123.
38 Fernandez-Hevia M,Delgado S,Castells A,et al. Transanal total mesorectal excision in rectal cancer:short-term outcomes in comparison with laparoscopic surgery. Ann Surg,2015,261(2):221-227.
39 Velthuis S,Nieuwenhuis DH,Ruijter TE,et al. Transanal versus traditional laparoscopic total mesorectal excision for rectal carcinoma. Surg Endosc,2014,28(12):3494-3499.
40 Deijen CL,Velthuis S,Tsai A,et al. COLOR Ⅲ:a multicentre randomised clinical trial comparing transanal TME versus laparoscopic TME for mid and low rectal cancer. Surg Endosc,2015,Nov 4.[Epub ahead of print]
41 Pigazzi A,Ellenhorn JD,Ballantyne GH,et al. Robotic-assisted laparoscopic low anterior resection with total mesorectal excision for rectal cancer. Surg Endosc,2006,20(10):1521-1525.
42 Speicher PJ,Englum BR,Ganapathi AM,et al. Robotic low anterior resection for rectal cancer:a national perspective on short-term oncologic outcomes. Ann Surg,2015,262(6):1040-1045.
43 Xiong B,Ma L,Huang W,et al. Robotic versus laparoscopic total mesorectal excision for rectal cancer:a meta-analysis of eight studies. J Gastrointest Surg,2015,19(3):516-526.
44 Sun Y,Xu H,Li Z,et al. Robotic versus laparoscopic low anterior resection for rectal cancer:a meta-analysis. World J Surg Oncol,2016,14(1):61-69.
45 Park EJ,Cho MS,Baek SJ,et al. Long-term oncologic outcomes of robotic low anterior resection for rectal cancer:a comparative study with laparoscopic surgery. Ann Surg,2015,261(1):129-137.
46 Cho MS,Baek SJ,Hur H,et al. Short and long-term outcomes of robotic versus laparoscopic total mesorectal excision for rectal cancer:a case-matched retrospective study. Medicine (Baltimore),2015,94(11):e522.
(修回日期:2016-05-25)
(责任编辑:李贺琼)
Laparoscopic Surgery for Rectal Cancer:Overseas Current Status and Future Perspective
ZengHuanhong,FuWei.
DepartmentofGeneralSurgery,PekingUniversityThirdHospital,Beijing100083,China
FuWei,E-mail:fuwei0720@sohu.com
Rectal cancer; Laparoscope
国家自然科学基金(项目编号:81272709);首都临床特色应用研究项目(项目编号:Z111107058811053)
**通讯作者,E-mail:fuwei0720@sohu.com
A
1009-6604(2016)07-0650-06
10.3969/j.issn.1009-6604.2016.07.020
2016-05-09)
【Summary】 Colorectal cancer is the one of the most common malignancies in the world. Currently,surgery is the main treatment for colorectal cancer. Although laparoscopic surgery for colon cancer has been widely accepted,laparoscopic approach for rectal cancer is still in clinical trials. At present,several trails have shown that the short- and long-term outcomes of laparoscopic rectal cancer resection are similar with open surgery,but others have shown that pathological outcomes and total resection rates of laparoscopic surgery are unsatisfactory. Laparoscopic rectal cancer surgery needs more grade Ⅰ evidences. Nowadays,researchers are exploring new ways to treat rectal cancer.
