大强度间歇运动对高脂喂养大鼠代谢表征和骨骼肌脂代谢基因表达的影响
2017-01-04沈友青黄国源王配才黄志强代会莹
沈友青,黄国源,王配才,黄志强,代会莹
大强度间歇运动对高脂喂养大鼠代谢表征和骨骼肌脂代谢基因表达的影响
沈友青1,黄国源2,王配才3,黄志强1,代会莹1
研究目的:探讨大强度间歇运动对高脂诱导大鼠肥胖症的预防作用及骨骼肌脂代谢调控机制,为肥胖症的预防提供理论和实践依据。研究方法:37只雄性SD大鼠分为对照安静组(CS组)、高脂安静组(HS组)、高脂持续运动组(HE组)和高脂间歇运动组(HI组)。HE组和HI组分别进行低强度持续运动和大强度间歇运动训练,每周5天,共10周。定期测量摄食量和体重,采用全自动生化分析技术检测血脂、血糖含量,Elisa试剂盒检测血清胰岛素含量,H&E染色法观察脂肪细胞大小,Real-time PCR技术检测骨骼肌脂代谢调控基因Rev-erbα、SCD1、CPT1和FAT/CD36 mRNA相对表达量,Western blot技术检测各调控基因的蛋白表达量。结果:HS组体重、血脂和血糖、脂肪细胞大小显著增加,QUICKI指数下降。HI组体重、血脂、血糖和脂肪细胞大小明显降低,QUICKI指数升高;且效果明显优于低强度持续运动方式。HS组FAT/CD36 和SCD1 mRNA与蛋白表达量明显高于CS组;HI组Rev-erbα、FAT/CD36和CPT1 mRNA表达量显著高于HS组;HE组与HS组无统计学差异。结论:高脂饮食诱导大鼠代谢表征和骨骼肌脂代谢异常。分子生物学机制分析表明,大强度间歇运动促进脂肪酸跨膜转运、胞内合成和参与β氧化,有效预防高脂饮食诱导的代谢表征异常和骨骼肌脂质代谢紊乱,其效果明显优于低强度持续运动方式。大强度间歇运动刺激Rev-erbα表达上调,增加对脂代谢调节因子的调控,可能是维持骨骼肌脂质稳态适应的新机制。关键词:低强度持续运动;大强度间歇运动;骨骼肌;Rev-erbα;脂肪酸转运蛋白;硬脂酰CoA去饱和酶1;肉毒碱棕榈酰转移酶1
肥胖症(Obesity)与饮食不健康、体力活动水平低等不良生活方式密切相关,被视为是最主要的可预防性疾病;降低其诱发因素,如体力活动不足、高脂膳食等,是实现肥胖症初级预防的重要理念和关键目标[36,50]。但如何采取有效措施预防肥胖症的发生,是当今预防医学和运动科学领域亟待解决的重要问题。美国运动医学会( ACSM) 发布的2015年度世界健身流行趋势的报告中,将大强度间歇运动作为关注的热点之一[49]。有动物实验和人体实验研究表明,大强度间歇运动可提高心肺机能、促进糖脂代谢和增加氧化应激能力,是心血管疾病、糖尿病等慢性病干预的重要选择[1-3,25,39]。大强度间歇运动是一种由快速、大强度运动,间歇采用安静或低强度运动恢复方式而实现的运动形式,由运动强度、运动时间、重复次数、间歇时间及恢复方式等要素构成[19]。该运动方式可利用较少的锻炼时间达到类似或优于传统持续运动方式的锻炼效果,且其运动形式的变化可消除锻炼时的枯燥感,有利于锻炼者坚持运动[13,15,28,45]。目前有关大强度间歇运动对高脂膳食诱导肥胖症的预防效果及其脂质代谢调控作用鲜有报道。
慢性病运动干预与骨骼肌病理生理适应机制有关,该领域是运动科学的研究热点[14,37]。研究发现,核受体Rev-erbα是骨骼肌脂代谢核心转录调控因子,在物质代谢和能量稳态维持中发挥关键作用[11,12,46]。已发现Rev-erbα与慢性代谢性疾病的发生发展密切相关,是重要的药物靶标[30]。目前关于运动干预联合高脂喂养对骨骼肌Rev-erbα表达及其脂肪酸代谢调节鲜有报道。本研究探讨大强度间歇运动对高脂喂养大鼠代谢表征和骨骼肌脂代谢调控因子的影响,并以低强度持续运动作为科学对照,研究大强度间歇运动对肥胖症的预防作用,并分析可能存在骨骼肌适应机制,为肥胖症等慢性病的预防提供理论和实践依据。
1 研究材料与方法
1.1 主要仪器和试剂
主要仪器:ZH-PT动物实验跑台、Aeroset全自动生化分析仪、RM2016石蜡切片机、EG1160石蜡包埋机、DP72电子显微镜、Thermo超低温冰箱、X1R高速冷冻离心机、Avanti J-26 xp冷冻离心机、PICO-17台式离心机、Eppendorf紫外分光光度计、JY600C水平电泳槽、Mini-P4垂直电泳仪、Bio-rad水平板半干电转仪、BOX EF2凝胶成像分析系统、IQTM5 MyCycler PCR检测系统、NC膜(HATF00010,Mi11ipore公司)。
主要试剂:大鼠胰岛素Elisa试剂盒(美国Linco公司)、苏木精和伊红(国药集团),QuantiTect反转录试剂盒、QuantiTect SYBR Green PCR试剂盒。β-actin(NM_013200)、Rev-erbα(NM_145775)、SCD1(NM_139192)、FAT/CD36(NM_031561)、CPT1(NM_013200)引物均购自Qiagen公司。BCA蛋白定量测定试剂盒(PICPI23223,Thermo公司);ECL化学发光试剂盒(WBKLS0100,Mi11ipore公司)。一抗GADPH(sc-48166)、Rev-erbα(sc-47626)、SCD1(sc-14720)、FAT/CD36(sc-7641)、CPT1(sc-20514)和二抗驴抗羊 IgG-HRP(sc-2020)均购自Santa Cruze公司。
1.2 实验动物与训练方案
8~10周龄普通级雄性SD大鼠37只,初始体重190±15 g,由武汉大学实验动物中心/ABSL-III实验室提供。适应性喂养后,称量体重并采用简化分层随机抽样法分为4组:对照安静组(CS,n=11)、高脂安静组(HS,n=10)、高脂持续运动组(HE,n=8)和高脂间歇运动组(HI,n=8)。每笼4~5只,灯控调节昼夜节律12∶12 h,室温23±1 ℃,湿度40%~60%。自由进食和饮水,饲料为纯成份对照饲料(D12450B,10%Fat)和高脂饲料(D12451,45%Fat),由美国Research Diets公司提供。D12450B和D12451的能量密度分别为3.85 kcal/g、4.73 kcal/g[48]。
1.3 体重与摄食量记录
喂养期间仔细观察并记录大鼠的一般状况。采用电子天平称量日喂食量和剩食量(精确度为0.1 g),并计算摄食量,根据饲料的能量密度计算每组大鼠的热能摄入量。采用电子称称量体重(精确度为0.5 g),每周记录2次。1.4 血液生化指标检测
建模结束后禁食12 h,采样时间控制在上午8:00~10:00。2%戊巴比妥钠(40 mg/kg)腹腔注射麻醉,备皮消毒。采集腹主动脉血7 mL,静置2 h后4℃ 3 000 rpm离心15 min,收集血清待测。检测指标包括血脂(TG、TC、LDL-C和HDL-C)、血糖(GLU)和胰岛素。血脂和血糖采用全自动生化分析仪检测,胰岛素水平采用大鼠胰岛素Elisa试剂盒检测。胰岛素敏感性利用QUICKI(Quantitative insulin sensitivity check index)指数评价,根据公式(1)计算,其中I0代表空腹胰岛素含量(μU/mL),G0代表空腹血糖浓度(mg/dL)[35,52]。
(1)
1.5 脂肪组织重量与H&E染色观察

高中的知识体系中往往蕴含着很多数学的思想方法。人教版高中数学必修1中将函数零点引进后,将函数的零点转化为方程的根,又可以转化为函数图像与x轴交点的横坐标,还可以转化成两个函数图像交点的横坐标,这就充分体现着数学的函数与方程的数学思想,以及数形结合的数学思想方法,还渗透着转化与化归的数学思想方法。所以对于数学的结构教学,要结合数学思想方法帮助我们更快更好的发现数学结构。
1.6 骨骼肌组织取材与目标基因 mRNA表达量检测
分离腓肠肌,置于1.5 mL消毒处理后的EP管中,放入液氮罐和-80℃超低温冰箱保存,用于靶分子生物学指标检测。基因检测采用两步法Real-time PCR,提取骨骼肌总RNA,检测纯度和完整性;反转录合成cDNA,总反应体系为20 μL,反应条件为:65 ℃温育2 min;扩增42 ℃ 60 min,70 ℃ 5 min。按照QuantiTect SYBR Green PCR试剂盒说明书操作,两步法扩增。采用3个复孔,反应体系为25 μL,反应条件为:1)95 ℃,15 min。2)94 ℃,15 s;57 ℃,30 s;72 ℃,30 s;循环35次。根据参考基因β-actin和目标基因的循环次数计算Rev-erbα、FAT/CD36、SCD1、CPT1 mRNA相对表达量[44]。
1.7 靶分子的蛋白表达量检测
蛋白检测采用Western blot法,抽提总蛋白,进行蛋白浓度测定。SDS-PAGE电泳,每孔上样量为30 μg蛋白;电压为浓缩胶80 V,分离胶120 V。将目标蛋白转至NC膜,电流量按照膜面积1.5 mA/cm2设置,转膜时间约2 h。用TBST配制5%脱脂奶粉封闭膜,4 ℃过夜后TBST洗膜,孵育一抗,37 ℃孵育2 h。TBST洗膜,孵育二抗,37 ℃孵育2 h。GAPDH为内参,一抗稀释比例为GAPDH 1∶1500、REV-ERBα 1∶200、FAT/CD36 1∶200、SCD1 1∶1 000、CPT1 1∶200,二抗稀释比例为1∶2 000。ECL 化学发光液反应1 min,X光片暗室曝光,凝胶成像分析系统扫描胶片并拍照。
1.8 数据处理
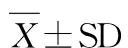
2 实验结果
2.1 各组大鼠摄食量与体重比较
HS组均只日摄食量低于CS组(P<0.05),而高脂组间摄食量无明显差异;热能摄入量各组间均无统计学差异(表1)。喂养期间,各组体重呈上升趋势(图1);10周后,HS组终末体重(P<0.01)和净增体重(P<0.01)较CS组分别高15.9%和31.4%。HI组终末体重(P<0.01)和净增体重(P<0.01)明显低于HS组;HE组与HS组无显著差异。
表 1 本研究各组大鼠均只摄食量、热能摄入量与体重比较一览表
Table 1 Effect of Exercise and Diet on Food Consumption,Caloric Intake and Body Weight
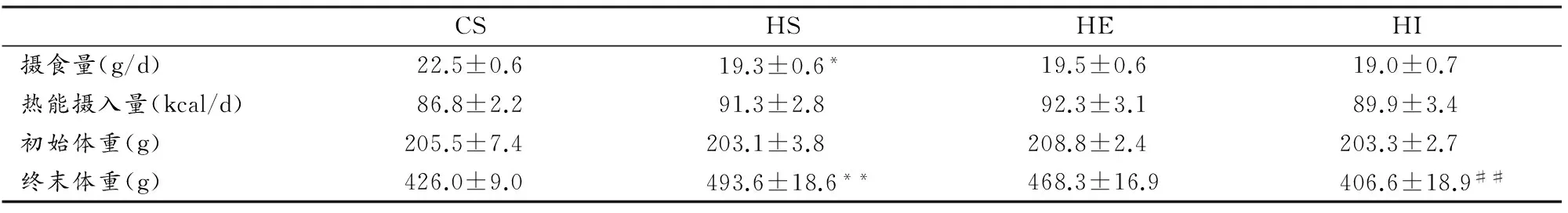
CSHSHEHI摄食量(g/d)22.5±0.619.3±0.6*19.5±0.619.0±0.7热能摄入量(kcal/d)86.8±2.291.3±2.892.3±3.189.9±3.4初始体重(g)205.5±7.4203.1±3.8208.8±2.4203.3±2.7终末体重(g)426.0±9.0493.6±18.6**468.3±16.9406.6±18.9##
注:* 表示与CS组对比P<0.05,**表示与CS组对比P<0.01,#表示与HS组对比P<0.05,##表示与HS组对比P<0.01,下同。

图 1 造模期间各组大鼠每周体重变化曲线图
Figure 1. Change Curve of Rats’ Body Weight during 10 Weeks
2.2 血液生化指标比较
HS组TG(P<0.01)、TC(P<0.01)、LDL-C(P<0.05)、GLU(P<0.01)含量高于CS组;QUICKI指数明显低于CS组(P<0.01)(表2)。在高脂组中,HI组TG(P<0.05)和GLU(P<0.01)明显低于HS组,QUICKI指数明显高于HS组(P<0.01);而HE组与HS组间无统计学差异。2.3 脂肪重量与H&E染色观察结果
HS组脂肪垫重量(RET,P<0.01;MES,P<0.01;EPI,P<0.01)和脂肪组织总重量(P<0.01)均显著高于CS组(图2)。高脂组中,HI组脂肪垫重量(RET,P<0.01;MES,P<0.01;EPI,P<0.01)、脂肪组织总重量(P<0.01)显著低于HS组。HI组与HE组脂肪垫重量部分存在差异,而脂肪组织总重存在明显差异(P<0.05)。
表 2 各组大鼠血液生化指标差异性比较一览表
Table 2 Effect of Exercise and Diet on Serum Biochemical Index

CSHSHEHITG(mmol/L)0.33±0.020.61±0.09**0.41±0.080.29±0.05#TC(mmol/L)1.22±0.081.54±0.04**1.45±0.031.53±0.07HDL-C(mmol/L)0.44±0.020.44±0.010.40±0.020.42±0.02LDL-C(mmol/L)0.18±0.020.23±0.01*0.21±0.010.23±0.01GLU(mmol/L)7.86±0.4113.95±0.70**11.06±0.878.63±0.75##Insulin(mU/L)13.75±0.6515.13±0.4514.87±0.5314.69±0.42QUICKI0.305±0.0030.280±0.002**0.287±0.0050.298±0.004##

图 2 各组大鼠各部位脂肪垫重量与脂肪组织总重对比图
Figure 2. Fat Weights in Different Regions and Total Fat Weights in All Groups
注:△表示与HI组对比P<0.05,△△表示与HI组对比P<0.01,下同。RET:肾周脂肪组织;MES:大网膜脂肪组织;EPI:睾周脂肪组织;TOTAL:脂肪组织总量。
采集肾周脂肪观察脂肪细胞形态学变化,镜下观显示脂肪细胞边界清晰(图3)。HS组脂肪细胞平均面积明显大于CS组(P<0.01);HE组和HI组较HS组脂肪细胞平均面积小(HE vs HS,P<0.01;HI vs HS,P<0.01),且HI组明显小于HE组(P<0.05)(图4)。
2.4 骨骼肌Rev-erbα、FAT/CD36、SCD1和CPT1 mRNA相对表达量和蛋白印迹
HS组骨骼肌Rev-erbα mRNA和CPT1 mRNA相对表达量与CS组无统计学差异,而FAT/CD36 mRNA(P<0.05)和SCD1mRNA(P<0.01)明显高于CS组。高脂组中,HI组Rev-erbα、FAT/CD36和CPT1 mRNA相对表达量均显著高于HS组(P<0.01);HI组FAT/CD36 mRNA表达量高于HE组(P<0.05);HE组与HS组各目标基因相对表达量均无统计学差异(图5-A)。蛋白印迹显示(图6-B)与mRNA表达水平基本一致。

图 3 各组大鼠脂肪组织H&E染色显微镜下观测示意图(×200倍,刻度尺为50 μm)
Figure 3. Histological Evaluation of Lipid Accumulation in Retroperitoneal Region

图 4 各组大鼠脂肪细胞平均面积比较图
Figure 4. Comparison of Average Size of Adipose Cell in All Groups

图 5 各组大鼠骨骼肌目标基因mRNA相对表达量和蛋白表达图谱
Figure 5. Effect of Diet and Exercise on Target Genes and Protein Expressions in All Groups
3 讨论与分析
3.1 大强度间歇运动改善高脂喂养大鼠的代谢表征
高饱和脂肪酸膳食诱导大鼠代谢表征(metabolic phenotype)如体成分、血糖与胰岛素敏感性、血脂轮廓(lipid profile)等的异常改变,表现为高脂膳食导致不良体重增长、内脏脂肪堆积,脂肪细胞体积增加;血脂(TG、TC和LDL-C)、血糖含量升高,胰岛素敏感性下降,本研究结果与现有报道相吻合[6,45]。本研究主要探讨大强度间歇运动对高脂喂养大鼠肥胖症的预防作用,成功地建立了高脂膳食诱导的肥胖症模型,为进一步研究肥胖症运动干预效果及分子机制提供重要的科学对照。

3.2 大强度间歇运动对骨骼肌FAT/CD36、SCD1和CPT1表达的影响与作用分析
骨骼肌是脂肪酸氧化代谢最活跃的部位之一,也是能量物质储存的主要外周组织。脂肪酸由微循环系统进入骨骼肌细胞参与代谢,需要在多个调控分子的作用下实现脂肪酸转运、胞内脂质合成、线粒体跨膜转运并参与β氧化代谢。FAT/CD36 是脂肪酸跨膜转运的关键转运体,目前已有关于不同运动方式对骨骼肌FAT/CD36影响的研究报道。Holloway等[23]发现,野生型小鼠急性运动后,骨骼肌线粒体FAT/CD36表达上调;Bradley等[9]发现,急性持续运动SD大鼠骨骼肌细胞膜FAT/CD36表达量增加20%;而Hoshino等[26]研究发现,大强度间歇运动增加大鼠骨骼肌脂肪酸氧化代谢能力,但与线粒体中FAT/CD36表达量无关。目前有关运动对FAT/CD36表达影响结果的观点并不一致,分析可能与运动强度、干预时间等运动要素有关。本研究中运动干预联合高脂喂养时FAT/CD36表达均呈上升趋势,大强度间歇运动诱导FAT/CD36表达增加幅度更明显,这与现有的研究结果一致。Kitaoka等[29]采用动物实验研究发现,大强度运动训练明显增加骨骼肌FAT/CD36蛋白表达,增加底物利用率。Talanian等[47]针对未参加系统训练女性的研究也发现,经过6周大强度间歇运动后骨骼肌FAT/CD36的活性显著增加。高脂喂养引起肌细胞外高浓度的脂肪酸供给,可诱导FAT/CD36表达以实现脂肪酸由循环系统转运至肌细胞内,作为能量物质储存。运动进一步促进FAT/CD36表达上调,使得脂肪酸膜转运、细胞内底物流通增加,为线粒体β氧化提供底物,同时,可充分动员外周组织如脂肪组织、肝脏中储存的脂肪,降低组织脂质含量[8,24]。FAT/CD36表达上调也可能增加细胞脂质堆积的风险及诱导胰岛素抵抗,胞内脂质维持动态平衡与脂肪酸跨膜转运、胞内脂质合成、脂肪酸氧化代谢等多环节协同作用密切相关。
SCD1是催化多不饱和脂肪酸(SFAs)转化为单不饱和脂肪酸(MUFAs)的限速酶,可为肌细胞内脂质(IMCL)合成提供充足的底物[16]。本研究发现,高脂膳食诱导骨骼肌SCD1表达增加,分析认为,SCD1受到营养条件影响较大,饱和脂肪酸含量丰富的膳食易诱导骨骼肌SCD1表达增加,促进IMCL合成,这与现有的报道一致[51]。有动物实验研究发现,2周游泳和6周跑台运动,均可增加肌肉中SCD1基因和蛋白表达量,调节肌细胞内甘油三酯的合成和增加骨骼肌氧化代谢运动适应能力[17,27]。人体研究与动物研究结果一致,Dube等[18]以超重或肥胖人群为研究对象,有氧锻炼干预后骨骼肌SCD1增加,IMTG含量和组织氧化代谢能力增加,同时,体重和体脂含量下降,胰岛素敏感性增加。Bergman等[7]研究表明,自行车运动员骨骼肌中SCD1含量较未训练人群明显增加,伴随IMTG含量上升,分析认为,耐力训练引起的骨骼肌适应性变化和氧化代谢能力增加,从而提高能源物质储备。本研究中,高脂安静组和运动组SCD1表达无明显差异,分析认为,运动方式可能对高脂喂养条件下骨骼肌SCD1表达没有影响。有研究指出,SCD1的代谢调节功能较为复杂,正常细胞功能的维持需要SCD1表达受到严格调控[4]。一方面,促进SFAs向MUFAs转化,防止SFAs过多和酯化障碍引起脂质毒性和细胞凋亡;另一方面,MUFAs是胞内脂质储存池IMTG的重要底物,合成过多同样会导致肌细胞脂质过载,诱导胰岛素抵抗和代谢异常。肌细胞内脂质维持动态平衡,可能与脂肪酸跨膜转运、氧化代谢等多环节协同作用密切相关。

3.3 大强度间歇运动促进Rev-erbα表达及调节骨骼肌脂质稳态的机制分析
Rev-erbα是脂代谢调节核心作用因子,Rev-erbα敲除后小鼠表现出明显的脂代谢异常[40]。Solt等[46]对高脂诱导的肥胖小鼠注射Rev-erbα激动剂后,骨骼肌中脂肪酸氧化代谢增加,伴随体重和体脂含量下降,因此Rev-erbα可能作为肥胖症等慢性病治疗的靶基因。尽管越来越多的证据支持Rev-erbα在脂代谢中的重要作用,但对于其在骨骼肌中表达的影响因素仍知之甚少。本研究发现,运动干预增加高脂喂养大鼠骨骼肌Rev-erbα表达量,尤其是大强度间歇运动方式引起其表达量显著上升。大强度间歇运动诱导骨骼肌Rev-erbα表达明显上调的机制需进一步研究,可能与骨骼肌收缩引起的能量消耗和物质代谢的适应性变化有关。
Rev-erb可直接调节脂质代谢基因,并可能通过建立脂质代谢信号通路的交联对话机制,共同调节骨骼肌脂代谢和维持能量稳态[11,31,46]。Solt等[46]采用Rev-erbα激动剂(SR9009、SR9011)对正常小鼠和肥胖小鼠进行干预,研究发现,小鼠骨骼肌脂肪酸代谢明显增加,FATP1、CPT1表达上调,而SCD1表达受到抑制,伴随组织中TG和体脂含量下降。Burris等[12]、Ramakrishnan等[38]也指出,Rev-erbs与FAT/CD36、SCD1、CPT1存在密切联系。
目前尚不清楚在高脂喂养联合运动干预时,Rev-erbα是否直接调控FAT/CD36、SCD1和CPT1的表达,影响脂肪酸转运、合成和氧化代谢,从而改善组织局部和整体代谢。本研究通过整合分析,提出如下可能作用机制:Rev-erbα通过刺激FAT/CD36表达使脂肪酸跨膜转运增加,促进细胞能量物质的供应,同时,动员外周组织如脂肪组织、肝脏中储存的脂肪,降低循环系统中流通的脂质含量。Rev-erbα调节SCD1的表达水平,既保障IMTG维持在一定水平为能量代谢提供底物储存,又防止再合成过载导致的脂质异常沉积。与此同时,增加脂肪酸β氧化限速酶CPT1的表达,促进线粒体生物合成并提供运动能量消耗,从而减少高脂膳食喂养诱导的细胞脂质毒性及胰岛素抵抗等。大强度间歇运动利用运动中较强的刺激效应和运动“后效应”,刺激能量诱导因子Rev-erbα表达上调,并发挥级联效应增加对脂代谢因子的协同调节,从而维持骨骼肌的脂质内稳态。运动干预联合高脂喂养时,Rev-erbα调控脂代谢信号通路的可能作用机制,仍需采用骨骼肌Rev-erbα特异性基因敲除和干扰模型进一步探索和验证。
4 结论
1.不同运动干预联合高脂喂养对肥胖症的预防作用效果存在差异;从代谢表征分析,大强度间歇运动方式具有较强的时效性,预防效果优于低强度持续运动方式。
2.大强度间歇运动促进骨骼肌脂代谢核心作用因子Rev-erbα表达上调,可能通过调控FAT/CD36、SCD1和CPT1的表达量,维持高脂喂养时脂肪酸跨膜转运、胞内合成和线粒体生物氧化,共同维持脂质稳态和能量平衡。Rev-erbα调控运动干预时脂代谢信号通路,可能是肥胖症预防骨骼肌适应的新机制,相关研究有待进一步深入。
[1]沈友青,宋涛,庞秋,等.大强度间歇运动在肥胖症及其相关慢性病干预中的应用研究进展[J].中国运动医学杂志,2013,32(8):741-748.
[2]施曼莉,朱荣.高强度间歇运动对骨骼肌糖原含量的影响及机制研究[J].体育科学,2015,35(4):66-71.
[3]AFZALPOUR M E,CHADORNESHIN H T,FOADODDINI M,etal.Comparing interval and continuous exercise training regimens on neurotrophic factors in rat brain[J].Physiol Behav,2015,147:78-83.
[4]ARREGUI M,BUIJSSE B,STEFAN N,etal.Heterogeneity of the Stearoyl-CoA desaturase-1(SCD1) gene and metabolic risk factors in the EPIC-potsdam study[J].PLoS One,2012,7(11):e48338.
[5]BEDFORD T G,TIPTON C M,WILSON N C,etal.Maximum oxygen consumption of rats and its changes with various experimental procedures[J].J Appl Physiol,1979,47(6):1278-1283.
[6]BENNETT C B,CHILIBECK P D,BARSS T,etal.Metabolism and performance during extended high-intensity intermittent exercise after consumption of low- and high-glycaemic index pre-exercise meals[J].Br J Nutr,2012,108 (Suppl 1):S81-90.
[7]BERGMAN B C,PERREAULT L,HUNERDOSSE D M,etal.Increased intramuscular lipid synthesis and low saturation relate to insulin sensitivity in endurance-trained athletes[J].J Appl Physiol,2010,108(5):1134-1141.
[8]BONEN A,DYCK D J,IBRAHIMI A,etal.Muscle contractile activity increases fatty acid metabolism and transport and FAT/CD36[J].Am J Physiol,1999,276(4 Pt1):E642-649.
[9]BRADLEY N S,SNOOK L A,JAIN S S,etal.Acute endurance exercise increases plasma membrane fatty acid transport proteins in rat and human skeletal muscle[J].Am J Physiol Endocrinol Metab,2012,302(2):E183-189.
[10]BRUCE C R,THRUSH A B,MERTZ V A,etal.Endurance training in obese humans improves glucose tolerance and mitochondrial fatty acid oxidation and alters muscle lipid content[J].Am J Physiol Endocrinol Metab,2006,291(1):E99-E107.
[11]BUGGE A,FENG D,EVERETT L J,etal.Rev-erbalpha and Rev-erbbeta coordinately protect the circadian clock and normal metabolic function[J].Genes Dev,2012,26(7):657-667.
[12]BURRIS T P.Nuclear hormone receptors for heme:REV-ERBalpha and REV-ERBbeta are ligand-regulated components of the mammalian clock[J].Mol Endocrinol,2008,22(7):1509-1520.
[13]COCKS M,SHAW C S,SHEPHERD S O,etal.Sprint interval and moderate-intensity continuous training have equal benefits on aerobic capacity,insulin sensitivity,muscle capillarisation and endothelial eNOS/NAD(P)Hoxidase protein ratio in obese men[J].J Physiol Biochem,2015.doi:10.1113/jphysiol.2014.285254.
[14]COCKS M,SHAW C S,SHEPHERD S O,etal.High intensity interval and endurance training are equally effective in increasing muscle microvascular density and eNOS content in sedentary males[J].J Physiol,2012,591(Pt 3):641-656.
[15]CORTE DE ARAUJO A C,ROSCHEL H,PICANCO A R,etal.Similar health benefits of endurance and high-intensity interval training in obese children[J].PLoS One,2012,7(8):e42747.
[16]DOBRZYN P,DOBRZYN A,MIYAZAKI M,etal.Stearoyl-CoA desaturase 1 deficiency increases fatty acid oxidation by activating AMP-activated protein kinase in liver[J].Proc Natl Acad Sci U S A,2004,101(17):6409-6414.
[17]DOBRZYN P,PYRKOWSKA A,JAZUREK M,etal.Endurance training-induced accumulation of muscle triglycerides is coupled to upregulation of stearoyl-CoA desaturase 1[J].J Appl Physiol,2010,109(6):1653-1661.
[18]DUBE J J,AMATI F,TOLEDO F G,etal.Effects of weight loss and exercise on insulin resistance,and intramyocellular triacylglycerol,diacylglycerol and ceramide[J].Diabetologia,2011,54(5):1147-1156.
[19]GIBALA M J,LITTLE J P,MACDONALD M J,etal.Physiological adaptations to low-volume,high-intensity interval training in health and disease[J].J Physiol,2012,590(Pt 5):1077-1084.
[20]GILLEN J,LITTLE J,PUNTHAKEE Z,etal.Acute high-intensity interval exercise reduces the postprandial glucose response and prevalence of hyperglycaemia in patients with type 2 diabetes[J].Diabetes Obes Metab,2012,14(6):575-577.
[21]HAFSTAD A D,BOARDMAN N T,LUND J,etal.High intensity interval training alters substrate utilization and reduces oxygen consumption in the heart[J].J Appl Physiol,2011,111(5):1235-1241.
[22]HARAM P M,KEMI O J,LEE S J,etal.Aerobic interval training vs.continuous moderate exercise in the metabolic syndrome of rats artificially selected for low aerobic capacity[J].Cardiovasc Res,2009,81(4):723-732.
[23]HOLLOWAY G P,JAIN S S,BEZAIRE V,etal.FAT/CD36-null mice reveal that mitochondrial FAT/CD36 is required to upregulate mitochondrial fatty acid oxidation in contracting muscle[J].Am J Physiol Regul Integr Comp Physiol,2009,297(4):R960-967.
[24]HOLLOWAY G P,LUIKEN J J,GLATZ J F,etal.Contribution of FAT/CD36 to the regulation of skeletal muscle fatty acid oxidation:an overview[J].Acta Physiol (Oxf),2008,194(4):293-309.
[25]HOLLOWAY T M,BLOEMBERG D,DA SILVA M L,etal.High intensity interval and endurance training are associated with divergent skeletal muscle adaptations in a rodent model of hypertension[J].Am J Physiol Regul Integr Comp Physiol,2015.308(11):R927-934.
[26]HOSHINO D,YOSHIDA Y,KITAOKA Y,etal.High-intensity interval training increases intrinsic rates of mitochondrial fatty acid oxidation in rat red and white skeletal muscle[J].Appl Physiol Nutr Metab,2013,38(3):326-333.
[27]IKEDA S,MIYAZAKI H,NAKATANI T,etal.Up-regulation of SREBP-1c and lipogenic genes in skeletal muscles after exercise training[J].Biochem Biophys Res Commun,2002,296(2):395-400.
[28]KILPATRICK M W,GREELEY S J,FERRON J M.A comparison of the impacts of continuous and interval cycle exercise on perceived exertion[J].Eur J Sport Sci,2015(Epub ahead of print).
[29]KITAOKA Y,MUKAI K,AIDA H,etal.Effects of high-intensity training on lipid metabolism in Thoroughbreds[J].Am J Vet Res,2012,73(11):1813-1818.
[30]KOJETIN D J,BURRIS T P.REV-ERB and ROR nuclear receptors as drug targets[J].Nat Rev Drug Discov,2014,13(3):197-216.
[31]LE MARTELOT G,CLAUDEL T,GATFIELD D,etal.REV-ERBalpha participates in circadian SREBP signaling and bile acid homeostasis[J].PLoS Biol,2009,7(9):e1000181.
[32]LINDEN M A,FLETCHER J A,MORRIS E M,etal.Treating NAFLD in OLETF rats with vigorous-intensity interval exercise training[J].Med Sci Sports Exe,2015,47(3):556-567.
[33]MORIFUJI M,SANBONGI C,SUGIURA K.Dietary soya protein intake and exercise training have an additive effect on skeletal muscle fatty acid oxidation enzyme activities and mRNA levels in rats[J].Br J Nutr.2006,96(3):469-475.
[34]MUNIYAPPA R,CHEN H,MUZUMDAR R H,etal.Comparison between surrogate indexes of insulin sensitivity/resistance and hyperinsulinemic euglycemic clamp estimates in rats[J].Am J Physiol Endocrinol Metab,2009,297(5):E1023-1029.
[35]NIU Y,YUAN H,FU L.Aerobic exercise's reversal of insulin resistance by activating AMPKα-ACC-CPT1 signaling in the skeletal muscle of C57BL6 mice[J].Int J Sport Nutr Exe Metab,2010,20(5):370-380.
[36]POPKIN B M,ADAIR L S,NG S W.Global nutrition transition and the pandemic of obesity in developing countries[J].Nutr Rev,2012,70(1):3-21.
[37]PRIEUR F,MUCCI P.Effect of high-intensity interval training on the profile of muscle deoxygenation heterogeneity during incremental exercise[J].Eur J Appl Physiol,2013,113(1):249-257.
[38]RAMAKRISHNAN S N,LAU P,BURKE L J,etal.Rev-erbbeta regulates the expression of genes involved in lipid absorption in skeletal muscle cells:evidence for cross-talk between orphan nuclear receptors and myokines[J].J Biol Chem,2005,280(10):8651-8659.
[39]RAMOS J S,DALLECK L C,TJONNA A E,etal.The impact of high-intensity interval training versus moderate-intensity continuous training on vascular function:A systematic review and meta-analysis[J].Sports Med,(Epub ahead of print).
[40]RASPE E,DUEZ H,MANSEN A,etal.Identification of Rev-erbalpha as a physiological repressor of apoC-III gene transcription[J].J Lipid Res,2002,43(12):2172-2179.
[41]ROBITAILLE J,HOUDE A,LEMIEUX S,etal.Variants within the muscle and liver isoforms of the carnitine palmitoyltransferase I (CPT1) gene interact with fat intake to modulate indices of obesity in French-Canadians[J].J Mol Med,2007,85(2):129-137.
[42]ROCHA R E,COELHO I,PEQUITO D C,etal.Interval training attenuates the metabolic disturbances in type 1 diabetes rat model.[J].Arq Bras Endocrinol Metabol.2013,57(8):594-602.
[43]SARIS W H,SCHRAUWEN P.Substrate oxidation differences between high- and low-intensity exercise are compensated over 24 hours in obese men[J].Int J Obes Relat Metab Disord,2004,28(6):759-765.
[44]SCHMITTGEN T D,LIVAK K J.Analyzing real-time PCR data by the comparative CT method[J].Nature Protocols,2008,3(6):1101-1108.
[45]SENE-FIORESE M,DUARTE F O,SCARMAGNANI F R,etal.Efficiency of intermittent exercise on adiposity and fatty liver in rats fed with high-fat diet[J].Obesity (Silver Spring),2008,16(10):2217-2222.
[46]SOLT L A,WANG Y J,BANERJEE S,etal.Regulation of circadian behaviour and metabolism by synthetic REV-ERB agonists[J].Nature,2012,485(7396):62-68.
[47]TALANIAN J L,HOLLOWAY G P,SNOOK L A,etal.Exercise training increases sarcolemmal and mitochondrial fatty acid transport proteins in human skeletal muscle[J].Am J Physiol Endocrinol Metab,2010,299(2):E180-188.
[48]THE JACKSON LABORATORY.JAX Diet-Induced Obesity(DIO)Models[EB/OL].(2012-03-21).http://jaxmice jax org/diomice/index html.
[49]THOMPSON W R.Worldwide survey of fitness trends for 2015:What’s driving the market[J].ACSM's Health Fitness J,2014,18(6):8-17.
[50]UN GENERAL ASSEMBLY.Draft political declaration of the high-level meeting on the prevention and control of non-communicable diseases[DB/OL],http://www.un.org/en/ga/ncdmeeting,2011.
[51]VOSS M D,BEHA A,TENNAGELS N,etal.Gene expression profiling in skeletal muscle of Zucker diabetic fatty rats:Implications for a role of stearoyl-CoA desaturase 1 in insulin resistance[J].Diabetologia,2005,48(12):2622-2630.
[52]WALLACE T M,LEVY J C,MATTHEWS D R.Use and abuse of HOMA modeling[J].Diabetes Care,2004,27(6):1487-1495.
[53]WHYTE L,GILL J,CATHCART A.Effect of 2 weeks of sprint interval training on health-related outcomes in sedentary overweightobese men[J].Metabolism,2010,59(10):1421-1428.
The Effects of High-intensity Interval Trainingon Metabolic Profiles and Gene Expression ofMuscle Lipid Metabolism in High-fat Diet Rat
SHEN You-qing1,HUANG Guo-yuan2,WANG Pei-cai3,HUANG Zhi-qiang1,DAI Hui-ying1
Objective:To explore the efficacy of high-intensity interval training on preventing high-fat diet-induced obesity,and the molecular mechanism of regulating lipid metabolism in skeletal muscle.Methods:Thirty-seven Sprague-Dawley male rats were divided into four groups,control diet/sedentary group (CS),high-fat diet/sedentary (HS),high-fat diet/mild-intensity endurance exercise (HE),and high-fat diet/high-intensity interval exercise (HI).After acclimation,all exercise groups were made to exercise for 10 weeks on a motor-driven rodent treadmill according to exercise protocols,with matched running distances.Body weight,fat content,blood metabolites,quantitative insulin sensitivity check index (QUICKI),and adipocyte size were assessed using measurement,automatic biochemical analyzer,and histochemical method,respectively.The expressions of gene and protein regulating fatty acid metabolism were quantified by real-time PCR and western blotting,including nuclear receptor subfamily 1,group D,member 1(Rev-erbα),stearoyl-CoA desaturase-1(SCD1),carnitine palmitoyltransferase 1(CPT1),and fatty acid translocase (FAT/CD36).Results:Body weight,TG,TC,LDL-C,and GLU in HS group was increased,while QUICKI was reduced.The size of adiposity cell in HS group was expanded.Body weight,serum lipid and GLU in HI group were lower than those in HS group,while insulin sensitivity was significantly improved in HI group.Adipocyte size in HI group was less than that in HS and HE group.The difference between HE group and HS group was not significant.The expression of FAT/CD36,and CPT1 was elevated in the HI group,which also had the highest level of Rev-erbα expression.The expression of FAT/CD36,and SCD1 was up-regulated in HS,with no statistic change in Rev-erbα expression.Conclusions:High-fat diet led to disorder of metabolic characterization and lipid metabolism in rat skeletal muscle.The HI-induced increase in fatty acid transport across the cell membrane,intracellular synthesis and ?-oxidation,which could effectively prevent the disorder of metabolic profiles and lipid imbalance.The effect of high-intensity interval training was more time-effective than that of mild-intensity durance training.The HI-induced up-regulation of Rev-erbα might be newly developed mechanism in interaction with regulatory of lipid metabolism,and further to maintain lipid homeostasis in skeletal muscle.
mild-intensityendurancetraining;high-intensityintervaltraining;skeletalmuscle;Rev-erbα;FAT/CD36;SCD1;CPT1
1002-9826(2016)01-0084-08
10.16470/j.csst.201601012
2015-04-13;
2015-09-10
湖北省自然科学基金资助项目(2015CFC881)。
沈友青(1978-),女,湖北孝感人,副教授,博士,主要研究方向为慢性病运动干预,Tel:(027)87942627,E-mail:future0104@hotmail.com;黄国源(1950-),男,上海人,教授,博士,主要研究方向为老年体育、健康体适能,E-mail:ghuang@usi.edu;王配才(1985-)男,山东临沂人,讲师,硕士,主要研究方向为运动生物医学监控,E-mail:275236880@qq.com;黄志强(1978-),男,江西南昌人,副教授,硕士,主要研究方向为健康体适能,E-mail:710236060@qq.com;代会莹(1983-),女,黑龙江哈尔滨人,讲师,硕士,主要研究方向为运动损伤康复治疗,E-mail:13370564@qq.com。作者单位:1.湖北第二师范学院 体育学院,湖北 武汉 430205;2.美国南印第安纳大学 运动科学系,印第安纳州 伊凡斯威尔市 47712;3.江汉大学 教育科学学院,湖北 武汉 430056 1.Hubei University of Education,Wuhan 430205,China;2.University of Southern Indiana,Evansville,47712,America;3.Jianghan University,Wuhan 430056,China.
G804.23
A
